番茄独脚金内酯合成关键基因CCD7、CCD8 RNA沉默载体的构建
2017-03-18田芳姚兆群陈美秀徐瑛赵思
田芳++姚兆群++陈美秀++徐瑛++赵思峰

摘要:根据已知的番茄(Lycopersicon esculentum Mill.)CCD7和CCD8基因的序列设计特异性引物,采用RT-PCR克隆CCD7和CCD8基因片段,通过特定酶切将2个基因进行拼接,再将串联基因以反向重复的方式连入pUCCRNAi载体,并定向插入到p35植物表达载体上。结果表明,克隆获得了大小约为400 bp的CCD7和CCD8基因片段,基因片段拼接后获得800 bp左右的串联片段CCD7-8;将该基因片段插入pUCCRNAi载体后得到1 700 bp大小的含Intron的反向重复序列In-7-8,并成功插入到植物表达载体p35中,通过酶切分析,RNAi载体构建正确。最终成功构建了番茄CCD7和CCD8 2个串联基因的RNA沉默表达载体p35-In-7-8。
关键词:番茄(Lycopersicon esculentum Mill.);独脚金内酯;列当;类胡萝卜素裂解双加氧酶7(CCD7)和8(CCD8);RNA沉默载体
中图分类号:Q78 文献标识码:A 文章编号:0439-8114(2016)21-5668-04
DOI:10.14088/j.cnki.issn0439-8114.2016.21.058
Construction of Strigolactones Key Genes CCD7、CCD8 of
Tomato RNA Silencing Expression Vector
TIAN Fang, YAO Zhao-qun, CHEN Mei-xiu, XU Ying, ZHAO Si-feng
(Key Laboratory of Universities of Xinjiang Uygur Autonomous Region for Oasis Agricul-tural Pest Management and Plant Protection Resource Utilization /College of Agriculture, Shihezi Uni-versity, Shihezi 832003, Xinjiang, China)
Abstract: In order to construct tomato(Lycopersicon esculentum Mill.) carotenoid cleavage dioxygense 7(CCD7) and 8 (CCD8) RNA silencing expression vector, the specific primers were designed according to the published sequence of tomato CCD7 and CCD8. The CCD7 and CCD8 fragments were obtained by RT-PCR amplification,then they were concatenated through specific enzyme digestion,and cloned into pUCCRNAi vector in a inverted repeat manner,finally inserted into p35 plant expression vector. Results show that we cloned about 400 bp CCD7 and CCD8 gene fragment,respectively. The concatenation gene CCD7-8 of 800 bp was constructed by gene fragment splicing. Two copies of CCD7-8 gene was inserted into pUCCRNAi vector and got 1 700 bp contain Introns inverted repeat sequence In-7-8. Then they were inserted into p35 vector successfully and the RNAi vector was constructed correctly by enzyme digestion analysis. Finally successful constructed tomato CCD7 and CCD8 two concatenation genes RNA silencing expression vector p35-In-7-8.
Key words: tomato(Lycopersicon esculentum Mill.); strigolactones; orobanche; carotenoid cleavage dioxygense 7(CCD7) and 8(CCD8);RNA silencing vector
列當(Orobanche coerulescens Steph.)是一类无叶绿素并以全寄生方式寄生于其他植物根部获取所需养分的植物,其可寄生在茄科、豆科、菊科、伞形科、葫芦科等多种重要经济作物上,造成寄主植物减产5%~100%,已在亚洲、欧洲、非洲、南美洲和北美洲的较多国家和地区发生,每年给农业生产造成的经济损失达数十亿美元[1-3]。人们采用农业、物理、化学、生物等各项措施防治列当,均无法完全防治,在列当严重发生地区的农民会因为防效和防治成本等问题直接放弃所种作物甚至弃耕土地[4,5]。列当靠种子进行繁殖,且种子产生量大,1株成熟植株可产生5万~50万粒种子,种子可随风、流水、人为活动等因素快速传播,可在土壤中存活数十年,这是列当难以防治的重要原因[1,3]。列当种子内的KAI2蛋白是一个受体蛋白,可感受到寄主植物根系分泌的独脚金内酯类似物的刺激然后诱导列当种子萌发[6],若能减少寄主植物分泌的独脚金内酯或使其不分泌,则有望培育出抗列当的寄主品种[7]。Dor等[8]发现番茄(Lycopersicon esculentum Mill.)突变株SL-ORT1因不能产生独脚金内酯从而对埃及(瓜)列当表现出高抗特性;用类胡萝卜素生物合成途径抑制剂氟啶草酮处理番茄后,与对照相比,处理番茄植株根系几乎检测不到独脚金内酯,同时根际大麻列当种子萌发率减少98%以上[9]。在植物体内,类胡萝卜素裂解双加氧酶7(CCD7)和8(CCD8)是独脚金内酯合成途经中最为关键的2个功能基因,可共同作用将β-类胡萝卜素裂解成独脚金内酯,这2个基因缺失或者沉默,均会导致独脚金内酯合成量下降或不能合成[7,10]。列当目前在新疆主要农业区均有分布,已在加工番茄、甜瓜、向日葵等重要经济作物上造成严重损失[3,11]。本研究从番茄上克隆CCD7和CCD8基因,并利用获得的基因,构建RNA沉默载体,为获得抗列当的独脚金内酯合成量减少的植株提供技术支撑。
1 材料与方法
1.1 材料
材料:所用番茄品种为改良毛粉802,将番茄种子用2%的次氯酸钠消毒后种植于营养土∶蛭石为 1∶1的花盆内并置于温室培养,2 d浇1次水,待长到7~8片真叶后将其从花盆中取出,切取根系并用水冲洗干净,晾干。根据TRIzol法提取根部RNA并反转录为cDNA备用。
载体:中间载体pUCCRNAi和植物表达载体p35由石河子大学生命科学学院黄先忠老师赠送。
菌株:大肠杆菌DH5α由本实验室保存。
主要试剂:pMD18-T Vector、DNA限制性内切酶、T4 DNA连接酶、Taq DNA聚合酶购自TaKaRa公司;质粒小量提取试剂盒,凝胶回收试剂盒购自天根生化科技(北京)有限公司;引物合成和基因测序由北京六合华大基因科技有限公司完成。
1.2 目的基因片段的获得及验证
根据NCBI上已知番茄CCD7和CCD8基因的序列信息,分别设计了两个基因部分片段引物(表1)。为了便于载体的构建,在扩增CCD7目标片段的上下游引物上分别引入XbaⅠ和StuⅠ酶切位点,在扩增CCD8目标片段的上下游引物上分别引入StuⅠ和SalⅠ酶切位点。
以提取的番茄根部cDNA为共同模板,7-F和7-R为引物,扩增CCD7基因片段;再以8-F和8-R为引物,扩增CCD8基因片段。利用琼脂糖凝胶电泳分离上述PCR扩增产物,割胶回收目的基因片段并连接于pMD18-T载体上转化培养,PCR鉴定为阳性的克隆进行测序验证。
1.3 目的片段的串联
将片段CCD7和CCD8分别克隆到pMD18-T载体上,通过PCR筛选目标基因片段,分别记作pMD18-T-7和pMD18-T-8。
用限制性内切酶StuⅠ和SalⅠ双酶切pMD18-T-7;再用StuⅠ和SalⅠ切取CCD8片段,用T4连接酶将片段CCD8连入pMD18-T-7中,并将新得到的克隆命名为pMD18-T-7-8。
1.4 反向重复序列在中间载体pUCCRNAi上的构建
1)串联片段正向插入pUCCRNAi质粒。以pMD18-T-7-8为模板,7-F和8-R为引物,PCR扩增串联片段CCD7-8。载体pUCCRNAi和pMD18-T-7-8分别用XbaⅠ和SalⅠ双酶切后,将串联片段正向插入到pUCCRNAi中,记作+pRNAi-7-8。
2)串联片段反向插入pUCCRNAi质粒。因为pUCCRNAi质粒上XbaⅠ、SalⅠ与SpeⅠ、XhoⅠ分别为同尾酶,所以载体+pRNAi-7-8用SpeⅠ和XhoⅠ双酶切后,直接将串联片段CCD7-8连入+pRNAi-7-8中,新得到的载体记作pRNAi-In-7-8。
1.5 沉默表达载体的构建
用PstⅠ将pRNAi-In-7-8上包含Intron在内的反向重复序列切下,插入用同样酶切且已去磷酸化的p35植物表达载体上,筛选转化重组体得到CCD7-8基因的反向重复植物表达载体p35-In-7-8。
2 结果与分析
2.1 目的基因片段的获得及验证
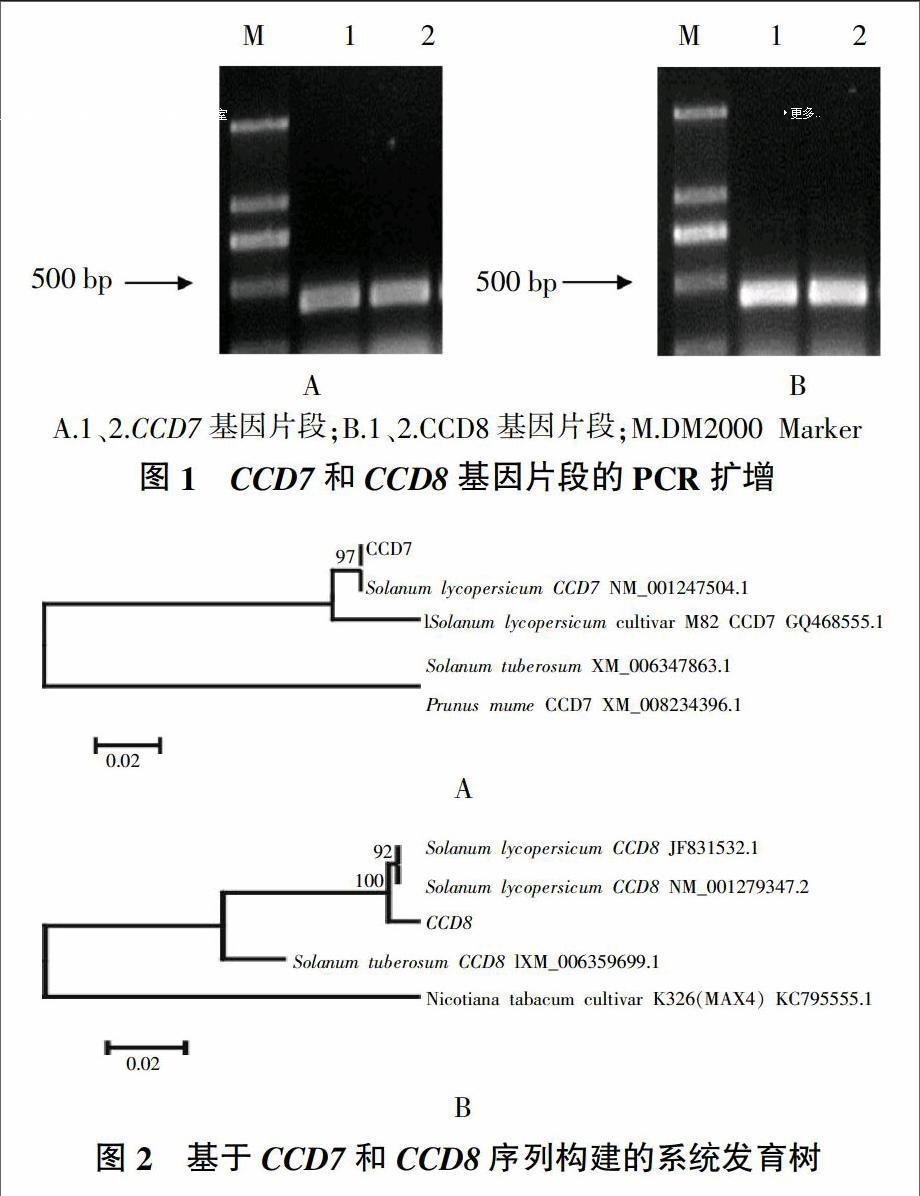
以7-F和7-R为引物,获得的番茄cDNA为模板进行PCR扩增,得到约400 bp大小的目标条带(图1A);以8-F和8-R为引物、番茄cDNA為模板进行PCR扩增,获得约400 bp大小的目标条带(图1B),均与预计结果接近。PCR产物与pMD-18-T载体连接后,挑选单克隆进行测序。将测得的序列登陆NCBI进行Blast比对。通过MEGA5.05软件构建系统发育树。CCD7的系统发育树(图2 A)显示CCD7与Solanum lycopersicum CCD7 NM_001247504.1在同一个分支上聚为一组,同源性达到97%;CCD8的系统发育树(图2B)显示,CCD8与Solanum lycopersicum CCD8 JF831532.1、Solanum lycopersicum CCD8 NM_001279347.2在同一个分支上聚为一组,同源性较高。结果表明,克隆的CCD7和CCD8序列正确。
2.2 目标片段的串联
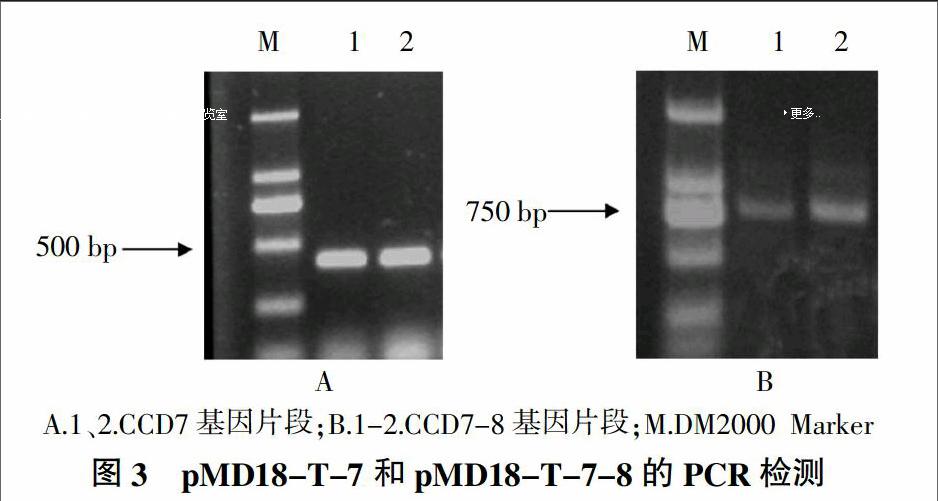
将片段CCD7与T载体连接,转化、挑克隆并摇菌,以7-F和7-R为引物进行菌液PCR,得到约400 bp大小的片段,说明片段CCD7已连上T载体,记作pMD18-T-7(图3A)。
用StuⅠ和SalⅠ双酶切片段CCD8后,与同样酶切的pMD18-T-7载体相连,以7-F和8-R为引物,PCR扩增串联片段CCD7-8,电泳检测,得到800 bp左右的条带,记作pMD18-T-7-8(图3B)。获得含有CCD7和CCD8 2个基因片段的串联基因。
2.3 干涉中间载体的构建
2.3.1 串联片段正向插入pUCCRNAi质粒 采用限制性内切酶XbaⅠ和SalⅠ对pMD18-T-7-8质粒进行酶切,获得大小为800 bp的串联基因片段CCD7-8。酶切片段经割胶回收后连入同样酶切开的pUCCRNAi载体,获得+pRNAi-7-8重组载体。以7-F和8-R为引物,PCR扩增,得到约800 bp的目标条带(图4),表明CCD7-8已连入pUCCRNAi载体。
2.3.2 串联片段反向插入pUCCRNAi质粒 采用限制性内切酶SpeⅠ和XhoⅠ酶切+pRNAi-7-8质粒,将串联基因CCD7-8连入其中,获得pRNAi-In-7-8重组载体。采用PstⅠ对重组载体进行酶切鉴定,结果显示,重组载体能切下1 700 bp左右的目的基因条带(图5)。表明串联基因CCD7-8已反向连入+pRNAi-7-8载体,pRNAi-In-7-8中间载体构建成功。
2.4 沉默表达载体的构建
用限制性内切酶PstⅠ双酶切pRNAi-In-7-8质粒,获取了包含Intron的In-7-8片段。将酶切后的In-7-8片段回收后定向插入以相同限制性内切酶酶切且去磷酸化的植物表达载体p35上。重组载体用限制性内切酶PstⅠ进行酶切,可切下大小约1 700 bp的条带(图6),表明包含Intron在内的串联基因CCD7-8已成功连入p35,从而得到具有反向重复序列的植物表达载体p35-In-7-8。
3 小结与讨论
独脚金内酯(Strigolactones,SLs)是一类新发现的类胡萝卜素衍生型植物激素,其在抑制植物分枝、调节根生长、叶老化和花的形成方面有重要作用,在刺激列当种子萌发并与寄主植物建立寄生关系过程中也至关重要[6,7]。目前已知有多个酶参与独脚金内酯的合成,其中胡萝卜素裂解双加氧7(CCD7)和胡萝卜素裂解双加氧酶8(CCD8)发挥了关键作用。本研究中克隆获得的番茄CCD7和CCD8基因经BLAST分析后与Solanum lycopersicum的CCD7和CCD8都有很高的同源性。Vogel等[10]将番茄中的CCD7沉默后,番茄上Orobanche ramosa的寄生量减少了90%,但同时番茄分枝量有了明显的增加;Pasare等[12]将马铃薯的CCD8沉默后马铃薯表现出侧枝增加,匍匐茎减少。Gomez-Roldan等[13]将豌豆体内与独脚金内酯合成密切相关的CCD8基因被缺失突变后突变体无法有效合成独脚金内酯,列当的寄生数量也显著减少。单个基因的沉默已经取得了良好的抗列当效果。
反向重复序列导入植物体是一种高效诱导RNA沉默的方法,其优点是在任何遗传转化体系成熟的植株中都可进行,且产生的RNA沉默高效持久并能在后代稳定遗传[14]。本研究先在一个小型中间载体中构建好反向重复序列后再转入植物表达载体,并且两个反向重复片断之间有Intron隔开,选用小型中间载体pUCCRNAi构建反向重复拷贝数高,操作容易。本研究在构建RNA沉默载体时所用的pUCCRNAi中间载体中已经插入了一段Intron序列,使用十分方便。同时把CCD7和CCD8进行串联,同时插入到一个载体中,减少了多余的试验操作,省时省力。
本研究以番茄根部提取的cDAN为模板,克隆CCD7和CCD8基因片段并使其串联,插入到中间载体pUCCRNAi中构建反向重复结构,最后插入到植物表达载体p35上,成功构建含2个基因片段的RNA沉默载体p35-In-7-8,为研究抗列当的番茄新品种培育提供了技术支撑。
参考文献:
[1] HABIMANA S,NDUWUMUREMYI A,CHINAMA R J D.Management of Orobanche in field crops——A review[J].Journal of Soil Science and Plant Nutrition,2014,14(1):43-62.
[2] ALY R.Advanced technologies for parasitic weed control[J]. Weed Science,2012,60(2):290-294.
[3] PARKER C. Observations on the current status of Orobanche and Striga problems worldwide[J].Pest Management Science, 2009,65(5):453-459.
[4] RUBIALES D,FERN?NDEZ-APARICIO M.Innovations in parasitic weeds management in legume crops. A review[J].Agronomy for Sustainable Development,2012,32(2):433-449.
[5] WESTWOOD J H,YODER J I,TIMKO M P,et al. The evolution of parasitism in plants[J].Trends Plant Science,2010,15(4):227-235.
[6] CONN C E,BYTHELL-DOUGLAS R, NEUMANN D,et al. Convergent evolution of strigolactone perception enabled host detection in parasitic plants[J].Science,2015,349(6247):540-543.
[7] CARDOSO C1,RUYTER-SPIRA C,BOUWMEESTER H J.Strigolactones and root infestation by plant-parasitic Striga, Orobanche and Phelipanche spp[J].Plant Science,2011,180(3):414-420.
[8] DOR E,YONEYAMA K,WININGER S,et al. Strigolactone deficiency confers resistance in tomato Line SL-ORF1 to the parasitic weeds Phelipanche and Orobanche spp[J].Phytopathology,2011,101(2):213-222.
[9] L?PEZ-R?EZ J A,CHARNIKHOVA T,G?MEZ-ROLD?N V,et al.Tomato strigolactones are derived from carotenoids and their biosynthesis is promoted by phosphate starvation[J].New Phytologist,2008,178(4):863-874.
[10] VOGEL J T,WALTER M H,GIAVALISCO P,et al. SlCCD7 controls strigolactone biosynthesis, shoot branching and mycorrhiza-induced apocarotenoid formation in tomato[J].The Plant Journal,2010,61(2):300-311.
[11] 張学坤,姚兆群,赵思峰,等.分枝(瓜)列当在新疆的分布、危害及其风险评估[J].植物检疫,2012,26(6):31-33.
[12] PASARE S A,DUCREUX L J,MORRIS W L,et al. The role of the potato (Solanum tuberosum) CCD8 gene in stolon and tuber development[J].New Phytol,2013,198(4):1108-1120.
[13] GOMEZ-ROLDAN V,FERMAS S,BREWER P B,et al.Strigolactone inhibition of shoot branching[J].Nature,2008,455:189-194.
[14] WATERHOUSE P M,HELLIWELL C A.Exploring plant genomes by RNA-induced gene silencing[J].Nature Reviews Genetics,2003,4(1):29-38.
