拟南芥叶色突变体F03—06的筛选及突变基因的克隆
2017-03-18平步云赵军安丽君
平步云++赵军++安丽君


摘要:植物光合作用是人类赖以生存的基础,叶绿体是植物进行光合作用的重要场所,叶色可作为叶绿体发育状态的标记,叶色突变体是研究光合作用机制的优良系统。通过EMS诱变筛选得到一个拟南芥叶色突变体F03-06,主要表型为叶片黄绿、叶脉深绿色、生长缓慢、株型矮小。遗传分析表明,F03-06突变表型受隐性单核基因控制。利用图位克隆技术,通过粗定位和精细定位发现该突变体表型与拟南芥At5g54810基因的突变体表型相似。对At5g54810基因的测序结果显示,其+865碱基由鸟嘌呤突变为腺嘌呤,从而使编码的丙氨酸变为苏氨酸。At5g54810基因被报道编码拟南芥色氨酸合成酶的β亚基,为进一步研究拟南芥色氨酸合成途径与叶绿体发育之间的调控机制提供了新的遗传材料。
关键词:叶色突变体;图位克隆;叶绿体发育;色氨酸生物合成
中图分类号:Q37;Q341 文献标识码:A 文章编号:0439-8114(2016)21-5664-04
DOI:10.14088/j.cnki.issn0439-8114.2016.21.057
Genetic Screening and Isolation of a Leaf Color Mutant F03-06 in Arabidopsis
PING Bu-yun,ZHAO Jun,AN Li-jun
(State Key Laboratory of Crop Stress Biology for Arid Areas/College of Life Sciences,Northwest A & F University,
Yangling 712100,Shaanxi,China)
Abstract: Photosynthesis that is proceeded in the chloroplast plays key role for human beings survival, leaf color mutants are excellent system to study the mechanisms of photosynthesis because leaf color could be used to mark the chloroplast development status. In an effort to identify genetic factors involved in plant photosynthesis,large scale genetic screening was carried out and one color mutant F03-06 was isolated from a EMS mutagenesis library in Col-0 back ground. Compared with the wild type,F03-06 mutant exhibited smaller pale green rosette leaves, dark veins and also retarded growing and dwarf plant size. Genetic analysis indicated that the F03-06 mutant phenotype was controlled by a single recessive nuclear locus. Based on the map-based cloning approach and DNA sequencing,there was a single nucleotide mutation at the +865th base pair within the gene At5g54810 were found which was reported to encode the β subunit of tryptophan synthetase. In addition,the loss function mutants of At5g54810 exhibit the similar phenotype to that of F03-06,At5g54810 could correspond to the mutation gene in F03-06 background. This work will provide new genetic material for studying and revealing the mutual regulation mechanisms between tryptophan synthesis and chloroplast development.
Key words:leaf color mutant;map-based cloning;chloroplast development;tryptophan biosynthesis
光合作用是地球上規模最大的能量转换形式,是生物界几乎所有物种赖以生存的关键。叶绿体是植物进行光合作用的重要细胞器,具有半自主性,具备独立的DNA和蛋白质合成体系[1]。叶绿素是植物叶绿体内参与光合作用的重要色素,由于其对400~700 nm波长范围内的绿光吸收值低,所以大多数的植物叶片都呈现绿色[2],但在某些特殊情况下,直接或者间接影响叶绿素的合成或者降解过程,造成植物体内叶绿素的变化,就会使叶色发生变异,形成叶色突变体[3]。叶色突变大致分为白化、黄叶、浅绿、深绿、黄绿、绿黄、条纹和斑点等类型,其突变的分子机制也较为复杂,植物叶绿素合成途径、血红素到光敏色素生色团生物合成途径的任何基因发生突变,都会导致叶色突变体的形成[4]。另外,细胞核编码的叶绿体基因发生突变也会导致叶色变异[5]。目前,叶色突变体已广泛应用于基础理论研究和实践生产,利用叶色突变体研究植物光合作用机制,以及培育观赏植物等。因此,发掘和筛选叶色突变体,克隆和鉴定突变基因的生物学功能具有重要的理论意义和实际应用价值。
本研究在大规模遗传诱变筛选中获得了一个拟南芥叶色突变体F03-06,该突变体莲座叶与野生型相比叶色黄绿、叶脉深绿色、叶片较小、呈圆形、叶柄短,植株整体生长缓慢,株型矮小。利用图位克隆技术[6],通过粗定位和精细定位以及DNA测序分析,确定该突变基因为At5g54810,它编码拟南芥色氨酸合成酶的β亚基[7,8],为进一步解释色氨酸合成途径与植物叶绿体发育之间的调控机制奠定基础。
1 材料与方法
1.1 材料
Columbia(Col-0)和Lansberg erecta(Ler)生态型野生型拟南芥种子由本实验室保存;Col-0背景的甲基磺酸乙酯(Ethyl methylsulfonate,EMS)突变体库由本实验室创制保存。
1.2 试验方法
1.2.1 植物材料的种植和培养方法 将Col-0背景的EMS诱变库按pool播种在进口品氏基质泥炭土(Pindstrup Substrate Peat Moss)上,4 ℃处理3 d保证种子发芽的一致性,随后移入植物生长间培养,培养条件为24 h持续光照,温度(20±2) ℃,相对湿度70%。培养2周左右待植物长出第3、第4片真叶时观察叶片颜色,筛选叶色异常的植物作为潜在的叶色突变体。
1.2.2 突变体遗传背景的纯化和遗传学分析 将挑选出的表型明显的突变体与野生型Col-0连续回交3次,纯化突变体的遗传背景并获得BC3种子。同时,在突变体与野生型Col-0回交的过程中,通过观察杂交F1代植株表型判断突变的显隐性;通过统计F2代群体中的分离比判断该突变体是否由单基因突变造成。另外,通过正反交试验验证突变位点是否为细胞核遗传。
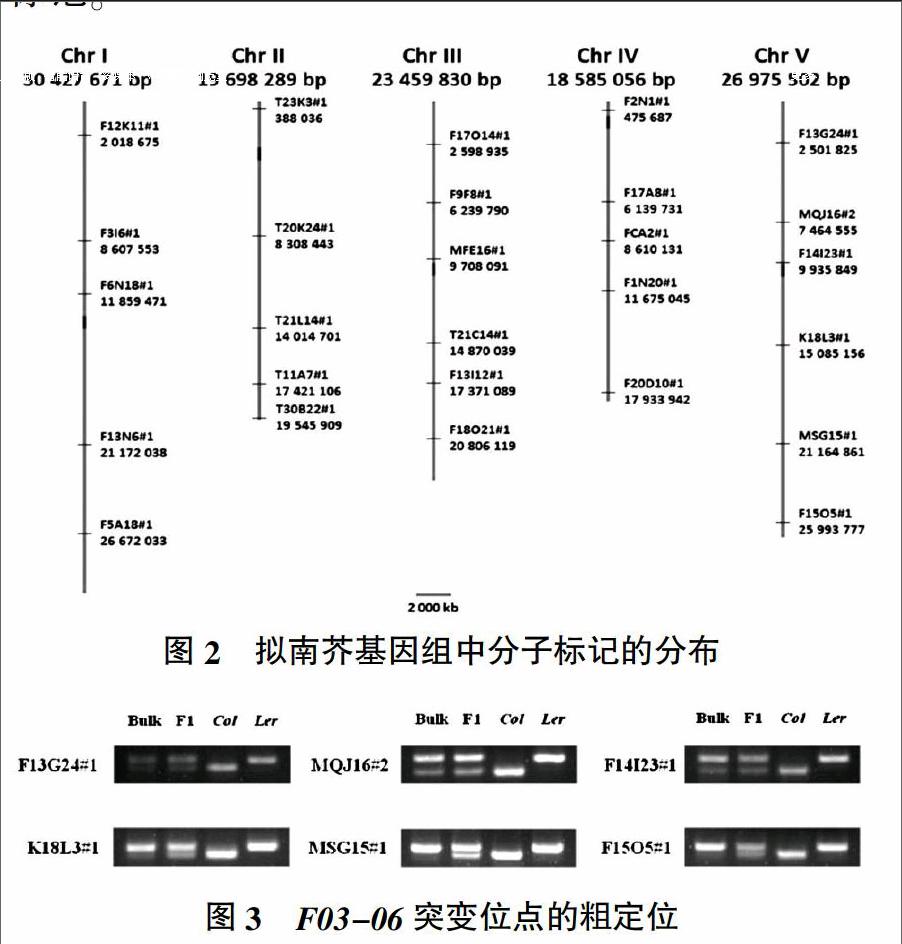
1.2.3 图位克隆 首先将背景纯化的突变体与Ler生态型拟南芥进行杂交,在杂交F2代植株中挑选具有突变体表型的植株作为图位克隆的作图群体。通过CTAB法提取约95棵突变体植物DNA并进行混合构建1个DNA混合池,利用已经公布的均匀分布拟南芥5条染色体的27对分子标记为引物进行初步定位。确定突变位点的染色体区间和侧翼分子标记后,继续扩大作图群体,增加分子标记密度进行精细定位,进一步缩小突变位点所在区间范围。
1.2.4 候选基因的确定 根据精细定位的区间,从拟南芥基因组数据库网站(www.arabidops-is.org)上获得区间内所包含的基因,查看基因注释信息及相关参考文献,筛选出候选突变基因,然后对这些候选突变基因设计引物,进行PCR扩增并测序,最终确定出突变位点。
2 结果与分析
2.1 F03-06突变体的获得及表型分析
在对以Col-0背景构建的EMS诱变库的筛选过程中,获得一个叶色突变体,根据命名系统,将其定名为F03-06(代表第三个诱变pool中筛选到的第6个突变体)。通过与Col-0野生型连续回交3次,F03-06的突变表型稳定。与Col-0野生型相比,F03-06突变体叶色黄绿、叶脉深绿色、叶形小圆、叶柄短,植株总体生长缓慢,且株型矮小(图1)。由于F03-06突变体表型明显,所以决定克隆突变基因,以期发现调控植物叶绿体发育的新的遗传因子。
正反交试验结果显示,无论是正交还是反交,所获得的F1代植物均表现与野生型一致的表型,表明突变体为该基因的隐性突变体。且F1自交后代F2中野生型表型与突变体表型个体的分离比为3∶1,符合孟德尔隐性单基因遗传规律,这说明F03-06突变表型是受隐性的单个核基因控制。
2.2 F03-06突变基因定位
2.2.1 F03-06突变位点的粗定位 将F03-06 BC3突变体植物与Ler生态型拟南芥进行杂交,在杂交F2代植株中挑选具有突变体表型的植株作为图位克隆的作图群体。利用已经公布的均匀分布拟南芥5条染色体的27个分子标记(图2)和突变体DNA混合池bulk进行染色体粗定位,结果发现突变位点与第5条染色体[9]上的分子标记MSG15#1(21 164 861 bp)连锁较为紧密(图3)。4条泳道中样品从左到右依次为bulk、F1、Col-0和Ler,F1、Col-0与Ler作为对照,以bulk为模板的PCR产物在分子标记MSG15#1处只扩增出明显的Col-0条带,而其余分子标记处,以bulk为模板的PCR产物均扩增出Col-0与Ler 2条条带,说明突变位点不与这些分子标记连锁或者不在这些分子标记附近。
以bulk中的95个突变体DNA为模板,以MSG15#1和新设计的分子标记MNC17#1为引物进行PCR扩增,结果显示突变位点位于分子标记MSG15#1和MNC17#1之间,所以将分子标记MSG15#1和MNC17#1作为后续定位的侧翼分子标记。
2.2.2 突变位点的精细定位 为了进一步缩小突变位点所在的区间,通过在侧翼分子标记区间内增加分子标记密度和扩大作图群体的数量,对F03-06突变位点进行了精细定位。利用已有的拟南芥Col-0生态型和Ler生态型基因组数据库,在侧翼分子标记区间内设计了5个新的插入/删除(In/Del)分子标记(表1)。以这些分子标记为引物,通过对F2作图群体中600株突变体表型植物的基因型进行分析,最终将突变基因定位在第5条染色体上分子标记MRB17#1(22 194 518 bp)和MCO15#1(22 401 666 bp)之间(图4)。该区间的物理距离为207 148 bp,在分子標记MRB17#1和MCO15#1处的交换率分别为0.08%和0.49%。
2.2.3 候选基因的筛选与初步确定 确定了F03-06突变位点所在的区间后,为了进一步确定造成F03-06突变表型的基因,查询了拟南芥基因组数据库(www.arabidopsis.org)。分子标记MRB17#1(22 194 518 bp)与MCO15#1(22 401 666 bp)所包含的染色体区间中共覆盖64个基因。其中基因At5g54810被报道定位在叶绿体中,编码拟南芥色氨酸合成酶的β亚基,并且At5g54810基因的功能缺失突变smo1/trp2-301、trp2-8和trp2-1与F03-06突变体的表型相似,与野生型相比,表现为叶色黄绿、叶脉深色、叶形小圆、叶柄短,整体生长缓慢,株型矮小[10](图5)。
根据F03-06突变体的表型及突变位点所在的区间,推测At5g54810基因突变很有可能是造成F03-06突变表型形成的原因。为了证实这个推测,设计了At5g54810基因特异性引物(表2),以F03-06BC3突变体DNA为模板对At5g54810基因进行PCR扩增并对PCR产物进行测序。测序结果显示,At5g54810基因的第+865处碱基由鸟嘌呤(G)突变为腺嘌呤(A),从而使所编码的丙氨酸(A)变为苏氨酸(T)(图4、图6)。这说明At5g54810基因的单碱基突变有可能是造成F03-06突变表型产生的原因,At5g54810有可能就是F03-06突变基因。
3 小结与讨论
模式植物拟南芥基因生物学功能的解析对于其他植物功能基因的研究意义重大,其研究方法和思路可以为其他植物特别是农作物和经济作物中与重要农艺性状相关的基因功能研究提供参考和借鉴。本研究通过对拟南芥Col-0野生型EMS诱变库的筛选获得一个拟南芥叶色突变体F03-06。与野生型相比,该突变体莲座叶色黄绿,叶形呈小圆形,植株整体生长缓慢,株型矮小。通过图位克隆和测序,证实F03-06突变体背景中At5g54810基因发生了单碱基突变(第+865处碱基由鸟嘌呤突变为腺嘌呤),由于EMS属于烷化诱变剂,能使DNA链中的鸟氨酸烷基化,烷化的鸟氨酸与胸腺嘧啶配对,代替胞嘧啶,从而在后续的DNA复制中发生碱基替换,即G∶C變为A∶T。对F03-06突变体背景中At5g54810基因的测序结果符合EMS诱变所形成的碱基替换,所以认为F03-06突变表型可能是由于At5g54810基因的单碱基突变所造成的。At5g54810基因也被称为TBS1,被认为是编码拟南芥色氨酸合成酶的β亚基。色氨酸不仅是合成蛋白质也是合成许多其他植物代谢产物如激素[11]等所必需的,色氨酸合成酶参与色氨酸合成的重要步骤[7],色氨酸合成途径受阻在细胞水平上影响细胞伸长、核内复制等过程,在整体水平上也使植株表现出明显的发育缺陷表型,如植株矮小、叶色黄绿、叶脉深色等。尽管研究者已经观察到色氨酸合成与植物叶绿体发育之间存在调控关系,但是具体的作用机制仍不明确[12]。
本试验所获得的F03-06突变体为进一步研究At5g54810基因的功能提供了新的遗传材料,为深入研究色氨酸与植物叶绿体发育的调控关系奠定了基础。
参考文献:
[1] 李保珠,赵孝亮,彭 雷.植物叶绿体发育及调控研究进展[J]. 植物学报,2014,49(3):337-345.
[2] GUTIRREZN M,GILLMORC C,JIMNEZ L,et al.CHLOROPLAST BIOGENESIS genes act cell and noncell autonomously in early chloroplast development[J].Plant Physiology,2004,135:471-482.
[3] 邢 才,王贵学,黄俊丽,等.植物叶绿素突变体及其分子机理的研究进展[J].生物技术通报,2008(5):10-12.
[4] 何 冰,刘玲珑,张文伟,等. 植物叶色突变体[J].植物生理学通讯,2006,42(1):337-345.
[5] LAULE O. Crosstalk between cytosolic and plastidial pathways of isoprenoid biosynt-hesis in Arabidopsis thaliana[J].The Proceedings of the National Academy of Sciences,2003,100(11): 6866-6871.
[6] LUKOWITZ W,GILLMOR C S,SCHEIBLE W R.Positional cloning in Arabidopsis[J].Plant Physiology,2000,123(3):795-806.
[7] JING Y J,CUI D Y,BAO F,et al.Tryptophan deficiency affects organ growth by retarding cell expansion in Arabidopsis[J].The Plant Journal,2009,57:511-521.
[8] SANJAYA P H,SU R C,TEIXEIRA DA SILVA J A,et al. Plant native tryptophan synthase beta 1 gene is a non-antibiotic selection marker for plant transformation[J].Planta,2007,225:897-906.
[9] TABATA S,KANEKO T,NAKAMURA Y.Sequence and analysis of chromosome 5 of the plant Arabidopsis thaliana[J].Nature,2014,408(6814):823-826.
[10] YIN R H,GIERL A,GLAWISCHNIG E,et al. Plants contain two distinct classes of functional tryptophan synthase beta proteins[J]. Phytochemistry,2010,71:1667-1672.
[11] LEHMANN T,HOFFMANN M,HENTRICH M,et al. Indole-3-acetamide-depende-ntauxin biosynthesis:A widely distributed way of indole-3-acetic acid production?[J].European Journal of Cell Biology,2010,89:895-905.
[12] MANUELL A L,WU J,MAYFIELD S P. Chloroplast translation regulation[J].Photosynthesis Research,2007,94(2-3):359-374.
