超声辅助提取筋骨草中生物碱的工艺优化
2017-03-18陈飞何先元周卯勤程鹏黄英
陈飞++何先元++周卯勤++程鹏++黄英如
摘要:通过研究料液比、乙醇体积分数、提取温度和超声时间对筋骨草[Schnabelia tetradonta (Sun) C. Y. Wu et C. Chen]中生物碱得率的影响,优选出超声最佳工艺,并以盐酸小檗碱为标准对照测定野生和家种筋骨草生物碱的得率。结果表明,生物碱的最佳提取工艺为药材加25倍的60%乙醇溶液(pH=1),50 ℃水浴1 h后超声30 min,得到野生筋骨草生物碱得率为0.072%,家种筋骨草生物碱得率为0.099%。该提取工艺合理,生物碱得率较高,为筋骨草生物碱的提取提供参考依据。
关键词:筋骨草[Schnabelia tetradonta (Sun) C. Y. Wu et C. Chen];生物碱;提取工艺;超声辅助提取
中图分类号:R284.2 文献标识码:A 文章编号:0439-8114(2016)21-5591-04
DOI:10.14088/j.cnki.issn0439-8114.2016.21.039
Optimization of the Extraction Technology of Alkaloids from Schnabelia tetradonta (Sun) C. Y. Wu et C. Chen by Ultrasound-Assisted Method
CHEN Fei1,HE Xian-yuan1,2,ZHOU Mao-qin2,CHENG Peng1,HUANG Ying-ru1
(1.College of Traditional Chinese Medicine/Experimental Management Center,Chongqing Medical University,Chongqing 401331,China;
2.Chongqing Institute of Medicinal Plant Cultivation,Chongqing 408435,China)
Abstract:The optimal extraction condition with ultrasonic was selected by studying the effect of solid-liquid ratio,ethanol concentration,extracting temperature and ultrasonic time on alkaloids yield of Schnabelia tetradonta(Sun) C. Y. Wu et C. Chen. Calculating alkaloids yield in wild and non-wild Schnabelia tetradonta(Sun) C. Y. Wu et C. Chen by using berberine hydrochloride as the standard control. The results showed the best process condition of alkaloids were adding 25 times amount of 60% ethanol solution(pH=1),1 h of extraction time with water bath and 30 min with ultrasonic at 50 ℃. Alkaloids yield could reached 0.072% in wild Schnabelia tetradonta(Sun) C. Y. Wu et C. Chen and 0.099% in non-wild Schnabelia tetradonta(Sun) C. Y. Wu et C. Chen. The extraction technology is feasible and alkaloids yield is higher,which can provide reference for the extraction of alkaloids from Schnabelia tetradonta (Sun) C. Y. Wu et C. Chen.
Key words:Schnabelia tetradonta (Sun) C. Y. Wu et C. Chen;alkaloids;extraction technology;ultrasonic-assisted extraction
筋骨草[Schnabelia tetradonta (Sun) C. Y. Wu et C. Chen]是唇形科四棱草屬植物,为中国所特有,也是重庆市国家级自然保护区金佛山8大特有药材之一,也称为四齿四棱草、四棱筋骨草。以全草入药,具有祛风除湿、行血通络、清热解毒和下火的功效[1]。民间还用来炖猪蹄猪脚、泡酒,用于治疗风湿骨痛、四肢麻木、跌打肿痛、胸胁胀闷、闭经等病症。由于疗效显著,民间应用广泛,野生资源供不应求。研究者从筋骨草根部和地上部分的乙醇提取物中分离纯化出5个环肽化合物和2个新二萜化合物,并且鉴定了其结构[2-4]。李帮经等[5]从筋骨草地上部分水煮提取物中分离得到了11个化合物。程鹏等[6]对筋骨草的抗运动疲劳作用进行了对比研究,发现筋骨草有抗运动疲劳的作用。生物碱大多数具有明显的生物活性,有抗肿瘤作用和抗菌作用[7-9],是多种药用植物的有效成分。但是有关筋骨草中生物碱等成分的研究报道较少,因此,本研究采用超声辅助提取筋骨草中生物碱,并对野生和家种筋骨草生物碱含量进行对比,为筋骨草的开发利用提供依据。
1 材料与方法
1.1 材料
家种筋骨草(生长年限为半年)和野生筋骨草采自重庆市南川区金佛山自然保护区,经重庆市药物种植研究所刘正宇研究员鉴定为唇形科筋骨草。
1.2 仪器
FW177型中草药粉碎机(天津市泰斯特仪器有限公司);DGG-9240B型电热恒温鼓风干燥箱(上海森信实验仪器有限公司);RE-52型旋转蒸发仪器(上海亚荣生化仪器厂);药典筛(浙江上虞市五四仪器厂);TU-1901型双光束紫外可见分光光度计(北京普析通用电器有限责任公司);UV-1200型紫外可见分光光度计(上海美谱达仪器有限公司);SB-5200DT型超声波清洗机(宁波新芝生物科技股份有限公司,200 W);SHZ-D(Ⅲ)型循环水式真空泵(巩义市予华仪器有限责任公司)。
1.3 试剂
盐酸、无水乙醇、冰醋酸、浓氨水、三氯甲烷[AR,重庆川东化工(集团)有限公司];盐酸小檗碱标准品(BR,UV≥98%,批号130412,北京德威钠生物技术有限公司);溴甲酚绿(AR,上海试剂三厂)。
1.4 方法
1.4.1 筋骨草中生物碱成分的定性测定 称取10 g野生筋骨草粉末,加蒸馏水加热煮沸3次,合并滤液。滤液用70%的乙醇进行醇沉,过滤后浓缩成膏状,浸膏加5%盐酸溶解后过滤,滤液用于生物碱成分的定性测定。分别用碘化铋钾、苦味酸和碘-碘化钾试验[10]检验是否含有生物碱。
1.4.2 溶液的配制 对照溶液:精密称取105 ℃烘干至恒重的盐酸小檗碱对照8 mg,置于50 mL棕色容量瓶中,加无水乙醇适量,超声使其溶解,放冷后加无水乙醇稀释至刻度,摇匀,即得浓度为0.16 mg/mL的盐酸小檗碱标准液。
筋骨草样品溶液:精密称取野生筋骨草粉末2 g(过3号药典筛),置于具塞锥形瓶中,精密加入70%的酸性乙醇[11,12](pH=1)40 mL,50 ℃水浴1 h后超声(200 W,40 kHz)提取20 min,抽滤,滤液浓缩至糖浆状,加入5%盐酸溶解后用浓氨水调节pH为10。用氯仿萃取2次,共50 mL,合并萃取液并用氯仿定容至50 mL棕色容量瓶中,即得到野生筋骨草样品溶液,备用。
1.4.3 测定方法的建立
1)溶液的显色:精密量取2 mL筋骨草样品溶液,依次加入pH为4.0的缓冲液4 mL,溴甲酚绿溶液2 mL,三氯甲烷5 mL,剧烈振摇后用分液漏斗静置40 min分層,分别取三氯甲烷层溶液进行比色。
2)测定波长的选择:精密量取筋骨草样品溶液和盐酸小檗碱标准液各2 mL,以70%乙醇溶液做空白,显色完成后,在200~800 nm波长范围内扫描。以二者共同的最大吸收波长为检测波长。
3)标准曲线的绘制:精密量取盐酸小檗碱标准液0、0.1、0.2、0.3、0.4、0.5、0.6 mL分别置于具塞试管中,加无水乙醇补充至1 mL,显色完成后,用0 mL的试管做空白对照,立即在最大吸收波长下测定吸光度。以吸光度A为纵坐标,以标准品浓度C为横坐标(mg/mL),绘制标准曲线。
4)筋骨草生物碱得率的计算:精密吸取筋骨草样品溶液2 mL,按显色完成后立即测定吸光度,由回归方程计算出供试样品中生物碱得率。生物碱得率=提取液中生物碱质量/筋骨草质量×100%。
1.4.4 筋骨草生物碱提取的优化 单因素试验:研究不同料液比(1∶10、1∶15、1∶20、1∶25、1∶30)(g∶mL)、乙醇体积分数(40%、50%、60%、70%、80%)、提取温度(40、50、60、70、80 ℃)、超声时间(20、30、40、50、60 min)对筋骨草生物碱得率的影响。
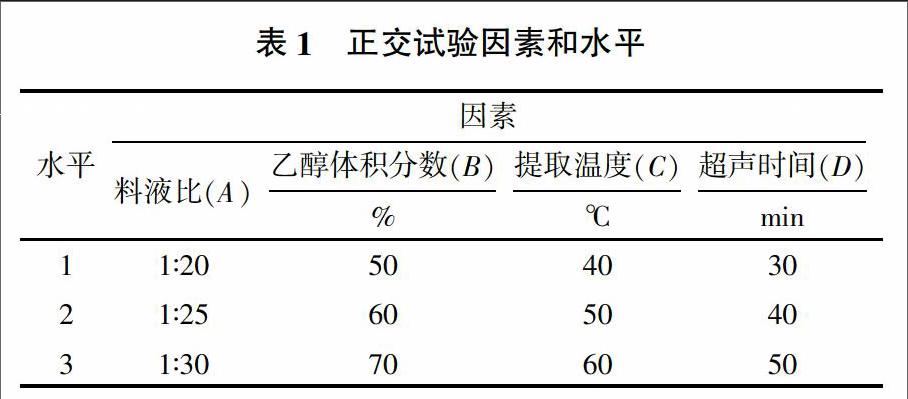
在单因素试验的基础上,选取了料液比、乙醇体积分数、提取温度、超声时间4个对筋骨草生物碱提取影响比较显著的因素,设计L9(34)正交试验(表1),研究其对筋骨草生物碱得率的影响,确定最佳提取工艺条件。
1.4.5 多糖提取的方法学考查
1)验证试验:准确称取野生筋骨草粉末3份,每份2 g,按照最佳提取工艺提取,显色完成后立即测定吸光度,计算野生筋骨草生物碱平均得率和含量。以相同方法计算家种筋骨草生物碱平均得率和含量。
2)精密度试验:准确称取野生筋骨草粉末2 g,按照最佳提取工艺提取,显色完成后立即连续7次测定溶液的吸光度,计算其RSD值。
3)稳定性试验:准确称取野生筋骨草粉末2 g,按照最佳提取工艺提取,显色完成后立即测定吸光度,之后每隔30 min测一次吸光度,考察4 h内生物碱的稳定性。家种筋骨草生物碱测定方法同上。
2 结果与分析
2.1 生物碱标准曲线的绘制
盐酸小檗碱和筋骨草样品溶液在415 nm处均有最大吸收波长,故选择415 nm为检测波长。将不同浓度的盐酸小檗碱标准液在最大吸收波长415 nm处测定吸光度。以吸光度A为纵坐标,盐酸小檗碱标准液浓度为横坐标(mg/mL),绘制标准曲线。得到线性回归方程Y=8.093 8x-0.054 2,R2=0.987 5。线性范围0.016~0.096 mg/mL。
2.2 单因素试验结果
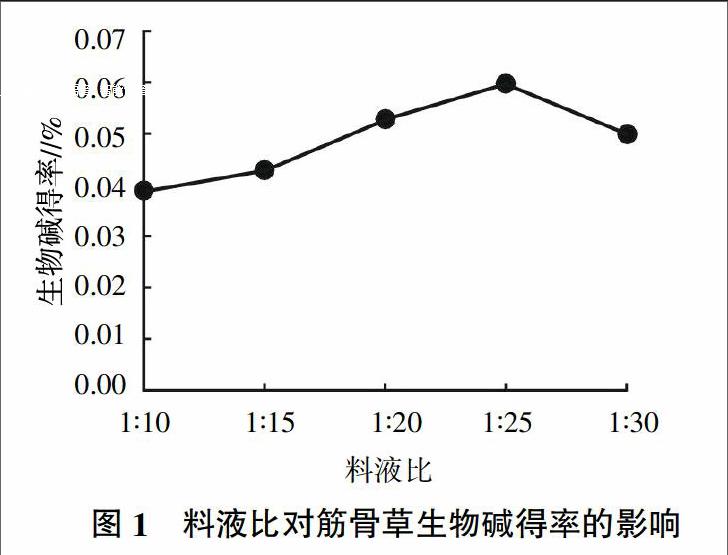
2.2.1 不同料液比对筋骨草生物碱得率的影响 如图1所示,随着料液比的增大,筋骨草生物碱得率先升高后下降,料液比为1∶25时,生物碱得率最高。料液比过低,溶剂量太少,导致提取过程中提取物含量过高,不利于未提取出的目标成分的扩散。但料液比过高不仅造成溶剂浪费,提取的杂质含量相应增加,而且造成后续生物碱提取液溶剂浓缩工艺困难加大,影响分离纯化效果。因此,确定适宜的料液比为1∶25。
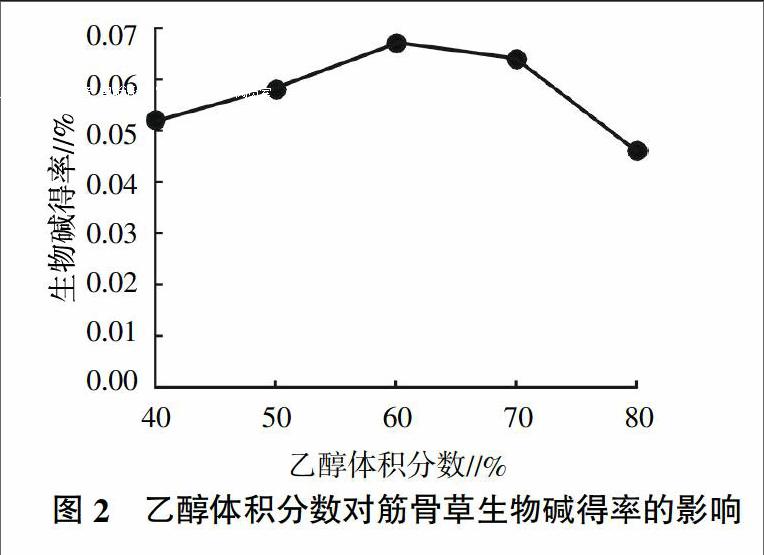
2.2.2 不同乙醇体积分数对筋骨草生物碱得率的影响 如图2所示,随着乙醇体积分数的增加,筋骨草生物碱的得率增加,但当乙醇体积分数达到60%后,再增加乙醇体积分数,生物碱得率反而下降。这是因为乙醇对植物细胞的穿透能力较好[13],因此一定程度上,随着乙醇体积分数升高生物碱提取效率增大。但是乙醇体积分数太高,会造成原料浪费,增加成本,同时脂溶性杂质相应增加。因此,选择60%乙醇提取较好。
2.2.3 不同提取温度对筋骨草生物碱得率的影响 试验结果如图3所示,随着提取温度的升高,筋骨草生物碱得率逐渐增高,但提取温度超过50 ℃后,生物碱得率下降,可能是随着提取温度的升高,细胞壁溶胀破碎的程度增加,生物碱溶出增加。但提取温度达到一定程度后,提取出的脂溶性杂质也增多,生物碱类物质与杂质发生反应,生物碱结构被破坏,生物碱得率有所下降。因此,选择50 ℃为最佳提取温度。
2.2.4 不同超声时间对筋骨草生物碱得率的影响 由图4可知,随着超声时间的延长,筋骨草生物碱得率增加,但超声时间超过40 min后,生物碱得率反而下降,可能是随着超声时间延长,生物碱受热时间过长,造成生物碱分解或与其他物质发生化学反应,使生物碱得率降低。另外提取时间延长,所提取的杂质含量增加,会加重后续分离纯化工序的工作量。因此,超声时间选择40 min为佳。
2.3 正交试验结果
由表2可知,各因素对筋骨草中生物碱得率的影响大小顺序为乙醇体积分数>超声时间>料液比>提取温度。生物碱最佳提取工艺组合是A2B2C2D1,即药材加25倍的60%乙醇溶液(pH=1),50 ℃水浴1 h后超声30 min,此时筋骨草的生物碱得率最高,高于其他试验组合的结果。
2.4 筋骨草生物碱最佳提取工艺的方法学考查
验证试验:野生筋骨草生物碱得率为0.072%,含量为0.72 mg/g,RSD=0.13%(n=3)。家种筋骨草生物碱得率为0.099%,含量为0.99 mg/g,RSD=0.20%(n=3)。
精密度试验:连续7次所测吸光度的RSD=0.02%(n=7),说明仪器精密度好。
稳定性试验:野生筋骨草吸光度结果RSD=0.174%(n=9),家种筋骨草的RSD=0.102%(n=9),说明在4 h内,野生和家种筋骨草生物碱采用本研究的提取方法和显色方法都比较稳定,尤其以家种筋骨草中生物碱更为稳定。
3 小结
从筋骨草中提取生物碱的最佳工艺条件为药材加25倍的60%乙醇溶液(pH=1),50 ℃水浴1 h后超声30 min,此时筋骨草的生物碱得率最高。野生筋骨草的生物碱得率为0.072%,生物碱含量为0.72 mg/g,家种筋骨草的生物碱得率为0.099%,含量为0.99 mg/g。
本试验采用超声提取技术,超声提取是一种节能、高效的现代高新技术,超声提取利用超声波产生的强烈的振动作用、空化效应和粉碎作用来提高生物碱类物质的提取效率。与传统方法比较,具有提取效率高、时间短、提取温度低等优点,适合于筋骨草生物碱的提取。此外,该方法提取液杂质少,有利于后续分离纯化,且成本低、环保、操作简单,是一种良好的提取生物碱的方法[14]。
参考文献:
[1] 张萃蓉,雷小英,曾维琼,等.四棱草和四齿四棱草开花生物学特性观察[J].植物学通报,1984,2(2-3):80-81.
[2] 窦 辉,廖 循,陈昌祥,等.四齿四棱草根部环肽化合物的分离及鉴定[J].高等学校化学学报,2004,25(10):1849-1852.
[3] 窦 辉,彭树林,李帮经,等.四齿四棱草根部的两个新二萜化合物[J].有机化学,2004,24(11):1469-1471.
[4] DOU H,ZHOU Y,PENG S L,et al.A New cyclic peptide from Schnabelia tetradonta[J].Chinese Chemical Letters,2003,14(9):934-935.
[5] 李帮经,陈昌祥,窦 辉,等.四齿四棱草水提取物的化学成分研究[J].天然产物研究与开发,2006,18(1):61-64,87.
[6] 程 鹏,陈 飞,何先元,等.四棱筋骨草等对小鼠抗运动疲劳比较研究[J].亚太传统医药,2014,10(13):9-11.
[7] 魯劲松,刘玉庆,李 明,等.黄连总生物碱对大鼠胃黏膜损伤的保护作用及其机制研究[J].中国中药杂志,2007,32(13):1333-1336.
[8] 张正付,郭 莹,魏雄辉.天然苄基异喹啉类抗肿瘤生物碱的筛选[J].中国中药杂志,2011,36(19):2684-2688.
[9] 陈莉华,张俊生,张 丽,等.湘西节节草总生物碱的提取及抑菌性研究[J].湖南农业科学,2011(9):101-104.
[10] 周 威,牟定浪,郝小燕.沙塘木总生物碱提取工艺研究[J].中国民族民间医药,2013,22(16):14-15,17.
[11] 魏秀德,杨 波,范 里,等.马钱子生物碱提取工艺的研究[J].吉林农业大学学报,2011,32(2):195-198.
[12] 刘 涛,李 娟,徐玉玲,等.苦参提取工艺优选[J].中国实验方剂学杂志,2012,18(20):58-60.
[13] 刘 红,董海丽.超声波辅助提取金钗石斛生物碱工艺优化[J].湖北农业科学,2013,52(8):1903-1904,1930.
[14] 孙良顺,郭勇全,申金龙,等.川贝中生物碱提取工艺优化[J].湖北农业科学,2010,49(2):424-426.
