利用渗透压研究猪卵母细胞发育过程中核迁移规律
2017-03-18肖红卫华再东张立苹李莉刘
肖红卫++华再东++张立苹++李莉++刘西梅++任红艳++华文君++毕延震++郑新民

摘要:本研究采用高渗操作液(氯化钠)处理体外成熟卵母细胞。结果表明,发现培养42 h的卵母细胞,中期核与第一极体刚开始分离。培养44 h的卵母细胞,中期核与第一极体已经分离,达到15°。培养46 h的卵母细胞,中期核与第一极体之间的角度达45°。培养48 h的卵母细胞,中期核与第一极体之间的角度达到近90°,中期核开始向卵母细胞中迁移。经过高渗处理的卵母细胞经过后续操作后可以得到克隆个体。结果表明,利用体外成熟培养42~44 h的卵母细胞进行去核操作,可以达到近100%的去核效率,而不会影响胚胎的正常发育。
关键词:猪卵母细胞;体外成熟;核移植;克隆胚胎
中图分类号:S828.3+5 文献标识码:A 文章编号:0439-8114(2016)21-5574-03
DOI:10.14088/j.cnki.issn0439-8114.2016.21.034
Use Osmotic Pressure to Study the Metaphase Nucleus Migration
in Porcine oocyte Development
XIAO Hong-wei,HUA Zai-dong,ZHANG Li-ping,LI Li,LIU Xi-mei,REN Hong-yan,
HUA Wen-jun,BI Yan-zhen,ZHENG Xin-min
(Institute of Animal and Veterinary Science,Hubei Academy of Agricultural Science/Hubei Key Lab of Animal Embryo and Molecular Breeding,Wuhan 430064,China)
Abstract: This experiment was conducted to research the nuclear migration rules in porcine oocytes development. Hypertonic oocyte manipulation medium(NaCl) was used to deal with the IVM oocytes. The results showed that the first polar body in the 42 h cultured oocytes were isolated from metaphase nucleus. In 44 h cultured oocytes,the metaphase nucleus and the first polar body had been separated,reaching 15 degrees. In 46 h cultured oocytes,the intermediate nucleus and the first polar body between the angle of 45 degrees. In 48 h cultured oocytes,the intermediate nucleus and the angle between the first polar body reached nearly 90 degrees,metaphase nucleus began to migrate to the oocytes. After the hypertonic treatment,the oocytes were treated with nuclear transplantation,and the clones were obtained. The results suggested that in vitro maturation of oocytes,the oocytes of 42~44 h could achieve nearly 100% of the nuclear efficiency without affecting the development of embryos.
Key words: porcine oocytes;IVM;nuclear transplatation;embryo clone
在进行核移植操作时,作为核受体的卵母细胞为早期胚胎的发育提供了大量必需的营养物质,为了后期胚胎的发育,操作者需要迅速判断卵母细胞质量。通常判断卵母细胞质量的依据有对卵母细胞形态和成熟度的考察,卵母细胞所处的成熟时期与盲吸去核的质量和效率密切相关,成熟的好坏直接影响着克隆胚胎能否最终发育成正常个体。
第一极体(First polar body,Pb1)出现后,随着培养时间的增加,第一极体与中期染色體的位置发生变化,中期染色体逐渐偏离Pbl向卵中央移位,有的卵Pbl退化,而失去定位标志,以第一极体为参照的盲吸去核法对卵母细胞成熟后可以进行去核操作的窗口期的把握要求严格,必须要在第一极体与中期染色体的位置最靠近时操作最好。
卵母细胞的膜是个半透膜,具有完整功能细胞膜的卵母细胞具有生理学意义,在人类辅助生殖上已经开始利用渗透压筛选具有完整膜功能的精子,而在卵母细胞的筛选上还没有利用渗透压筛选优质卵母细胞的研究。在研究第一极体与中期染色体位置的方法上,通常采用荧光染料后进行研究,而该种染料对重构胚的发育影响很大。本研究从渗透压角度,研究卵母细胞的筛选以及卵母细胞体外成熟培养时间对第一极体与中期染色体位置变化的影响。
1 材料与方法
1.1 试验材料
卵母细胞的培养器皿购自Nunc公司;FBS购自Hyclone公司;其他药品除特殊注明外均购自Sigma公司。卵巢取自武汉某屠宰场。
1.2 主要溶液
洗卵液为改良TL-Hepes-PVA液;成熟液为改良的TCM199;操作液为添加0.017 5 g NaCl的Hepes-TCM-199;胚胎培养液为NCSU-23。
1.3 卵母细胞的体外成熟及核受体卵母细胞的准备
1)按孙健等[1]的方法准备真空泵及其附属装备,并调节负压值为0.02个大气压。用16号针头抽取卵巢上直径在3~6 mm的卵泡。显微镜下挑取颗粒细胞包裹完整、胞质均匀的卵丘卵母细胞复合体(Cumulus-oocyte complexes,COCs),将挑选的COCs放入成熟液中培养40~48 h,培养条件为39 ℃,5% CO2,饱和湿度。
2)培养40~48 h后,将卵母细胞移入0.1%透明质酸酶中在漩涡振荡仪上处理1 min,之后移入洗卵液中洗涤3次,换到新操作液里处理30 min后,在显微镜下观察。
1.4 试验设计
1.4.1 利用Spindle viewer观察卵母细胞 利用“1.3”所获得的卵母细胞,在显微镜下观察核的位置。
1.4.2 利用滲透压处理卵母细胞 利用“1.3”所获得的卵母细胞在高渗液处理,在显微镜下观察中期核突出现象。
1.5 核供体细胞准备
无菌操作取出出生后5 d的猪耳部组织,常规0.25%胰蛋白酶(GIBCO公司)消化法分离组织细胞,原代细胞采用DMEM(GIBCO公司)添加20%胎牛血清贴壁培养,传代细胞采用DMEM添加10%胎牛血清贴壁培养,培养条件为38.5 ℃,5%CO2、95%空气的气体环境,饱和湿度。用3~5代的接触抑制成纤维细胞用于核移植试验。
1.6 核移植及胚胎移植
1.6.1 去核/注核 将猪成熟卵和消化好的成纤维细胞放入覆盖有石蜡油的含有7.5 mg/L细胞松弛素B(Cytochalasins B,CB)的操作液中,在显微镜下采用盲吸法去核,用外径120~150 μm,内径25~30 μm的固定吸管固定卵母细胞,用去核针拨动卵母细胞使其旋转并使第一极体位于4~5点钟方向,用内径20~25 μm,尖端倾角为45°的去核针从3点钟方向刺进透明带并吸出第一极体(Frist polar body,Pbl)及其附近1/4~1/5胞质。
用Injection pipette从操作皿底捡拾呈单个存在的供体细胞,顺着去核后留下的孔进针,释放细胞进卵周隙中,并使之与猪卵母细胞膜紧密接触。
1.6.2 融合/激活 采用直流电介导融合/激活,参数为DC(直流电):1.0~1.5 kV/cm,1次脉冲,60 μs或1.3 kV/cm,2次脉冲,60 μs。
1.6.3 克隆胚的培养/胚胎移植 融合后的克隆胚在NCSU-23+7.5 μg/mL CB培养液中培养4 h后换成没有CB的NCSU-23培养液,经过24~48 h培养后利用外科手术法对前一天有静立反射的母猪进行胚胎移植。
1.7 仔猪出生
母猪移植胚胎后,单圈喂养,经过2个情期后用B超检测母猪妊娠状态,确认怀孕的母猪经过精心喂养后,待仔猪出生。
2 结果与分析
2.1 利用Spindle viewer观察卵母细胞
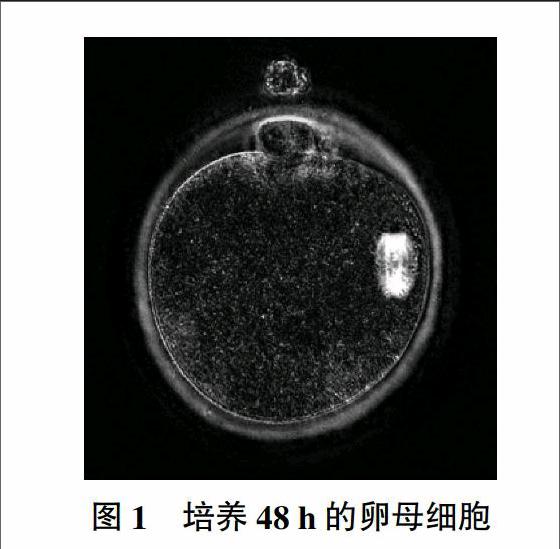
由图1可知,培养48 h的卵母细胞在Spindle viewer观察下,中期核与第一极体之间的角度达90°。
自从克隆羊“多莉”问世后,体细胞核移植技术突飞猛进,并且在优秀动物个体复制、濒危动物保护以及细胞分化研究中取得一些举世瞩目的成就,已成为生命科学研究的热点领域之一。由于猪在生理、形态上与人的器官非常相似,近年来应用猪的体细胞核移植技术研制人类基因疾病的动物模型,以及生产基因敲除猪、用于人异种器官移植成为猪核移植相关研究的热点方向之一[1,2]。就体细胞核移植而言,成功克隆出小猪的概率总体只有1%,极大制约核移植克隆猪相关工作的开展[3,4]。去核胞质能否成功融合是克隆成功的关键步骤之一,融合率的高低也直接影响到核移植的总体效率。影响融合效率的因素包括:去核胞质与供体之间的黏合方式,融合过程施加的交流电、直流电的频率、脉冲大小,以及融合的步骤、供体直径的大小等。Kragh等[5]应用两步融合参数,第一步融合后,间隔1 h,进行第二步融合,获得了较高的融合率及囊胚发育率。Lagutin等[6]应用一步融合法进行融合,缩短了核移植操作时间,同样得到较高的融合率并产出无透明核移植的猪。陆凤花等[7]在水牛核移植的研究中发现,交流电对于直径为20~30 μm的供体细胞的融合率无显著影响;但对于直径小于15 μm的供体细胞,能显著提高其融合率。本试验探讨不同电融合参数对融合效率的影响,以及电融合参数对猪手工克隆重构胚胎发育潜能的影响,从而优化猪HMC的技术体系。
1 材料与方法
1.1 主要试剂
胎牛血清(FBS)购于Gbico公司;TCM-199粉剂、DMEM粉剂购于美国Gbico公司;激素为eCG,hCG购于美国Sigma公司,其他化学试剂均购置于美国Sigma Aldrich公司。ECM2001型细胞融合仪,BTX 450型融合槽,DN-10式胚胎积聚针,卵母细胞成熟培养皿:35 mm及60 mm塑料平皿,去核切割刀自制,胚胎培养皿:四孔板。
1.2 卵母细胞的成熟
培养卵巢从南宁市的屠宰场获取,装入含有双抗的生理盐水中,用保温壶在4 h内送回实验室。先用普通生理盐水把卵巢冲洗干净,然后加入预热的含双抗的生理盐水,送回胚胎室抽取卵母细胞。用10 mL的注射器抽取卵巢表面2~6 mm的卵泡,卵泡液放入试管中静置,弃上清,留沉淀部分分装。挑选含有3层及以上有颗粒/卵丘细胞包被、折光性良好的卵丘卵母细胞复合体(COCs),放入成熟液中(含10 IU/mL hCG+10 IU/mL eCG)培养,20~22 h后换成不含激素的培养液,继续培养18~20 h至细胞成熟。
1.3 胎儿成纤维细胞的培养(组织块培养法)
胎猪从南宁市屠宰场获取,置于双抗生理盐水中,4 h内送回实验室。先用生理盐水清洗3遍,转移至无菌超净台,分离出部分大腿组织,之后用含双抗的PBS清洗2遍,放入60 mm的平皿,将其剪碎至2~3 mm的组织块,往培养皿中加入少量含10% FBS的DMEM培养液,用镊子将其均匀铺开,在皿盖作好标记,将其倒扣于培养箱中,4 h后加入少量培养液,防止组织块漂浮。24 h后在平皿底部加满培养液,48 h后继续观察成纤维细胞的生长状况,待成纤维细胞生长至90%左右汇合度时,进行传代,用作猪手工克隆供体细胞。
1.4 卵母细胞的去核方法
挑选优质的卵母细胞置于洗卵液中,吹打数次以去除颗粒细胞。然后将其移入链霉蛋白酶溶液中,透明带开始变形时,立即移入含20% FBS的洗液(T20)中洗涤,然后放入T20中等其恢复成圆形,用玻璃吸管将卵母细胞转移至切割液(含2.5 μg/mL CB)中,挑选恢复完整的卵母细胞用于去核。
极体定位法:挑取第一极体完整的细胞,将极体置于6点或12点的位置,用切割刀切去极体方向约1/3的卵胞质,去核胞质留做后续试验。
1.5 供/受体细胞的黏合/融合/激活采用一步融合法
黏合/融合/激活分為3步,首先进行黏合,然后再进行融合/电激活,最后进行化学激活。
黏合1:先用植物凝集素(PHA)把去核半卵和供体细胞黏合,形成半卵-供体细胞配对物;然后再用另一个去核半卵与配对物黏合,形成卵-供体-卵式的黏合体(形成三角状),移入电融合液中待融合。
黏合2:先用PHA把两个去核半卵和供体细胞黏合,然后再把供体细胞黏合于其中一个胞质的一端,形成卵-卵-供体式的黏合体,移入电融合液中待融合。
融合/电激活:将黏合体均匀放入融合槽中,加入适量的电融合液,采用一步融合法,设置不同的电融合参数:参数1(AC:6 V/cm;DC:1.6 kV/cm, 80 μs,1次)、参数2(AC:6 V/cm;1.8 kV/cm,80 μs,1次)、参数3(AC:6 V/cm;2 kV/cm,80 μs,1次)、参数4(AC:6 V/cm;2.2 kV/cm,80 μs,1次)。电激活完成后放入培养箱中恢复30 min,然后检查其融合/激活情况。
化学激活:将融合后的重构胚放入PZM-3中激活,其含5 μg/mL CB和10 μg/mL CHX,每滴激活液中放入1枚重构胚,激活4 h。
1.6 重构胚的微穴培养
为保证无透明带的HMC重构胚能够在相对独立的环境下生长,本研究采用微穴培养法。将激活后的胚胎转移到预先在CO2培养箱中平衡至少4 h并且有石蜡油覆盖的PZM-3中的微穴中。微穴的制备:用胚胎聚集针在四孔板底部均匀旋转扎微穴,微穴大小根据试验的要求设置,每个微穴中放入1枚胚胎。48 h观察卵裂率,160~168 h观察囊胚率。
1.7 囊胚细胞计数收集
第6~7天的囊胚,于CCM中清洗2~3次后,置于10 μmol/mL Hoechst 33342染液,室温中避光染色15 min,取出后再用CCM清洗2~3次,石蜡-凡士林封片,荧光显微镜下观察记录囊胚细胞总数目。
1.8 数据统计
试验数据由SPSS17.0软件进行统计分析。
2 结果与分析
2.1 不同黏合方法的融合效率
去核后的半卵胞质,用两种不同的方式进行黏合:卵-供体-卵、卵-卵-供体式黏合(图1),采用一步融合法,施以适当的融合参数。由表1可知,以卵-供体-卵的黏合方式进行融合,其融合率高达(88.26±0.58)%,显著高于以卵-卵-供体的黏合方式的融合率(75.38±0.82)%。
2.2 不同电融合参数对融合率的影响
卵-供体-卵式的黏合体用4组不同的参数进行融合/激活,参数1:AC:6 V/cm;DC:1.6 kV/cm,80 μs,1次脉冲;参数2:AC:6 V/cm;1.8 kV/cm,80 μs,1次脉冲;参数3:AC:6 V/cm;2 kV/cm,80 μs,1次脉冲;参数4:AC:6 V/cm;2.2 kV/cm,80 μs,1次脉冲。由表2可知,4组参数中,在条件不变的前提下(脉宽80 μs,1次脉冲),4组参数对HMC重构胚的胞质融合率差异不显著。对供体核的融合率而言,参数3、4与参数1、2相比,HMC重构胚的供体核融合率显著提高。
2.3 不同电融合参数对HMC重构胚发育效果的影响
由表3可知,两个参数对HMC重构胚卵裂率的影响差异不显著,而参数3的囊胚率以及细胞计数显著高于参数4。
3 讨论
去核半卵的黏合方式对胞质及供体核的融合起关键作用。卵-卵-供体式的黏合方式,比较简便利于操作,可提高操作效率;卵-供体-卵式的黏合方法,相对比较耗时,但可以提高融合效率。两个胞质将供体夹在中间,增加了供体细胞与胞质及胞质与胞质之间细胞膜的黏附能力,这样使整个细胞串的结构变得更稳定,由于它们紧密的接触也使融合率提高达(90%~95%)[8]。本试验采用一步融合法进行融合,比较卵-卵-供体、卵-供体-卵两种不同黏合方式对对胞质及供体核融合效率的影响,结果表明,卵-供体-卵式的融合率显著高于卵-卵-供体式。
目前核移植程序中,应用最广泛的电融合方法是在直流脉冲前施加适当的交流电脉冲。施加的交流电,能使细胞产生极化,偶极的形成促使细胞膜之间紧密接触并与细胞定位,同时膜-膜接触面垂直于电场,从而提高融合率。Smith等[9]的研究表明,融合时直流脉冲前施加交流电脉冲,对于提高融合率有较好的效果。因此本研究施以较低的交流电压6 V/cm,以提高胞质的融合率。就融合步骤而言,猪卵母细胞手工克隆研究中有报道使用两步融合法[10,11],也有报道使用一步融合法[12],这两种方法的融合效率相当,本研究为提高工作效率采用了一步融合法。Booth等[13]在猪卵母细胞手工克隆研究中,采用一步法进行胞质融合,其融合率达85%,本研究的融合效率达83.75%,81.78%与其保持一致。任子利等[12]研究表明直流脉冲在一定的范围内,随着脉冲的增大,融合效率随之提高,本研究中的直流脉冲从1.6 kV/cm增加至2.2 kV/cm,其融合效率也从73.39%增加到81.78%,与其结论相似。本研究比较了参数3:AC:6 V/cm;2 kV/cm,80 μs,1次脉冲;参数4:AC:6 V/cm;2.2 kV/cm,80 μs,1次脉冲对HMC重构胚发育效果的影响,结果表明,两个参数对HMC重构胚卵裂率的影响差异不显著,而参数3的囊胚率以及细胞计数显著高于参数4。这与李日聪等[14]的研究结果相一致。这可能是由于2.2 kV/cm的直流脉冲影响了卵母细胞膜上发生了较多的不可逆电击穿和裂解,从而影响了HMC重构胚的后续发育能力,进而影响了囊胚率以及囊胚的细胞总数。
4 结论
卵-供体-卵的黏合方式有利于提高胞质的融合率;融合参数3(2 kV/cm,80 μs,1次)和参数4(2.2 kV/cm,80 μs,1次)有利于提高去核胞质的融合率,两个参数对HMC重构胚的卵裂率的影响差异不显著,但参数3的囊胚率以及囊胚细胞总数显著高于参数4。
参考文献:
[1] 张德福,刘 东,汤琳琳,等.不同供体细胞及其处理对猪核移植重构胚体外发育的影响[J].遗传,2007,29(2):211-217.
[2] LAI L X,KOLBER-SIMONDS D,PARK K W,et al. Production of α-1,3-galactosyltransferase knockout pigs by nuclear transfer cloning[J].Science,2002,2959(5557):1089-1092.
[3] VAJTA G,ZHANG Y H,MACH?TY Z. Somatic cell nuclear transfer in pigs:recent achievements and future possibilities[J].Reproduction,Fertilityand Development,2007,19(2):403-423.
[4] COLMAN A. Review:Somatic cell nuclear transfer in mammals:Progress and applications[J].Cloning,1999,1(4):185-200.
[5] KRAGH P M,DU Y T,CORYDON T J,et al.Efficient in vitro production of porcine blastocysts by handmade cloning with a combined electrical and chemical activation[J].Theriogenology,2005,64(7):1536-1545.
[6] LAGUTINA I,LAZZARI G,GALLI C. Birth of cloned pigs from zona-free nuclear transfer blastocysts developed in vitro before transfer[J].Cloning and Stem Cells,2006,8(4):283-293.
[7] 陸凤花,石德顺,韦英明,等.不同融合条件对水牛体细胞核移植效果的影响[J].广西农业生物科学,2005,24(1):1-5.
[8] VAJTA G,LEWIS I M,TECIRLIOGLU R T. Handmade somatic cell cloning in cattle[J].Methods in Molecular Biology,2006, 348:183-195.
[9] SMITH L C,WILMUT I. Influence of nuclear and cytoplasmic activity on the developmentin-vitroof sheep embryos after nuclear transplantation[J].Biology of Reproduction,1989,40(5):1027-1035.
[10] LI J,VILLEMOES K,ZHANG Y H,et al. Efficiency of two enucleation methods connected to handmade cloning to produce transgenic porcine embryos[J]. Reproduction in Domestic Animals,2009,44(1):122-127.
[11] LUOY L,LI J,LIU Y,et al.High efficiency of BRCA1 knockout using rAAV-mediated gene targeting:developing a pig model for breast cancer[J].Transgenic Research,2011,20(5):975-988.
[12] 任子利,赵彦玲,杨小金,等.猪手工体细胞核移植电融合/激活参数的优化[J].畜牧兽医学报,2010,41(10):1246-1252.
[13] BOOTH PJ,TAN S J,REIPURTH R,et al. Simplification of bovine somatic cell nuclear transfer by application of a zona-free manipulation technique[J].Cloning and Stem Cells,2001, 3(3):139-150.
[14] 李日聪,王 锦,薛林涛,等.猪体细胞核移植电融合参数的研究[J].广西农业生物科学,2008,27(4):304-308.
2.2 利用渗透压处理卵母细胞
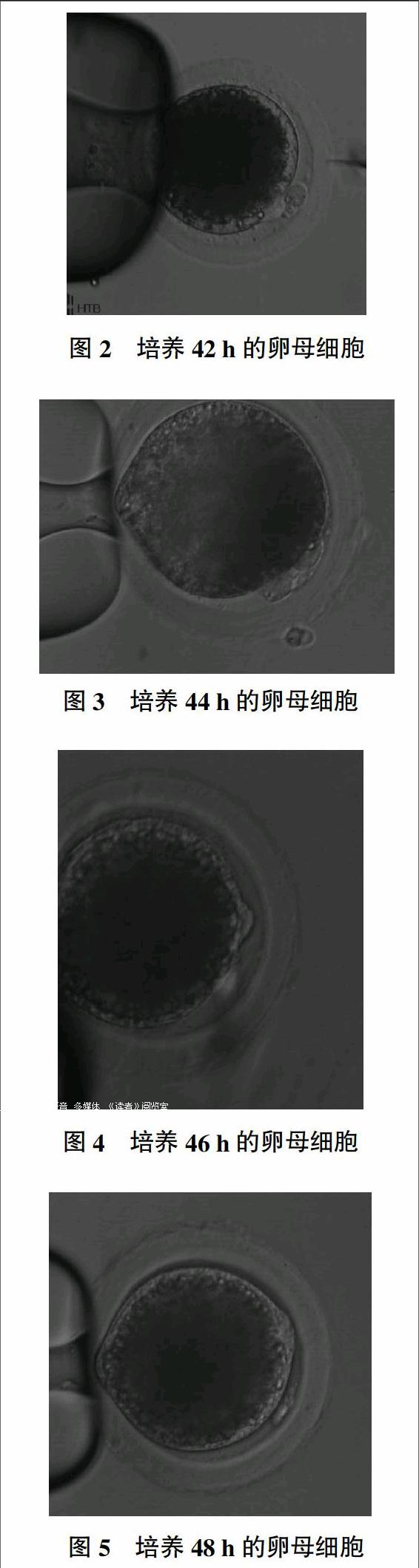
由图2至图5可知,培养42 h的卵母细胞,中期核与第一极体刚开始分离;培养44 h的卵母细胞,中期核与第一极体已经分离,达到15°;培养46 h的卵母细胞,中期核与第一极体之间的角度达45°;培养48 h的卵母细胞,中期核与第一极体之间的角度达到近90°,中期核开始向卵母细胞中迁移。
2.3 克隆猪的出生
本研究顺利得到克隆猪个体(图6),说明本研究中通过渗透压筛选的卵母细胞不影响克隆后代的出生。
3 讨论
在核移植中,供体细胞都是经过同期化处理过的,而大多数猪卵母細胞在经过去核、融合/激活后不能发育到囊胚,除了不理想的培养条件外,所处不合适时期的卵母细胞重编程供体细胞的程度不够很可能是主要的限制因素。在猪卵母细胞成熟过程中核质成熟不同步,在核成熟(以第一极体排出为标志)时胞质还没有成熟,而继续培养时中期核与第一极体之间的位置又会有变化。纺锤体成像系统可以对卵母细胞纺锤体进行观测来指导去核操作,对照纺锤体成像系统所得照片发现,只要去掉极体以及发现为中期核所在位置的胞质,去核效率可以达到近100%。
然而由于纺锤体成像系统比较昂贵,本课题组从渗透压角度来研究猪卵母细胞发育过程中核迁移的规律。Wang等人[2-4]研究发现,质量不同的卵母细胞的渗透调节机能存在差异,在核移植的去核操作中采用3SCOM处理小鼠卵母细胞,后经IVF和ET,已得到产仔。Zhou等[5]利用0.3 mol/L的蔗糖溶液处理排出第一极体的成熟卵母细胞,发现体外成熟的山羊卵母细胞在高渗液中呈现不同形态,根据这些形态选择卵母细胞可以获得比培养前按Ⅰ、Ⅱ、Ⅲ级卵标准筛选生物卵母细胞更高的注射后存活率、受精率和桑椹/囊胚率。这从另外的角度说明体外成熟的卵母细胞的质量跟是否排出第一极体没有关系。
本研究用氯化钠替代蔗糖添加到操作液中对培养后卵母细胞进行处理,发现培养42 h的卵母细胞,中期核与第一极体刚开始分离。培养44 h的卵母细胞,中期核与第一极体已经分离,达到15°。培养46 h的卵母细胞,中期核与第一极体之间的角度达45°。培养48 h的卵母细胞,中期核与第一极体之间的角度达到近90°,中期核开始向卵母细胞中迁移。在去核操作时选择在体外已经培养了42~44 h的卵母细胞,这样的卵母细胞中的极体和中期核之间的距离很小,在去核操作时能够达到近100%的去核效率。
由于在本研究中采用的是200枚以上的重构胚进行移植,没有研究渗透压处理对胚胎的囊胚发育率的影响。本研究中经过高渗处理的卵母细胞经过后续操作后可以得到克隆个体,与兰宗宝等[6]研究发现的适当提高培养液的渗透压不会损害猪胚胎结论相同。
高渗处理卵母细胞可以在去核环节提高去核效率,从而提高猪体细胞核移植技术体系的效率,为克隆猪的产业化奠定了基础。
参考文献:
[1] 孙 健,吴曙限,肖红卫,等.采用真空泵法快速获取猪卵母细胞[J].湖北农业科学,2009,48(10):97-100.
[2] WANG M K,LIU J L,LI G P,et al. Sucrose pretreatment for enucleation:An efficient and non-damage method for removing the spindle of the mouse MII oocyte[J].Molecular Reproduction & Development,2001,58(4):432-436.
[3] WANG M K,LI G P,CHEN D Y,et al. Progress on the estimation of the quality of oocytes,zygotes and early embryos[J].Journal of Reproductive Medicine,2002,11(3):171-175.
[4] WANG M K,CHEN D Y,LIU J L,et al.In vitro fertilization of mouse oocytes transfer of metaphase II chromosomes results in live births[J]. Zygote,2001,9(1):14-19.
[5] ZHOU J B,WU Y G,HAN D,et al.Effects of sperm and oocyte quality control on intracytoplasmic sperm injection(ICSI) in goats[J].Acta Biologiae Experimentalis Sinica,2004,37(5):367-374.
[6] 兰宗宝,王修文,何若钢,等.不同渗透压及山梨醇浓度对猪体外受精卵早期发育的影响[J].广西农业科学,2008,39(1):89-93.
