两种血清抗性检测方法的比较分析
2017-03-18徐旺烨樊琛李一经
徐旺烨++樊琛++李一经
摘要:采用流式细胞术法对大肠杆菌的血清抗性进行檢测,并与传统涂板法相比较,探讨流式细胞术在血清抗性检测方法中的应用。结果表明,两者呈正相关关系(P=0.034<0.05),流式细胞术法可以代替涂板法对大肠杆菌的血清抗性进行检测。该方法可以减少由于涂板不均匀、人工计数等造成的误差,且易操作、计算少、耗时少,数据更准确。
关键词:血清抗性;涂板法;流式细胞术法
中图分类号:S858.31 文献标识码:A 文章编号:0439-8114(2016)21-5571-03
DOI:10.14088/j.cnki.issn0439-8114.2016.21.033
Comparison and Analysis of Two Methods of Serum Resistance Tests
XU Wang-ye1,FAN Chen2,LI Yi-jing1
(1.College of Veterinary Medicine,Northeast Agricultural University,Harbin 150030,China;
2.Agricultural College of Liaocheng University, Liaocheng 252059,Shandong,China)
Abstract: Flow cytometry and plating method were used to detect serum resistance of Escherichia coli. The results showed that there was a positive correlation between flow cytometry and conventional plating method(P=0.034<0.05). The flow cytometry method can replace plating to test the serum resistance of E. coli. The method can reduce the error beause of uneven plating and counting by eyes. In comparison with plating method, this flow cytometry had less calculation and takes less time,but accurater data.
Key words: serum resistance; plating method; method of flow cytometry
大肠杆菌是自然环境中的常在菌,处于温血动物肠道下段[1],一般不会致病,但当饲养环境差,通风不好,营养缺乏或应激等情况出现会诱发鸡大肠杆菌病[2]。鸡大肠杆菌病的主要病型有腹泻、心包炎、眼炎、腹膜炎和输卵管炎、脐炎等[3]。鸡大肠杆菌病是集约化养殖厂经常发生的一类疾病,多危害雏鸡,死亡率为5%~50%[4],造成经济损失。大肠杆菌致病过程为:大肠杆菌在呼吸道上皮或肠黏膜上皮黏附聚集定殖,进一步a侵染机体并增殖,再进入血液循环,形成全身性感染。当大肠杆菌进入血液后,将面对来自于血液如溶菌素、补体等物质的杀菌作用,此时大肠杆菌对血清的抵御能力将关系到其能否进一步扩大对宿主机体的感染程度。Iss基因(Increased serum survival gene,Iss)的作用是增强大肠杆菌在血清中的存活能力,是大肠杆菌的重要毒力基因之一[5]。此外,外膜蛋白也具有抵抗血清杀菌作用的能力[6]。有学者通过检测吸光度的变化来衡量大肠杆菌的血清抗性[7],此种方法相对粗糙。通常都使用涂板的方法对大肠杆菌的血清抗性进行检测[8,9],本研究提供一种基于流式细胞术的方法来检测大肠杆菌的血清抗性,与传统的涂板法进行比较来验证其可靠程度及优势。
1 材料与方法
1.1 菌株
检测的20株大肠杆菌均为东北农业大学动物医学院保存菌株。
1.2 血清
血清为SPF鸡血清。
1.3 染料
LIVE/DEAD BacLight Bacterial Viability Kits购自赛默飞世尔科技公司。
1.4 涂板法
用接种环挑取平板上的单菌落,在LB液体培养基中37 ℃培养至对数期。取500 μL菌液5 000 r/min离心2 min,弃掉上清液,用生理盐水洗1~2次,重悬于0.9%的生理盐水,倍比稀释。再将100 μL细菌悬液与400 μL血清相混合,37 ℃温育2 h,分别于0、2 h取样平板计数。平行2次取平均值,计算2 h与0 h活菌数比值[10,11]。
1.5 流式细胞术法
血清抗性检测通过流式细胞术进行检测,将大肠杆菌划线培养,挑取单菌落于液体LB培养基中振荡培养至约108 CFU/mL,然后离心,经生理盐水漂洗2次,并用PBS悬浮、倍比稀释。将100 μL含有约107 CFU大肠杆菌的稀释液加入含有SPF鸡血清的生理盐水溶液中(终浓度为10%),37 ℃水浴1 h, 12 000 r/min离心3 min,弃上清,加入500 μL生理盐水,再加入预先混合好的染料(A液∶B液=1∶1)1.5 μL,混匀,避光染色15 min,再通过流式细胞仪检测,检测结果用活菌数与全菌体比值。
2 结果与分析
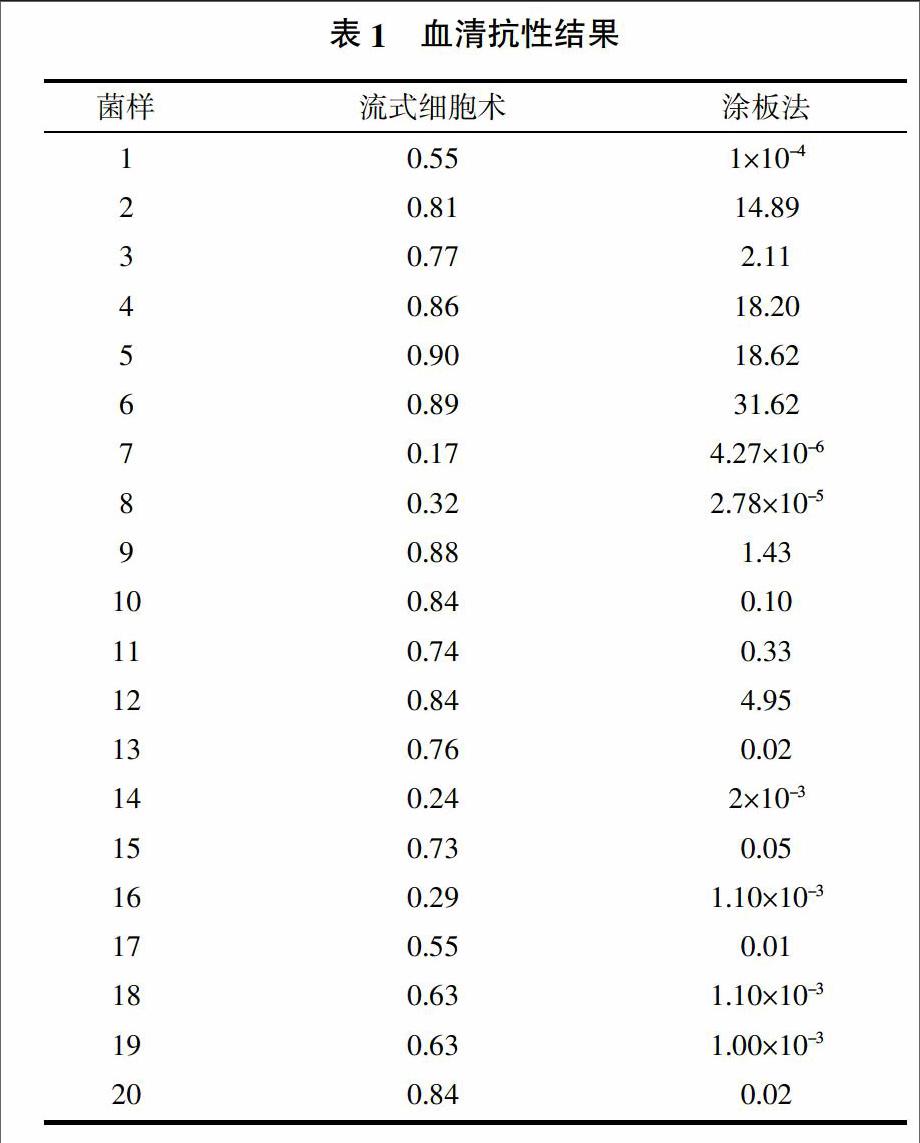
涂板法计算使用血清处理前后平板上活菌数的比值。流式细胞术法计算活菌和全菌体的比值。通过统计软件计算90%置信区间,流式细胞术法结果为(0.57,0.75),涂板法结果为(1.12,8.06)。在流式细胞术法中,血清敏感的菌株为1、7、8、14、16、17,中等敏感的菌株为11、15、18、19,血清抗性菌株为2、3、4、5、6、9、10、12、13、20。在涂板法中,血清敏感的菌株为1、7、8、10、11、13、14、15、16、17、18、19、20,中等敏感的菌株为2、3、9、12,血清抗性菌株为4、5、6。流式细胞术法95%置信区间为(0.58,0.78),血清敏感的菌株为1、7、8、14、16、17,中等敏感的菌株为3、11、13、15、18、19,血清抗性菌株为2、4、5、6、9、10、12、20。通过SPSS软件分析,二者显著正相关(P=0.034<0.05),说明流式细胞术检测方法是可行的,结果如表1所示。
3 讨论
流式细胞术使用的染料是基于PI和SYTO 9的原理对大肠杆菌进行染色,然后通过流式细胞术的方法进行检测。由于血清黏性较大,使用流式细胞术的方法进行检测时,离心及检测不易操作,故两种方法使用的血清浓度不同。但从两种方法的结果来看,使用涂板法检测的菌,有5株在血清处理后存活者很少,这几株菌相对的流式细胞术法检测的数值也较低,但不接近0,这是因为涂板法使用的血清浓度较大、作用时间较长,故对大肠杆菌的杀伤程度也较大。通过统计软件分别分析两种方法得到的结果90%置信区间,结果显示:流式细胞术的血清敏感菌株有6株,中等敏感的有4株,血清抗性的有10株;涂板法血清敏感的有13株,中等敏感的有4株,血清抗性的有3株。但是通过统计软件分析,二者呈显著正相关(P=0.034<0.05)。这说明,虽然使用的血清浓度不同,但血清对于大肠杆菌的杀伤作用趋势还是一致的。故流式细胞术法可以代替涂板法来进行血清抗性的检测。计算流式细胞术法95%置信区间,得到结果为(0.58,0.78),血清敏感菌株有6株,中等敏感的有6株,血清抗性的有8株。结果显示,置信区间的取值影响菌株血清抗性/敏感的判定。在实际应用中可根据实验需要,调整置信区间取值。
血清抗性是大肠杆菌毒力的重要组成部分,对于血清抗性的检测,也是检验大肠杆菌毒力的重要指标之一。对大肠杆菌使用涂板的方法检测大肠杆菌对血清的抵抗能力的方法较为繁琐,且涂板过程中容易受到涂得不均匀等因素的影响造成误差,对于单菌落的计数也比较费时费力,但对实验器材要求低,价格便宜。采用流式细胞术的方法来检测大肠杆菌的血清抗性,避免了涂板的操作误差、人工计数的误差,计算简单、准确,操作简便、省时省力。只是流式细胞术的方法需要特殊仪器及染料,价格相对昂贵。
参考文献:
[1] 黄 熙,邓小玲,黄 琼,等.2011年德国O104∶H4肠出血性大肠杆菌感染暴发疫情报告[J].中华预防医学杂志,2011,45(12):1133-1136.
[2] 钱 晨,顾 艳,杨建泉.扬州市郊区鸡大肠杆菌病的流行病学调查及诊治[J].中国家禽,2005,27(18):27-28.
[3] 汤小敏,吕亚辉.鸡大肠杆菌病防治[J].畜牧兽医杂志,2012, 31(5):125-127.
[4] 荣 禄,邝.禽病学[M].北京:中国农业出版社,1997.
[5] BINNS M M,DAVIES D L,HARDY K G.Cloned fragments of the plasmid ColV,I-K94 specifying virulence and serum resistance[J].Nature,1979,279(5716):778-781.
[6] NOLAN L K,WOOLEY R E,GIDDINGS C W,et al. Characterization of an avirulent mutant of a virulent avian Escherichia coli isolate[J].Avian Diseases,1994,38(1):146-150.
[7] SALARI S,SALEHI T Z,FASAEI B N,et al. Construction of an iss deleted mutant strain from a native avian pathogenic Escherichia coli O78∶K80 and in vitro serum resistance evaluation of mutant[J].Iranian Journal of Veterinary Medicine,2014, 8(1):1-8.
[8] DISSANAYAKE D R A,WIJEWARDANA T G,GUNAWARDENA G A,et al. Distribution of lipopolysaccharide core types among avian pathogenic Escherichia coli in relation to the major phylogenetic group[J].Veterinary Microbiology,2008, 132(s3-4):355-363.
[9] CHUBA P J,LEON M A,BANERJEE A,et al. Cloning and DNA sequence of plasmid determinant iss,coding for increased serum survival and surface exclusion,which has homology with lambda DNA[J].Molecular & General Genetics Mgg,1989, 216(2-3):287-292.
[10] 樊 琛,劉桂芹,王 宇,等.鸡源致病性大肠杆菌iss基因原核表达产物的免疫保护作用[J].畜牧与兽医,2010,42(11):84-86.
[11] 李贵萧,朱宗涛,康燕青,等.鸡大肠杆菌的血清抗性与致病性检验[J].江苏农业科学,2015(11):301-303.
