心血管疾病合并正常甲状腺功能病态综合征的物质代谢研究
2017-03-18王美玲李海燕鄂立平崔晓婷
王美玲++李海燕++鄂立平++崔晓婷++于萍

[摘要] 目的 提高對心血管疾病(CVD)合并正常甲状腺功能病态综合征(ESS)的临床特点认识,为进一步的临床干预、改善疾病预后提供依据。 方法 回顾性分析2016年5~9月在北京市和平里医院心内科住院的143例CVD患者入院前3 d的临床资料,分为ESS组(28例)和正常甲状腺功能(EUT)组(115例),比较两组蛋白质、葡萄糖和脂质代谢、炎性反应及心功能等临床指标。 结果 ESS组血浆白蛋白(Alb)、血红蛋白(Hb)、总胆固醇(TC)、三酰甘油的自然对数(lgTG)和高密度脂蛋白胆固醇(HDL-C)均小于EUT组(均P < 0.05);ESS组血尿素氮(BUN)、游离脂肪酸(FFA)、C反应蛋白(CRP)和B型脑钠肽(BNP)的自然对数lgBUN、lgFFA、lgCRP和lgBNP以及血白细胞(WBC)和嗜中性粒细胞(NEU)均高于EUT组(均P < 0.05);两组血低密度脂蛋白胆固醇(LDL-C)以及肌酐(Cr)、空腹血糖(FBG)和糖化血红蛋白(HbA1c)的自然对数lgCr、lgFBG和lgHbA1c比较,差异均无统计学意义(均P > 0.05)。 结论CVD合并ESS患者存在严重代谢紊乱,包括合成代谢减低、分解代谢增强、被掩盖的胰岛素抵抗和FFA氧化增强,同时伴有严重的炎性反应和心功能下降。
[关键词] 正常甲状腺功能病态综合征;低白蛋白血症;游离脂肪酸;B型脑钠肽
[中图分类号] R54 [文献标识码] A [文章编号] 1673-7210(2017)01(b)-0070-04
Study of metabolic dysfunction in patients with cardiovascular disease accompanied by euthyroid sick syndrome
WANG Meiling LI Haiyan E Liping CUI Xiaoting YU Ping
Department of Cardiology, Beijing Hepingli Hospital, Beijing 100013, China
[Abstract] Objective To improve recognition of clinical characteristics of cardiovascular diseases (CVD) accompanied by euthyroid sick syndrome (ESS), in order to provide evidence for further clinical intervention and improvment of prognosis of disease. Methods A total of 143 cases with CVD admitted to Department of Cardiology, Beijing Hepingli Hospital between May and September 2016 were retrospectively analyzed and divided into ESS group with 28 cases and euthyroidism (EUT) group with 115 cases. Clinical parameters of protein, glucose, lipid, inflammation and cardiac function were compared between the two groups. Results Compared with EUT group, ESS gorup pateints presented with lower plasma albumin (Alb), hemoglobin (Hb), total cholesterol (TC), natural logarithm of triglyceride (lgTG) and high density lipoprotein cholesterol (HDL-C) (P < 0.05), and higher blood white blood cell (WBC), neutrophil (NEU) and natural logarithm of blood urea nitrogen (lgBUN), free fatty acid (lgFFA), C reactive protein (lgCRP) and B type natriuretic peptide (lgBNP) (P < 0.05). Low density lipoprotein cholesterol (LDL-C) and natural logarithm of creatine (lgCr), fasting blood glucose (lgFBG) and glycated hemoglobin (lgHbA1c) were not statistically different between ESS and EUT groups (P > 0.05). Conclusion Severe metabolic dysfunction is found in CVD patients accompanied by ESS, including decreased anabolism, increased catabolism, enhanced FFA oxidation, covered insulin resistance, more pronounced inflammation and more severe cardiac dysfunction.
[Key words] Euthyroid sick syndrome; Hypoalbuminemia; Free fatty acid; B-type natriuretic peptide
正常甲状腺功能病态综合征(ESS),又称低T3综合征(LT3),是指各种疾病在一定条件下出现血中三碘甲状腺原氨酸(T3)降低,反三碘甲状腺原氨酸(rT3)升高,伴或不伴甲状腺素(T4)和/或促甲状腺素(TSH)降低的过程。ESS不是某一疾病特有的表现,而是各种疾病均可能出现的改变,发生这种改变的病理生理机制尚不明确,但目前一致认为ESS与疾病的严重程度和预后密切相关[1-5],而目前临床对ESS的认识普遍不够,本文回顾性分析伴或不伴ESS的心血管疾病(CVD)患者的常见蛋白质、葡萄糖、血脂等临床指标,揭示ESS所伴随的严重代谢紊乱等问题,提高对ESS的认识,为进一步临床干预及改善疾病预后提供依据。
1 资料与方法
1.1 一般资料
回顾性分析2016年5~9月在北京市和平里医院心内科(以下简称“我科”)住院常规行甲状腺功能检查的167例CVD患者入院前3 d的临床资料,排除原发性甲状腺疾病12例,单独TSH降低8例,单独总T4(TT4)降低3例,服用药物华法林1例,保留甲状腺功能正常(EUT)患者115例和ESS 28例。EES组男11例,女17例;年龄59~99岁,平均(81.75±9.80)岁;EUT组男52例,女63例;年龄32~94岁,平均(77.37±11.12)岁。两组基础疾病构成包括高血压病、冠心病、2型糖尿病和脑血管病,同一患者常患多个基础疾病。
两组性别构成、年龄、基础疾病中冠心病、糖尿病和脑血管病的构成差异无统计学意义(均P > 0.05),两组基础疾病中高血压病的构成差异有统计学意义(P < 0.05),ESS组收缩压低于EUT组,差异有高度统计学意义(P < 0.01),两组舒张压的差异无统计学意义(P > 0.05)。见表1。
1.2 临床指标观察
甲状腺功能指标:TT4、总T3(TT3)、游离T4(FT4)、游离T3(FT3)和TSH;蛋白质、葡萄糖和脂质指标:血浆白蛋白(Alb)、血红蛋白(Hb)、糖化血红蛋白(HbA1c)、空腹血糖(FBG)、总胆固醇(TC)、三酰甘油(TG)、低密度脂蛋白胆固醇(LDL-C)、高密度脂蛋白胆固醇(HDL-C)和游离脂肪酸(FFA);炎症指标:C反应蛋白(CRP);感染指标:血白细胞(WBC)和嗜中性粒细胞(NEU);心功能指标:B型脑钠肽(BNP);其他:血尿素氮(BUN)和肌酐(Cr)。
1.3 统计学方法
采用SPSS 23.0统计学软件进行数据分析,呈正态分布或经自然对数转换为正态分布的计量资料数据用均数±标准差(x±s)表示,两组间比较采用t检验;计数资料用率表示,组间比较采用χ2检验,以P < 0.05为差异有统计学意义。
2 结果
2.1 两组蛋白质、lgBUN、lgCr和葡萄糖水平比较
ESS组Alb和Hb水平均低于EUT组,差异有高度统计学意义(均P < 0.01);ESS组lgBUN高于EUT组,差异有统计学意义(P < 0.05);两组lgCr、lgFBG、lgHbA1c差异无统计学意义(均P > 0.05)。见表2。
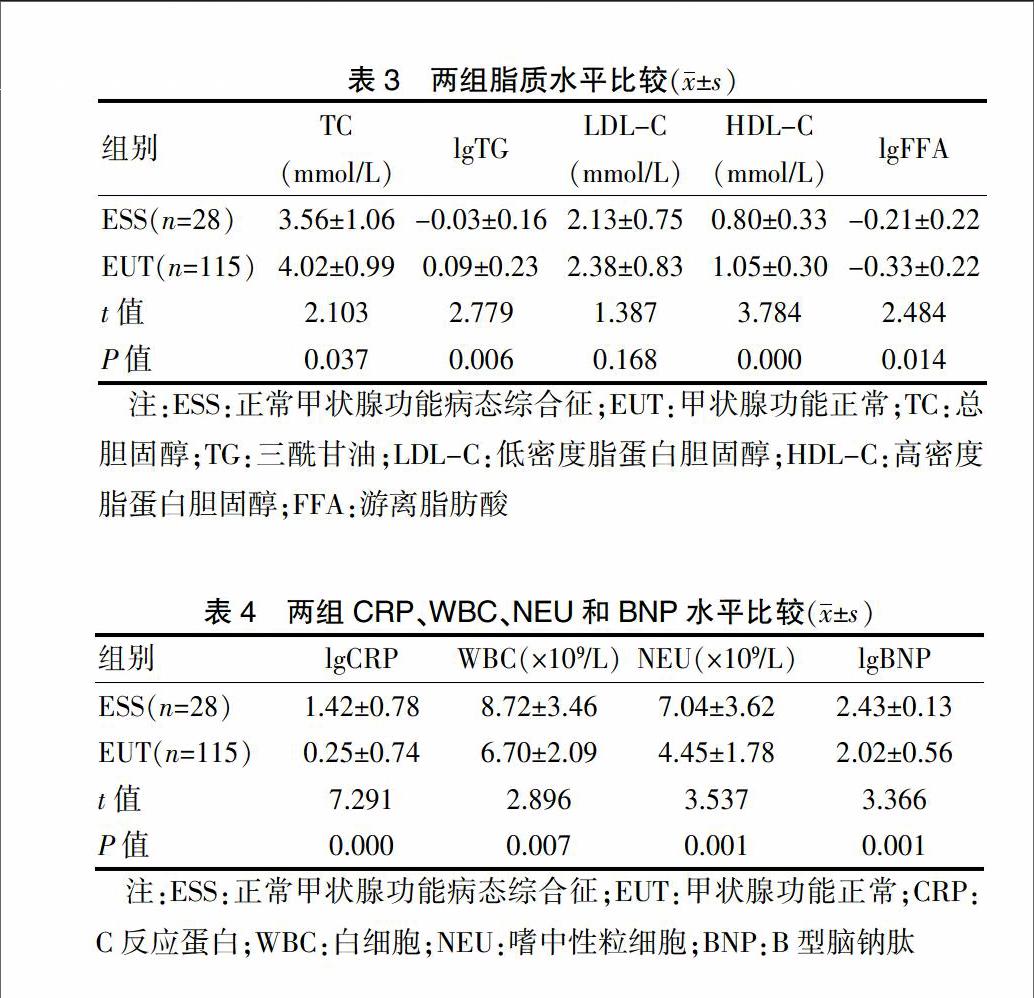
2.2 两组脂质水平比较
ESS组TC、lgTG和HDL-C均低于EUT组,差异有统计学意义(均P < 0.05);ESS组lgFFA高于EUT组,差异有统计学意义(P < 0.05);两组LDL-C水平比较差异无统计学意义(P > 0.05)。见表3。
2.3 两组CRP、WBC、NEU和BNP水平比较
ESS组lgCRP、WBC、NEU和lgBNP水平均高于EUT组,差异有高度统计学意义(均P < 0.01)。见表4。
3 讨论
生理和病理情况下,甲状腺激素(TH)通过基因和非基因途径调节心肌细胞肌浆网钙敏感的ATP酶(SERCA)、受磷蛋白及钠-钾ATP酶、钠-钙交换体等离子通道的表达,使心肌收缩和舒张速率增加,同时扩张外周血管,导致收缩压升高、舒张压降低[6-7]。ESS组的收缩压低于EUT组,与TH降低密切相关,由于CVD合并ESS常同时存在交感神经和肾素-血管紧张素-醛固酮(RAS)系统的激活,可能导致舒张压没有明显改变。
Alb和Hb均是人体的结构和功能蛋白,对维持人体正常生理功能发挥重要作用,在生理情况下,其合成和分解处于动态平衡,在疾病状态下,食物摄入不足以及感染等消耗性因素可导致Alb和Hb合成减少、分解增加。ESS组WBC和NEU升高,提示合并感染增加。BUN是人体蛋白质代谢的主要终末产物,其血浆水平受肾功能影响;Cr是反映肾功能最基本的指标;兩组lgCr差异无统计学意义,而lgBUN升高提示ESS组蛋白质分解代谢增加。ESS组由于病情更重、合并感染增加,推测其食物摄入明显不足,蛋白质合成代谢下降,加上分解代谢增强,导致Alb和Hb均显著下降。食物摄入不足在一定程度上促进ESS的发生[8]。有研究指出血浆Alb降低是ESS的特异性指标[4]。除了公认的可导致低合成代谢的因素外,心衰患者发生ESS与体内低合成代谢存在独立相关性[3]。
两组患者FBG和HbA1c水平差异均无统计学意义,似乎ESS时糖代谢未发生明显改变,但在摄入不足、分解代谢增强情况下,常常出现血糖降低,ESS患者血糖无明显降低可能恰恰反映被掩盖的胰岛素抵抗,这可从下文得到部分线索。
ESS组TC、lgTG和HDL-C均较EUT组下降,说明脂质代谢亦处于负平衡,但FFA却明显升高,FFA由TG水解产生,但同时受胰岛素、交感神经、肾上腺激素的调节[9],同时还受肝素使用的影响[10]。心梗、心衰、脑梗、疼痛等疾病、应激条件下,交感神经兴奋、儿茶酚胺释放增加可动员体内脂肪分解产生FFA增加,血中FFA升高,可抑制葡萄糖的利用,导致胰岛素抵抗[11-12];FFA氧化利用增加,比利用葡萄糖消耗更多氧,导致线粒体功能紊乱和活性氧(ROS)产生增加、诱导炎性反应[11-12];FFA升高还可以激活血小板,促进血栓形成[13];血液中部分FFA与Alb结合,在血Alb降低情况下,可供利用的FFA增加[13],进一步加重FFA的上述不利影响。ESS组在TG降低的情况下,FFA升高,在一定程度上反映交感-肾上腺系统的激活和胰岛素抵抗,同时产生严重的炎性反应,ESS组lgCRP较EUT明显升高,证实存在严重的炎性反应;而炎性反应是ESS形成的重要条件,各种ESS动物模型均建立在不同因素诱导炎性反应的基础上[14]。
BNP是反映心衰嚴重程度和心血管预后的重要生物标志物,ESS组lgBNP显著升高,提示与EUT组相比,心功能显著下降,心衰患者T3下降与心功能降低呈正相关,和NT-ProBNP(BNP代谢过程中产生的非活性片段)呈负相关[3,15]。TH对维持心脏正常的收缩和舒张功能发挥重要作用[6,16]。ESS组lgBNP升高除了提示基础CVD引起更严重的心衰外,还与TH降低密切相关。心肌细胞内肌球蛋白重链α(MHCα)表达降低而肌球蛋白重链β(MHCβ)表达增加是慢性心衰心室重塑的重要特征,而甲状腺功能减退的患者心肌可发生类似的改变[17],且心梗后心室重塑发生的上述改变可以被TH抑制[2],提示心衰时心脏组织水平的TH降低参与心室重塑的过程。心衰时缺氧、压力和容量负荷增加可诱导心肌局部脱碘酶3(D3)高表达,使T3降解、失活,最终出现病理性心室重塑的心脏改变如MHC α降低、MHC β增加等[18]。而心衰合并ESS提示系统性TH降低,可进一步激化心室重塑的过程,导致BNP进一步升高。此外,除了其经典的利尿、利钠和扩张容量血管的作用之外,BNP还能产生独立于儿茶酚胺之外的促进脂肪分解和脂质氧化的作用[19-21],导致FFA增加和心肌能量代谢障碍,因此,BNP的升高还可进一步加重代谢紊乱。
综上所述,CVD合并ESS患者体内蛋白质和脂质合成减少、分解增加,同时伴有严重炎性反应和心功能下降;疾病状态下食物摄入不足、感染、炎症、交感神经兴奋、儿茶酚胺增加等因素可导致物质合成减少、分解增加,而Alb下降、FFA和BNP升高可进一步加重代谢紊乱,诱导胰岛素抵抗,扩大炎性反应,促进ESS产生,导致病情加重。因此,临床可从纠正代谢紊乱入手预防ESS的发生,改善疾病预后。
[参考文献]
[1] Fliers E,Bianco AC,Langouche L,et al. Thyroid function in critically ill patients [J]. Lancet Diabetes Endocrinol,2015, 3(10):816-825.
[2] Pantos C,Mourouzis I,Cokkinos DV. Rebuilding the post-infarcted myocardium by activating physiologic hypertrophic signaling pathways:the thyroid hormone paradigm [J]. Heart Fail Rev,2010,15(2):143-154.
[3] Brenta G,Thierer J,Sutton M,et al. Low plasma triiodothyronine levels in heart failure are associated with a reduced anabolic state and membrane damage [J]. Eur J Endocrinol,2011,164(6):937-942.
[4] Girvent M,Maestro S,Hernández R,et al. Euthyroid sick syndrome,associated endocrine abnormalities,and outcome in elderly patients undergoing emergency operation [J]. Surgery,1998,123(5):560-567.
[5] Cengiz SE,Cetinkaya E,Altin S,et al. Nutritional and prognostic significance of sick euthyroid syndrome in non-small cell lung cancer patients [J]. Intern Med,2008,47(4):211-216.
[6] Moolman JA. Thyroid hormone and the heart [J]. Cardiovasc J S Afr,2002,13(4):159-163.
[7] Boelen A,Kwakkel J,Fliers E. Beyond low plasma T3:local thyroid hormone metabolism during inflammation and infection [J]. Endocr Rev,2011,32(5):670-693.
[8] De Vries EM,Van Beeren HC,Ackermans MT,et al. Differential effects of fasting vs food restriction on liver thyroid hormone metabolism in male rats [J]. J Endocrinol,2015,224(1):25-35.
[9] Ebbert JO,Jensen MD. Fat depots,free fatty acids,and dyslipidemia [J]. Nutrients,2013,5(2):498-508.
[10] Shi S,Gao Y,Wang L,et al. Elevated free fatty acid level is a risk factor for early postoperative hypoxemia after on-pump coronary artery bypass grafting: association with endothelial activation [J]. J Cardiothorac Surg,2015, 10(1):1.
[11] Opie LH,Knuuti J. The adrenergic-fatty acid load in heart failure [J]. J Am Coll Cardiol,2009,54(18):1637-1646.
[12] Oliver MF. Fatty acids and the risk of death during acute myocardial ischaemia [J]. Clin Sci,2015,128(6):349-355.
[13] Dhindsa S,Ghanim H,Dandona P. Nonesterified Fatty acids,albumin,and platelet aggregation [J]. Diabetes,2015,64(3):703-705.
[14] De Vries EM,Fliers E,Boelen A. The molecular basis of the non-thyroidal illness syndrome [J]. J Endocrinol,2015,225(3):R67-R81.
[15] Selvaraj S,Klein I,Danzi S,et al. Association of serum triiodothyronine with B-type natriuretic peptide and severe left ventricular diastolic dysfunction in heart failure with preserved ejection fraction [J]. Am J Cardiol,2012,110(2):234-239.
[16] Portman MA. Thyroid hormone regulation of heart met-abolism [J]. Thyroid,2008,18(2):217-225.
[17] Soukup T. Effects of long-term thyroid hormone level alterations,n-3 polyunsaturated fatty acid supplementation and statin administration in rats [J]. Physiol Res,2014, 63(1):S119.
[18] Pol CJ,Muller A,Simonides WS. Cardiomyocyte-specific inactivation of thyroid hormone in pathologic ventricular hypertrophy:an adaptative response or part of the problem? [J]. Heart Fail Rev,2010,15(2):133-142.
[19] Palmer BF,Clegg DJ. An emerging role of natriuretic peptides:igniting the fat furnace to fuel and warm the heart [J]. Mayo Clin Proc,2015,90(12):1666-1678.
[20] Lafontan M,Moro C,Sengenes C,et al. An unsuspected metabolic role for atrial natriuretic peptides the control of lipolysis,lipid mobilization,and systemic nonesterified fatty acids levels in humans [J]. Arterioscler Thromb Vasc Biol,2005,25(10):2032-2042.
[21] Lafontan M,Moro C,Berlan M,et al. Control of lipolysis by natriuretic peptides and cyclic GMP [J]. Trends Endocrinol Metab,2008,19(4):130-137.
(收稿日期:2016-10-09 本文編辑:程 铭)