博来霉素气管多次给药诱导小鼠肺纤维化模型
2017-03-18陈孟毅林帅杜朋李程程孟爱
陈孟毅++林帅++杜朋++李程程++孟爱民


[摘要] 目的 建立小鼠博来霉素气管多次给药肺纤维化模型。 方法 SPF级雄性C57BL/6J小鼠45只,按体重随机分为未处理组(5只)和处理组(40只),未处理组小鼠不经处理,处理组小鼠博来霉素气管给药(0.4 mg/mL),2周给药1次,共8次。处理组小鼠在初次给药后2周、1个月、2个月、4个月时分别取出肺组织称重计算肺系数、固定做HE染色和Masson染色,制备冰冻切片进行细胞衰老β-半乳糖苷酶(SA-β-Gal)染色。 结果 与未处理组小鼠比较,处理组小鼠在给药2周时肺系数显著升高(P < 0.05);同时,肺组织病理观察结果显示,给药2周时,小鼠肺泡腔内渗出和血管周围炎细胞浸润较为严重,病理评分与未处理组小鼠比较显著升高(P < 0.05)。此外,处理组小鼠在给药2周、2个月与4个月时肺泡间隔增宽相对稳定,与未处理组小鼠比较,病理评分显著升高(P < 0.05),但胞浆渗出逐渐减少、炎细胞浸润减轻,评分接近未处理组小鼠水平;胶原染色结果显示处理组小鼠在给药2周时出现蓝绿色的胶原纤维,并在1、2、4个月时胶原纤维持续存在;SA-β-Gal染色结果表明,与未处理组小鼠比较,博来霉素气管给药4个月时小鼠的肺组织中衰老细胞明显增多。 结论 博来霉素气管多次给药可以建立小鼠肺纤维化模型,且模型小鼠具有肺纤维化进展不可逆、炎性反应明显减少两个重要特点,并提示肺纤维化与衰老细胞有一定关系。
[关键词] 博来霉素;纤维化;肺;模型
[中图分类号] R563.02;R363 [文献标识码] A [文章编号] 1673-7210(2017)01(b)-0008-04
特发性肺纤维化(idiopathic pulmonary fibrosis,IPF)是一种原因不明、以弥漫性肺泡炎和肺泡结构紊乱最终导致肺间质纤维化为特征的慢性疾病[1-2]。临床上除肺移植外无有效的治疗手段[3-4],且预后极差,动物肺纤维化模型在肺纤维化机制及其防治研究中非常重要。二氧化硅[5]、石棉、博来霉素[6](BLM)等都能诱导肺纤维化,常用BLM诱导肺纤维化模型[7],BLM气管给药是最常用的方式[8],气管给药又分为气管插管和气管滴注。有文献报道BLM单次给药模型在给药6周后,小鼠肺损伤部位有明显修复[9],与人类肺纤维化疾病的发展过程不同;病理学表现也不相同,人肺纤维化疾病的肺损伤部位细胞外基质的沉积增多,中性粒细胞炎性反应不突出[10],而单次给药肺纤维化模型中常有明显的嗜中性粒细胞的炎性反应[11],并有文献显示经单次给药肺纤维化模型筛选出的药物治疗方案,在临床上多数是无效的[12]。基于以上因素,笔者在参阅相关文献后,拟采用BLM气管滴注多次给药方式造成小鼠肺持续性损伤,希望制备更符合人体IPF发病情况的BLM肺纤维化模型。
1 材料与方法
1.1 实验动物
C57BL/6J小鼠45只(SPF级),体重20~22 g,10~12周,购自北京华阜康生物科技股份有限公司[动物合格证:SCXK(京)2015-0035],动物饲养在中国医学科学院医学实验动物研究所动物房屏障环境内,温度20~26℃,相对湿度50%~60%。
1.2 试剂
注射用盐酸BLM:日本化药株式会社;盐酸氯胺酮注射液:沈阳市兽药厂;细胞衰老β-半乳糖苷酶染色试剂盒:碧云天;核固红染色液(0.5%):北京雷根生物技术有限公司。
1.3 模型建立
14周龄C57BL/6J雄性小鼠按体重随机分为未处理组(5只)和处理组(40只),处理组气管滴注BLM溶液(0.4 mg/mL,每只100 μL),未处理组小鼠不经处理,处理组小鼠用注射用盐酸氯胺酮150 mg/kg腹腔注射麻醉,固定,暴露声门,用接套管的1 mL注射器气管给药。2周给药1次,共8次,初次给药后2周(0.5个月)、1个月、2个月、4个月时取肺组织。
1.4 HE染色
肺组织10%中性甲醛中固定24 h,常規脱水、石蜡包埋后,切片5 μm,进行苏木精-伊红染色,普通光学显微镜(BX50,Olympus,Japan)观察肺组织病变,病理学镜检人员单盲评分。
1.5 Masson染色
石蜡切片脱蜡,水洗,Masson染色复合液染色5 min,水洗,0.2%醋酸浸洗,1%磷钨酸浸洗,亮绿染色液染色15 min,水洗,0.2%醋酸浸洗,水洗片刻脱水、透明、固封。
1.6 肺系数
肺系数=肺组织重量(mg)/小鼠体重(g)。
1.7 冰冻切片
小鼠在BLM初次给药0.5、1、2、4个月取右肺中叶,速冻后将肺组织浸没在适量包埋剂中,冰冻切片机制作8 μm的切片。
1.8 细胞衰老β-半乳糖苷酶染色方法
冰冻切片固定液固定15 min,PBS洗3次,每次3 min,配染色液,滴加到切片上,37℃培养箱(无CO2)过夜,PBS洗后核固红(0.5%)复染15 min。
1.9 统计学方法
采用SPSS 22.0统计软件对数据进行分析,计量资料以均数±标准差(x±s)表示,多组间比较采用单因素方差分析,组间两两比较采用LSD-t检验,以P < 0.05 为差异有统计学意义。
2 结果
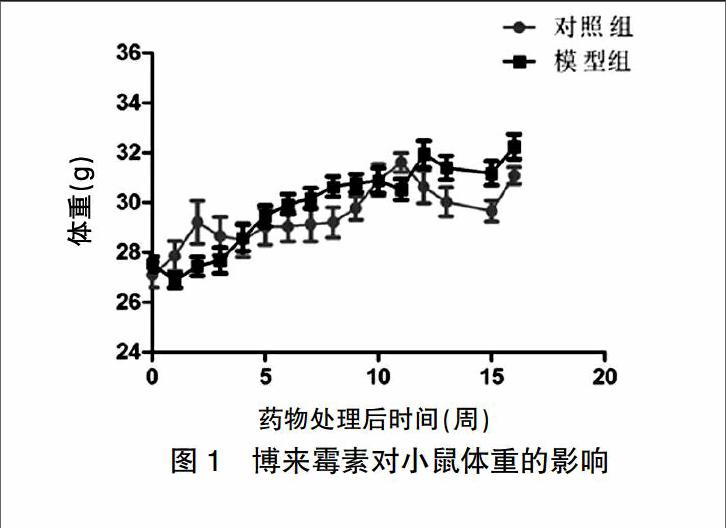
2.1 博来霉素多次给药对小鼠体重的影响
处理组小鼠第1次BLM给药为0周,小鼠每周称重1次。未处理组小鼠整体上体重呈逐渐上升趋势。与未处理组小鼠比较,处理组小鼠在BLM第1次给药(0周)后体重下降,初次给药1周时体重处于最低点,随后体重逐渐增加,在第5周时接近未处理组小鼠体重,之后与未处理组小鼠体重增长趋势一致,在12周时体重超过未处理组小鼠(图1)。
2.2 博來霉素多次给药过程中肺系数的变化
处理组小鼠在0.5、1、2、4个月时的肺系数有高于未处理组小鼠的趋势,与未处理组小鼠比较,处理组小鼠0.5个月时肺系数显著升高,差异有统计学意义(P < 0.05);且处理组小鼠在0.5个月时具有高于1、2、4个月时肺系数的趋势(图2)。
2.3 博来霉素多次给药肺组织病理学改变
根据HE染色结果,对肺组织病理学评分:由0~12分组成,3个分类评价指标[13]:肺泡间隔增宽、肺泡腔内纤维化渗出的严重度、血管周围炎细胞浸润的程度,每种分类分为:0分正常;1分轻度;2分中度;3分重度;4分极重度。合并后记分。
图3显示,BLM给药过程中,小鼠在给药后0.5、1、2、4个月时肺组织肺泡腔胞浆渗出逐渐减少,炎细胞浸润依次减弱,但肺泡间隔增宽没有明显变化。
A.未处理组;B.0.5个月;C.1个月;D.2个月;E.4个月
图3 小鼠肺组织HE染色(100×)
从总分来看,与未处理组小鼠比较,处理组小鼠在BLM初次给药后0.5、1、4个月的评分显著升高(P < 0.05或P < 0.01)。从单项评分来看,①肺泡间隔增宽:与未处理组小鼠比较,处理组小鼠在0.5、2、4个月评分显著升高(P < 0.05或P < 0.01);②肺泡腔内渗出:0.5个月时处理组小鼠分数高于其他三个时间点,但差异无统计学意义(P > 0.05),与未处理组小鼠比较,处理组小鼠在0.5、4个月时评分显著升高(P < 0.01);③血管周围炎细胞浸润:处理组小鼠0.5个月时与未处理组小鼠比较差异有高度统计学意义(P < 0.01),4个月时处理组小鼠与未处理组小鼠炎细胞浸润水平接近。见表1。
2.4 博来霉素多次给药肺组织胶原沉积的变化
与未处理组小鼠比较,处理组小鼠在初次给药后0.5个月时出现蓝绿色的胶原纤维,在继续给药1、2、4个月时胶原纤维持续存在(图4,封四)。
2.5 博来霉素多次给药对肺组织衰老细胞的影响
小鼠初次给药4个月时肺组织冰冻切片进行SAβ-Gal染色,衰老细胞胞浆为蓝色。在BLM初次给药4个月后,处理组小鼠冰冻切片中蓝色细胞明显比未处理组小鼠多,说明处理组小鼠在4个月时肺组织中存在较多衰老细胞(图5,封四)。
3 讨论
BLM单次给药肺纤维化模型易于操作,在阐明肺纤维化与细胞因子、生长因子[6]信号通路上具有重要作用,如TGF-β在肺纤维化过程中的作用[14]。但该模型并没有复制出人IPF进展慢、不可逆这两个重要特点[15],且炎性反应较为明显[11],利用此模型筛选出的200多种治疗手段,在临床转化后没有取得预期结果[8],该模型需要进一步优化。
BLM多次给药能造成小鼠肺持续性损伤,本研究观察了BLM多次给药造模过程中小鼠的动态变化,与未处理组小鼠比较,处理组小鼠体重相对稳定,肺局部反应持续存在。实验结果证明,多次给药肺纤维化模型具有肺纤维化不可逆、炎性反应明显减弱等优势,多次给药模型更接近临床人类肺纤维化疾病的发展进程。因此,我们希望能利用多次给药模型进行抗纤维化药物筛选及药效学评价,为临床有效治疗肺纤维化提供更多的参考。
目前肺纤维化发病机制尚不明确[16],之前认为是由慢性炎症引起肺纤维化[17],但抑制炎性反应阻止肺纤维化的发展未取得预期效果。近年来研究发现肺泡上皮细胞损伤在肺纤维化发生过程中起重要作用[18],相比单次给药,多次给药模型小鼠炎性反应减少且有明显的肺泡上皮细胞增生[11,19],这是多次给药模型又一优势,在肺纤维化机制研究中具有重要意义,并能用于上皮-间质转化(epithelial-mesenchymal transition,EMT)、肺重塑和修复的评估[11]。
关于BLM肺纤维化模型的机制,之前观点是BLM诱导DNA断裂产生自由基诱导氧化应激反应[12],引起细胞凋亡或坏死,产生炎性反应和纤维化。Aoshiba等[20]认为BLM诱导肺泡Ⅰ型细胞死亡,具有干细胞特性的肺泡Ⅱ型细胞增殖分化进行修复,但BLM造成Ⅱ型细胞损伤,修复过程受阻,纤维母细胞被激活迁移到上皮细胞间缺陷处,从而导致肺纤维化。肺泡Ⅱ型细胞的损伤及过度增殖导致细胞衰老,可能是肺纤维化发生的一种新机制。SAβ-Gal染色结果也证明BLM处理组4个月的小鼠肺组织中出现细胞衰老的现象。通过清除衰老细胞是否可以治疗肺纤维化疾病,这将是我们下一步研究的重点,也许是肺纤维化疾病的一个新的治疗方向。
[参考文献]
[1] Demedts M,Costabel U. ATS/ERS international multidisciplinary consensus classification of the idiopathic interstitial pneumonias [J]. EurRespir J,2002,19(5):794-796.
[2] Huang X,Wang W,Yuan H,et al. Sunitinib,a Small-Molecule Kinase Inhibitor,Attenuates Bleomycin-Induced Pulmonary Fibrosis in Mice [J]. Tohoku J Exp Med,2016, 239(4):251-261.
[3] Moll S,Chaykovska L,Meier M,et al. Targeting the epithelial cells in fibrosis:a new concept for an old disease [J]. Drug Discov Today,2013,18(11/12):582-591.
[4] Costabel U. Idiopathic pulmonary fibrosis in 2011:key updates on guidelines and therapeutics Concluding remarks [J]. Respiratory Research,2013,14 Suppl 1:S8.
[5] Latoche JD,Ufelle AC,Fazzi F,et al. Secreted Phosphoprotein 1 and Sex-Specific Differences in Silica-Induced Pulmonary Fibrosis in Mice [J]. Environ Health Perspect,2016,124(8):1199-1207.
[6] Yilmaz O,Oztay F,Kayalar O. Dasatinib attenuated bleo-mycin-induced pulmonary fibrosis in mice [J]. Growth Factors,2015,33(5/6):366-375.
[7] Latta VD,Cecchettini A,Ry SD,et al. Bleomycin in the setting of lung fibrosis induction:From biological mechanisms to counteractions [J]. Pharmacol Res,2015,97:122-130.
[8] Degryse AL,Lawson WE. Progress toward improving animal models for idiopathic pulmonary fibrosis [J]. Am J Med Sci,2011,341(6):444-449.
[9] Chung MP,Monick MM,Hamzeh NY,et al. Role of repeated lung injury and genetic background in bleomycin-induced fibrosis [J]. Am J Respir Cell Mol Biol,2003,29(3 Pt 1):375-380.
[10] Moore BB,Hogaboam CM. Murine models of pulmonary fibrosis [J]. Am J Physiol Lung Cell Mol Physiol,2008,294(2):L152-160.
[11] Degryse AL,Tanjore H,Xu XC,et al. Repetitive intratracheal bleomycin models several features of idiopathic pulmonary fibrosis [J]. Am J Physiol Lung Cell Mol Physiol,2010,299(4):L442-452.
[12] Moeller A,Ask K,Warburton D,et al. The bleomycin animal model:a useful tool to investigate treatment options for idiopathic pulmonary fibrosis? [J]. Int J Biochem Cell Biol,2008,40(3):362-382.
[13] Gelinas R,Chesler EJ,Vasconcelos D,et al. A genetic approach to the prediction of drug side effects:bleomycin induces concordant phenotypes in mice of the collaborative cross [J]. Pharmgenomics Pers Med,2011,4:35-45.
[14] Goodwin A,Jenkins G. Role of integrin-mediated TGFbeta activation in the pathogenesis of pulmonary fibrosis [J]. Biochem Soc Trans,2009,37(4):849-854.
[15] Chua F,Gauldie J,Laurent GJ. Pulmonary fibrosis:searching for model answers [J]. Am J Respir Cell Mol Biol,2005,33(1):9-13.
[16] Andrade-Sousa AS,Rogerio Pereira P,MacKenzie B,et al. Aerobic Exercise Attenuated Bleomycin-Induced Lung Fibrosis in Th2-Dominant Mice [J]. PLoS One,2016,11(9):e0163420.
[17] Kropski JA,Lawson WE,Young LR,et al. Genetic studies provide clues on the pathogenesis of idiopathic pulmonary fibrosis [J]. Dis Model Mech,2013,6(1):9-17.
[18] Loomis-King H,Flaherty KR,Moore BB. Pathogenesis,current treatments and future directions for idiopathic pulmonary fibrosis [J]. Curr Opin Pharmacol,2013,13(3):377-385.
[19] Lee SH,Lee EJ,Lee SY,et al. The effect of adipose stem cell therapy on pulmonary fibrosis induced by repetitive intratracheal bleomycin in mice [J]. Exp Lung Res,2014, 40(3):117-125.
[20] Aoshiba K,Tsuji T,Nagai A. Bleomycin induces cellular senescence in alveolar epithelial cells [J]. Eur Respir J,2003,22(3):436-443.
(收稿日期:2016-10-13 本文編辑:张瑜杰)