大豆抗原蛋白β-conglycinin线性表位及其不同种属动物过敏血清结合能力比较
2017-03-16孙赵洋赵元袁志杰娜仁高娃强嘉楠潘丽秦贵信
孙赵洋,赵元,袁志杰,娜仁高娃,强嘉楠,潘丽,秦贵信
(动物生产及产品质量安全教育部重点实验室,吉林省动物营养与饲料科学重点实验室,吉林农业大学动物科学技术学院,长春 130118)
大豆抗原蛋白β-conglycinin线性表位及其不同种属动物过敏血清结合能力比较
孙赵洋,赵元,袁志杰,娜仁高娃,强嘉楠,潘丽,秦贵信*
(动物生产及产品质量安全教育部重点实验室,吉林省动物营养与饲料科学重点实验室,吉林农业大学动物科学技术学院,长春 130118)
试验通过生物信息学方法预测β-conglycinin线性表位,综合已发表文献筛选出四段具有代表性氨基酸序列合成短肽,采用ELISA和点杂交法检测表位肽段与仔猪、犊牛、兔三种不同种属动物过敏血清结合程度差异。结果表明:通过生物信息学方法预测合成的肽段均为β-conglycinin表位肽;三种动物过敏血清与四段表位肽结合能力存在显著差异,其中四段表位肽与仔猪、犊牛过敏血清结合能力显著高于兔过敏血清(P<0.05);同一动物与四段不同肽段结合敏感程度差异显著(P<0.05),兔过敏血清与肽段β1结合能力最强,仔猪过敏血清与α1肽段结合能力最强,犊牛过敏血清与肽段β2肽段结合能力最强。结果为寻找β-conglycinin最佳优势表位提供理论支持,同时为揭示大豆抗原蛋白种属间致敏差异机理奠定基础。
β-伴大豆球蛋白;表位;ELISA法;点杂交法;动物种属
大豆营养价值丰富,富含蛋白质及脂质,广泛应用于食品和饲料工业。但大豆含有多种抗营养物质,可引发腹泻,影响生长发育[1]。其抗原物质主要有大豆疏水蛋白(Soybean hydrophobic protein)、大豆壳蛋白(Soybean hull protein)、大豆抑制蛋白(Soybean profilin)、大豆空泡蛋白(Soybean vacuolar protein)、大豆球蛋白(Glycinin)、伴大豆球蛋白(Conglycinin)和Kunitz胰蛋白酶抑制因子等[2]。Glycinin和β-conglycinin对动物影响最大,二者占大豆抗原蛋白总量65%~80%[3]。β-conglycinin具有较强抗原性,可抵抗胃酸;由α、α'、β三种亚基组成,分子质量分别为67、68及48 ku,其中α、β亚基占主要地位;α亚基由543个氨基酸残基组成,β亚基由438个氨基酸残基组成,目前α、β亚基具体表位尚不清楚。
研究发现,免疫细胞难以借助其表面受体识别整个蛋白质抗原分子,仅识别抗原分子上特定部分即抗原表位,又称抗原决定簇,是抗原分子中决定抗原特异性特殊化学基团,可激发机体体液和细胞免疫,根据结合受体差异,抗原表位可分为T细胞表位和B细胞表位,根据结构可分为线性表位和构象表位。线性表位即连续性表位,存在抗原分子任意部分,蛋白质变性前后均可测定[4-6],构象表位由于抗原蛋白氨基酸序列盘曲折叠产生,抗原表位是机体特异性免疫基础。随生物信息学发展和数据库扩增,生物信息学软件应用于蛋白质抗原表位预测,提高试验效率[7-8]。近年来研究发现,β-conglycinin β亚基与猪、狗、兔、鲈鱼血清结合产生抗原表位敏感区域不同[9];Chunjiang等研究发现β-conglycinin α亚基与猪血清结合产生抗原表位敏感区域差异显著[10]。对β-conglycinin致敏犊牛产生抗原表位研究较少,本试验采用生物信息学方法,运用计算机软件分析预测β-conglycinin α亚基及β亚基蛋白结构和抗原表位,结合已发表研究成果,用ELISA和点杂交方法比较大豆抗原蛋白β-conglycinin致敏兔、仔猪、犊牛三种不同种属动物产生抗原表位差异。为研究大豆过敏原及低致敏大豆制品研发奠定基础。
1 材料与方法
1.1 主要试剂及仪器
山羊抗兔IgG抗体、兔抗猪IgG抗体、兔抗牛IgG抗体(带有辣根过氧化物酶标记)购自北京博奥森生物技术有限公司;美国96孔Corning可拆酶标板购自上海越研生技公司;硝酸纤维膜(0.15 μm)购自浙江四甲生化塑料厂;DAB显色液购自北京康为世纪生物科技有限公司;多功能酶标仪、脱色摇床(其林贝尔仪器制造有限公司),扫描仪(Epson),37℃恒温培养箱。
1.2 大豆过敏原β-conglycinin α亚基与β亚基抗原表位预测
通过Pubmed网络服务器(http://www.ncbi.nlm. gov/pubmed/)检索β-conglycinin α亚基与β亚基氨基酸序列。
应用Bepipred1.0网络服务器,输入氨基酸序列,根据氨基酸序列给出形成表位可能评分,得到表位数据。
应用DNAstar生物分析软件中protean程序,采用Jameson-Wolf法、Kyte-Doolittle法、Emini法和Karplus-Schulz法分别预测蛋白的抗原指数、亲水性、表面可及性和柔韧性。
将大豆过敏原β-conglycinin α亚基与β亚基蛋白结构预测结果与抗原指数、亲水性、表面可及性和柔韧性预测结果结合,分析抗原表位。
1.3 表位肽合成
根据试验结果,综合文献与预测结果,筛选β-conglycinin α亚基和β亚基各两段代表性氨基酸序列,由北京华大蛋白公司合成短肽,纯度达90%以上,合成肽保存在-20℃冰箱。
1.4 直接ELISA法检测仔猪、犊牛、兔过敏血清与表位肽结合程度
1.4.1 直接ELISA法所用溶液及配置
碳酸纳缓冲液(包被液):将0.05 g Na2CO3,0.308 g NaHCO3,用蒸馏水定容至500 mL。样品处理液(PBS):将9 g NaCl,2.9 g Na2HPO4,0.3 g NaH2PO4,用蒸馏水定容至1 000 mL。封闭液(1% BSA):0.1 g BSA溶于10 mL PBS,储存于4℃中。PBST:将PBS和吐温20按照一定比例配置;终止液:5.55 mL浓硫酸,44.45 mL水。
1.4.2 直接ELISA法
无菌去离子水将四段表位肽稀释至浓度为1 μg·mL-1后,以每孔0.3 mL包被到96孔酶标板,封好4℃过夜。次日将孔内液体倒掉,PBST清洗3次,拍干,每孔加0.1 mL封闭液,37℃孵育2 h。清洗同上,拍干后向96孔酶标板中加入0.1 mL稀释后待检兔、仔猪、犊牛过敏血清,37℃孵育2 h。洗板(同上)后加入相应用辣根过氧化物酶(HPR)标记抗兔、猪、牛IgG抗体(用样品处理液稀释3 000倍),每孔0.1 mL,37℃孵育2 h。酶标板清洗拍干,每孔加0.1 mL底物液,37℃孵育10 min,孵育后,每孔加入50 μL终止液终止反应。测每孔在波长490 nm下吸光值,记录结果。
1.5 点杂交试验验证
点杂交抑制试验用于验证所得表位肽片段IgG结合能力。将硝酸纤维素膜(0.45 μm)于双蒸水浸泡后取出,硝酸纤维素膜半干时,将合成β-conglycinin α亚基和β亚基四段表位肽用碳酸盐缓冲液(pH 9.6)溶解,滴到膜上(每个点5 μg),室温下放置干燥。将硝酸纤维素膜放入含5%脱脂奶粉PBST(含0.1%吐温20的0.01 mol·L-1,pH 7.4 PBS)封闭。兔、仔猪、犊牛过敏血清(用含2.5%脱脂奶粉PBST稀释)滴至封闭后硝酸纤维素膜中室温孵育过夜。硝酸纤维素膜PBST洗涤3次,每次5 min。加入辣根过氧化物酶标记抗兔、仔猪、犊牛二抗(含2.5%的PBST稀释)37℃孵育1 h,二抗稀释度根据供应商建议选择1:2 000。之后用PBST洗3次,第1次15 min,后2次5 min,接着用PBS洗1次,5 min。迅速将洗后硝酸纤维素膜放入显色液,显色2~3 min双蒸水终止反应。对照组不加合成表位肽,碳酸盐缓冲液(pH 9.6)替代,其余步骤一致,扫描仪(Epson)扫描记录显色结果。
1.6 统计分析
ELISA数据以平均±标准误表示。采用SPSS 20.0单因子方差分析处理数据,以P<0.05作差异显著标准。
2 结果与分析
2.1 生物信息学软件预测结果分析
大豆致敏源β-conglycinin α亚基氨基酸序列共543个氨基酸残基。由图1可知,β-转角区域在整个氨基酸序列中出现频率较高,出现表位可能性高。
DNAStar的Protean程序提供精确抗原表位。蛋白质亲水性,表面可及性、柔韧性等在抗原形成中具有重要作用,当亲水性>0,抗原指数>0,表面可及性>1时,形成表位可能性大,由图2可知,亲水性区域占据整个氨基酸序列绝大部分,该蛋白质亲水性能较高。蛋白表面可及性和柔韧性区域越多代表易折叠、伸展。抗原性指数代表蛋白质形成表位能力,蛋白质抗原指数高,形成表位可能性大。
β-conglycinin β亚基氨基酸序列共438个氨基酸残基,β-转角区域在整个氨基酸序列中出现频率较高,说明该区域出现表位可能性较高(见图3)。
β-conglycinin β亚基蛋白质亲水性,表面可及性、柔韧性等性质预测判定方法同β-conglycinin α亚基,结果见图4。
BepiPred 1.0软件结合Markov模型和规模化方法预测B细胞线性表位,结果见表1。在DNAStar和BepiPred 1.0预测结果基础上筛选预测β-conglycinin α和β亚基表位。
结合预测结果,筛选β-conglycinin α亚基和β亚基各两段氨基酸序列,由北京华大蛋白公司合成短肽,纯度达90%以上,结果见表2。
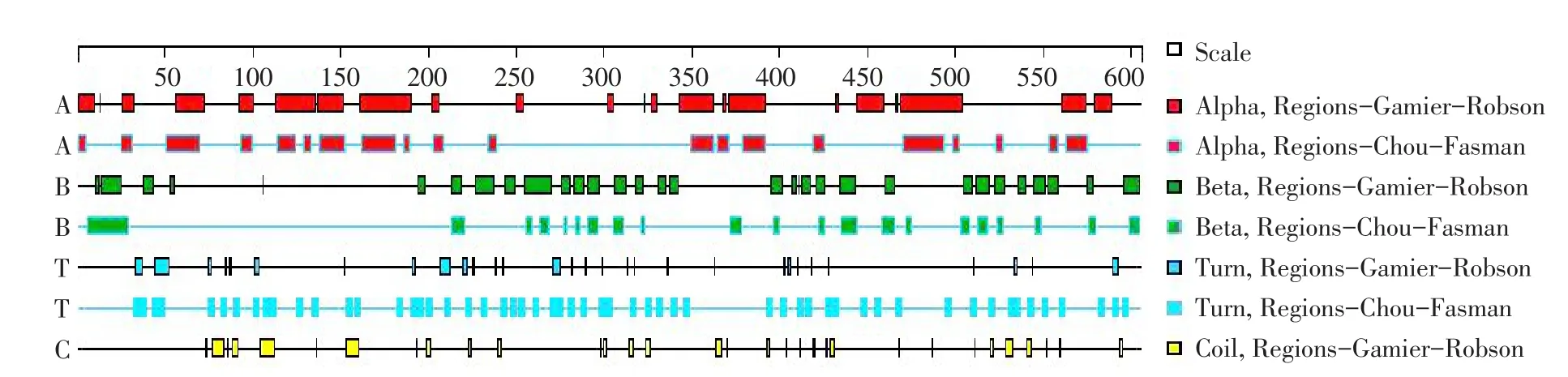
图1 DNAStar分析β-conglycinin α亚基二级结构Fig.1Secondary structure of α subunit from β-conglycinin analysised by DNAStar
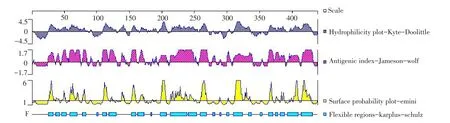
图2 DNAStar分析β-conglycinin α亚基亲水性、柔韧性、抗原性指数和表面可及性Fig.2DNAstar prediction result of antigenicindex,hydrophilicity,surface probability and flexible regions of α Subunit of β-conglycinin
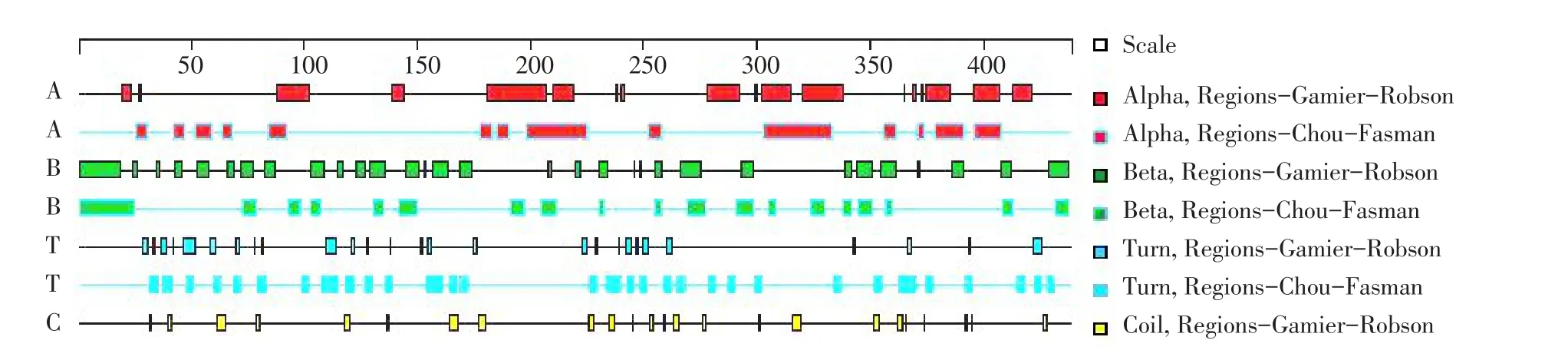
图3 DNAStar分析β-conglycinin β亚基二级结构Fig.3Secondary structure of β Subunit from β-conglycinin analysised by DNAStar
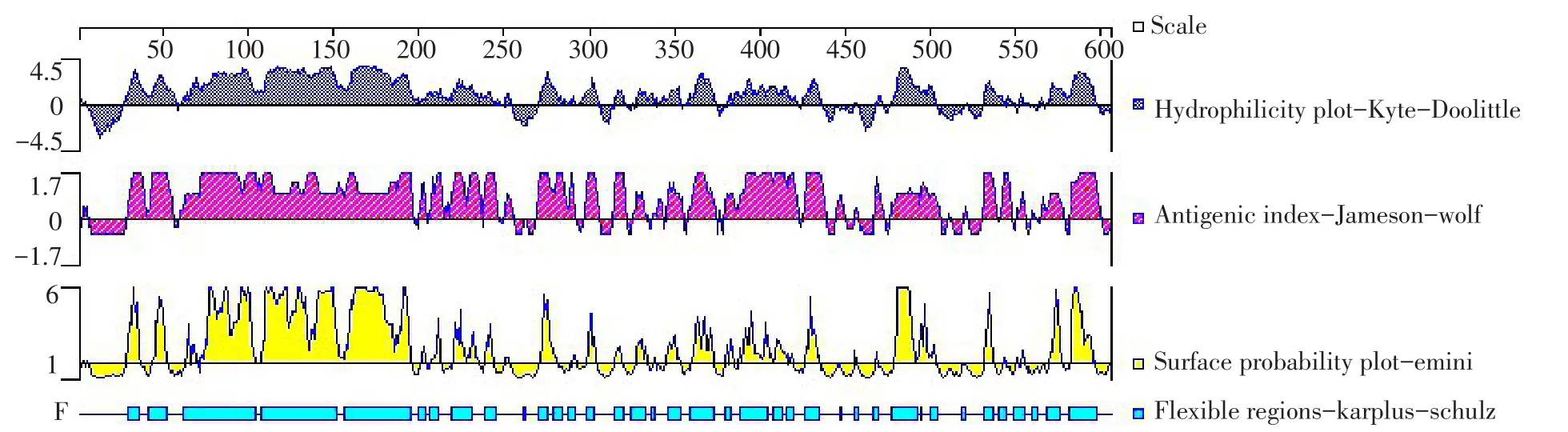
图4 DNAStar分析β-conglycinin β亚基亲水性、柔韧性、抗原性指数和表面可及性Fig.4DNAstar prediction result of antigenicindex,hydrophilicity,surface probability and flexible regions of β Subunit of β-conglycinin

表1 DNAstar和BepiPred 1.0预测结果Table 1DNAstar and BepiPred 1.0 predicted results

表2 β-conglycinin α亚基与β亚基合成表位肽结果Table 2β-conglycinin α subunit and β subunit synthesis epitope peptide results
2.2 直接ELISA法检测兔、仔猪、犊牛过敏血清与表位肽结合程度分析
ELISA法检测兔、仔猪、犊牛过敏血清与表位肽结合能力,酶标仪在490 nm处测得吸光值,经SPSS 20.0分析结果见表3。
由表3可知,同一动物与四段不同肽段结合敏感程度差异显著(P<0.05),对兔过敏血清,肽段α 1和α2、β2与之结合能力较差,与β1结合能力较强;对仔猪过敏血清,肽段β2结合能力最差,α1结合能力最强;对犊牛过敏血清,肽段α2和β1结合能力较差,β2结合能力最强。不同种属动物与同一肽段结合敏感程度差异显著(除β1外)(P<0.05),对α1肽段,犊牛与之结合能力显著高于兔和仔猪(P<0.05);对α2肽段,兔与之结合能力显著低于仔猪和犊牛(P<0.05);对β2肽段,仔猪与之结合能力最差,犊牛结合能力最强,三种动物间有显著差异(P<0.05)。
2.3 点杂交验证结果
点杂交试验验证预测潜在表位结合能力,如图5所示。

表3 ELISA检测兔、仔猪、犊牛过敏血清与四段表位肽结合结果Table 3ELISA detection of rabbit,piglets,calves allergic serum and four epitopes peptide binding results

图5 三种不同种属动物β-conglycinin过敏血清与四段肽点杂交试验结果Fig.5Results of dot-blot test between β-conglycinin allergic serum from three different species of animals and four peptides
由图5可见,β-conglycinin致敏三种不同种属动物过敏血清结合程度,兔结合能力最弱,仔猪与犊牛较强,对照组无颜色;兔过敏血清与肽段β1和肽段β2结合能力较强,与肽段α1和肽段α2结合能力较弱,仔猪过敏血清与肽段α1和肽段β1结合能力较强,与肽段α2和肽段β2结合能力较弱,犊牛过敏血清与肽段β2结合能力较强,与肽段α1、α2和β1结合能力较弱,对照组均无颜色。
3 讨论
传统免疫学技术通过克隆、表达和分离纯化完整蛋白抗原,利用抗原获得与之交叉反应性强抗体,方法复杂,表达效率低[11]。随生物信息学发展,通过生物信息学及序列分析软件预测,获得蛋白质基因和氨基酸序列中蕴含抗原表位或与抗原表位相关信息[12]。预测蛋白质表位算法主要有亲水性、柔韧性、二级结构、表面可及性以及抗原性指数等方法。抗原表位鉴定耗时长、费用高,需严格筛选。生物信息学方法预测可克服该缺点,是便捷快速鉴定方法。利用生物信息学方法预测分析蛋白质表位,可减少盲目性。蛋白质表位形成因素多,仅凭单个软件预测结果精确率低。结合ELISA和点杂交方法预测抗原表位,可提高预测效率及成功率[13]。本试验以两种生物信息学软件预测β-conglycinin抗原表位区域,结合Chunjiang研究结果,在抗原表位区域筛选四段较具有代表性肽段[10],经ELISA和点杂交方法验证,结果真实可信。
目前,大豆致敏不同种属动物产生抗原表位差异研究倍受关注。Earl等研究发现,β-conglycinin β亚基致敏猪、狗、兔、鲈鱼产生抗原表位敏感区域差异显著,四种动物敏感区域在β-conglycinin氨基酸序列上分布在不同区域[9];Chunjiang等研究发现β-conglycinin α亚基与猪血清结合产生抗原表位区域差异显著,S185-R231区域产生明显抗性区域[10]。本试验系统的比较β-conglycinin致敏兔、仔猪、犊牛产生抗原表位差异,ELISA验证结果与点杂交验证结果一致。结果表明,不同种属动物与同一肽段结合敏感程度差异显著(P<0.05),其中兔血清与四段肽段反应均不明显。这可能因兔属于啮齿动物,与大豆中β-conglycinin不易产生过敏反应或反应较弱,与其生理结构特性有关。仔猪与犊牛免疫反应相对较强,可能因大豆抗原蛋白引起断奶动物肠道形态变化,诱发过敏反应发生[14];Barratt和Sissons等对犊牛的研究表明,大豆中β-conglycinin对犊牛消化道具有较强致敏作用,血清中大豆抗原特异性滴度升高,犊牛肠道结构损伤,消化吸收障碍,继发过敏性腹泻[15-16]。本试验同一动物与四段不同肽段结合敏感程度差异显著(P<0.05),可能是因免疫细胞难以借助其表面受体识别蛋白质抗原分子。本试验仅选择四段具代表性肽段,比较大豆抗原蛋白β-conglycinin线性表位与三种不同种属动物过敏血清结合能力,存在一定局限性。
4 结论
大豆抗原蛋白β-conglycinin可使兔、仔猪、犊牛三种不同种属动物发生过敏反应,大豆抗原蛋白β-conglycinin与三种动物过敏血清发生特异性结合的线性抗原表位敏感区域差异显著;β-conglycinin致敏仔猪、犊牛产生过敏血清与四段表位肽结合能力显著高于兔子。
[1]Frankr A A,Halm B M,Ashburn L A.Isoflavones in children and adults consuming soy[J].Archives of Biochrmistry and Biophysics,2008,476(2):161-170.
[2]Qin G X.Thermal-processing of whole soyabeans-Studies on the in-activation of antinutritional factors and effects on ileal digestibility in piglets[J].Anim Feed Sci Tech,1996,57(4):313-324.
[3]Amigo Benavent M,Clemente A,Ferranti P,et al.Digestibility and immunoreactivity of soybean β-conglycinin and its deglycosylated form[J].Food Chemistry,2011,129:1598-1605.
[4]文雪霞,陈化兰,熊永忠,等.抗原表位鉴定方法的研究进展[J].中国畜牧兽医,2012,39(7):66-70.
[5]李海侠,毛旭虎.蛋白质抗原表位研究进展[J].微生物学免疫学进展,2007,35(1):54-58.
[6]李燕芳,何颖,邹泽红.应用生物信息学分析大米过敏原RAG1的B细胞表位[J].安徽农业科学,2012(6):304-306.
[7]鞠会艳,乔军,高玉伟,等.犬瘟热病毒小熊猫株核蛋白和融合蛋白基因克隆及序列分析[J].东北农业大学学报,2010,41(5): 112-120.
[8]李广兴,丛培君,潘龙,等.鸡堆型艾美尔球虫3-1E抗原表位的生物信息学预测[J].东北农业大学学报,2015,46(5):38-43.
[9]Earl T,Telisa M L,Marc J T,et al.Identification of epitopes of the subunit of soybean-conglycinin that are antigenic in pigs, dogs,rabbits and fish[J].Sci Food Agric,2014,94:2289-2294.
[10]Chunjiang J F,Joseph M J,Monty S K,et al.Identification,Characterization,epitope mapping,and three-dimensional modeling of the α-subunit of β-conglycinin of soybean,a potential allergen for young pigs[J].Agric Food Chem,2007,55:4014-4020.
[11]章辉,朱荫昌.B细胞表位预测的研究进展[J].中国血吸虫病防治杂志,2006,18(3):236-238.
[12]韩婷,高金燕,李欣,等.牛乳β-乳球蛋白过敏原线性表位串联体的分子设计[J].食品科学,2008,29(11):465-468.
[13]Maeda K,Mizukoshi F,Hamano M,et al.Development of an equine herpesvirus type 4-specific enzyme-linked immunosorbent assay using a b-cell epitope as an antigen[J].Journal of Clinical Microbiology,2004,42(42):1095-1098.
[14]孙鹏.大豆抗原蛋白Glycinin诱发仔猪过敏反应的机理及其缓解机制的研究[D].北京:中国农业大学,2008.
[15]Barratt M E J,Strachan P J,Porter P.Immunologically mediated nu-tritional disturbances associated with soyaprotein antigens[J]. Proc Nutr Soc,1979,38:143-150.
[16]Sissons J W.Effects of soyabean products on digestive processes in the gastrointestinal tract ofpreruminant calves[J].Proc Nutr Soc,1982,41:53-61.
Comparison of binding capacity of soybeanβ-conglycinin linear
epitopes and allergic serum of different species animals/
SUN Zhaoyang,
ZHAO Yuan,YUAN Zhijie,Narengaowa,QIANG Jianan,PAN Li,QIN Guixin(Key Laboratory of Animal Production,Product Quality and Security,Ministry of Education,Jilin Provincial Key Laboratory of Animal Nutrition and Feed Science,School of Animal Science and Technology,Jilin Agricultural University,Changchun 130118,China)
The binding capacity of β-conglycinin linear epitopes and three different species(rabbit, piglets,calf)allergic serum was compared in this study.The linear epitopes were firstly predicted by bioinformatics method,then the four peptides with linear epitopes were selected and synthesized in terms ofthe predicted results and relative reports.The four peptides were identified with different allergic serum by ELISA and Dot blot.Result showed that the peptides synthesized by bioinformatics method were all βconglycinin peptides;Another finding was that the binding ability of the different species animals and the same peptides have the significant difference(P<0.05),four peptides and piglets,calf allergies serum bining ability significantly stronger than rabbit serum;Four different peptides bining with the allergic serum of the same animal showed significant difference(P<0.05),the allergic rabbit serum presented the strongest combined ability with the peptidesβ1;the allergic piglets serum presented the strongest combined ability with the peptidesα1;the allergic calf serum presented the strongest combined ability with peptidesβ2.The result provided theoretical support for selectβ-conglycinin best advantage peptide,and revealed the mechanism of soybean protein antigen sensitization differences between species.
β-conglycinin;epitope;ELISAmethod;dot-blot method;species
S823;S828;S829.1
A
1005-9369(2017)01-0058-07
2016-11-24
国家自然科学基金(31572439,31572415);吉林省自然科学基金(20160101348JC);吉林省教育厅“十二五”科学技术研究项目(2015198)
孙赵洋(1991-),女,硕士研究生,研究方向为动物营养与饲料科学。E-mail:sunzhaoyang702@126.com
*通讯作者:秦贵信,教授,博士生导师,研究方向为比较动物营养。E-mail:qgx@jlau.edu.cn
时间2017-1-9 15:46:03[URL]http://www.cnki.net/kcms/detail/23.1391.S.20170109.1546.002.html
孙赵洋,赵元,袁志杰,等.大豆抗原蛋白β-conglycinin线性表位及其不同种属动物过敏血清结合能力比较[J].东北农业大学学报,2017,48(1):58-64.
Sun Zhaoyang,Zhao Yuan,Yuan Zhijie,et al.Comparison of binding capacity of soybeanβ-conglycinin linear epitopes and allergic serum of different species animals[J].Journal of Northeast Agricultural University,2017,48(1):58-64.(in Chinese with English abstract)
