硝化/脲酶抑制剂对石灰性潮土N2O减排效果及氮素转化的比较
2017-03-16杨柳青季加敏巨晓棠
杨柳青,季加敏,巨晓棠
(中国农业大学资源与环境学院,北京 100193)
硝化/脲酶抑制剂对石灰性潮土N2O减排效果及氮素转化的比较
杨柳青,季加敏,巨晓棠*
(中国农业大学资源与环境学院,北京 100193)
以华北平原石灰性潮土为对象,采用室内静态培养方法,在土壤中添加不同类型的抑制剂(硝化抑制剂、脲酶抑制剂),监测N2O和无机氮随时间变化的特征,对比分析何种添加剂减排N2O效果明显,为其在农业生产中的应用提供科学依据。试验设置7个处理:不施肥(CK);只施尿素(U);尿素和2-氯-6-三氯甲基吡啶(Nitrapyrin,由中化集团公司代理)同时施用(U+NP);尿素和推荐用量2-氯-6-三氯甲基吡啶(Nitrapyrin,由陶氏化学公司代理)同时施用(U+NPD);尿素和2倍推荐用量2-氯-6-三氯甲基吡啶(Nitrapyrin,由陶氏化学公司代理)同时施用(U+2NPD);尿素和双氰胺同时施用(U+DCD);尿素和N-丁基硫代磷酰三胺同时施用(U+nBPT),共培养56 d。在培养第1、2、3、5、7、10、14、19 d采气测定N2O和CO2,气体监测到培养第19 d为止;在培养的第0、1、3、7、14、21、28、42、56 d进行破坏性取样,监测土壤氮素转化。结果表明:供试硝化抑制剂能够降低87.4%~99.6%的N2O排放,脲酶抑制剂降低30.0%N2O排放;氮素转化过程中,硝化抑制剂处理只有0.03%~0.84%的铵态氮转化为N2O,脲酶抑制剂处理有4.69%的铵态氮转化为N2O。DCD和陶氏公司Nitrapyrin产品在抑制N2O排放的效果上无显著差异,与推荐用量陶氏公司Nitrapyrin相比,施用2倍推荐量并没有显著降低N2O排放。综上,供试硝化抑制剂能够显著降低石灰性土壤N2O的排放,减排效果最好的处理为U+NP,陶氏公司Nitrapyrin产品按推荐用量施用即可。
硝化抑制剂;脲酶抑制剂;N2O排放;氮素转化;潮土
N2O是仅次于CO2、CH4的第三大温室气体,具有极强的温室效应,其强度是CO2的近300倍[1]。同时,N2O可以参与大气中的一些光化学反应,破坏臭氧层,导致到达地面的紫外线增加,影响人类健康。N2O的排放源有自然源和人为源,农业是人为排放源中的重要贡献者,全球尺度上农业源占全部人为源N2O排放的66%[2],在中国,该比例高达75%[3]。农田土壤N2O排放受多种因素的综合影响,包括土壤O2浓度、土壤湿度、土壤温度、pH、土壤碳氮含量以及当时的氧化-还原势[4]。
农田土壤N2O排放的主要生物学过程包括硝化细菌的硝化作用,硝化细菌的反硝化作用,反硝化细菌的反硝化作用,以及耦合硝化-反硝化作用[5-9],究竟哪个过程处于主导,需要综合考虑当地的气候、土壤状况等。多年研究表明,欧洲土壤因为富含有机质,可利用碳含量高,反硝化作用是N2O排放的主要途径[10-11]。中国华北平原石灰性土壤特征为低碳、缺水、高硝化潜势,主要农作物种植体系为冬小麦-夏玉米轮作体系,所用肥料类型主要为铵态氮肥或者尿素,硝化作用为N2O排放的主要途径[12-13]。要减少该地区土壤的N2O排放,必须抑制氨氧化细菌的活性,减缓向的转化速率,延长在土壤中的持留时间。
众多研究表明,硝化抑制剂能够有效抑制土壤中硝化细菌的活性,减少硝酸盐淋溶或N2与N2O等氮的损失[14-16]。该地区主要的氮肥施用形态为尿素,尿素施入土壤后在脲酶的作用下快速被水解为,脲酶抑制剂通过减缓该过程的发生,延长施肥点处的尿素扩散时间,降低土壤中的浓度,从而抑制氨氧化作用,减少N2O排放。常用的硝化抑制剂有DMPP(3,4-dimethylpyrazole phosphate)、DCD(Dicyandiamide),还有其他抑制剂如三氨甲基吡啶(Nitrapyrin)、烯丙基硫脲(Allythiourea)、脒基硫脲(Amidinothiourea)等[17-20],低浓度的C2H2(10 Pa)也可以抑制氨氧化过程,高浓度的乙炔不仅可以抑制氨氧化过程,还能够抑制氧化亚氮还原酶的活性[21]。
目前,有不少关于具有抑制作用的化合物的报道,但是真正大规模用于农业生产的不多。因为它们的减排效果受各种因素的限制,比如抑制剂进入土壤后的降解速率、气候和土壤环境对抑制剂效果的影响以及抑制剂在土壤中的迁移等。华北平原作为中国十分重要的粮食产地,找到合适的硝化/脲酶抑制剂对减排N2O、提高氮肥利用效率具有重要意义。本研究以华北平原典型农田土壤为基质进行室内培养试验,向土壤中施入尿素的同时添加几种硝化抑制剂和脲酶抑制剂,通过对比分析找出减排效果好的硝化抑制剂,进而为硝化抑制剂在华北平原农业生产中的应用提供理论支持。
1 材料与方法
1.1 供试土壤
供试土壤采自河北省邯郸市曲周县中国农业大学曲周实验站长期定位试验优化处理农田,类型为盐化潮土,表层土壤(0~20 cm)质地为轻壤土,亚表层(20~40 cm)为沙壤土[22]。土壤砂粒为39.34%,粉粒为58.25%,粘粒为2.41%。供试土壤(0~20 cm)的基本理化性质为:pH 7.7(水土比2.5∶1),容重1.37 g·cm-3,有机质含量12.60 g·kg-1,全氮0.70 g·kg-1,速效磷4.80 mg·kg-1,速效钾72.70 mg·kg-1,铵态氮0.59 mg N·kg-1,硝态氮13.35 mg N·kg-1。
该试验为冬小麦-夏玉米一年两熟种植体系,小麦季氮肥投入量为N 100~263 kg·hm-2,夏玉米季的施氮量为N 185 kg·hm-2,灌溉时间和灌溉量根据作物关键生育期前的土壤含水量来确定,标准为保持土壤含水量在45%~80%,试验期间小麦在返青期和抽穗期分别灌溉75 mm和90 mm,玉米播种后灌溉90 mm。小麦收获后,秸秆和麦茬用粉碎机打碎后贴茬播种夏玉米,玉米收获后秸秆用粉碎机打碎后深翻25cm,混入土内[23]。采集的新鲜土置于冰盒中运回实验室,过2 mm筛,挑拣出其中的石头、植物根系和残茬,储存于4℃冰箱中。
1.2 供试肥料和硝化/脲酶抑制剂
供试肥料为尿素,供试硝化抑制剂为2-氯-6-三氯甲基吡啶(Nitrapyrin),分别由中化集团公司代理和陶氏化学公司代理。购自中化集团的Nitrapyrin纯度为24%,以乳油为溶剂,购自陶氏化学公司的Nitrapyrin纯度为17.67%。双氰胺(DCD)购自北京化学试剂公司,纯度≥99.5%。脲酶抑制剂为N-丁基硫代磷酰三胺(nBPT),购自AGROTAIN公司,有效成分含量为20%。具体用量均按照商品的推荐用量设置,购自陶氏化学公司的Nitrapyrin增设一个2倍推荐用量,详见下文试验设计部分。
1.3 试验设计
试验采用室内静态培养方法,培养温度(18±1)℃,土壤水分含量设置为70%土壤孔隙含水量(WF PS)。不同抑制剂添加组合施用等量的尿素N 80 mg· kg-1。抑制剂的添加浓度为:中化集团的Nitrapyrin为尿素氮的0.8%,陶氏化学公司的Nitrapyrin为尿素氮的0.31%和0.62%,DCD为尿素氮的5%,nBPT为尿素氮的0.26%。试验设置7个处理:(1)不施肥处理(CK),(2)单施尿素处理(U),(3)尿素+中化集团的Nitrapyrin(U+NP),(4)尿素+推荐用量的陶氏化学公司的Nitrapyrin(U+NPD),(5)尿素+2倍推荐用量的陶氏化学公司的Nitrapyrin(U+2NPD),(6)尿素+双氰胺(U+DCD),(7)尿素+N-丁基硫代磷酰三胺(U+ nBPT),每个处理3次重复,随机排列。
正式试验开始之前,取适量土壤置于恒温培养室预培养1~2周,保持土壤湿润,但是含水量要低于目标值。分别将各种抑制剂和肥料混合溶于一定量的去离子水,用注射器将溶液均匀喷洒于土壤中,翻动土壤直至混匀,称460 g(烘干重)土壤至1165 mL的带胶塞广口瓶(高16.3 cm、内径9.5 cm)用于温室气体的监测,另称取364 g(烘干重)至500 mL广口瓶用于破坏性取样,监测土壤的N素转化。共9次取样,时间分别为培养第0、1、3、7、14、21、28、42、56 d。事先在广口瓶的2.5 cm和5 cm处标记刻度,全部土壤按重量计算分两次装入并压实到刻度,使瓶中土层高度为5 cm,容重为1.3 g·cm-3。装土完成后,根据目标含水量和土壤目前含水量计算应再加入的水量,用注射器均匀喷洒于瓶内土壤中,在瓶口盖上Parafilm透气保水膜,瓶外罩上黑色塑料袋。共21个大瓶子,168个小瓶子,避光培养56 d,在培养第1、2、3、5、7、10、14、19 d采气测定N2O和CO2。由于气体排放至19 d时就已经接近0,大瓶子的气体监测持续到培养的第19 d,到培养结束时,和小瓶子一起进行破坏性取样测定培养结束时的土壤理化性质。培养过程中每隔3~4 d通气一次,维持好气培养,一周调节一次水分,保持土壤水分含量(WFPS)在70%。试验装置示意图见图1。

图1 土壤装瓶前后示意图Figure 1 Experimental set-up before and after soil bottling
1.4 测定项目
气体采集方法:上午8:30—9:00采集气体,采样前揭开Parafilm膜通气5 min,盖上橡皮塞,橡皮塞上连有TeflonR管和三通阀,通过注射器和三通阀连接采集广口瓶顶部气体,此时刻记为t0,用20 mL医用一次性注射器分别在第0、10、20 min采集3针气体,每针20 mL,同时记录采样时间。采集的样品在24 h之内用气相色谱(Agilent GC6820)测定N2O、CO2浓度,并计算其排放通量。
土壤无机氮测定:称取混匀的新鲜土壤24.00 g于180 mL振荡瓶中,加入100 mL 1 mol·L-1的优级纯KCl浸提液,充分混匀后置于往复振荡机中180 r· min-1下振荡1 h,用定性无铵滤纸过滤至10 mL离心管中,用三通道连续流动分析仪(AA3)测定滤液中的硝态氮和铵态氮含量。同时称取25 g左右鲜土于铝盒中,105℃烘干测定土壤质量含水量。
土壤亚硝态氮的测定[24]:称取鲜土24.00 g于250 mL聚乙烯瓶中,加入100 mL 2 mol·L-1优级纯KCl溶液,调节pH值至8.0,(20±2)℃,180 r·min-1恒温振荡10 min,转移约40 mL提取液于50 mL聚乙烯离心管中,室温1200 r·min-1离心10 min,将上清液转移至50 mL三角瓶中待用。吸取土壤浸提液5 mL,加入14 mL去离子水,每个比色管中加入1 mL显色剂,充分混匀,室温静置60~90 min。同时配制标准品,绘制标准曲线。分光光度计波长为543 nm,以去离子水为参比,用10 nm比色皿测定吸光度。计算公式为:

式中:x为提取液中样品浓度,mg·L-1;D为提取液的稀释倍数;R为提取液体积与干燥土壤质量的比例系数;V为提取液体积,100 mL;m为提取土壤的质量,24 g;W为土壤中水分百分含量,%。
1.5 数据处理与统计方法
N2O通量计算公式为:

式中:F1为N2O排放通量,μg N2O-N·kg-1·d-1;T为瓶内温度,℃;28为1 mol N2O中N的质量数;22.4为温度在273 K时的N2O摩尔体积,L·mol-1;W为每瓶土壤干重,kg;V为土壤上层气体体积,L;c为N2O的气体浓度,nL·L-1;t为关瓶时间,min;dc/dt为采样瓶内N2O气体浓度的时间变化,nL·L-1·min-1。
CO2通量计算公式为:
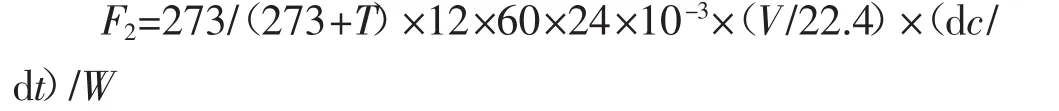
式中:F2为CO2排放通量,mg CO2-C·kg-1·d-1;12为每摩尔CO2分子中C的质量数;c为CO2气体浓度,μL· L-1;t为关瓶时间,min;dc/dt为采样箱内CO2气体浓度的时间变化率,μL·L-1·min-1。

式中:T为土壤铵态氮或硝态氮含量,mg N·kg-1;c为铵态氮、硝态氮或亚硝态氮浓度,mg N·L-1;w为土壤质量含水量,%。
采用Microsoft Excel 2010进行数据处理,SPSS 20统计软件进行统计分析,LSD法检验差异显著性,Sigmaplot 12.5软件作图。
2 结果与分析
2.1 N2O的排放通量
从N2O排放通量(图2)来看,CK处理在培养期间基本没有N2O排放,与CK相比,U处理极大促进了N2O的排放,并且在施肥后的2~3 d排放通量达到最大,近750 μg·kg-1·d-1,随后降低。与U相比,硝化/脲酶抑制剂不同程度地降低了N2O的排放,抑制效果最明显的为U+NP处理,N2O排放量最少,低至等同于不施肥处理(CK)。这与Nitrapyrin的施用量大、活性成分较多有关。U+NPD、U+2NPD与U+DCD处理的N2O排放通量明显低于U处理,但是减排效果不如U+NP处理,三者间的减排效果无显著差异,培养期间N2O排放通量维持在205 μg·kg-1·d-1以下;尽管U+nBPT处理也降低了N2O的排放,但效果不如其他添加抑制剂处理。
2.2 CO2的排放通量
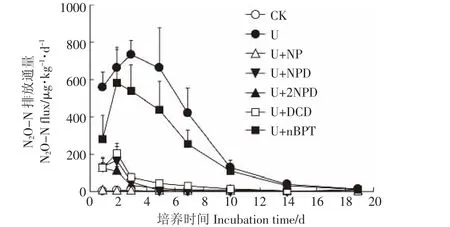
图2 不同处理N2O排放通量Figure 2 N2O fluxes of different treatments

图3 不同处理CO2排放通量Figure 3 CO2fluxes of different treatments
从CO2排放通量(图3)可看出,CK处理CO2排放在培养期间一直处于较低水平;只施尿素处理U在培养前两天CO2排放量较低,从第2 d开始CO2排放量增加并持续到培养第7 d,随后下降;对于添加抑制剂的处理,不同处理的排放规律不尽相同。培养初期,除了U+nBPT处理CO2排放通量呈现上升趋势外,其他各添加抑制剂处理间没有显著差异,均保持较低水平,随后各处理的CO2日排放量趋势各不相同。培养开始至第7 d,U+nBPT处理CO2排放量高于只施尿素处理U,可能是因为产品中的其他添加物分解释放CO2,或nBPT在抑制尿素水解过程中自身分解产生大量CO2;U+NPD处理CO2排放量最低,可能是因为施用推荐用量的陶氏化学Nitrapyrin产品能够有效抑制微生物的活性,降低了呼吸作用,但其2倍推荐量处理(U+2NPD)在整个培养期间CO2排放通量显著高于U+NPD处理,原因可能是高剂量的Nitrapyrin自身分解产生了大量的CO2。各处理的CO2排放在大多数情况下并未达到显著水平。
2.3 N2O和CO2的总排放量
从N2O排放总量(表1)可以看出,CK处理的排放总量很低,U处理显著促进了N2O排放,为CK的217倍;与U相比,添加抑制剂的处理不同程度降低了N2O排放总量,由大到小的顺序为U+nBPT>U+ DCD>U+NPD>U+2NPD>U+NP,分别降低了30.0%、87.4%、91.8%、93.1%和99.6%。可以看出,U+nBPT的抑制效果显著弱于其他添加抑制剂处理,效果最好的为U+NP处理,N2O排放显著低于其他添加抑制剂处理,在统计学上U+NPD、U+2NPD和U+DCD处理间N2O排放没有显著差异,加大陶氏公司Nitrapyrin剂量并不能显著降低N2O排放。
与CK相比,U处理增加了14.5%的CO2的排放;与U相比,U+NP和U+NPD均减少了CO2总排放量,但是处理间没有显著差异。U+2NPD、U+DCD和U+ nBPT处理CO2排放总量较U分别增加了39.0%、23.9%和30.0%,但均未达到显著水平;U+2NPD处理的CO2总排放量显著大于U+NPD,增加了1.25倍,这与Nitrapyrin自身分解有关。

表1 不同处理N2O、CO2排放总量(19 d)Table 1 Total N2O,CO2emissions of different treatment(19 d)
2.4 不同处理土壤NH+4、NO-3和NO-2的变化
从图4a可以看出,CK处理土壤NH+4含量非常低,U处理土壤的NH+4浓度在培养的第1 d有短暂的上升趋势,因为尿素施入土壤后遇水会迅速发生水解使NH+4浓度上升,随后NH+4浓度迅速下降,在培养第7 d左右降至CK水平,说明在此期间土壤中的氨氧化细菌利用进行硝化作用将其转化为图4b),并且有大量的累积(图5),浓度在培养第3 d累积量达到最大。对于添加抑制剂的处理来说,U+NP处理的浓度降低速度最慢,在培养28 d时其含量还维持在21.6 mg·kg-1(图4a),培养超过40 d后才完全转化为(图4b),培养的前7 d基本没有的累积(图5),说明该抑制剂可能对微生物活性的抑制效果较强,显著减缓了向的转化,延长了在土壤中的持留时间。U+NPD、U+ 2NPD和U+DCD处理的土壤和浓度(图4)均没有显著差异,3个处理中向的转化过程类似,但是在培养第3 d左右,U+DCD处理检测出近14 mg·kg-1的(图5)。对于U+nBPT处理,培养初期nBPT能够抑制尿素的水解,土壤含量最低(图4a),仅为U处理的52%,但培养1~3 d,该处理NH+4含量与U处理无显著差异,说明nBPT只能在短期内延缓尿素的水解,而不能抑制向的转化,土壤和浓度(图4)呈现此消彼长的趋势,在培养的前3 d有3.5 mg·kg-1的累积(图5)。


2.5 培养前后土壤无机氮的变化及N2O生成比率
表2为培养前后土壤无机氮含量的变化及N2O生成比率的关系。可以看出,N2O的释放占土壤氮素转化的比例较小,主要是N和之间的转化。所有处理在培养结束时NH+4都已完全消耗,U处理最终有74%的外加转化为NO3-N,6.7%的外加转化为N2O排放到大气中,另外20%的可能被土壤微生物利用或转化为有机氮,或者以NH3和NOx(N2O、NO、N2、NO2)的形式排放到大气中。添加硝化抑制剂的处理明显降低了转化为N2O的比例,在0.03%~0.84%之间,其中转化量最少的为U+ NP处理,N2O排放仅占转化量的0.03%,明显低于U+DCD处理(0.8%)和U+NPD处理(0.6%),可见中化集团的Nitrapyrin对N2O的减排效果最明显;2倍添加陶氏公司Nitrapyrin处理仅比推荐用量处理降低了16.4%;U+nBPT处理也降低了N2O排放占转化的百分比,只有4.69%的转化为N2O,比U处理降低了30%,但是与其他硝化抑制剂相比则高出许多。可见脲酶抑制剂nBPT不能有效抑制N2O的排放。
3 讨论
通过室内培养试验,比较不同硝化/脲酶抑制剂添加对华北平原石灰性潮土N2O排放通量及氮素转化的影响,计算尿素施入土壤后的氮素转化以及N2O排放占施入N的百分比,得出供试的几种硝化抑制剂的减排N2O效果优于供试脲酶抑制剂,供试硝化抑制剂中以中化集团的Nitrapyrin效果最好,陶氏公司Nitrapyrin按推荐量施用即可。施用尿素的同时施用硝化抑制剂,能够有效降低N2O排放,原因是硝化抑制剂延缓了向的转化,抑制了在该过程中的累积,从而减少了N2O的排放。此外,本试验施用相同量的尿素,培养时不论是否施用硝化抑制剂,结束时土壤的含量基本相同,原因是N2O排放量占硝态氮量的比例很小。

表2 培养前后无机氮的变化及N2O生成比率Table 2 The change of Nmin and N2O ratio of different treatments before and after the incubation
脲酶抑制剂的作用时间较短,研究表明nBPT在非酸性土壤中可以使尿素水解推迟5 d以上[25]。但在本试验中脲酶抑制剂对尿素水解的抑制作用更短,只在培养前期(2 d内)降低了的浓度,可能和具体的土壤环境有关。其他研究报道[26],脲酶抑制剂虽然能够延缓尿素的水解,但是可能会促进硝化和反硝化的氮素损失。本试验中脲酶抑制剂减排N2O效果较弱的另外一个原因可能是:在土壤中存在另外一种不能被脲酶抑制剂抑制的尿素水解酶——羧基酶[27]。
相比脲酶抑制剂,硝化抑制剂的N2O减排效果较好,过去几年中,众多研究发现了硝化抑制剂对硝化作用的显著抑制效果,其可使土壤中的较长时间保持在较高水平,减少N2O的排放和的累积[28-32]。同时施用牛粪水和DCD降低了60%的N2O排放[33],在畜牧草地上施用DCD也能够降低N2O排放[30]。本研究中,DCD对N2O的减排也有较强的作用,达到87%。课题组之前的室内培养试验发现,添加DCD减少了80%的N2O排放[13,34],与本试验的87.4%减排效果是吻合的,但是培养第3 d有较高的累积,其原因仍需探索。前人报道硝化抑制剂Nitrapyrin能够大幅降低硝化作用,但是可能增加NH3的挥发[35]。Nitrapyrin是美国最早商品化并大量使用于农作物上的硝化抑制剂,它对亚硝化细菌有选择性作用,处理中硝化细菌不仅会被抑制或被降低活性,有些细菌种群甚至会被杀死,但是该产品在中国一直没有得到广泛使用。刘涛等[36]在石灰性土壤上的培养试验中发现,Nitrapyrin与(NH4)2SO4一起施入土壤能够有效提高土壤含量,降低含量,与本研究结果相吻合。中化集团的Nitrapyrin抑制效果最好,N2O的排放较U处理降低了99.6%,加大陶氏公司的Nitrapyrin施用量并没有显著降低N2O排放,反而增加了CO2的排放,因此使用推荐用量即可。需要注意的是,中化集团的Nitrapyrin含较多的氯甲基吡啶,施用量过大或长期使用会对环境造成污染,而且其本身具有毒性会影响作物的生长[37-39]。
综上,脲酶抑制剂在降低N2O排放方面低于硝化抑制剂,减排效果最好的为中化代理产品Nitrapyrin,与其推荐使用浓度高有关系。硝化抑制剂DCD与陶氏化学公司的Nitrapyrin产品对N2O排放的减排效果无显著差异,DCD具有价格便宜、施用方便的特点,而陶氏产品优点主要体现在用量低、效率高和污染少。在实际应用中,应该综合考虑农作物生长状况、气候条件、土壤类型来选择硝化抑制剂以达到最佳N2O减排效果,并避免潜在的环境风险。
4 结论
在石灰性潮土上同时施用尿素和硝化/脲酶抑制剂能够不同程度地降低N2O的排放,其中硝化抑制剂对N2O的减排效果显著优于脲酶抑制剂,供试的几种硝化抑制剂降低了87.4%~99.6%的N2O排放,以中化集团代理的Nitrapyrin产品减排效果最好,培养期间减少了99.6%的N2O排放,延缓了的氧化过程,延长在土壤中的持留时间长达42 d,同时避免了在土壤中的累积。施用该抑制剂可以作为农田生产过程中N2O减排的重要农业措施。陶氏公司的Nitrapyrin产品按推荐量施用即可。
[1]IPCC.Changes in atmospheric constituents and in radiative forcing[M]// Solomon S,Qin D,Manning M.Climate Change 2007:The Physical Science Basis.Cambridge,United Kingdom/New York,USA:Cambridge University Press,2007:141-212.
[2]Bouwan L,Daniel J S,Davidson E A,et al.Drawing down N2O to protect climate and the ozone layer[M]//A UNEP Synthesis Report.Nairobi:U-nited Nations Environment Programme,2013.
[3]National Development and Reform Commission.The People′s Republic of China national greenhouse gas inventory[M].Beijing:China Environmental Science Press,2014.
[4]Venterea R T,Halvorson A D,Kitchen N,et al.Challenges and opportunities for mitigating nitrous oxide emissions from fertilized cropping systems[J].Frontiers in Ecology and the Environment,2012,10(10):562-570.
[5]Wrage N,Velthof G L,vanBeusichem M L,et al.Role of nitrifier denitrification in the production of nitrous oxide[J].Soil Biology and Biochemistry,2001,33(12):1723-1732.
[6]Wrage N,van Groenigen J W,Oenema O,et al.A novel dual-isotope labelling method for distinguishing between soil sources of N2O[J].Rapid Communications in Mass Spectromtry,2005,19(22):3298-3306. [7]Kool D M,Wrage N,Zechmeister-Boltenstern S,et al.Nitrifier denitrification can be a source of N2O from soil:A revised approach to the dualisotope labelling method[J].European Journal of Soil Science,2010,61(5):759-772.
[8]Baggs E M.Soil microbial sources of nitrous oxide:Recent advances in knowledge,emerging challenges and future direction[J].Current Opinion in Environmental Sustainability,2011,3(5):321-327.
[9]Zhu X,Burger M,Doane T A,et al.Ammonia oxidation pathways and nitrifier denitrification are significant sources of N2O and NO under low oxygen availability[J].Proceedings of the National Academy of Sciences of the United States of America,2013,110(16):6328-6333.
[10]Bakken L R,Bergaust L,Liu B B,et al.Regulation of denitrification at the cellular level:A clue to the understanding of N2O emissions from soils[J].Philosophical Transactions of the Royal Society Biological Sciences,2012,367(1593):1226-1234.
[11]Loick N,Dixon E R,Abalos D,et al.Denitrification as a source of nitric oxide emissions from incubated soil cores from a UK grassland soil[J].Soil Biology and Biochemistry,2016,95:1-7.
[12]Ju X T,Lu X,Gao Z L,et al.Processes and factors controlling N2O production in an intensively managed low carbon calcareous soil under sub-humid monsoon conditions[J].Environmental Pollution,2011,159(4):1007-1016.
[13]Huang T,Gao B,Hu X K,et al.Ammonia-oxidation as an engine togenerate nitrous oxide in an intensively managed calcareous fluvoaquic soil[J].Scientific Reports,2014,4:3950.
[14]Guo Y J,Di H J,Cameron K C,et al.Effect of application rate of a nitrification inhibitor,dicyandiamide(DCD),on nitrification rate,and ammonia-oxidizing bacteria and archaea growth in a grazed pasture soil:An incubation study[J].Journal of Soils and Sediments,2014,14(5):897-903.
[15]张姝婷,石美,梁东丽,等.不同硝化抑制剂对尿素转化的影响[J].西北农林科技大学学报(自然科学版),2011,39(2):178-184.
ZHANG Shu-ting,SHI Mei,LIANG Dong-li,et al.Effects of different nitrification inhibitors on urea transformation[J].Journal of Northwest A&F University(Natural Science Edition),2011,39(2):178-184.
[16]隽英华,陈利军,武志杰,等.脲酶/硝化抑制剂在土壤N转化过程中的作用[J].土壤通报,2007,38(4):773-780.
JUAN Ying-hua,CHEN Li-jun,WU Zhi-jie,et al.Effect of urease/nitrification inhibitor on soil-N transformation[J].Chinese Journal of Soil Science,2007,38(4):773-780.
[17]Akiyama H,Morimoto S,Hayatsu M,et al.Nitrification ammonia oxidizing communities,and N2O and CH4fluxes in an imperfectly drained agricultural field fertilized with coated urea with and without dicyandiamide[J].Biology and Fertility of Soils,2013,49(2):213-223.
[18]Di H J,Cameron K C.Inhibition of ammonium oxidation by a liquid formulation of 3,4-Dimethylpyrazole phosphate(DMPP)compared with a dicyandiamide(DCD)solution in six New Zealand grazed grassland soils[J].Journal of Soils and Sediments,2011,11(6):1032-1039.
[19]Ruser R,Schulz R.The effect of nitrification inhibitors on the nitrous oxide(N2O)release from agricultural soils:A review[J].Journal of Plant Nutrition and Soil Science,2015,178(2):171-188.
[20]Shen T L,Stieglmeier M,Dai J L,et al.Responses of the terrestrial ammonia-oxidizing archaeon Ca.Nitrososphaera viennensis and the ammonia-oxidizing bacteriumNitrosospira multiformisto nitrification inhibitors[J].FEMS Microbiology Letters,2013,344(2):121-129.
[21]Klemedtsson L,Svensson B H,Rosswall T.A method of selective inhibition to distinguish between nitrification and denitrification as sources of nitrous oxide in soils[J].Biology and Fertility of Soils,1988,6(2):112-119.
[22]牛灵安,郝晋珉,张宝忠,等.长期施肥对华北平原农田土壤呼吸及碳平衡的影响[J].生态环境学报,2009,18(3):1054-1060.
NIU Ling-an,HAO Jin-min,ZHANG Bao-zhong,et al.Soil respiration and carbon balance in farmland ecosystems on North China Plains[J]. Ecology and Environmental Sciences,2009,18(3):1054-1060.
[23]Gao B,Ju X T,Meng Q F,et al.The impact of alternative cropping systems on global warming potential,grain yield and groundwater use[J].Agriculture,Ecosystems and Environment,2015,203:46-54.
[24]Stevens R J,Laughlin R J.Nitrite transformation during soil extraction with potassium chloride[J].Soil Science Society of America Journal, 1995,59(3):933-938.
[25]Wang Z P,Van Cleemput O,Demeyer P,et al.Effect of urease inhibitors on urea hydrolysis and ammonia volatilization[J].Biology and Fertility of Soils,1991,11(1):43-47.
[26]Gioacchini P,Claudio A N,Giovannini C M C.Influence of urease and nitrification inhibitors on N losses from soils fertilized with urea[J].Biology and Fertility of Soils,2002,36(2):129-135.
[27]蔡贵信.脲酶抑制剂在提高尿素增产效果中的作用[J].土壤学进展,1989,17(5):1-8.
CAI Gui-xin.Effect of urease inhibitor on improving production for urea[J].Progress in Soil Science,1989,17(5):1-8.
[28]Slangen J H G,Kerkhoff P.Nitrification inhibitors in agricultures and horticulture:A literature review[J].Fertilizer Research,1984,5(1):1-76.
[29]Dittert K,Bol R,King R,et al.Use of a novel nitrification inhibitor to reduce nitrous oxide emission from15N-labelled dairy slurry injected intosoil[J].RapidCommunicationsinMassSpectrometry,2001,15(15):1291-1296.
[30]Di H J,Cameron K C.Mitigation of nitrous oxide emissions in spray-irrigated grazed grassland by treating the soil with dicyandiamide,a nitrification inhibitor[J].Soil Use Manage,2003,19(4):284-290.
[31]Boeckx P,Xu X,Van Cleemput O.Mitigation of N2O and CH4emission from rice and wheat cropping systems using dicyandiamide and hydroquinone[J].Nutrient Cycling in Agroecosystems,2005,72(1):41-49.
[32]Pereira J,Fangueiro D,Chadwick D,et al.Effect of cattle slurry pretreatment by separation and addition of nitrification inhibitors on gaseous emissions and N dynamics:A laboratory study[J].Chemosphere,2010,79(6):620-627.
[33]Merino P,Estavillo J M,Graciolli L A,et al.Mitigation of N2O emissions from grassland by nitrification inhibitor and Actilith F2 applied with fertilizer and cattle slurry[J].Soil Use Manage,2002,18(2):135-141.
[34]Ma L,Shan J,Yan X Y.Nitrite behavior accounts for the nitrous oxide peaks following fertilization in a fluvo-aquic soil[J].Biology and Fertility of Soils,2015,51(5):563-572.
[35]Freney J R,Keerthisinghe D G,Phongpan S,et al.Effect of urease,nitrification,algal inhibitors on ammonia loss and grain yield of flooded rice in Thailand[J].Fertilizer Research,1995,40(3):225-233.
[36]刘涛,梁永超,褚贵新,等.三种硝化抑制剂在石灰性土壤中的应用效果比较[J].土壤,2011,43(5):758-762.
LIU Tao,LIANG Yong-chao,CHU Gui-xin,et al.Effect comparison of three different types of nitrification inhibitors(DCD,DMPP and Nitrapyrin)in calcareous soils[J].Soils,2011,43(5):758-762.
[37]Zerulla W,Barth T,Dressel J,et al.3,4 Dimethylpyrazole phosphate(DMPP):A new nitrification inhibitor for agriculture and horticulture [J].Biology and Fertility of Soils,2001,34(2):79-84.
[38]Maftoun M,Yasrebi J,Darbekeshti M.Comparative phytotoxicity of nitrapyrin and ATC to several leguminous species[J].Plant and Soil, 1981,63(2):303-306.
[39]Thomson C J,Marschner H,RÊmheld V.Effect of nitrogen fertilizer form on the pH of the bulk soil and rhizosphere,and on the growth, phosphorus,and micronutrient up take by bean[J].Journal of Plant Nutrition,1993,16(3):493-506.
Effects of nitrification/urease inhibitors on mitigating N2O emission and transformation of N from calcareous fluvo-aquic soil
YANG Liu-qing,JI Jia-min,JU Xiao-tang*
(College of Resources and Environmental Sciences,China Agricultural University,Beijing 100193,China)
N2O emission can be reduced by nitrification and urease inhibitors which are also connected to soil N transformation.An incubation experiment was conducted in calcareous fluvo-aquic soil in order to compare the effects of different nitrification/urease inhibitors on N2O emissions and N transformation,find out proper nitrification/urease inhibitor for this soil,provide scientific basis for applying proper inhibitors in agricultural production.Seven treatments were set:No fertilizer(CK),Urea(U),Urea plus Nitrapyrin belonged to the Sinochem Group(U+NP),Urea plus recommended dosage of Nitrapyrin belonged to the Dow Chemical Company(U+NPD),Urea plus double recommended dosage of Nitrapyrin belonged to the Dow Chemical Company(U+2NPD),Urea plus Dicyandiamide(U+DCD)and Urea plus nBPT(U+nBPT).The incubation last for 56 days.Gases were sampled on the first,second,third,fifth,seventh,tenth,fourteenth and nineteenth day of the incubationfor N2O and CO2analysis,soils were sampled on the zero,first,third,seventh,fourteenth,twenty-first,twenty-eighth,forty-second and fifty-sixth day of the incubation for N transformation analysis.The main results showed that the experimental nitrification/ urease inhibitors reduced N2O emissions in different degrees,from 87.4%to 99.6%for nitrification inhibitor treatments while 30%for U+ nBPT treatment compared with CK.There was only 0.03%to 0.84%of the ammonium transformed into N2O for nitrification inhibitor treatments,while 4.69%for U+nBPT treatment.There was no significant difference on mitigating N2O emissions between U+DCD and U+NPD, double recommended dosage of Nitrapyrin did not increase the effect on reducing N2O emission correspondingly.In summary,the experimental nitrification inhibitors significantly reduced N2O emissions from the calcareous fluvo-aquic soil,and the nitrification inhibitor effects were better than urease inhibitor.The best one was U+NP treatment.
nitrification inhibitor;urease inhibitor;N2O emission;N transformation;calcareous fluvo-aquic soil
X511
A
1672-2043(2017)03-0605-08
10.11654/jaes.2016-1295
杨柳青,季加敏,巨晓棠,等.硝化/脲酶抑制剂对石灰性潮土N2O减排效果及氮素转化的比较[J].农业环境科学学报,2017,36(3):605-612.
YANG Liu-qing,JI Jia-min,JU Xiao-tang,et al.Effects of nitrification/urease inhibitors on mitigating N2O emission and transformation of N from calcareous fluvo-aquic soil[J].Journal of Agro-Environment Science,2017,36(3):605-612.
2016-10-11
杨柳青(1987—),女,河南濮阳人,博士研究生,主要从事土壤温室气体N2O排放机理研究。E-mail:yangliuqing.1224@163.com
*通信作者:巨晓棠E-mail:juxt@cau.edu.cn
公益性行业(农业)专项(201503106);国家重点研发计划项目(2016YFD0800102);国家自然科学基金项目(41471190)
Project supported:Speial Fund for Scientific(Agriculural)Reseach on Public Causes(201503106);National Key Research and Development Program(2016YFD0800102);The National Natural Science Foundation of China(41471190)
