沸石-纳米零价铁的制备及其对溶液中Cu2+的吸附研究
2017-03-16王顺利王秀红周新初艾晓杰邱江平李银生
王顺利,王秀红,周新初,艾晓杰,邱江平,李银生
(上海交通大学农业与生物学院,上海 200240)
沸石-纳米零价铁的制备及其对溶液中Cu2+的吸附研究
王顺利,王秀红,周新初,艾晓杰,邱江平,李银生*
(上海交通大学农业与生物学院,上海 200240)
采用液相还原法制备沸石-纳米零价铁复合材料,并通过添加不同质量的沸石得到不同铁与沸石比例的沸石-纳米零价铁复合材料(Z-nZVI),考查了不同比例复合材料对Cu2+的吸附效果,确定最佳铁与沸石比例为1∶6,并对该比例材料、纳米零价铁与沸石进行了性状表征(包括:TEM、XRD及BET)。该比例复合材料对Cu2+的吸附动力学实验结果表明,其吸附平衡时间约为1 h;动力学方程拟合结果表明,该材料的动力学过程更符合准二级动力学方程,且平衡吸附量达到515.46 mg·g-1Fe0;对等温吸附实验数据进行Langmuir和Freundlich拟合结果表明,Langmuir方程更适用于描述沸石-纳米零价铁对Cu2+的吸附。比较而言,沸石-纳米零价铁(1∶6)对于Cu2+的吸附效果要优于纳米零价铁并远高于沸石。三因素三水平正交试验(溶液温度:25、35、45℃;pH:3、4、5;Z-nZVI添加量:0.1、0.14、0.21 g·40 mL-1)结果表明,铁沸石比为1∶6的沸石-纳米零价铁对Cu2+的最优吸附条件为:温度45℃,pH 3,Z-nZVI添加量0.21 g·40 mL-1。上述结果表明沸石-纳米零价铁可应用于水体中Cu2+的去除。
沸石-纳米零价铁复合材料;铜离子;吸附能力
矿冶、机械制造、化工、电子、仪表等工业中许多生产过程会产生大量含重金属离子的废水,其对水环境造成了严重的污染,其中铜是污染最广泛的重金属元素之一。
虽然铜是动植物生长必需的微量元素,但过量的铜不仅会给动植物生长带来毒害,还会在生物体或土壤中累积,从而造成其在水/土壤的食物链中富集[1]。随着现代工业的迅速发展和含铜物料的大量使用,我国铜污染的土壤面积逐年扩大。2014年全国土壤污染调查公报显示,铜污染的点位超标率达到2.1%,在重金属污染中排名第三位(仅次于镉和汞)[2]。铜污染的治理具有紧迫性。
针对重金属污染的治理方法有很多,零价铁(ZVI)因具有强还原性而被用来去除水中的各种污染物,在处理重金属废水中表现出高效性。纳米零价铁(nZVI)不仅具有零价铁的性质,其优点在于比普通零价铁具有更大的比表面积,更高的反应活性以及更好的吸附性能[3-5]。然而,纳米零价铁颗粒的表面能较高,其颗粒为了更稳定的存在而易于发生团聚,形成亚微米级或者是微米级的较大颗粒,导致零价铁比表面积和氧化还原电势增加,从而降低污染物去除效率,失去其作为纳米材料的优势[6]。这就限制了零价纳米铁在污染修复方面的应用。Wang等[7]首先将纳米零价铁负载于NaY沸石表面以获得一种新型的Fenton催化剂,结果表明新型催化剂不仅催化效果较好,而且相较于传统的催化剂来说具有更宽的pH工作范围(1.7~5),有望成为一种可应用于环境修复的新型异质Fenton催化剂。Kim等[8]研究表明,沸石的存在可减少团聚的发生,负载剂的存在可减少纳米零价铁的团聚,粒子的分散使得其具有更大的比表面积和更高的反应活性。沸石-纳米零价铁复合物(Z-nZVI)的平均比表面积为80.37 m2·g-1,而单独的纳米零价铁和沸石的比表面积仅分别为12.25、1.03 m2·g-1[8]。沸石-纳米零价铁复合物对Pb(Ⅱ)的吸附容量达到806 mg Pb(Ⅱ)·g-1Z-nZVI[8]。Sepehri等[9]将沸石负载纳米零价铁应用于溶液中硝酸盐的去除,也得到了良好的效果。天然沸石容易获得且成本较低,已被广泛应用于水体和土壤中重金属污染物的去除[10-11]。Zhou等[12]研究了Z-nZVI对化学元素锑的去除,从文献报道看,针对Z-nZVI的研究屈指可数,因而需要更多的研究来关注沸石-纳米零价铁这一新型吸附材料。目前尚无该材料应用于铜吸附的研究报道。
本文采用液相合成法制备了几种不同铁沸石比例的沸石-纳米零价铁(Z-nZVI),并通过吸附试验找到最佳铁与沸石比例,探究该比例的沸石-纳米零价铁复合物对于水溶液中Cu2+的吸附效果,旨在为其在污水治理中的实际应用提供理论依据。
1 材料与方法
1.1 试剂、材料和仪器
沸石(高温改性)购于河南琪康水处理材料有限公司;CuSO4·5H2O、FeCl3·6H2O、HNO3、NaBH4、无水乙醇,均为分析纯,购于国药集团。
恒温水浴振荡器—SHZ-82B,国旺仪器;ICPOES—Perkin Elmer Optimer 8000,USA;无油隔膜真空泵—GM-0.33A,天津津腾;全自动快速比表面仪—ASAP 2460,美国Micromeritics;Bio-TEM—Tecnai G2 Spirit Biotwin,FEI。
1.2 沸石-纳米零价铁复合物的制备
沸石使用前与1 mol·L-1HNO3溶液于室温下振荡24 h,以除去可溶性杂质,然后用超纯水洗涤3~5次。于80℃干燥过夜,研磨、过100目筛。
沸石-纳米零价铁制备过程:称取4.83 g FeCl3· 6H2O溶于50 mL 30%(V/V)乙醇溶液中,向其中加入一定质量的沸石(分别为1、2、4、6、8 g),常温下搅拌12 h。将100 mL 0.8 mol·L-1的NaBH4溶液通过蠕动泵滴加到上述混合溶液中,同时通入氮气并剧烈搅拌,滴加完毕后继续搅拌30 min(整个还原过程均有氮气存在)。还原方程如下:

反应完成后真空抽滤得到黑色固体(沸石-纳米零价铁复合物,其中Fe与沸石的比例分别为1∶1、1∶2、1∶4、1∶6、1∶8),用超纯水洗涤3次,最后用无水乙醇洗涤1次。将得到的黑色固体置于真空干燥箱中80℃干燥过夜,取出后保存于真空干燥器中。
1.3 Cu2+吸附实验
1.3.1 不同比例沸石-纳米零价铁复合材料吸附Cu2+效果比较
在保证Fe添加量相同(0.5 g Fe0·L-1)的情况下,向初始溶液浓度为100、200、300 mg·L-1的Cu2+溶液中添加相应质量的不同比例(1∶1、1∶2、1∶4、1∶6、1∶8)沸石-纳米零价铁复合物。于室温下,180 r·min-1振荡2 h后取溶液过0.45 μm滤膜,采用ICP-OES测定Cu2+含量。
1.3.2 动力学实验
在保证Fe添加量相同(0.5 g Fe0·L-1)的情况下,向初始溶液浓度为200 mg·L-1的Cu2+溶液中加入相应质量的沸石、nZVI和Z-nZVI。沸石的加入量与Z-nZVI相同。室温下180 r·min-1振荡,分别于5、10、15、30、45、60、90、120、150、180 min时取样过0.45 μm滤膜,测定Cu2+含量。
测定结果运用Origin 8.0分别对动力学过程进行准一级和准二级动力学方程拟合[14]。

式中:qe为平衡吸附量mg·g-1;k为一次方程吸附速率常数;t为反应时间,min。

式中:qe为平衡吸附量mg·g-1;k为二次方程吸附速率常数;t为反应时间,min。
1.3.3 pH影响实验
配制200 mg·L-1Cu2+溶液,用1 mol·L-1的NaOH和1 mol·L-1的HNO3调节溶液pH为1、2、3、4、5、6(正负偏差0.2)。材料的添加量同上,于室温下、180 r· min-1振荡2 h后取样过0.45 μm滤膜,测定Cu2+含量。
1.3.4 等温吸附实验
配制浓度分为100、200、300、400、500 mg·L-1的Cu2+溶液。分别于25、45℃的温度下,180 r·min-1振荡2 h后取样过0.45 μm滤膜,测定Cu2+含量。材料的添加量同上。
1.3.5 沸石-纳米零价铁复合材料对Cu2+吸附的最优条件研究
根据预实验配制300 mg·L-1的Cu2+溶液,设置三因素(温度、pH、材料用量)三水平正交试验L9(33),研究铁、沸石比为1∶6的沸石-纳米零价铁复合材料对Cu2+吸附的最优条件。各因素及水平如表1所示,共进行9次试验。
1.4 试验材料的性状表征
对纳米零价铁、沸石、沸石-纳米零价铁复合材料的结构和形貌特征采用生物透射电镜(Bio-TEM,Tecnai G2 Spirit Biotwin,FEI)在120 kV加速电压下进行扫描测定。分析之前,需将样品超声分散于无水乙醇溶液内,然后取一滴分散液在碳涂层铜网表面,多余的溶液用滤纸吸干。

表1 沸石-纳米零价铁复合材料对Cu2+吸附条件优化的三因素三水平试验Table 1 The three level orthogonal experiment for the adsorption of Cu2+by zeolite-nanoscale zero valent iron composite
比表面积的测定采用BET法,仪器为‘Micromerit ics’ASAP2020AcceleratedSurfaceArea and Porosimetry Analyzer。称取0.1~0.2 g复合材料,120℃脱气3 h以除去水分及其他吸附质。
沸石、纳米零价铁及沸石-纳米零价铁的XRD表征在Philips-X′Pert Pro MPD(Netherlands)仪器上进行。分析参数为Cu Kα射线,λ=1.540 3Å,电流30 mA,电压40 kV,步长0.02°,扫描范围10°~90°,扫描速度为12°·min-1。
1.5 数据分析
采用SPSS 18.0软件对所测定的数据进行描述性统计和单因素方差分析(One-way ANOVA),并进行LSD检验,P<0.05为差异显著。用Excel软件绘图。
2 结果与讨论
2.1 性状表征
沸石、nZVI及Z-nZVI的TEM图像如图1。nZVI以链状形式存在,团聚现象非常明显,导致其比表面积较小,反应活性下降。从Z-nZVI的TEM图像可知:虽仍有部分纳米零价铁团聚成链状,而沸石的存在显著降低了纳米零价铁的团聚程度,使得其分散度增加,保证了比表面积。图1d显示纳米零价铁具有“核壳结构”,其中零价铁(Fe0)为核,铁氧化生成的铁氧化物/氢氧化物为壳,这使得其可以对金属离子同时进行吸附和还原沉淀[17]。对nZVI及Z-nZVI的BET比表面积测定显示,nZVI比表面积仅为13.71 m2·g-1,而Z-nZVI的比表面积为42.53 m2·g-1。团聚现象的减少可能是比表面积增加的主要原因[8]。
沸石、nZVI及Z-nZVI的XRD表征如图2。沸石XRD图谱中于2θ=22.9°、25.9°、28.1°、30.1°处出现的强峰表明片沸石(Heulandie)在其中占有较大的比例。纳米零价铁及沸石-纳米零价铁XRD图谱中2θ= 44.8°、65.1°处出现较强的衍射峰证明了Fe0的存在。沸石-纳米零价铁仍保有沸石的特征结构,沸石的框架及晶体结构在Fe0加入之后并没有发生显著变化,表明Fe0可能负载于沸石的表面[9]。
2.2 不同比例沸石-纳米零价铁复合物吸附Cu2+效果比较
各比例材料对Cu2+的吸附效果如图3。在一定的反应条件下随着沸石在材料中添加比例的提高,沸石-纳米零价铁复合物对Cu2+的去除率逐渐增加;而当铁与沸石比例达到1∶8时,Cu2+的去除率出现下滑。在初始浓度为200、300 mg·L-1的溶液吸附中也出现了相同变化,进一步证明了这一趋势,即随着沸石添加比例的增大,复合材料对Cu2+的去除率先增加后下降。三种浓度下,添加沸石的材料对Cu2+的去除率均显著高于nZVI对Cu2+的去除率(P<0.05)。由这一现象可知,增加改性材料的用量能提高Z-nZVI对Cu2+的去除率。这主要是因为对nZVI进行改性可以解决其自身的不足,保持其反应活性与稳定性。当改性材料用量过多时,去除效率反而降低,其原因可能是过量的改性材料占据了nZVI的表面,抑制nZVI表面的电子向Cu2+转移,从而阻止反应的进行[15]。Shi等[16]针对这一现象的解释则是过量的沸石添加可能会阻碍制备过程中nZVI的形成。单位质量Fe0的吸附量变化趋势与去除率一样:随着沸石添加比例的增加,单位质量Fe0对Cu2+的吸附量逐渐增加;当铁与沸石比例为1∶6时,单位质量Fe0对Cu2+的吸附量最大,而后开始下降。
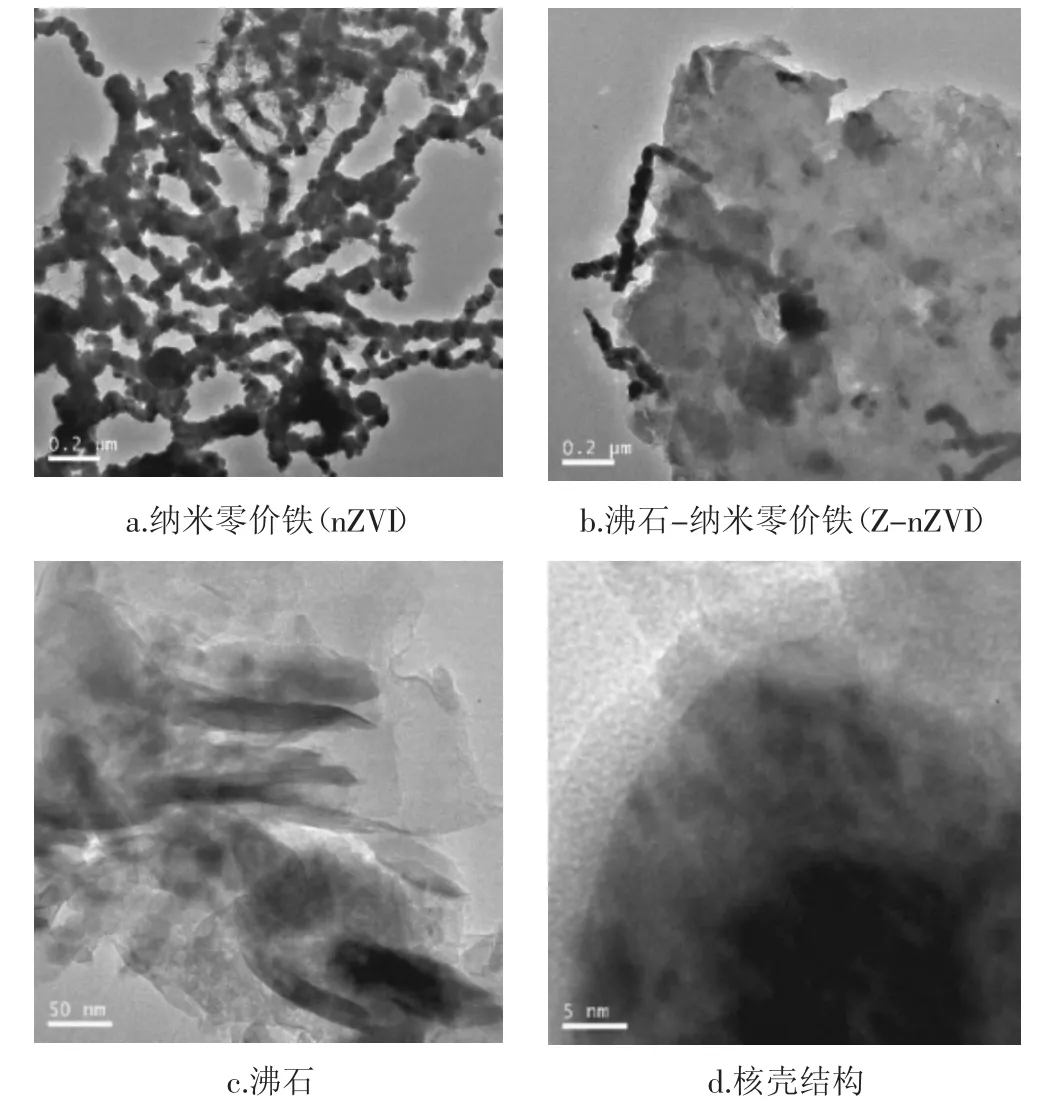
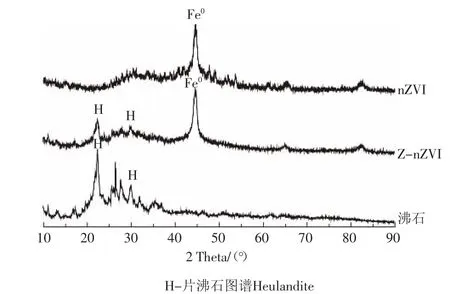
图2 沸石、纳米零价铁及沸石-纳米零价铁XRDFigure 2 XRD pattern of Z,nZVI and Z-nZVI
由于图3中1∶4和1∶6的Z-nZVI对Cu2+去除率的差别并不明显,为了更具说服力,又分别做了二者在400、500 mg·L-1浓度时的吸附实验。由图4可见,两种材料的去除率均随着初始浓度的增加而显著降低。其主要原因是低浓度时Z-nZVI表面的活性位点足够去除低浓度Cu2+,当溶液中Cu2+的浓度增加到一定量时,Z-nZVI则会因为表面的活性位点被完全占据而导致还原能力下降[15]。二者在低浓度时的去除率相当,但随着溶液浓度的增加,1∶6 Z-nZVI的去除率始终高于1∶4 Z-nZVI,并且下降趋势较缓。综上可知,1∶6为最佳比例,该比例材料单位质量Fe0的利用率最高。
2.3 动力学实验

图3 不同铁与沸石比例的纳米零价铁材料对溶液中Cu2+的去除率比较Figure 3 The comparison of Cu2+removal efficiency by Z-nZVI with different ratio of Fe/zeolite
由图5可知,随着反应时间的延长,溶液中Cu2+浓度均逐渐降低,表明三种材料对溶液中Cu2+均有一定的去除作用。根据溶液中Cu2+浓度下降趋势可知,对nZVI和Z-nZVI而言,在反应的初始阶段二者对Cu2+的吸附较快,随着时间的延长,溶液中Cu2+浓度的下降速度逐渐减慢,当吸附时间达到60 min之后,溶液中Cu2+浓度几乎不再变化而维持在一定范围内,此时吸附反应达到平衡。沸石的吸附动力学过程也遵循溶液中Cu2+浓度逐渐降低的总体趋势,但中间出现较大幅度的波动。根据其他文献[18-20]出现波动应属正常情况。
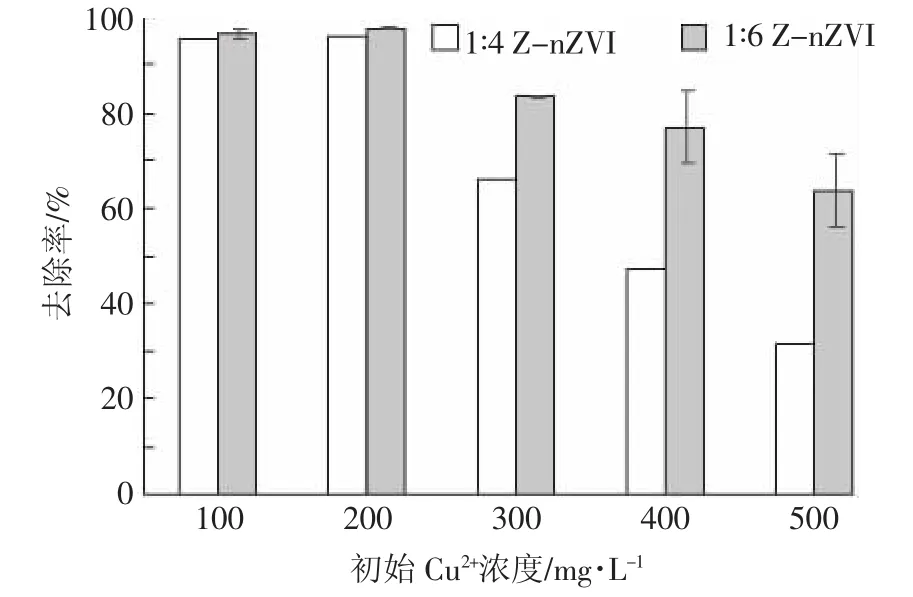
图4 两种比例材料对Cu2+去除率随浓度变化Figure 4 The effect of Cu2+concentration on the removal efficiency

图5 三种材料吸附动力学过程Figure 5 The adsorption kinetics of zeolite,nZVI and Z-nZVI
分别对三种材料的吸附动力学过程进行准一级动力学和准二级动力学方程拟合,拟合参数如表2。结果表明三种材料的吸附动力学过程均更符合准二级动力学过程(根据R2的大小)。Yang等[21]对walnutnZVI的研究结果也显示,该材料对Cu2+的吸附动力学更符合准二级动力学方程,且由准二级动力学方程拟合得到的三种材料的平衡吸附量中,nZVI-Z的平衡吸附量最大,可达到515.46 mg·g-1Fe0,约为nZVI平衡吸附量(218.34 mg·g-1Fe0)的2倍。准一级动力学方程拟合得到的两种材料平衡吸附量之间也存在着约2倍的关系。这证明沸石的存在显著增强了纳米零价铁对Cu2+的吸附能力,提高了单位质量纳米零价铁的利用率。此外,Z-nZVI的初始反应速率也大于nZVI。这主要是因为沸石的存在增加了纳米零价铁的分散度,减少了纳米零价铁的团聚,使其比表面积增加,因而活性位点数目增加[16]。
2.4 pH影响实验

表2 准一级及准二级动力学方程拟合参数Table 2 Parameters of pseudo-first order kinetics and pseudo-second order kinetics for Cu2+adsorption
实验过程中发现,当调节溶液pH=6时,溶液中就会出现蓝色絮状沉淀,说明有Cu2+沉淀析出。因此本实验中设置pH上限为6,没有涉及到中性及碱性pH的影响。在偏酸的条件下,铜主要以Cu2+形式存在[22]。由图6可知,溶液pH值在1~5之间时,随着pH的增加Z-nZVI对Cu2+的吸附量逐渐提高,pH=5时吸附量达到最大;而当pH>5后,Z-nZVI对Cu2+的去除率出现下降趋势。pH在3~5之间时吸附量最高,此时去除率也最大,均在90%以上。Xu等[23]的研究结果也显示,当pH处于3~5之间时,蒙脱石负载纳米零价铁对溶液中铀的去除率最佳。这是因为该材料对于Cu2+的去除主要通过还原作用实现,即Fe0失去电子变为Fe2+,同时Cu2+得到电子被还原成Cu0,在略偏酸性的条件下溶液中含有适量的H+,可以与Z-nZVI表面的铁氧/氢氧化物反应将其溶解,即去除nZVI表面的金属钝化层从而暴露出Fe0内核,使得Fe0与Cu2+的反应更加直接快速。由实验所得数据可知:pH=1时Z-nZVI对Cu2+的去除率仅为9.81%,远小于pH=5时的96%;pH=2时去除率已明显下降为77.6%。其原因可能在于:当pH过低(pH≤2)时溶液中H+含量过多,将材料中大部分Fe0溶解转化成Fe2+,使其失去还原Cu2+的能力,因而去除率较低(在pH=1的实验过程中发现大部分黑色固体被溶解)。
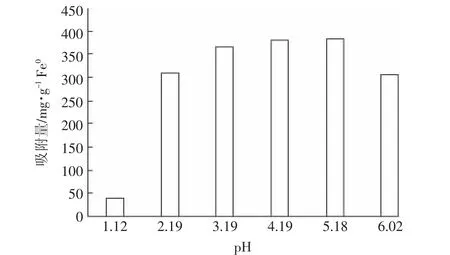
虽然Kim等[8]对溶液中Pb2+的去除研究认为,沸石-纳米零价铁对Pb2+去除率受pH影响很小,但本实验结果显示pH的变化对于溶液中Cu2+去除率有较大影响。
2.5 吸附等温线
分别于25、45℃的条件下进行Cu2+等温吸附实验,以其吸附量与Cu2+平衡浓度作图,获得Cu2+在复合材料上的吸附等温线如图7,并分别用Langmuir、Freundlich等温吸附模型对其数据进行拟合。

式中:Ce为平衡浓度,mg·L-1;qm为最大吸附量,mg·g-1;b为吸附平衡常数,L·mg-1;qe为平衡吸附量,mg·g-1;Kf为Freundlich亲和系数,(mg·g-1)/(mg·L-1);n为Freundlich常数。
由图7可以看出,随着平衡浓度的增大,平衡吸附量先迅速增加后趋于平缓。对该复合材料吸附Cu2+的数据分别进行Langmuir和Freundlich等温吸附模型拟合得到的参数列于表3。Freundlich公式中n的大小可以表明吸附的难易情况,通常情况下当2<n<
图7 Cu2+在沸石-纳米零价铁复合材料上的吸附等温线Figure 7 The adsorption isotherm of Cu2+on Z-nZVI10时,易于吸附;当1<n<2时,适量吸附;当n<1时,几乎没有吸附特性。本实验中两种温度下(25、45℃)的指数n分别为5.576、7.395,表明Z-nZVI易于吸附水溶液中的Cu2+[24]。两种温度下,Langmuir方程拟合的相关系数均大于Freundlich方程拟合的,说明Langmuir方程描述的等温吸附模型更适用于描述Z-nZVI对Cu2+的吸附。由Langmuir方程拟合得到的最大吸附量分别为793.651 mg·g-1Fe0(25℃)和909.091 mg·g-1Fe0(45℃),可推知在一定的温度范围内温度升高对于Cu2+的吸附去除具有促进作用。

表3 Langmuir及Freundlich方程拟合参数Table 3 Parameters of Langmuir and Freundlich isotherm for Cu2+adsorption
2.6 三因素三水平正交试验
由表4可知,Z-nZVI对于Cu2+吸附过程的主要影响因素是添加量,其次为温度,最后为pH,最优组合为45℃下,pH 3,添加量0.21 g·40 mL-1。高温可加速吸附反应的进行并使吸附平衡向右移动,与Shi等[16]的研究结果相同,即反应温度升高可提高反应速率。偏酸性的条件可溶解部分纳米零价铁表面的铁氧/氢氧化物,使零价铁内核暴露出来,从而加速反应的进行。
参照已有结果及部分文献[22,25-26]报道,对沸石-纳米零价铁复合材料对Cu2+的吸附机理可作出如下推测:沸石-纳米零价铁存在的“核壳结构”使其可以对金属离子同时进行吸附和还原沉淀,“壳”结构(由铁氧/氢氧化物组成)与溶液的界面处含有的氢氧基团通过表面络合作用将Cu2+吸附在材料表面。铜的标准还原电势高于铁,即:Cu2+/Cu0=+0.34 V(25℃),Cu2+/ Cu+=+0.16 V(25℃),Fe2+/Fe0=-0.44 V(25℃)。因而,由Fe0组成的“核”可作为电子源失去电子,将Cu2+还原为Cu0,被还原为零价的铜沉淀附着在沸石-纳米零价铁的表面。该复合材料吸附去除Cu2+的机理需要结合其他手段进一步深入研究。
3 结论
(1)当铁含量一定时,随着沸石添加比例的增大,沸石-纳米零价铁复合物对Cu2+的去除率先逐渐上升,当铁与沸石之比达到1∶8时去除率开始下降,铁沸石最佳比例为1∶6。

表4 根据预实验结果设置的正交试验因素Table 4 The parameters and the results of the three level orthogonal experiments
(2)Z-nZVI对于Cu2+的吸附过程的主要影响因素是添加量,其次为温度,最后为pH,最优组合为45℃,pH 3,添加量0.21 g·40 mL-1。
(3)沸石的加入可以提高单位质量Fe0的利用率,沸石-纳米零价铁具有经济、高效的优点,可应用于重金属铜污染治理。
[1]孙艳.不同钝化剂对土壤中Cu的钝化能力及其对土壤速效养分影响的研究[D].济南:山东师范大学,2011.
SUN Yan.A study on the passivation ability of different passivators for Cu and the effects on available nutrient elements[D].Jinan:Shandong Normal University,2011.
[2]环境保护部,国土资源部.全国土壤污染调查公报[R].2014.
Ministry of Environmental Protection and Ministry of Land and Resources.National soil pollution survey bulletin[R].2014
[3]付丰连.基于零价铁的重金属废水处理技术[J].科学观察,2015,10(6):69-70.
FU Feng-lian.The technology based on the zero valent iron for the restoration of heavy metal contaminated wastewater[J].Science Focus,2015,10(6):69-70.
[4]徐佳丽.蒙脱石负载纳米零价铁对水溶液中铀去除的研究[D].北京:中国地质大学,2014.
XU Jia-li.Removal of uranium from aqueous solution using montmorillonite-supported zero-valent iron nanoparticles[D].Beijing:China U-niversity ofGeosciences,2014.
[5]Xi Y F,Mallavarapu M,Naidu R.Reduction and adsorption of Pb2+in aqueous solution by nano-zero-valent iron:A SEM,TEM and XPS study[J].Materials Research Bulletin,2010,45(10):1361-1367.
[6]Zhang X,Lin S,Lu X Q,et al.Removal of Pb(Ⅱ)from water using synthesized kaolin supported nanoscale zero-valent iron[J].Chemical EngineeringJournal,2010,163(3):243-248.
[7]Wang W,Zhou M H,Mao Q,et al.Novel NaY zeolite-supported nanoscale zero-valent iron as an efficient heterogeneous Fenton catalyst [J].Catalysis Communications,2010,11(11):937-941.
[8]Kim S A,Seralathan K K,Lee K J,et al.Removal of Pb(Ⅱ)from aqueous solution by a zeolite-nanoscale zero-valent iron composite[J].Chemical Engineering Journal,2013,217:54-60.
[9]Sepehri S,Heidarpour M,Jahangir A K.Nitrate removal from aqueous solution using natural zeolite-supported zero-valent iron nanoparticles [J].Soil&Water Research,2014,9(4):224-232.
[10]Apiratikul R,Pavasant P.Sorption of Cu2+,Cd2+,and Pb2+using modified zeolite from coal fly ash[J].Chemical Engineering Journal,2008, 144(2):245-258.
[11]Erdem E,Karapinar N,Donat R.The removal of heavy metal cations by natural zeolites[J].Journal of Colloid and Interface Science,2004,280(2):309-314.
[12]Zhou Z,Dai C M,Zhou X F,et al.The removal of antimony by novel Z-nZVI eolite:The role of iron transformation[J].Water Air&Soil Pollution,2015,226(3):76-91.
[13]Zhang X,Lin S,Chen Z L,et al.Kaolinite-supported nanoscale zerovalent iron for removal of Pb2+from aqueous solution:Reactivity,characterization and mechanism[J].Water Research,2011,45(11):3481-3488.
[14]邓述波.环境吸附材料及应用原理[M].北京:科学出版社,2012:19-34.
DENG Shu-bo.Environmental adsorption materials and application principle[M].Beijing:Science Press,2012:19-34.
[15]苏慧杰,方战强.纳米零价铁修复Cr(VI)污染土壤的研究进展[J].农业资源与环境学报,2015,32(6):525-529.
SU Hui-jie,FANG Zhan-qiang.Research progresses in remediation of hexavalent chromium-contaminated soil by nanoscale zero-valent Iron [J].Journal of Agricultural Resources and Environment,2015,32(6):525-529.
[16]Shi L N,Zhou Y,Chen Z L,et al.Simultaneous adsorption and degradation of Zn2+and Cu2+from wastewaters using nanoscale zero-valent iron impregnated with clays[J].Environmental Science and Pollution Research,2013,20(6):3639-3648.
[17]朱岩,张亚雷,代朝猛,等.纳米零价铁颗粒用于地下水原位修复的研究进展[J].现代农业科技,2015(4):204-208.
ZHU Yan,ZHANG Ya-lei,DAI Chao-meng,et al.A review on application of nanoscale zero valent iron particles for comtaminated subsur-face site remediation[J].Modern Agricultural Science and Technology,2015(4):204-208.
[18]Doula M,Ioannou A,Dimirkou A.Copper adsorption and Si,Al,Ca, Mg and Na release from clinoptilolite[J].Journal of Colloid and Interface Science,2002,245(2):237-250.
[19]Kragovi C M,Dakovi C A,Markovi C M,et al.Characterization of lead sorption by the natural and Fe(Ⅲ)-modified zeolite[J].Applied Surface Science,2013,283:764-774.
[20]刘琳,吴树彪,郭建斌,等.天然沸石对猪场厌氧发酵液中氨氮吸附作用的试验研究[J].农业环境科学学报,2011,30(10):2130-2135.
LIU Lin,WU Shu-bin,GUO Jian-bin,et al.Adsorption of ammonia nitrogen in effluent from pig manure biogas plant by zeolite[J].Journal of Agro-Environment Science,2011,30(10):2130-2135.
[21]Yang F,He Y,Sun S,et al.Walnut shell supported nanoscale Fe0for the removal of Cu(Ⅱ)and Ni(Ⅱ)ions from water[J].Journal of Applied Polymer Science,2016,133(16). doi:10.1002/app.43304.
[22]Üzüm Ç,Shahwan T,Erogˇlu A E,et al.Synthesis and characterization of kaolinite-supported zero-valent iron nanoparticles and their application for the removal of aqueous Cu2+and Co2+ions[J].Applied Clay Science,2009,43(2):172-181.
[23]Xu J,Li Y,Jing C,et al.Removal of uranium from aqueous solution using montmorillonite-supported nanoscale zero-valent iron[J].Journal of Radioanalytical and Nuclear Chemistry,2014,299(1):329-336.
[24]郭晶晶.蒙脱石/零价铁纳米复合材料修复水体重金属污染效率及机理研究[D].呼和浩特:内蒙古大学,2014.
GUO Jing-jing.Efficiency and mechanisms of removing heavy metal ions from aqueous solutions using Montmorillonite/zero valent iron nanoparticles[D].Hohhot:Inner Mongolia University,2014.
[25]Shi L N,Zhang X,Chen Z L.Removal of chromium(Ⅵ)from wastewater using bentonite-supported nanoscale zero-valent iron[J].Water Research,2011,45(2):886-892.
[26]Fu R B,Yang Y P,Xu Z,et al.The removal of chromium(Ⅵ)and lead(Ⅱ)from groundwater using sepiolite-supported nanoscale zero-valent iron(S-NZVI)[J].Chemosphere,2015,138:726-734.
The preparation and application for the composite of nanoscale zero valent iron-zeolite adsorption to Cu2+from aqueous solution
WANG Shun-li,WANG Xiu-hong,ZHOU Xin-chu,AI Xiao-jie,QIU Jiang-ping,LI Yin-sheng*
(School of Agriculture and Biology,Shanghai Jiao Tong University,Shanghai 200240,China)
In this study,the composite of zeolite-nanoscale zero valent iron(Z-nZVI)was synthesized by liquid reduction and characterized by transmission electron microscopy(TEM)and X-ray diffraction(XRD).The specific surface area was determined using Brunauer-Emmett-Teller(BET)measurement.The presence of zeolite in the composite resulted in decreased aggregation of iron nanoparticles and improved the surface area.The adsorption efficiency of Cu2+by Z-nZVI with different ratio of Fe and zeolite was investigated.The results showed that the Z-nZVI with 1∶6 ratio of Fe to zeolite performed best.The adsorption kinetics of Cu2+fitted better with pseudo-second order kinetics than with pseudo-first order kinetics.The equilibrium data were analyzed against the Langmuir and Freundlich isotherm models, which revealed that the Langmuir isotherm was the most suitable model for describing Cu2+adsorption.The results of the three level orthogonal experiment showed that the optimal condition for Cu2+adsorption by Z-nZVI was achieved through adding 0.21 g·40 mL-1Z-nZVI to the solution with a pH of 3 and at a temperature of 45℃.Results support the potential use of the Z-nZVI composite for theremoval of Cu2+from aqueous solution.
zeolite-nanoscale zero valent iron(Z-nZVI);Cu2+;adsorption capacity
X52
A
1672-2043(2017)03-0583-08
10.11654/jaes.2016-1209
王顺利,王秀红,周新初,等.沸石-纳米零价铁的制备及其对溶液中Cu2+的吸附研究[J].农业环境科学学报,2017,36(3):583-590.
WANG Shun-li,WANG Xiu-hong,ZHOU Xin-chu,et al.The preparation and application for the composite of nanoscale zero valent iron-zeolite adsorption to Cu2+from aqueous solution[J].Journal of Agro-Environment Science,2017,36(3):583-590.
2016-09-18
王顺利(1992—),女,江苏宿迁人,硕士研究生,研究方向为重金属污染防治。E-mail:907360267@qq.com
*通信作者:李银生E-mail:yinshengli.@sjtu.edu.cn
国家自然科学基金项目(41471203)
Project supported:The National Natural Science Foundation of China(41471203)
