特色马铃薯品种红宝石再生系统的筛选
2017-03-15黄萍马朝宏颜谦
黄萍+马朝宏+颜谦

摘 要:采用3因素3水平L9(34)正交试验设计,以特色马铃薯品种红宝石试管苗茎段为试材,分别选用3种植物激素(诱导愈伤用NAA,2,4-D,6-BA;诱导分化用NAA,GA3,6-BA)的3个水平对其茎段的离体再生进行研究,筛选适合红宝石的愈伤和芽分化诱导培养基。结果表明,不同培养基表现出不同的诱导效果,愈伤组织诱导的最佳培养基是MS+NAA 0.5 mg·L-1+2,4-D 1.0 mg·L-1+6-BA 0.5 mg·L-1,愈伤率达100%;植株再生最佳培养基是MS+NAA 0.5 mg·L-1+GA3 1.0 mg·L-1+6-BA 1.0 mg·L-1,再生率为80.3%,分化后再生苗健壮。
关键词:特色马铃薯;愈伤组织;诱导;分化
中图分类号:S532 文献标识码:A DOI 编码:10.3969/j.issn.1006-6500.2017.02.004
Abstract: L9(34)orthogonal design was adopted to select the optimal plant hormone combination for regeneration of ‘Hongbaoshi potato stem. Three plant hormones(callus induction with NAA、2,4-D、6-BA and bud differentiation with NAA、GA3、6-BA) were applied at three different levels to study their influences on the growth and differentiation of potato stem. The results indicated that the optimal medium for callus induction from stem was the 6 number medium (MS+NAA0.5 mg·L-1+2.4-D1.0 mg·L-1+6-BA0.5 mg·L-1), with 100% induction percentage. The optimal medium for inducing bud differentiation from stem callus were the number 8 medium (MS+NAA0.5 mg·L-1+GA31.0 mg·L-1+6-BA1.0 mg·L-1), with 80.3% induction percentage of adventitious buds and strong seedling.
Key words: potato;callus;induction;differentiation
通过遗传转化实现目的基因的转移,从而改良经济性状,使马铃薯遗传基础日益丰富,产量和品质不断得到提高[1-4]。而无论是基因转化,还是转基因植株数量的增加,都依赖于良好的植物受体系统的建立,受体系统的建立则主要依赖于植物组织培养的再生环节,即建立高效的马铃薯离体再生体系。许多研究表明,再生系统易受基因型、外植体种类、植物激素种类及浓度、培养条件和操作水平等诸多因素的影响[5-11]。因此,对特定品种、特定材料进行再生系统筛选,以确定有针对性的最佳培养基配方非常必要。
红宝石是一个皮肉皆是红色的彩色马铃薯特色品种,因其外形美观、品质好(适合烤、蒸、煮、炸、炒,且色泽不变)、营养价值高(比普通马铃薯丰富)、商品附加值高、适用性强而备受青睐,具广泛的应用前景。本试验在前人研究的基础上,对特色马铃薯品种红宝石的茎段离体培养和再生进行初报,以期为其基因转化研究奠定基础。
1 材料和方法
1.1 试验材料
以特色马铃薯品种红宝石脱毒试管苗茎段为材料,由贵州省马铃薯研究所组培室茎尖脱毒培养构建而成。
1.2 方 法
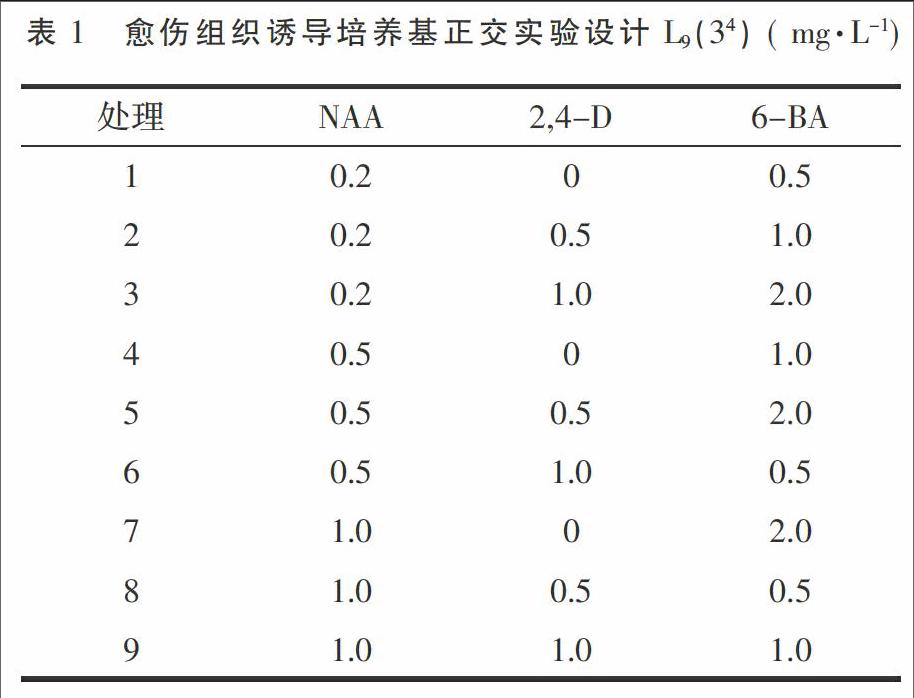
1.2.1 愈傷组织诱导及分化培养基配制 以MS为基本培养基,附加30 g·L-1蔗糖和6 g·L-1琼脂,添加不同激素配制成愈伤组织诱导培养基,具体设计采用3因素3水平L9(34)的正交试验(表1),NAA质量浓度为0.2,0.5,1.0 mg·L-1;2,4-D质量浓度为0,0.5,1 mg·L-1;6-BA质量浓度为0.5,1,2 mg·L-1。
以MS为基本培养基,附加30 g·L-1蔗糖和6 g·L-1琼脂,添加不同激素配制成分化培养基,具体设计采用3因素3水平L9(34)的正交试验(表1),NAA质量浓度为0.05,0.1,0.5 mg·L-1;GA3质量浓度为0,1,2 mg·L-1;6-BA质量浓度为1,2,3 mg·L-1。
1.2.2 接种试管苗茎段 将培养25~30 d的供试材料试管苗置于超净工作台上,剪取长约0.5~1.0 cm、不带腋芽茎段平铺于愈伤组织诱导培养基上培养,接种15瓶,每瓶5个茎段。
1.2.3 愈伤组织诱导 培养温度(22±2) ℃,黑暗培养5~8 d后进行16 h·d-1光照培养,光照强度2 000 lx。40 d后统计愈伤组织诱导率及愈伤组织颜色、形状、生长量。
愈伤组织诱导率=愈伤组织数/接种茎段数×100%
1.2.4 愈伤组织分化 将愈伤组织取出接种在分化培养基内,培养温度(22±2) ℃,16 h·d-1光照培养,光照强度1 500~2 000 lx。50 d后统计芽分化率。
芽分化率=分化出芽的愈伤组织数/总愈伤组织数×100%
平均芽数=总芽数/出芽愈伤数。
1.3 数据分析
数据采用Excel和DPS软件进行统计分析。
2 结果与分析
2.1 茎段愈伤组织诱导情况
茎段接种在愈伤组织诱导培养基上培养后,切面渐渐褐化,7 d左右两端开始膨大变粗,逐渐扩展到中间,约20 d切口处长出肉眼可见的愈伤组织。
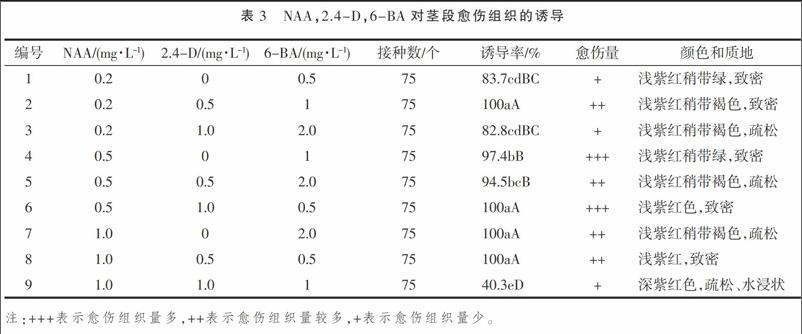
由表3可知, 9种激素组合均能使供试材料诱导出愈伤组织,但愈伤的诱导率差异较大,最高可达100%,最低只有40.3%。愈伤组织形状多为哑铃状、表面光滑、粗糙或布满细小颗粒,结构有致密和疏松两种类型,颜色主要浅紫红、浅紫红带绿、浅紫红带褐、深紫红色。马铃薯品种红宝石茎段在各种培养基上诱导出的愈伤组织在质地、大小、颜色和生长速度等方面存在很大差异,茎段在2,6,7,8号处理的愈伤组织诱导率最高,达100%,但在4种培养基上形成愈伤的量不同,其中6号培养基上愈伤组织的生长量最高,且结构致密,适合诱导芽。2,7号和8号培养基上形成的愈伤组织量差异不明显,但在质地和颜色上存在差异,三者相比之下2号和8号培养基激素组合更优于7号。9号培养基愈伤诱导率最低,只有40.3%,呈深紫红色,质地疏松且呈水浸状,不利于芽的诱导。1,3号培养基上愈伤诱导率高于80%,但愈伤量低。4,5号培养基上愈伤诱导率90%以上,但愈伤量和质地上存在差异。综合上述试验结果分析,6号培养基最利于红宝石诱导愈伤组织,在后期愈伤组织再生培养中可选择该培养基作为愈伤诱导培养基。
2.2 愈伤组织不定芽分化
愈伤组织转入分化培养基中培养,其颜色逐渐加深,致密程度加强,30 d左右,部分培养基上的愈伤组织开始萌发芽点,逐渐生长成小苗。由表4可知,不同培养基对茎段愈伤组织不定芽分化的影响不同,芽分化率最高可达84.6%,而在未添加GA3的培养基上芽诱导率均为0。在所试9种培养基中,除1、4和7号培养基外,其余6种培养基上的愈伤组织平均出芽数均超过2个,9号培养基上的平均出芽数最高,为6.9个,但苗细弱、淡黄绿色,不利继代培养;8号培养基上的出芽数次之(4.8个),5号培养基上出芽数第3(4.2个)。从芽分化率和不定芽长势来看,诱导茎段愈伤不定芽分化的最佳培养基为8号培养基。
3 讨 论
植物激素是植物细胞、组织、器官离体培养必不可少的物质,培养基中激素的组配和浓度非常重要,马铃薯的愈伤诱导和芽分化的激素组合因不同的品种、外植体差异很大。韩善华等[12]用6-BA 2.0 mg·L-1,NAA 0.2 mg·L-1从茎段愈伤组织再生了植株,诱导率为50%;叶彦等[13]用6-BA 2.0 mg·L-1,NAA 0.2 mg·L-1的培养基也得到了再生植株,但诱导率很低,只有5%;李娟等[14]用6-BA 2.0 mg·L-1,NAA 0.2 mg·L-1培养基诱导茎段愈伤组织却得到了高达96.7%的再生植株诱导率。齐恩芳等、卢翠华[15] 、李娟等[16]研究结果表明,对芽分化促进作用最大的是6-BA,不含6-BA的处理愈伤易生根,不易分化出芽。本试验结果发现,GA3对芽分化和伸长有明显促进作用,在没添加GA3的培养基中无芽形成,调整GA3浓度是提高分化效果的关键因素,这与叶彦[13]、李凤云等[8]研究结果相符。由此可见,一种或几种培养基并不能适应所用的品种,因此,针对不同基因型选择诱导再生激素类型和浓度十分必要。
参考文献:
[1]陈铮,金红,罗智敏.提高马铃薯遗传转化体系再生频率的研究[J].天津农业科学,2002,8(4):4-6.
[2]王萍,王罡,季静.马铃薯两个基因型不同外植体的组织培养与植株再生[J].中国马铃薯,2006,20(6):326-328.
[3]王永锋,栾雨时.马铃薯转基因研究进展[J].中国马铃薯,2004,18(4):227-231.
[4]李晶.马铃薯再生体系的建立及遗传转化的研究[D].哈尔滨:东北农业大学,2003.
[5]陈爱芹,艾辛.紫外线辐照对马铃薯茎段愈伤组织及其再生植株的影响[J].长江蔬菜,2010 (22):12-16.
[6]齐恩芳,张金文,王一航.马铃薯茎段再生的植物激素配比優化[J].甘肃农业大学学报,2006,41(6):14-17.
[7]杨琼芬,白建明,李先平,等.彩色马铃薯叶片再生体系的研究[J].西南农业学报,2006,19(S1):83-88.
[8]李凤云,盛万民,于天峰,等.马铃薯不同品种茎段再生系统的筛选[J].中国农学通报,2005,21(8):99-100, 113.
[9]董颖苹,黄萍,颜谦,等.几个马铃薯栽培种的茎段愈伤组织诱导[J].贵州农业科学,2005,33(5):24-26.
[10]罗源,陈耀锋,李春莲,等.马铃薯茎段愈伤组织培养体系的优化[J].西北农林科技大学学报(自然科学版),2007,35(10):159-162.
[11]黄雪丽,潘庆明,倪苏,等.PP333对马铃薯试管叶片与茎段愈伤组织诱导与分化的影响[J].中国马铃薯,2009,23(2):87-89.
[12] 韩善华,郑国锠.马铃薯(Solanum tuberosum L.)幼茎(芽)愈伤组织培的诱导和植株再生(简报)[J].实验生物学报,1982(1):113-119.
[13]叶彦,缪树华.长期继代培养马铃薯愈伤组织的植株再生[J].应用与环境生物学报,1995,1(1):26-33.
[14]李娟,程智慧,张国裕.四个马铃薯品种幼茎段再生技术的研究[J].西北农林科技大学学报(自然科学版),2006,34(3):122-126.
[15]卢翠华,秦昕,武小霞,等.马铃薯极早熟品种东农303再生系统的筛选[J].中国马铃薯,2001(5):280-281.
[16]李娟,程智慧,张国裕.马铃薯叶片高效再生体系的建立[J].西北植物学报,2004,24(4):610-614.
