大白菜抗TuMV分子标记辅助选择技术研
2017-03-15李巧云张志刚赵智中刘栓桃
李巧云++张志刚++赵智中++刘栓桃++王立华++高会超++李溢真++徐文玲++刘贤娴++刘辰

究
摘要:分别以大白菜TuMV国家级抗源材料8407和高感TuMV的核心种质材料冠291为亲本构建分离群体,为验证TuMV抗性基因TuRBCS01两侧紧密连锁的分子标记mBr4055和BrID10723的检测准确率,对上述两个亲本F2代分離群体的107个单株进行自交构建F2∶3家系,并对每个家系的TuMV抗性进行鉴定,以判断原F2单株的TuMV抗性及基因型,同时利用上述两个标记引物对F2代107个单株进行检测,根据检测结果及抗病性鉴定结果计算标记检测的准确率。结果表明,两标记均检测为纯合抗病的株系有22株,其中有2株经抗病性验证为杂合抗病,其余均为纯合抗病,检测准确率为90.9%;两标记均检测为杂合抗病的有48株,经抗病性验证,其中5株为纯合抗病,5株为纯合感病,其余均为杂合抗病,检测准确率为79.2%;两标记均检测为纯合感病的有23株,经抗病性验证,其中4株为杂合抗病,1株为纯合抗病,鉴定准确率为78.3%。上述检测结果为更好地利用标记mBr4055和BrID10723进行分子标记辅助选择奠定了基础。
关键词:大白菜;TuMV;抗性基因;分子标记应用
中图分类号:S634.103.6文献标识号:A文章编号:1001-4942(2017)02-0010-05
大白菜是我国的重要蔬菜,病毒病是危害我国大白菜生产的主要病害,其中,芜菁花叶病毒(Turnip mosaic virus, 简称TuMV)是主要病原[1]。传统的大白菜抗TuMV育种方法周期长、效率低、选择准确性差,利用分子标记辅助选择可大大加快育种进程,提高选择效率和准确率。
近年来,国内外已开展了一些与大白菜TuMV抗性相关的分子标记研究。闫瑾琦[2]筛选到2个与大白菜抗TuMV基因紧密连锁的RAPD标记,连锁距离分别为9.5 cM和15.36 cM。韩和平等[3]采用AFLP方法,筛选到2个与大白菜TuMV感病基因紧密连锁的AFLP标记,连锁距离分别为7.5 cM和8.4 cM。张俊华等[4]筛选出2个与大白菜TuMV抗病基因连锁的EST-PCR-AFLP标记,连锁距离均为6.5 cM。张晓伟等[5]采用多模型QTL作图的方法,检测到3个与大白菜抗TuMV相关的QTLs (Tu-1、Tu-2和Tu-3), AFLP标记E36M47-7 (2.9 cM)、E33M60-5 (0.5 cM) 和E36M59-5 (2.4 cM) 分别与上述三个QTLs连锁。Rusholme 等[6]的研究表明,RFLP标记pN202e1与定位在大白菜4号染色体上的隐性TuMV抗性基因retr01共分离;RFLP标记pO52e2 和 pO85e1与定位在大白菜8号染色体上的显性TuMV抗性基因ConTR01共分离。Qian等[7]报道,Indel标记BrID10694 (0.3 cM)和 BrID101309 (0.6 cM)与大白菜隐性TuMV抗性基因retr02紧密连锁,且分别位于该基因的两侧。Jin等[8]的研究结果显示,SSR标记H132A24-s1 (0.2 cM)和KS10960 (0.6 cM)分别与大白菜显性TuMV抗性基因TuRB07紧密连锁并位于该基因的两侧。本课题组鉴定出了两个大白菜TuMV抗性基因——隐性TuMV抗性基因retr02[9] 和显性TuMV抗性基因TuRBCS01[11],筛选到一个与retr02紧密连锁的SSR标记HCC259(3.8 cM)[12]和9个与TuRBCS01紧密连锁的SSR或InDel标记,其中SSR标记mBr4055和InDel标记BrID10723分别位于TuRBCS01基因的两侧,与该基因的连锁距离分别为0.6 cM和1.3 cM[13]。
对分子标记检测准确率的研究,有利于更好地将其用于分子标记辅助选择。Piao等[14]的研究表明,与大白菜抗根肿病基因CRb紧密连锁的共显性标记 TCR01 能够准确鉴定出纯合抗性植株。张晶等[15]利用小麦春化基因特异性标记Vrn-D1对石麦 12 与石家庄 8 号杂交后代 F2∶3株系进行冬、春性鉴定,结果与表型鉴定结果一致。焦荻等[16]利用西瓜抗枯萎病基因SNP标记,对两个四倍体西瓜材料(易感病的 NF3 为受体,抗病的 JH 为供体)回交后自交群体BC1F2代673 个单株进行检测,结果表明,检测到的纯合基因型抗病单株与表型鉴定结果一致。目前,尚未见利用大白菜抗TuMV分子标记进行辅助选择技术研究的报道。
本研究通过构建大白菜抗TuMV材料8407和感病材料冠291的F2∶3家系,对每个F2∶3家系的TuMV抗性进行鉴定,进而判断原F2代单株的TuMV抗性及基因型,结合标记检测结果,对标记检测的准确率进行分析,旨在为利用大白菜TuMV抗性基因TuRBCS01两侧紧密连锁的分子标记进行该基因的辅助选择奠定基础。
1材料与方法
1.1试验材料与毒源
抗病亲本材料为大白菜TuMV国家级抗源材料8407,感病亲本材料为高感TuMV的核心种质材料冠291,以两亲本构建的F2代107个单株及F2代单株自交构建的F2∶3家系为研究对象,用于大白菜TuMV抗性基因TuRBCS01分子标记辅助选择技术研究。
将上述材料播种于直径7~8 cm的营养钵中,选用德国大汉(Klasmann-Deilmann)泥炭营养土育苗培养,人工气候室温度为25℃,湿度40%~60%,光照强度9 000~10 000 lx,光照时间每天11.5 h。
毒源为引自中国农业科学院蔬菜花卉研究所的TuMV-C4株系,接种前一个月在感病材料上繁毒,病叶用于接种亲本对照及试验材料。
1.2基因组DNA提取
采用快捷型植物基因组DNA提取试剂盒对大白菜F2代107个单株样品的基因组DNA进行提取,具体步骤如下:
(1)取灭菌的2 mL EP管,每管加入直径为3 mm陶瓷珠4个,称取供试样品新鲜幼嫩叶片0.1 g,置于EP管中,加入液氮充分研磨。(2)加入400 μL缓冲液FP1和RNase A (10 mg/mL) 6 μL,涡旋振荡1 min,室温放置10 min。(3)加入130 μL緩冲液FP2,充分混匀,涡旋振荡1 min。(4)12 000 r/min离心5 min,将上清转移至新的离心管中。(5)向上清液中加入0.7倍体积的异丙醇,充分混匀,此时会出现絮状基因组DNA。12 000 r/min离心2 min,弃上清,保留沉淀。(6)加入70%乙醇600 μL,涡旋振荡5 s,12 000 r/min离心2 min,弃上清。(7)重复步骤6。(8)开盖倒置,室温静置5~10 min,彻底晾干残余的乙醇。(9)加入适量洗脱缓冲液TE,65℃水浴10~60 min溶解DNA,其间颠倒混匀数次助溶,最终得到DNA溶液。
用分光光度计测定所提取DNA的浓度和纯度,并用1%琼脂糖胶进行电泳检测。使用前用去离子水将其稀释至70 ng/μL。
1.3引物序列
试验所用引物为基因TuRBCS01两端的SSR标记mBr4055和InDel标记BrID10723,其中引物mBr4055的上下游序列分别为5′-GGGTTCTCGGCTACTGGACT-3′和5′-TCATCATGAGACACATCCTCTCC -3′,引物BrID10723的上下游序列分别为5′-GCTTTCCTCGTGTCATTAGA-3′和5′-CTTTCCGAGTTTCCATAGTG -3′。
1.4PCR扩增
PCR扩增在美国ABI SimpliAmp PCR仪上进行。扩增体系为10 μL:2×Taq Master Mix 5 μL,0.5 μmol/L正向引物1 μL,0.5 μmol/L反向引物1 μL,模板DNA(浓度为70 ng/μL)1 μL;双蒸水(ddH2O)2 μL。PCR扩增程序: 95℃预变性4 min;94℃变性60 s,退火45 s(退火温度需要随着扩增引物的变更而进行调整),72℃延伸45 s,此过程共进行30个循环(循环数也可根据PCR扩增引物的不同而进行微调);72℃延伸10 min,PAGE检测或4℃保存备用。若需将PCR产物隔夜放置,可将其置于-20℃条件下保存。
1.5PCR扩增产物检测
采用浓度为8%的非变性聚丙烯酰胺凝胶(29∶1)对PCR扩增产物进行电泳检测。所用电泳仪为美国Labnet International公司Power Station200型,电泳槽为北京六一的DYCZ-24B型。175~190 V恒压电泳1.5~3.0 h。银染检测电泳结果。
1.6病毒接种
待大白菜苗长至三叶一心时,采用摩擦接种法,对上述试验材料及对照接种TuMV-C4,具体方法参见李巧云等[10]的方法,三周后进行抗病性调查鉴定。
1.7抗病性鉴定
采用生物学观察法对F2∶3家系的TuMV抗性进行鉴定,单株病级及病情指数的计算方法参考标准GB/T 19557.5—2004,根据F2∶3家系的病情指数判断原F2单株的抗性,进而推测该单株的基因型。
1.8数据统计分析
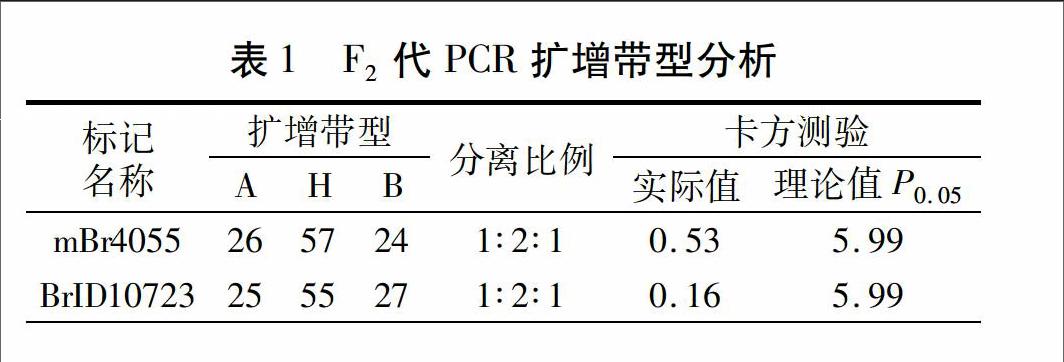
与亲本8407扩增带型一致的单株基因型记为A;与亲本冠291扩增带型一致的单株基因型记为B;杂合带型记为H。F2单株的TuMV抗性根据F2∶3株系的病情指数来判断,病情指数为“0”的,单株基因型记为AA;病情指数在0~55.55之间的,单株基因型记为Aa;病情指数在55.55以上的,单株基因型记为aa。根据单株抗病性鉴定和PCR扩增结果,分析基因TuRBCS01两侧标记mBr4055和BrID10723的检测准确率。
2结果与分析
2.1大白菜基因组DNA提取
提取的样品基因组DNA经1%琼脂糖胶电泳检测无拖尾现象(图1),分光光度计测定其OD260/OD280比值在1.8~2.0之间,说明DNA提取质量较高,可用于PCR扩增。
M:DNA Marker;1~10:部分大白菜F2代单株
3讨论与结论
对于那些性状鉴定受多种因素影响、难以在F2代或BC1代确保单株性状鉴定准确无误的标记,为了更好地用于分子标记辅助选择,有必要进一步通过F2∶3家系的性状鉴定验证其鉴定准确率。
张晶[15]、焦荻[16]等分别利用F2:3家系和BC1F2代对标记的有效性进行了验证。Piao等[14]利用与大白菜根肿病抗性基因CRb紧密连锁的共显性标记TCR01和TCR05检测37个根肿病抗性品种和10个非根肿病抗性品种,结果表明,扩出标记条带TCR01200和TCR05279的18个品种均为抗病品种,而没有扩出上述两条带的品种,有的是抗病品种,有的不是抗病品种。表明标记TCR01和TCR05可选择性地用于抗病品种的筛选。
本研究通过对大白菜抗TuMV材料8407和感病材料冠291的F2∶3家系的性状鉴定确定原F2单株的基因型,结合基因TuRBCS01两侧标记mBr4055和BrID10723的单株扩增,检测两标记对F2代单株的鉴定准确率。结果表明,利用两标记检测纯合抗病株,效果最好,检测准确率为90.9%;其次是杂合抗病株和纯合感病株,检测准确率分别为79.2%和78.3%。上述检测结果为更好地利用以上两标记进行分子标记辅助选择奠定了基础。
参考文献:
[1]冯兰香,徐玲,刘佳,等.北京地区大白菜芜菁花叶病毒株系的鉴定[J].中国蔬菜,1988(4):23-25.
[2]阎瑾琦. 大白菜抗芜菁花叶病毒病基因的 RAPD分子标记[D]. 北京:中国农业科学院蔬菜花卉研究所,2000.
[3]韩和平,孙日飞,张淑江,等.大白菜中与芜菁花叶病毒(TuMV)感病基因连锁的AFLP标记[J].中国农业科学,2004,37(4):539-544.
[4]张俊华,屈淑平,崔崇士.大白菜抗芜菁花叶病毒的QTL分析[J].植物病理学报,2008,38(2):178-184.
[5]张晓伟,原玉香,王晓武,等.大白菜DH群体TuMV抗性的QTL定位与分析[J].园艺学报,2009,36(5):731-736.
[6]Rusholme R L, Higgins E E, Walsh J A, et al. Genetic control of broad-spectrum resistance to Turnip mosaic virus in Brassica rapa (Chinese cabbage) [J]. Journal of General Virology,2007,88 (11):3177-3186.
[7]Qian W, Zhang S J, Zhang S F, et al. Mapping and candidate-gene screening of the novel Turnip mosaic virus resistance gene retr02 in Chinese cabbage (Brassica rapa L.)[J].Theor. Appl. Genet., 2013, 126(1):179-188.
[8]Jin M, Lee S S, Ke L, et al. Identification and mapping of a novel dominant resistance gene, TuRB07 to Turnip mosaic virus in Brassica rapa[J]. Theor. Appl. Genet., 2014, 127(2):509-519.
[9]佟海申.大白菜抗芜菁花叶病毒病基因的SSR分子标记的研究[D]. 青岛:青岛农业大学,2010.
[10]李巧云,张志刚,成文华,等.利用ELISA方法鉴定大白菜TuMV抗性[J].科技导报,2009,27(1):42-45.
[11]张晓亮.大白菜抗芜菁花叶病毒基因分子标记筛选与定位[D]. 青岛:青岛农业大学,2012.
[12]Li Q Y, Tong H S, Zhang Z G, et al. Inheritance and development of EST-SSR marker associated with Turnip mosaic virus resistance in Chinese cabbage[J]. Canadian Journal of Plant Science, 2011,91(4):707-715.
[13]Li Q Y, Zhang X L, Zeng Q, et al. Identification and mapping of a novel Turnip mosaic virus resistance gene TuRBCS01 in Chinese cabbage (Brassica rapa L.)[J]. Plant Breeding, 2015, 134 (2): 221-225.
[14]Piao Z Y,Choi S R,Lee Y M,et al. The use of molecular markers to certify clubroot resistant cultivars of Chinese cabbage[J]. Hort. Environ. Biotechnol.,2007, 48 (3):148-154.
[15]張晶,吴锁伟,刘秉华,等. 黄淮冬麦区小麦冬、春性改良及分子标记辅助选择技术初探[J]. 作物学报,2010, 36(3): 385-390.
[16]焦荻,任毅,宫国义,等. 四倍体西瓜抗枯萎病生理小种 1 分子标记辅助选择技术研究[J]. 园艺学报,2015,42 (6):1112-1120.山 东 农 业 科 学2017,49(2):15~19Shandong Agricultural Sciences山 东 农 业 科 学第49卷第2期于淑婷,等:华北夏谷区近30年来主要谷子育成品种农艺和品质性状演变分析DOI:10.14083/j.issn.1001-4942.2017.02.003
收稿日期:2016-11-23
基金项目:国家现代农业产业技术体系建设专项(CARS-07-13.5-A11);山东省现代农业产业技术体系杂粮创新团队专项(SDAIT-15-03);山东省重大科技专项(2015ZDJS03001-2)
作者简介:于淑婷(1990-),女,硕士研究生,研究方向为谷子栽培生理。E-mail:yust1123@126.com
通讯作者:管延安(1965-)
