不同植物叶片臭氧伤害症状及其生理响应机制的差异
2017-03-14杨宁王效科张玉龙郑飞翔陈媛媛
杨宁,王效科,张玉龙,郑飞翔,3,*,陈媛媛
1. 中国科学院生态环境研究中心城市与区域生态国家重点实验室,北京 100085 2. 中国科学院大学, 北京 100049 3. 中国农业科学院农业环境与可持续发展研究所, 北京 100081
在城市化过程中,绿化植物的引进在装点城市市容、改善城市生态环境、提高市民精神生活质量方面具有重要的作用[1]。城市化的快速发展带来了一系列的环境问题,其中之一就是机动车、发电站及工厂排放于大气中的NOx、挥发性有机化合物(volatile organic compounds,VOC)浓度急剧升高[2-4]。NOx、VOC为对流层臭氧形成的前体物质,其在强光存在的条件下可快速反应形成臭氧(ozone,O3)。对流层臭氧具有明显的季节分布特征,Wang等[5]对华东地区部分省份臭氧分布分析发现,大多数地区高浓度臭氧主要集中于夏季,其次为秋季,而这2个季节恰好是植物快速生长时期,因此植物正常生长势必受到高浓度臭氧暴露的干扰,植物的潜在生态效益也因此会被削弱。已有相当一部分研究指出了臭氧对农作物产量[6-8]、森林生产力[9]、草地群落结构[10]的负面影响,这些研究对象均是生长在自然生态环境中,而生长于城市中的景观植物由于特有的城市问题的存在(地表硬化、热岛效应)对臭氧胁迫将更加敏感[1],因此明确景观植物的臭氧响应机制将会有利于采取更有针对性的保护措施维持其生态效益。

就突变体而言,其内源激素对臭氧胁迫的响应(激素形成、合成途径以及造成的相关伤害)存在差异,但是对于自然界中臭氧敏感植物,虽然臭氧暴露后会产生特定的臭氧伤害,但是否这些伤害源于不同的激素响应尚未见报道。因此本文以常用的万寿菊(Tagetes erecta Linn.)、矮牵牛(Petunia hybrida Vilm.)及圆叶牵牛(Pharbitis purpurea (L.) Voigt)作为供试材料,研究臭氧胁迫下各种植物激素的变化规律,旨在阐述引起不同植物叶片臭氧伤害的激素差异,能够为制定具有针对性的保护措施提供科学依据。
1 材料与方法 (Materials and methods)
1.1 实验地点与设计
实验地点位于北京市昌平区马池口镇丈头村(40°12`N, 116°8`E)种子站,该地气候为典型的温带季风气候,四季分明。年均气温及降雨量分别为11.8 ℃、550.3 mm(降雨主要集中在6到8月)[19]。
本实验采用开顶式气室(Open-Top Chamber,OTC)进行盆栽控制实验。完整系统包括O3浓度控制系统、O3发生系统、鼓风系统、布气系统、暴露室、O3浓度监测系统。暴露室由铝合金框架及钢化玻璃构成,O3由纯O2通过O3发生器产生,之后由离心式鼓风机通过聚氯乙烯管(polyvinylchloid, PVC)鼓入暴露室,目标浓度通过玻璃转子流量计进行调整,由O3分析仪(Model 49i,Thermo Scientific, USA)进行监测。
实验共设3个O3水平,自然大气(non-filter, NF),低浓度臭氧(NF+60 ppb)以及高浓度臭氧(NF+120 ppb)。每种植物O3暴露期间的日(9-h)平均臭氧浓度如图1所示(图1A. 万寿菊和圆叶牵牛;图1B. 矮牵牛)。为避免气室效应,暴露室按南北方向依次排开以确保一致的太阳辐射;暴露室间距为3 m,避免处理之间互相干扰。
1.2 实验材料
本实验以常见的景观植物万寿菊、矮牵牛及圆叶牵牛为供试材料。对于万寿菊和矮牵牛,挑选规格一致(以株高为挑选标准:万寿菊,12.8 cm,矮牵牛,7.0 cm)的幼苗移栽进行实验,每盆一株,为避免植株死亡造成的后续测量实验受限,每个暴露室放置万寿菊20盆,矮牵牛15盆。圆叶牵牛种子购买于北京北林花卉科技有限公司,于2014年8月4日直接播种于开顶式气室中。供试材料之间因其生长期的差异薰气时间有所不同:万寿菊及圆叶牵牛,2014年8月4日至9月28日;矮牵牛,2014年3月21日至6月5日,熏蒸期间遇雨天停止熏气。3种植物每日熏气时间一致,开始于早上8:30,结束于下午17:30。整个生育期内,除O3外其他条件一致,并确保其不成为植物生长的限制因子。

图1 供试植物暴露期间的日平均臭氧浓度(A,万寿菊、短牵牛;B,圆叶牵牛)注:NF,自然大气;NF+60,NF+60 ppb O3;NF+120,NF+120 ppb O3。Fig. 1 Diurnal (9-h) mean O3 concentration for tested plants (A, marigold and morning glory; B, petunia) during experimentNote: NF, non-filter; NF+60, NF+60 ppb O3; NF+120, NF+120 ppb O3.
于盛花期采集每种植物叶片样品。取样时在各OTC中随机选取5棵植株,采集同一位置的叶片(万寿菊,从顶部数第二个分枝上完全展开的叶片;矮牵牛和圆叶牵牛,紧挨着处于盛花期的花朵),用湿毛巾将叶片上的灰尘沾掉,然后包裹于铝箔纸中并保存在液氮中,带回实验室进行各项生理指标测量。
1.3 指标测量
1.3.1 臭氧症状观测
每日对供试植物进行观测直到臭氧症状出现,然后通过相机拍摄,比较臭氧处理与对照组供试植物叶片和整株生长之间的差异。
1.3.2 氧化伤害
MDA(malonalgehyde):硫代巴比妥酸法,具体步骤参考Feng等[20]的方法。可溶性蛋白:比较成熟的考马斯亮蓝法,以牛血清白蛋白作为标准品,具体步骤参考Bradford[21]的研究。
1.3.3 水杨酸、茉莉酸及脱落酸
参考Pan等[22]的测量方法,测量过程中由于仪器型号之间的差异,仪器参数设置过程中略有修改。1)浸提:称取0.1000 g新鲜样品于液氮中研成粉末,转移至2 mL离心管中后,加入50 μL内标,随后加入l mL混合浸提剂(异丙醇:超纯水:浓盐酸体积比为2:1:0.002),于震荡机(4 ℃、100 r·min-1)中震荡30 min,随后于每个样品中加入1 mL二氯甲烷,于之前的震荡条件下继续震荡30 min,结束之后于冷冻离心机(4 ℃,13 000 g)中离心5 min,此时出现明显的分层现象,吸取下层液体900 μL于另一只离心管中,氮吹仪吹干后用0.1 mL甲醇溶解;2)高效液相色谱-质谱联用仪测量(HPLC-ESI-MS/MS):吸取50 μL浸提液进行HPLC-ESI-MS/MS分析。分析柱:反相C18柱(规格:4.6 mm×5 cm, 1.8 μm);优化后的主要质谱条件:负离子模式,扫描模式为MRM(multiple reaction monitoring),根据激素种类设置母离子和子离子(SA:136.6,92.8;ABA:262.8,152.6;JA:209.0,59.0);3)流动相:2元梯度分离,通过改变流动相B的比例完成目标激素的分离(流动相A:纯乙腈;流动相B:0.1%乙酸),0~0.5 min,90%B,0.5~5 min,95%B,5~8 min,90%B稳定仪器。
1.4 数据分析
采用SPSS 16.0统计软件中一元方差分析法对供试植物各指标进行显著性分析,若存在显著差异,则用LSD法进行多重比较。方差分析之前对每种供试植物各指标进行了正态分布及方差齐性检验,且各样本之间相互独立,利用Sigmaplot 11.0软件绘图。
2 结果与分析(Results and analysis)
2.1 O3伤害
本实验中,供试植物万寿菊、矮牵牛及圆叶牵牛均在臭氧胁迫后表现出不同程度的臭氧伤害,但各种植物之间症状表现又不尽相同。1)万寿菊、矮牵牛:臭氧暴露后,万寿菊与矮牵牛表现出叶脉间黄化,且随暴露时间延长黄化程度加剧(图2和图3),意味着臭氧浓度升高致使供试植物提前衰老,且衰老程度较对照组加剧;2)圆叶牵牛:臭氧暴露严重影响了圆叶牵牛的出苗率,对于顺利出苗的植株,其叶片叶脉间出现白色斑点,随暴露时间延长,斑点密集形成白色斑块,最终导致叶片干枯(图4)。表明臭氧对植物的影响不是开始于已长出的叶片,而可能会直接改变种子的内部组分,致使出苗率受到影响,从而严重影响最终生产力。

图2 万寿菊(Tagetes erecta Linn.)单叶及植株生长对臭氧胁迫的响应Fig. 2 O3 injury to marigold (Tagetes erecta Linn.) leaves and growth of the whole plant
2.2 臭氧胁迫对供试植物的氧化伤害
2.2.1 丙二醛(MDA)
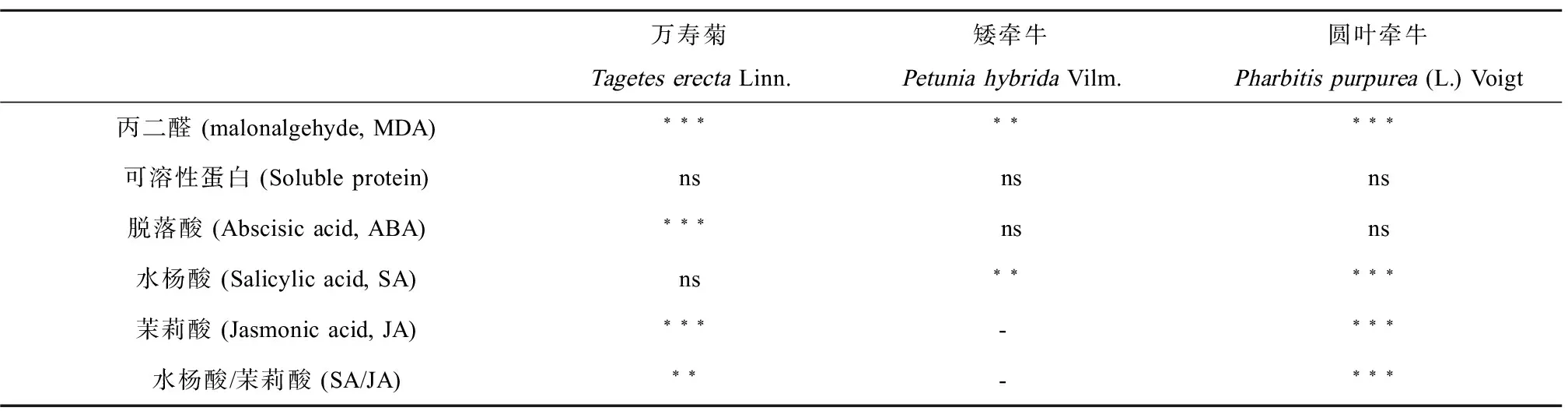
MDA是磷脂过氧化的产物,可用于判断膜受损程度。本实验中,低浓度臭氧处理致使植物叶片发生严重的膜脂过氧化(表1和图5.A),与对照相比,万寿菊、矮牵牛及圆叶牵牛叶片MDA含量分别增加了50.2%、23.0%和126.1%,低浓度与高浓度臭氧处理之间叶片MDA含量没有明显的差异,说明低浓度臭氧足以最大程度的对植物细胞造成不可逆转伤害。
2.2.2 可溶性蛋白(soluble protein)
臭氧暴露对3种供试植物叶片可溶性蛋白含量没有明显影响(表1和图5B),臭氧处理后的叶片可溶性蛋白含量与对照组相应植物含量一致。

图3 矮牵牛(Petunia hybrida Vilm.)单叶及植株生长对臭氧胁迫的响应Fig. 3 O3 injury to petunia (Petunia hybrida Vilm.) leaves and growth of the whole plant

图4 圆叶牵牛(Pharbitis purpurea (L.) Voigt)单叶及植株生长对臭氧胁迫的响应Fig. 4 O3 injury to morning glory (Pharbitis purpurea (L.) Voigt) leaves and growth of the whole plant
万寿菊TageteserectaLinn.矮牵牛PetuniahybridaVilm.圆叶牵牛Pharbitispurpurea(L.)Voigt丙二醛(malonalgehyde,MDA)********可溶性蛋白(Solubleprotein)nsnsns脱落酸(Abscisicacid,ABA)***nsns水杨酸(Salicylicacid,SA)ns*****茉莉酸(Jasmonicacid,JA)***-***水杨酸/茉莉酸(SA/JA)**-***
注: ns表示臭氧处理与对照之间无显著差异;*表示臭氧处理与对照之间具有显著差异(**P≤0.01;***P≤0.001)。
Note: ns stands for significant difference between O3treatment and control;**P≤0.01,***P≤0.001, significant difference between O3treatment and control.

图5 臭氧胁迫对万寿菊1(Tagetes erecta Linn.)、矮牵牛2(Petunia hybrida Vilm.)及圆叶牵牛3(Pharbitis purpurea (L.) Voigt)叶片膜脂过氧化(A)及可溶性蛋白含量(B)的影响Fig. 5 O3 effect on plasmalemma lipid peroxidation (MDA, A) and soluble protein (B) of marigold 1 (Tagetes erecta Linn.), petunia 2 (Petunia hybrida Vilm.) and morning glory 3 (Pharbitis purpurea (L.) Voigt)

图6 臭氧胁迫对万寿菊1(Tagetes erecta Linn.)、矮牵牛2(Petunia hybrida Vilm.)及圆叶牵牛3(Pharbitis purpurea (L.) Voigt)叶片激素含量的影响Fig. 1 O3 effect on salicylic acid (SA, A), jasmonic acid (JA, B) and abscisic acid (ABA, C) of marigold 1 (Tagetes erecta Linn.), petunia 2 (Petunia hybrida Vilm.) and morning glory 3 (Pharbitis purpurea (L.) Voigt)
2.3 供试植物激素对臭氧胁迫的响应
臭氧暴露对万寿菊叶片水杨酸的代谢没有明显影响(表1和图6A),但是显著抑制了茉莉酸的合成(图6B),与对照相比其含量降低了78.8%~80.5%。高浓度臭氧显著增加了万寿菊叶片脱落酸含量,比对照增加了154.0%(图6C)。
臭氧暴露刺激了矮牵牛叶片水杨酸合成,与对照相比低浓度与高浓度处理下叶片水杨酸含量分别增加了111.5%和94.6%,臭氧处理之间其含量没有差异(图6A);矮牵牛叶片茉莉酸含量较少,在本实验中用Pan等[22]的方法未检测出(图6B);叶片脱落酸含量对臭氧胁迫响应不敏感,其含量与对照相比没有明显变化(图6.C)。
高浓度臭氧暴露促进了圆叶牵牛叶片水杨酸的累积(图6A),与对照相比其含量增加了62.5%;茉莉酸对臭氧胁迫的响应与水杨酸呈相反的趋势,即臭氧浓度升高不利于茉莉酸在叶片的累积,即使是低浓度处理,其含量较对照也降低了28.9%,随臭氧浓度增加,降低幅度增大(83.9%)(图6B);脱落酸对臭氧胁迫响应不敏感,臭氧熏蒸后,其浓度没有明显变化(图6C)。
高浓度臭氧暴露扰乱了万寿菊与圆叶牵牛叶片的激素平衡,致使SA/JA比值增加,与对照相比分别增加了720%和1300%,低浓度臭氧处理后SA/JA亦表现出增加的趋势(图7)。

图7 万寿菊1(Tagetes erecta Linn.)、矮牵牛2(Petunia hybrida Vilm.)及圆叶牵牛3(Pharbitis purpurea (L.) Voigt)叶片激素稳态对臭氧胁迫的响应Fig. 7 O3 effect on the ratio of salicylic acid to jasmonic acid (SA/JA) of marigold 1 (Tagetes erecta Linn.), petunia 2 (Petunia hybrida Vilm.) and morning glory 3 (Pharbitis purpurea (L.) Voigt)
3 讨论(Discussion)
万寿菊、矮牵牛和圆叶牵牛作为常用的城市景观植物已广泛存在于市民的日常生活中。本实验中,供试植物对臭氧胁迫的响应表现不一致,但都产生了不可逆转的臭氧伤害:臭氧处理后万寿菊和矮牵牛叶脉间出现黄化,且最初症状分别发生在NF+120处理暴露后的第5 天和第21 天,对应的臭氧累积值AOT40分别为6.4和17.3 ppm·h,随暴露时间的延长黄化程度加剧;逐渐升高的臭氧浓度显著地抑制了圆叶牵牛的出苗率,播种18 d时出苗的植株已全部长出真叶,但同时也伴随着真叶臭氧伤害的形成(此时NF+60处理后臭氧累积值,AOT40为15.4 ppm·h):叶脉间产生白色斑点,随暴露时间的延长和臭氧浓度的升高,白色斑点扩大形成白色斑块,完全覆盖2条叶脉之间的空间,最终可以看到出现白色症状的地方颜色变暗、干枯。局部伤害的形成最终致使植物的整体长势受到影响。所以就可视伤害而言,3种供试植物对臭氧都比较敏感,可作为臭氧指示植物初步了解城市的臭氧污染情况。
植物表观臭氧伤害特征的形成源于其内在生理发生的变化[23]。臭氧通过气孔进入叶片后,一部分可被酶类与非酶类的抗氧化物质降解[24-25],剩余部分则退化形成氧化能力较强的活性氧,与细胞膜上不饱和脂肪酸双键反应,触发脂质过氧化,进一步引起膜结构及功能的变化[26]。MDA是脂质过氧化的终端产物,是评估细胞膜脂过氧化程度的成熟指标[27],其含量高低间接反映了细胞损伤的程度。本实验中臭氧处理加剧了供试植物的膜脂过氧化程度,意味着植物细胞发生了严重的氧爆反应,活性氧的形成显然超过了细胞组分的自我清除能力[28],激活了额外的ROS合成[29],与膜脂过氧化形成正反馈循环,加速细胞伤害的形成。臭氧诱发产生氧化伤害后,植物细胞会自发启动一系列抗氧化防御机制减弱臭氧伤害[30]。植物体内可溶性蛋白质扮演的重要角色是作为酶类参与细胞代谢,其具有很强的持水力,可为细胞抵御外界胁迫提供良好的生理基础[31]。本实验中3种供试植物叶片可溶性蛋白对臭氧响应不敏感,臭氧胁迫后期其含量没有明显变化,意味着该时期供试植物臭氧伤害的形成并非源于蛋白质抵御臭氧胁迫能力的下降。
水杨酸、茉莉酸以及脱落酸是植物体内三大激素,是调节植物生长发育的痕量信号分子,它们可单独或共同调节植物代谢。明确臭氧胁迫下各激素变化规律可为植物提前预防臭氧伤害提供科学依据。前人研究发现,SA、ABA可刺激产生ROS,因此被认为是负面调节剂[14, 16],而JA可以延缓甚至遏制细胞病变及死亡的蔓延,因此被认为是正面调节剂[12, 17, 32]。本实验中,不同供试植物对臭氧胁迫的激素响应有所差异:臭氧浓度升高降低了万寿菊叶片茉莉酸含量,这与之前在农作物和森林树种上的研究结果不同,Ren等[33]和Koch等[34]指出植物细胞为了限制ROS伤害,会刺激JA的合成,造成此种差异的原因可能是臭氧促进了万寿菊叶绿体解体(数据未列出),导致JA合成场所减少[17]。臭氧处理后水杨酸含量没有明显的变化,说明万寿菊臭氧伤害的形成主要源于JA对植物的保护能力降低,而非直接的由于臭氧诱导的SA伤害能力的增强。矮牵牛叶片激素对臭氧胁迫的响应与万寿菊不同,臭氧暴露后增加了矮牵牛叶片SA含量,JA含量太少,无论是对照组还是处理组,用Pan等[22]的方法均未检测出,ABA含量对臭氧胁迫不敏感,说明臭氧对矮牵牛造成的胁迫是由于SA累积的直接伤害引起的。Jaiwal等[35]曾指出,臭氧敏感的植物体内会累积大量的SA,而SA的大量合成,会引起质外体活性氧的大量产生[36]。高浓度臭氧处理圆叶牵牛后,其叶片SA含量显著上升,JA含量显著降低,意味着该植物SA累积的直接伤害加强,同时JA的保护能力降低,两者共同导致其臭氧伤害的形成。各类激素之间若能相互配合调节ROS产生与细胞处理ROS之间的平衡,则植物形成的臭氧伤害的蔓延会得到一定程度的遏制[12],所以植物体内的激素平衡对维持植物生长发育水平有重要的作用[37]。本实验中,高浓度臭氧暴露使万寿菊和圆叶牵牛叶片SA与JA的比值增加,意味着植物体内的激素平衡被打乱,JA对SA拮抗作用的能力降低,JA已不足以保护植物免遭臭氧诱导的SA累积伤害。
因此,在臭氧浓度尚得不到有效控制的情况下,明确不同植物臭氧伤害形成的激素响应,可有效采取针对性保护措施最大程度地维持其生态效益。
致谢:感谢国家自然科学基金(No. 31200295)对本研究的资助。
[1] Pellegrini E. PSII photochemistry is the primary target of oxidative stress imposed by ozone in Tilia americana [J]. Urban Forestry and Urban Greening, 2014, 13(1): 94-102
[2] Huang J, Zhou C, Lee X, et al. The effects of rapid urbanization on the levels in tropospheric nitrogen dioxide and ozone over East China [J]. Atmospheric Environment, 2013, 77: 558-567
[3] 黄伟, 余家燕, 鲍雷, 等. 重庆市交通道路氮氧化物排放简析[J]. 环境科学导刊, 2015, 34(2): 131-134
Huang W, Yu J Y, Bao L, et al. Investigation of characteristics of nitrogen oxides emission from road in Chongqing City [J]. Environmental Science Survey, 2015, 34(2): 131-134
[4] 李茜, 宋金平, 张建辉, 等. 中国城市化对环境空气质量影响的演化规律研究[J]. 环境科学学报, 2013, 33(9): 2402-2411
Li Q, Song J P, Zhang J H, et al. Dynamics in the effect of China's urbanization on air quality [J]. Acta Scientiae Circumstantiae, 2013, 33(9): 2402-2411 (in Chinese)
[5] Wang X, Manning W, Feng Z, et al. Ground-level ozone in China: Distribution and effects on crop yields [J]. Environmental Pollution, 2007, 147(2): 394-400
[6] Avnery S, Mauzerall D L, Liu J, et al. Global crop yield reductions due to surface ozone exposure: 2. Year 2030 potential crop production losses and economic damage under two scenarios of O3pollution [J]. Atmospheric Environment, 2011, 45(13): 2297-2309
[7] Chuwah C, van Noije T, van Vuuren D P, et al. Global impacts of surface ozone changes on crop yields and land use [J]. Atmospheric Environment, 2015, 106: 11-23
[8] Ghude S D, Jena C, Chate D, et al. Reductions in India's crop yield due to ozone [J]. Geophysical Research Letters, 2014, 41(15): 5685-5691
[9] Proietti C, Anav A, De Marco A, et al. A multi-sites analysis on the ozone effects on gross primary production of European forests [J]. Science of The Total Environment, 2016, 556: 1-11
[10] Gilliland N, Chappelka A, Muntifering R, et al. Changes in southern Piedmont grassland community structure and nutritive quality with future climate scenarios of elevated tropospheric ozone and altered rainfall patterns [J]. Plant Biology, 2016, 18(S1): 47-55
[11] Jyothsna P, Murthy S D S. A review on effect of senescence in plants and role of phytohormones in delaying senescence [J]. International of Plant, Animal and Environmental Sciences, 2016, 6(1): 152-161
[12] Overmyer K, Brosché M, Kangasjärvi J. Reactive oxygen species and hormonal control of cell death [J]. Trends in Plant Science, 2003, 8(7): 335-342
[13] 赵天宏, 刘波, 王岩, 等. 臭氧胁迫对大豆根系激素含量和活性氧代谢的影响[J]. 干旱地区农业研究, 2013, 31(4): 119-123
Zhao T, Liu B, Wang Y, et al. Effects of ozone stress on soybean roots endogenous hormones and reactive oxygen metabolism [J]. Agricultural Research in the Arid Areas, 2013, 31(4): 119-123 (in Chinese).
[14] Rao M V, Lee H-i, Creelman R A, et al. Jasmonic acid signaling modulates ozone-induced hypersensitive cell death [J]. The Plant Cell, 2000, 12(9): 1633-1646
[15] Miura K, Okamoto H, Okuma E, et al. SIZ1 deficiency causes reduced stomatal aperture and enhanced drought tolerance via controlling salicylic acid-induced accumulation of reactive oxygen species in Arabidopsis [J]. The Plant Journal, 2013, 73(1): 91-104
[16] Pellegrini E, Trivellini A, Campanella A, et al. Signaling molecules and cell death in Melissa officinalis plants exposed to ozone [J]. Plant Cell Reports, 2013, 32(12): 1965-1980
[17] Bartoli C G, Casalongué C A, Simontacchi M, et al. Interactions between hormone and redox signalling pathways in the control of growth and cross tolerance to stress [J]. Environmental and Experimental Botany, 2013, 94: 73-88
[18] Overmyer K, Tuominen H, Kettunen R, et al. Ozone-sensitive Arabidopsis RCD1 mutant reveals opposite roles for ethylene and jasmonate signaling pathways in regulating superoxide-dependent cell death [J]. The Plant Cell, 2000, 12(10): 1849-1862
[19] 佟磊, 冯宗炜, 苏德·毕力格, 等. 冬小麦气孔臭氧通量拟合及通量产量关系的比较分析[J]. 生态学报, 2012, 32(9): 2890-2899
Tong L, Feng Z W, Sudebilige, et al. Stomatal ozone uptake modeling and comparative analysis of flux-response relationships of winter wheat [J]. Acta Ecologica Sinica, 2012, 32(9): 2890-2899 (in Chinese)
[20] Feng Z, Pang J, Kobayashi K, et al. Differential responses in two varieties of winter wheat to elevated ozone concentration under fully open-air field conditions [J]. Global Change Biology, 2011, 17(1): 580-591
[21] Bradford M M. A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding [J]. Analytical Biochemistry, 1976, 72(1-2): 248-254
[22] Pan X, Welti R, Wang X, et al. Quantitative analysis of major plant hormones in crude plant extracts by high-performance liquid chromatography-mass spectrometry [J]. Nature Protocols, 2010, 5(6): 986-992
[23] 张巍巍, 郑飞翔, 王效科, 等. 臭氧对水稻根系活力、可溶性蛋白含量与抗氧化系统的影响[J]. 植物生态学报, 2009, 33(3): 425-432
Zhang W, Zheng F, Wang X, et al. Effects of ozone on root activity, soluble protein content and antioxidant system in Oryza sativa roots [J]. Chinese Journal of Plant Ecology, 2009, 33(3): 425-432 (in Chinese)
[24] Booker F L, Burkey K O, Jones A M. et al. Re-evaluating the role of ascorbic acid and phenolic glycosides in ozone scavenging in the leaf apoplast of Arabidopsis thaliana L [J]. Plant, Cell and Environment, 2012, 35(8): 1456-1466
[25] Conklin P, Barth C. Ascorbic acid, a familiar small molecule intertwined in the response of plants to ozone, pathogens, and the onset of senescence [J]. Plant, Cell and Environment, 2004, 27(8): 959-970
[26] Urbach W, Schmidt W, Kolbowski J, et al. Wirkung von Umweltschadstoffen auf Photosynthese und Zellmembranen von Pflanzen. In: 1. Status seminar der PBWU zum Forschungsschwerpunkt "Waldschii-den" GSF Bericht 6/89 [M]. Neuherberg: GSF, 1989: 195-206
[27] Ranieri A, D'Urso G, Nali C, et al. Ozone stimulates apoplastic antioxidant systems in pumpkin leaves [J]. Physiologia Plantarum, 1996, 97(2): 381-387
[28] Singh A A, Agrawal S, Shahi J, et al. Investigating the response of tropical maize (Zea mays L.) cultivars against elevated levels of O3at two developmental stages [J]. Ecotoxicology, 2014, 23(8): 1447-1463
[29] Sawada H, Komatsu S, Nanjo Y, et al. Proteomic analysis of rice response involved in reduction of grain yield under elevated ozone stress [J]. Environmental and Experimental Botany, 2012, 77: 108-116
[30] Ahsan N, Nanjo Y, Sawada H, et al. Ozone stress-induced proteomic changes in leaf total soluble and chloroplast proteins of soybean reveal that carbon allocation is involved in adaptation in the early developmental stage [J]. Proteomics, 2010, 10(14): 2605-2619
[31] 张鹏, 曾祥国, 韩永超, 等. 草莓‘晶瑶’感染炭疽病后抗性生理指标分析[J]. 中国农学通报, 2014, 30(13): 161-167
Zhang P, Zeng X G, Han Y C, et al. Study on physiological factors in strawberry 'Jingyao' inoculated with anthracnose [J]. Chinese Agricultural Science Bulletin, 2014, 30(13): 161-167 (in Chinese)
[32] Whitacre D M. Reviews of Environmental Contamination and Toxicology [M]. Springer, 2011: 61-111
[33] Ren Q, Sun Y, Guo H, et al. Elevated ozone induces jasmonic acid defense of tomato plants and reduces midgut proteinase activity in Helicoverpa armigera [J]. Entomologia Experimentalis et Applicata, 2015, 154(3): 188-198
[34] Koch J R, Creelman R A, Eshita S M, et al. Ozone sensitivity in hybrid poplar correlates with insensitivity to both salicylic acid and jasmonic acid. The role of programmed cell death in lesion formation [J]. Plant Physiology, 2000, 123(2): 487-496
[35] Jaiwal P K, Singh R P, Dhankher O P. Genetic Manipulation in Plants for Mitigation of Climate Change [M]. Springer, 2015: 1-14
[36] Xu E, Brosché M. Salicylic acid signaling inhibits apoplastic reactive oxygen species signaling [J]. BioMed Central Plant Biology, 2014, 14(1): 155-171
[37] 郑莎莎, 孙传范, 孙红春, 等. 不同外源激素对花铃期棉花主茎叶生理特性的影响[J]. 中国农业科学, 2009, 42(12): 4383-4389
Zheng S S, Sun C F, Sun H C, et al. Effects of different exogenous hormones on physiological characteristics of main stem leaves at flower and boll stage in cotton [J]. Scientia Agricultura Sinica, 2009, 42(12): 4383-4389 (in Chinese)
