虹鳟传染性胰脏坏死病毒的分离鉴定及聚类分析
2017-03-14刘淼徐黎明赵景壮曹永生刘红柏尹家胜卢彤岩
刘淼,徐黎明,赵景壮,曹永生,刘红柏,尹家胜,卢彤岩
(中国水产科学研究院黑龙江水产研究所,黑龙江哈尔滨150070)
虹鳟传染性胰脏坏死病毒的分离鉴定及聚类分析
刘淼,徐黎明,赵景壮,曹永生,刘红柏,尹家胜,卢彤岩
(中国水产科学研究院黑龙江水产研究所,黑龙江哈尔滨150070)
为研究传染性胰脏坏死病毒 (IPNV)感染虹鳟Oncorhynchus mykiss的病理特性,取云南省某养殖场大规模死亡的虹鳟稚鱼进行了病原的分离与鉴定,试验中利用鲑鳟鱼常见病毒敏感细胞大鳞大麻哈鱼胚胎细胞 (Chinook salmon embryo cells,CHSE-214)、鲤上皮瘤细胞 (Epitheliaoma papulosum cyprinid,EPC)和虹鳟性腺细胞 (Rainbow trout gonad cell line,RTG-2)对虹鳟稚鱼无菌组织悬液进行病毒培养,并对产生细胞病变的上清进行病毒RNA提取及鲑鳟鱼常见病毒的RT-PCR检测,利用敏感细胞进行病毒分离株的噬斑培养及滴度测定,并对病毒形态进行透射电镜观察。结果表明:细胞培养显示,该组织悬液能使CHSE-214和RTG-2细胞产生明显的细胞病变;RT-PCR结果显示,检测样本呈IPNV阳性,传染性造血器官坏死病毒(IHNV)呈阴性;该IPNV分离株(命名为ChRtm213)在CHSE-214、RTG-2和EPC细胞上的病毒滴度分别为105.2、103.2、102.3TCID50/mL,在CHSE-214细胞上培养4 d即可形成肉眼可见的病毒噬斑;在透射电镜下清晰可见大量病毒粒子呈晶格状排列于细胞质内;ChRtm213分离株与西班牙毒株2310 (AY489225)VP2相似度较高,核苷酸序列一致性为96.4%;聚类分析结果显示,ChRtm213分离株与参考毒株加拿大Jasper(ATCC:VR-1325)聚为一簇,属于Gengroup 5基因型。研究表明,ChRtm213分离株异于已报道的IPNV分离株,具有不同的血清型及病毒毒力,可为传染性胰脏坏死病毒的检测及防控提供参考。
虹鳟;传染性胰脏坏死病毒 (IPNV);CHSE-214;基因型
传染性胰脏坏死病毒 (Infectious pancreatic necrosis virus,IPNV)隶属于双RNA病毒科Birnaviridae、水生双 RNA病毒属Aquabirnavirus[1]。该病毒为二十面体对称,无囊膜,直径为50~75 nm,核酸为双链RNA[2-3]。由于毒株、宿主和环境因素的不同,IPNV可造成10%~90%的死亡率[4-5]。传染性胰腺坏死病 (Infectious pancreatic necrosis,IPN)是鲑鳟鱼类最为严重的传染性疾病之一,该病主要危害虹鳟Onchorhyncus mykiss、美洲红点鲑 Salvelinus fontinalis、褐鳟 Salmo trutta、大西洋鲑Salmo salar和大麻哈属Oncorhynchus spp.的鱼苗及幼鱼[6]。IPN最早发生在加拿大、美国,后来扩散至欧亚的十余个国家[1],于20世纪80年代末又传入日本[7]、韩国[8]和中国的辽宁、山西、山东、甘肃等地[9-12]。近年来,关于IPN的报道主要集中在检测方法的建立及病毒特性研究[13-15],而有关IPN大规模暴发的研究报道较少。
本研究中,以中国云南省某养殖场出现大规模(近70%)死亡的虹鳟稚鱼 (1.5 g左右)为研究对象,收集样本并进行常规病毒检测,分离出一株IPNV(命名为ChRtm213),并利用滴度测定、噬斑培养、透射电镜观察、基因型分析、血清学预测等方法对ChRtm213分离株进行了生物学鉴定。结果表明,该分离株与中国已报道的IPNV毒株具有不同的来源、病毒滴度和血清型,本研究结果可为中国IPNV的全面监测及防控提供数据支持。
1 材料与方法
1.1 材料
试验用虹鳟稚鱼150尾取自云南省某养殖场,大鳞大麻哈鱼胚胎细胞 (Chinook salmon embryo cells,CHSE-214)、鲤上皮瘤细胞 (Epitheliaoma papulo sum cyprinid,EPC)、虹鳟性腺细胞(Rainbowtrout gonad cell line,RTG-2)由中国水产科学研究院长江水产研究所鱼类病害教研室曾令兵教授惠赠;MEM培养基购自 Hyclone公司;胎牛血清(Fetal Bovine Serum,FBS)、0.25%EDTA-Tyrisin购自Gibco公司;SV Total RNA Isolation System购自Promega公司;PrimeScriptTMOne Step RT-PCR Kit Ver 2.0试剂盒、pMD19-T simple载体和DNA Marker均购自宝生物工程技术有限公司;低熔点琼脂糖购自Lonza公司;其他试剂均为分析纯。
1.2 方法
1.2.1 引物合成 根据GenBank收录的IPNV表面蛋白VP2的基因序列,利用Primer Premier 5.0选取保守序列设计引物,上游引物 VP2-F:5′CAAGGCAACCGCAACYTACT 3′,下游引物VP2-R:5′ATKGCAGCTGTGCACCTCAT 3′,目的片段大小为584 bp。传染性造血器官坏死病毒 (Infectious hematopoietic necrosis virus,IHNV)检测用引物HL-F/HL-R为黑龙江水产研究所鱼病实验室建立的检测方法中设计的引物[16]。
1.2.2 病毒的细胞检测 试验中将虹鳟稚鱼全鱼进行匀浆,在12 000 g条件下离心10 mim,上清液经0.22 μm无菌滤膜过滤,按1∶100的最终稀释度稀释,取适量接种于生长单层的CHSE-214、EPC和RTG-2细胞中,18℃下吸附1 h后弃去孵育液,加入细胞维持液,在18℃培养箱中培养,利用倒置显微镜每日观察细胞病变情况并拍照。同时,设立不加入孵育液的细胞作为对照组。当细胞病变达到80%后,反复冻融细胞培养物3次,分装病毒悬液于冰箱 (-80℃)中保存备用。
1.2.3 病毒的RT-PCR鉴定 吸取上述所得病毒悬液200 μL,按照SV Total RNA Isolation System说明书提取病毒基因组RNA。按照一步法RT-PCR试剂盒说明书,分别以VP2-F/VP2-R和HL-F/ HL-R为引物进行病毒检测。RT-PCR扩增程序为:94℃下预变性5 min;94℃下变性1 min,50℃下退火1 min,72℃下延伸50 s,共进行30个循环;最后在72℃下再延伸10 min。RT-PCR产物经10 g/L琼脂糖凝胶电泳后进行胶回收,回收产物与pMD19-T simple载体连接,连接产物转化至DH5α感受态细胞中,挑取单菌落扩大培养后,提取质粒并进行PCR鉴定,将鉴定正确的质粒进行测序,测序结果在GenBank中进行Blast分析。
1.2.4 使半数组织细胞致死的病毒感染量(TCID50)的测定 取生长状态良好的EPC细胞,消化后按照2×104cells/100 μL分装于96孔板中,接种各分离株不同稀释度的病毒悬液,每个稀释度8孔,每孔100 μL,同时设立空白对照组,20℃下培养,观察7 d后,利用Reed-Muench法计算TCID50。
1.2.5 病毒的噬斑培养 取生长状态良好的CHSE-214细胞,用0.25%的 EDTA-Tyrisin消化后分装于6孔板中,当细胞汇合成单层时备用。将病毒悬液稀释,按1∶1000、1∶10 000、1∶100 000倍比稀释成10-3、10-4、10-53个浓度,分别取1 mL各浓度病毒悬液接种于单层CHSE-214细胞的6孔板中,18℃下吸附1 h。将湿热灭菌后的15 g/L低熔点琼脂糖置于40℃水浴中保存,然后与2×MEM细胞维持液按照1∶1混匀,弃去病毒悬液,用Hanks液洗涤后,每孔加入2 mL含有低熔点琼脂糖的细胞维持液,凝固后于18℃下倒置培养,每天观察噬斑的形成和变化,4 d后每孔中加入含有中性红 (终浓度为0.06%)的低熔点琼脂糖细胞维持液,12 h后进行拍照,并挑取合适的噬斑进行传代培养。
1.2.6 电镜观察 取生长状态良好的CHSE-214细胞,以0.25%EDTA-Tyrisin消化后,于25 cm2小瓶 (Corning)中传代培养,当细胞汇合成单层时,接种1 mL稀释1000倍的第5代病毒悬液,18℃下吸附1 h,弃去病毒悬液,加入5 mL细胞维持液,18℃条件下病毒感染48 h后,将细胞维持液吸出,加入体积分数为2.5%的戊二醛固定,取固定好的细胞培养物制备超薄切片,进行透射电镜观察。
1.3 数据处理
利用MegAlign软件,以VP2基因片段为目标基因,对IPNV-ChRtm213与GenBank收录的其他国家IPNV分离株及部分水生双RNA病毒进行VP2核苷酸序列同源性分析。利用MEGA 5.0软件构建系统进化树。试验所用毒株信息如表1所示。
2 结果与分析
2.1 病毒分离结果
将虹鳟匀浆液接种于 CHSE-214、EPC和RTG-2细胞后,观察细胞病变情况。显微镜观察结果显示:48 h时,CHSE-214细胞出现皱缩变圆、崩解脱落等明显的细胞病变,RTG-2细胞只出现少数的病变灶,且病变灶细胞形态异常,而EPC细胞未出现任何异常;72 h时,CHSE-214细胞大面积崩解脱落,RTG-2细胞病变部位扩大,只有很少部分细胞崩解脱落,而EPC细胞仍然未有任何变化,生长正常 (图1)。

表1 试验用病毒分离株信息Tab.1 Information of IPNV isolates used in this study
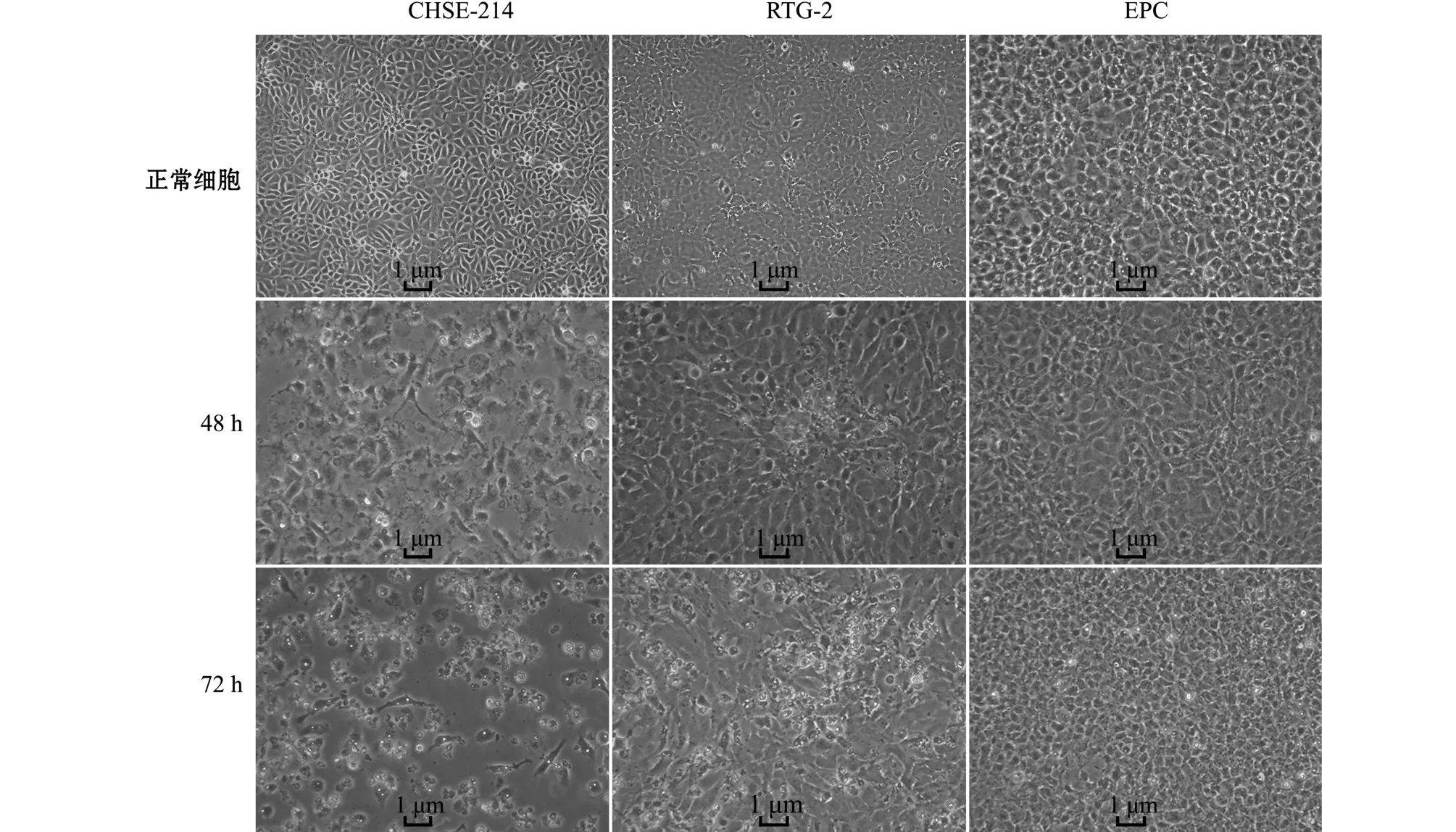
图1 虹鳟组织悬液接种细胞产生的细胞病变 (20×)Fig.1 Cytopathic effect of cells inoculated with rainbow trout suspension(20×)
2.2 RT-PCR检测
对提取的病毒RNA进行RT-PCR检测,产物经10 g/L琼脂糖凝胶电泳分析,结果显示,在IPNV泳道出现符合目的片段大小的特异性条带(584 bp),而在IHNV对应的泳道上未见任何条带(图2)。特异性片段序列与GenBank收录的多条IPNV VP2序列一致性为 90%,说明该病毒为IPNV,命名为ChRtm213。
2.3 病毒TCID50测定及空斑纯化
将ChRtm213接种于生长在6孔细胞培养板中的CHSE-214、EPC和RTG-2细胞中,利用Reed-Muench法测定 ChRtm213在不同细胞系中的TCID50。结果显示,ChRtm213在CHSE-214细胞中具有最高的滴度,为105.2TCID50/mL,在EPC 和RTG上分别为102.3、103.2TCID50/mL。
将病毒悬液按103~105倍进行梯度稀释后接种到CHSE-214细胞中,2 d后产生肉眼可见噬斑,随着培养时间的延长,噬斑逐渐增大,4 d后加入中性红染色,噬斑更加清晰可见,且噬斑数量与病毒悬液稀释度呈负相关 (图3)。染色12 h后,挑取噬斑进行传代培养。
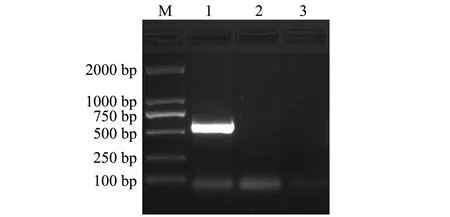
图2 RT-PCR扩增结果Fig.2 Amplification by RT-PCR

图3 IPNV在CHSE-214细胞中形成的噬斑Fig.3 Plagues caused by IPNV in CHSE-214
2.4 电镜观察
将CHSE-214细胞接种ChRtm213分离株,24 h后,制备超薄切片进行电镜观察,结果显示,在细胞质中观察到呈晶格状排列的多面体IPNV病毒粒子,无囊膜,直径为50~70 nm(图4)。
2.5 聚类分析
同源性分析结果显示,本研究中 ChRtm213 (KX234591) 分离株与西班牙毒株 2310 (AJ489225)VP2相似度较高,核苷酸序列一致性为96.4%,与美国毒株OV2(AY026484)VP2相似度较低,核苷酸序列一致性为81.0% (图5)。聚类分析结果显示,ChRtm213分离株与参考毒株加拿大Jasper(ATCC:VR-1325)聚为一簇 (图6),具有较近的亲缘关系。

图4 CHSE-214细胞中IPNV的电镜观察Fig.4 Electron microscopy of IPNV in CHSE-214
3 讨论
3.1 敏感细胞系的选择
IPNV最早流行于欧美等国家,随着水产品贸易的增加,后扩散至亚洲多个国家。中国水产养殖业于20世纪80年代暴发了IPN病,曾造成流行区域虹鳟的大规模死亡。目前,该病毒并未进入世界动物卫生组织 (OIE)要求上报的疫病名录中。中国对IPNV病毒的研究资料较少,主要集中在病毒检测方法的建立及疫苗的初步构建上。病毒细胞敏感性分析显示,ChRtm213分离株可在CHSE-214 和RTG-2细胞上增殖,并产生典型细胞病变,但CHSE-214比RTG-2细胞具有更好的敏感性,主要表现为出现细胞病变所需时间短及病毒滴度高。ChRtm213分离株在EPC细胞上的滴度最低 (102.3TCID50/mL),当病毒含量较低时,无法利用EPC细胞进行检测,该结论与有关文献报道[17]相一致。因此,CHSE-214是检测IPNV的最适细胞系,透射电镜观察表明,接种了IPNV的CHSE-214细胞质内存在大量晶格状排列的IPNV病毒粒子,进一步说明CHSE-214细胞对IPNV病毒具有较好的敏感性,是IPNV病毒体外增殖的首选细胞。
3.2 分离毒株的血清型分析
IPNV病毒含有10个血清型,其中A组血清型包含A1(West Buxton,WB)、A2(Spajarup,Sp)、A3(Abild,Ab)、A4(Hecht,He)、A5(Tellina, Te)、A6(Canada 1,C1)、A7(Canada 2,C2)、A8(Canada 3,C3)和A9(Jasper,JaATCC),B组含有B1(Tellinavirus,TV-1)。根据IPNV的多聚蛋白氨基酸序列,可将 IPNV分为6个基因簇(Genogroup 1~6),其中Genogroup 1对应血清型为A3,Genogroup 2为A5和A6,Genogroup 3为A2,Genogroup 4为A7和A8,Genogroup 5为A1 和A9,Genogroup 6为 A4[18]。本研究中,利用IPNV主要表面蛋白VP2氨基酸序列对ChRtm213分离株进行基因型分析,结果显示,ChRtm213与美国的VR299(A1)、西班牙的2310(A1)和加拿大Jasper(A9)同属于Genogroup 5基因型。根据文献推导可知,中国ChRtm213分离株的血清型为A1或A9;同源性分析结果显示,中国ChRtm213分离株与A1血清型的VR299和2310分离株VP2具有更高的相似度,但ChRtm213分离株血清型的确定有待进一步验证;此外,由于在GenBank数据库中未检索到中国IPNV分离株的基因序列信息,因此,在同源性分析过程中,加入了同属的水生双RNA病毒日本分离株Y-6 (AB006783)和YTAV-06(AB281673),并进行了比较,ChRtm213分离株与水生双RNA病毒日本分离株VP2相似度相对较低,核苷酸序列一致性为84.5%左右。前期研究表明,中国现有IPNV分离株血清型均为A2(SP),病毒滴度均高达108TCID50/mL,具有很高的致死性[6-9],而本研究中的ChRtm213分离株病毒滴度最高为105TCID50/ mL,但由于未检索到已报道的中国IPNV毒株的任何基因序列,因此,无法对国内IPNV分离株间的TCID50及血清型的差异进行深入分析。
综上所述,本研究中分离的ChRtm213不同于中国现行的其他IPNV分离株,该病株具有不同的血清型及病毒毒力。本研究结果可为中国不同地区的IPNV监测及疫苗研制提供数据参考。
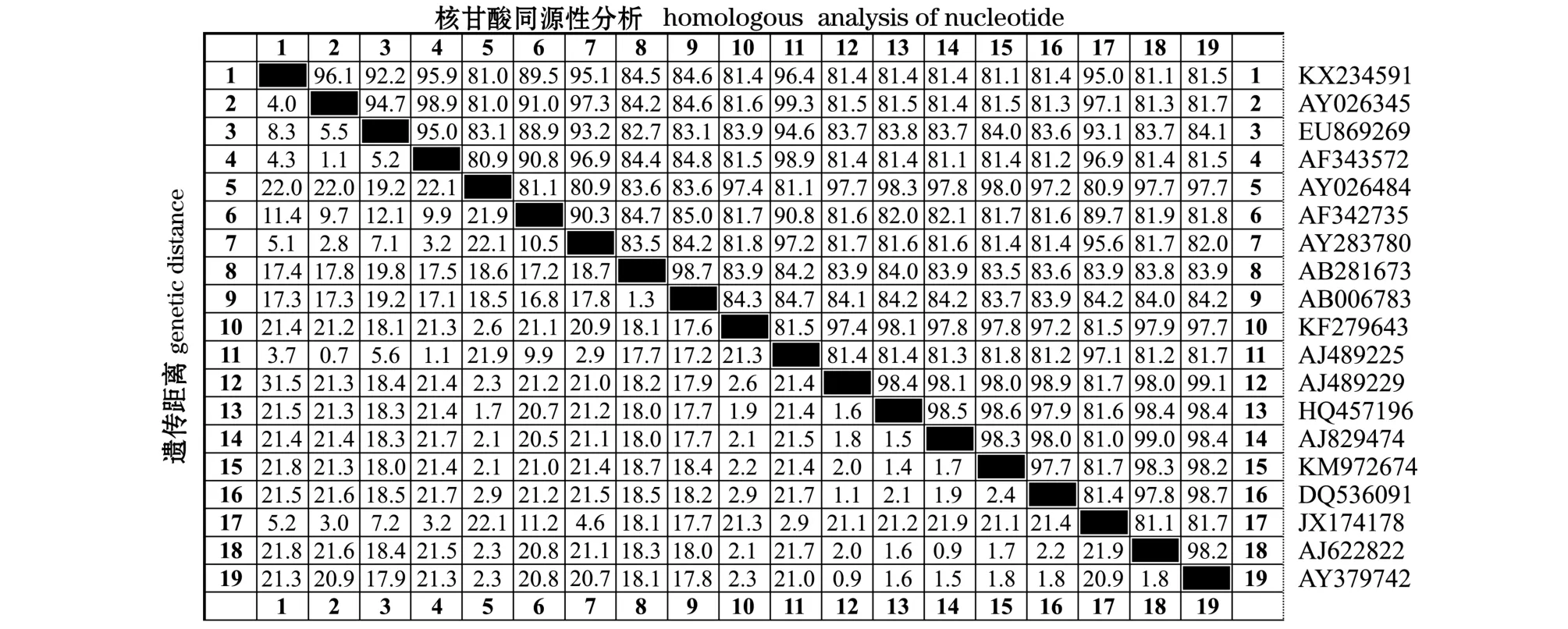
图5 ChRtm213与不同国家IPNV分离株VP2的同源性分析Fig.5 Homological analysis of VP2 in ChRtm213 with IPNV isolates from different countries

图6 以VP2基因序列构建的ChRtm213分离株进化树Fig.6 Phylogenetic tree of ChRtm213 isolate based on gene sequence of VP2
[1] 胡晓利,李伟,肇慧君,等.虹鳟鱼传染性胰脏坏死病病毒的分离与鉴定[J].中国动物检疫,2012,29(3):27-30.
[2] Cuesta A,Chaves-Pozo E,de Las Heras A I,et al.An active DNA vaccine against infectious pancreatic necrosis virus(IPNV)with a different mode of action than fish rhabdovirus DNA vaccines[J]. Vaccine,2010,28(19):3291-3300.
[3] Munang′andu H M,Mutoloki S,Evensen Ø.Acquired immunity and vaccination against infectious pancreatic necrosis virus of salmon[J].Developmental&Comparative Immunology,2014,43(2): 184-196.
[4] Biering E,Villoing S,Sommerset I,et al.Update on viral vaccines for fish[J].Developments in Biologicals,2005,121:97-113.
[5] Roberts R J,Pearson M D.Infectious pancreatic necrosis in Atlantic salmon,Salmo salar L.[J].Journal of Fish Diseases,2005,28 (7):383-390.
[6] OIE.Diagnostic Manual for Aquatic Animal Diseases[S].France: Office International Des Epizooties,1995:91-99.
[7] Sano T.Studies on viral diseases of Japanese fishes-I:infectious pancreatic necrosis of rainbow trout:first isolation from epizootics in Japan[J].Bulletin of the Japanese Society for the Science of Fish,1971,37(6):495-498.
[8] Hah Y C,Hong S W,Kim M H,et al.Isolation of infectious pancreatic necrosis virus from goldfish(Carassius auratus)and chum salmon(Oncorhynchus keta)in Korea[J].The Korean Journal of Microbiology,1984,22(2):85-90.
[9] 孙颖杰,陈文义,夏德昌,等.虹鳟鱼传染性胰脏坏死病毒的分离与鉴定[J].水产学杂志,1993,6(1):50-56.
[10] 江育林,徐伯亥,李伟,等.虹鳟传染性胰脏坏死病病毒(IPNV)的初步研究[J].水生生物学报,1989,13(4):353-358.
[11] 童裳亮,Hetrick F M.山东虹鳟暴发传染性胰脏坏死病(IPN) [J].海洋通报,1989,8(1):118.
[12] 刘兴发,王熹洲,娄淑杰,等.虹鳟鱼传染性胰腺坏死病毒的分离与鉴定[J].中国兽医科技,1991,21(6):11-14.
[13] 吴斌,肇慧君,李叶,等.传染性胰脏坏死病毒逆转录聚合酶链式反应法(RT-PCR)的研究[J].中国动物检疫,2012,29 (9):46-48.
[14] 连科迅,赵丽丽,张琳琳,等.传染性胰腺坏死病毒VP2 COE蛋白单克隆抗体的制备与初步应用[J].水产学报,2013,37 (8):1229-1235.
[15] 刘敏,赵丽丽,葛俊伟,等.传染性胰腺坏死病毒VP3蛋白在干酪乳杆菌的表面表达[J].中国预防兽医学报,2010,32 (1):19-22.
[16] 徐黎明,刘红柏,徐进,等.传染性造血器官坏死病病毒高效RT-PCR检测方法的建立[J].水生生物学报,2013,37(6): 1164-1168.
[17] Lorenzen E,Carstensen B,Olesen N J.Inter-laboratory comparison of cell lines for susceptibility to three viruses:VHSV,IHNV and IPNV[J].Diseases of Aquatic Organisms,1999,37(2):81-88.
[18] Cutrín J M,Barja J L,Nicholson B L,et al.Restriction fragment length polymorphisms and sequence analysis:an approach for genotyping infectious pancreatic necrosis virus reference strains and other aquabirnaviruses isolated from northwestern Spain[J]. Applied and Environmental Microbiology,2004,70(2):1059-1067.
Isolation,identification and cluster analysis of an infectious pancreatic necrosis virus
LIU Miao,XU Li-ming,ZHAO Jing-zhuang,CAO Yong-sheng, LIU Hong-bai,YIN Jia-sheng,LU Tong-yan
(Heilongjiang River Fisheries Research Institute,Chinese Academy of Fishery Sciences,Harbin 150070,China)
A pathogen of an infectious pancreatic necrosis(IPN)was isolated and cultured in rainbow trout Oncorhynchus mykiss collected from Yunnan Province by chinook salmon embryo cells(CHSE-214),epitheliaoma papulosum cyprinid(EPC)and rainbow trout gonad cell line(RTG-2)inoculated with sterile tissue suspension. The RNA was extracted from cells with cytopathic effect,and identified by RT-PCR assays used for common salmon virus detection.The isolate was further analyzed with plaque assay,virus titer detection,and electron microscopy observation.The cell culture showed that the tissue suspension led to produce typical cytopathic effect(CPE) on CHSE-214 and RTG-2 instead of EPC.The RT-PCR showed that the sample was positive to infectious pancreatic necrosis virus(IPNV)and negative to infectious hematopoietic necrosis virus(IHNV).The IPNV isolate was named as ChRtm213,with titer of 105.2TCID50/mL on CHSE-214,103.2TCID50/mL on RTG-2 and 102.3TCID50/mL on EPC.ChRtm213 produced plagues in CHSE-214,and plenty of virons in crystalline arrangement was observed in cytoplasm.The ChRtm213 had the maximal homology with Spain IPNV-2310 isolate,with nucleotide identity of 96.4%.The cluster analysis revealed that ChRtm213,in the same cluster with reference strain Canada isolate Jasper(ATCC:VR-1325),belonged to Gengroup 5.A novel IPNV was isolated and identified from Yunnan Province,and the findings provide reference for the monitoring and vaccine development of IPNV in China.
Oncorhynchus mykiss;infectious pancreatic necrosis virus;CHSE-214;gene type
Q785;S917
A
10.16535/j.cnki.dlhyxb.2017.01.010
2095-1388(2017)01-0056-06
2016-04-13
黑龙江省应用技术研究与开发计划项目 (GA13B401);黑龙江省自然科学基金资助项目 (C201462);中央级公益性科研院所基本科研业务费专项 (HSY201514)
刘淼 (1987—),女,硕士。E-mail:446048847@qq.com
卢彤岩 (1976—),女,研究员。E-mail:lutongyan@hotmail.com
