响应面法优化鲟鱼精蛋白的提取工艺
2017-03-14饶丹华耿胜荣邓子浩熊光权鉏晓艳李海蓝王宝华
饶丹华,白 婵,耿胜荣,邓子浩,徐 晨,熊光权,鉏晓艳,李海蓝,季 飞,王宝华,李 新,廖 涛,*
(1.武汉工程大学化学与环境工程学院,湖北武汉 430073;2.湖北省农业科学院农产品加工与核农技术研究所/湖北省农产品辐照工程技术研究中心,湖北武汉 430064;3.武汉鲟龙生物科技有限公司,湖北武汉 430015)
响应面法优化鲟鱼精蛋白的提取工艺
饶丹华1,2,白 婵2,耿胜荣2,邓子浩2,徐 晨1,2,熊光权2,鉏晓艳2,李海蓝2,季 飞3,王宝华3,李 新2,廖 涛2,*
(1.武汉工程大学化学与环境工程学院,湖北武汉 430073;2.湖北省农业科学院农产品加工与核农技术研究所/
湖北省农产品辐照工程技术研究中心,湖北武汉 430064;3.武汉鲟龙生物科技有限公司,湖北武汉 430015)
以鲟鱼-甲骨板的精巢组织为原料,从中提取鱼精蛋白粗品,建立硫酸提取分离鱼精蛋白的最优工艺。以蛋白得率为指标,通过单因素实验研究硫酸浓度、液料比、提取温度、提取时间和提取次数的影响大小,初步确定鱼精蛋白的最佳分离条件。进一步利用响应面软件Box-Behnken设计模型确定鲟鱼精蛋白的最佳提取工艺条件,结果表明:硫酸浓度0.83 mol/L,液料比6.2∶1 mL/g,提取时间0.5 h,提取温度35 ℃,提取次数4次。经验证,最优工艺条件下鱼精蛋白的得率平均达到11.28%,且纯度高达86.13%,分子量约为10 ku,有良好的抑菌活性,金黄色葡萄球菌抑菌圈直径达15.75 mm。
鱼精蛋白,响应面,提取,鲟鱼
鱼精蛋白是一类以精氨酸为主的多聚阳离子碱性蛋白肽,常存在于鱼类精巢组织细胞核中与DNA结合构成核精蛋白。鱼精蛋白不仅具有促使细胞繁殖发育的作用,而且具有阻碍血液凝固、助呼吸、促消化、增强肾功能和抑制肿瘤生长繁殖等多种功能[1-2]。尤其是具有强烈的抑菌活性,可作为化学防腐剂的替代品在食品中使用[3-4],因此受到广泛关注。
对鱼精蛋白的研究,多以硫酸提取[5-7]为主要提取方法,近年也有超声波辅助提取[8]的方法。国外多侧重于海水鱼类的研究如鲑科鱼[9]、鲱科鱼[10],而我国这类海鱼资源较缺乏,淡水鱼资源丰富,淡水鱼副产物精巢原料充足。但到目前为止,国内鱼精蛋白的研究中淡水鱼来源仍范围较窄,并且得率仍旧较低。如利用硫酸溶液辅助超声波提取的方法,上官新晨[8]最多得到5.23%的鱼精蛋白。若简化工艺不辅以超声提取,刘燕妮[11]得到鲑鱼和鲤鱼鱼精蛋白得率分别为2.32%和4.46%,黄占旺[12]最多得到5.23%的鲤鱼精蛋白,刘红玉[7]得到7.38%的大马哈鱼精蛋白。
淡水鲟鱼产业近年发展迅速,鲟鱼向来以高营养价值著称,蛋白质含量高,8种必需氨基酸评分均超过WHO推荐的成人氨基酸需要量模式[13]。鲟鱼-甲骨板是达氏鳇和史氏鲟的杂交品系,由于其生长快,抗病力强,已在湖北省乃至全国广泛人工养殖。且鲟鱼全身脂肪含量低,甲骨板精巢组织较大[14],以鲟鱼-甲骨板为原料提取鱼精蛋白具有更高蛋白提取率和更强的抑菌特性的可能性。鉴于超声波辅助提取需20 min[8],与直接酸提所需时间相差不大,并考虑实际工艺越简化越易操作且成本越低,因此本实验采用硫酸提取对制备工艺及鱼精蛋白抑菌性能进行研究,一方面为选取优势原料来源、提取高得率鱼精蛋白提供了理论基础,一方面也提高了鲟鱼加工副产物的附加价值。
1 材料与方法
1.1 材料与仪器
鲟鱼-甲骨板精巢组织 武汉鲟龙生物科技有限公司;浓硫酸、95%乙醇、丙酮、乙醚、磷酸 均为国药集团,分析纯;考马斯亮蓝G250 国药集团;金黄色葡萄球菌 中国典型培养物保藏中心。
T18 ULTRA-TURRAX高速匀浆机 德国IKA;ME303E分析天平 METTLER TOLEDO;DF-101S集热式恒温加热磁力搅拌器 武汉科尔仪器设备有限公司;GL-25MS高速冷冻离心机 上海卢湘仪离心机仪器有限公司;UH5300紫外可见分光光度计 HITACHI;生物安全柜 Heal Force;LDZM-80KCS立式压力蒸汽灭菌器 上海中安医疗器械厂。
1.2 实验方法
1.2.1 提取工艺 参照黄占旺[12]等人的研究方法并稍作修改,将冰冻的鱼白(即鱼精巢组织)取出解冻,去除脂肪、结缔组织、上皮组织等杂质。称取10 g除杂处理的鱼白切碎成浆状,置于100 mL离心管中,加入100 mL 0.14 mol/L NaCl溶液,均质匀浆1 min,于0 ℃中搅拌20 min,静置10 min,4000 r/min低温(0 ℃)离心分离10 min,弃去上清液。
在沉淀物中按一定量加入一定浓度的硫酸溶液在一定温度下提取一定时间,4000 r/min低温(0 ℃)离心10 min,上清液过滤;离心后的沉淀再重复操作一定次数。
将滤液合并,用三倍体积的95%冷乙醇沉淀,沉淀用丙酮洗涤两次,乙醚洗涤一次,再冷冻干燥,得鱼精蛋白粗品。以产品的得率为测定指标,进行比较实验。重复实验3次,取平均值。
1.2.2 鱼精蛋白得率的测定 蛋白质含量测定采用考马斯亮蓝G250染色法[15]。
鱼精蛋白得率(%)=蛋白含量/鲟鱼精巢总重×100
1.2.3 单因素实验 硫酸浓度∶固定硫酸与原料的液料比为3∶1 mL/g,0 ℃提取1 h,提取次数1次,硫酸浓度分别设为0.1、0.2、0.4、0.6、0.8、1、1.2 mol/L,比较不同硫酸浓度下的鱼精蛋白得率。
液料比:固定硫酸浓度为0.8 mol/L,0 ℃提取1 h,提取次数1次,液料比分别设为2∶1、3∶1、4∶1、5∶1、6∶1、7∶1、8∶1 mL/g,比较不同液料比下的鱼精蛋白得率。
提取时间:固定硫酸浓度为0.8 mol/L,液料比为6∶1 mL/g,0 ℃提取,提取次数1次,提取时间分别设为0.25、0.5、1、1.5、2 h,比较不同提取时间下的鱼精蛋白得率。
提取温度:固定硫酸浓度为0.8 mol/L,液料比为6∶1 mL/g,提取时间0.5 h,提取1次,提取温度分别设为0、15、25、35、45、55、65 ℃,比较不同提取温度下的鱼精蛋白得率。
提取次数:固定硫酸浓度为0.8 mol/L,液料比为6∶1 mL/g,35 ℃水浴提取,提取时间0.5 h,提取次数分别设为1、2、3、4、5、6次,比较不同提取次数下的鱼精蛋白得率。
1.2.4 响应面实验 在单因素实验的基础上,利用软件Design-Expert V8.0.6中的Box-Behnken Design设计原理,选取对鱼精蛋白得率影响较为显著的硫酸浓度、液料比、提取次数作为考察因素,设计3因素3水平响应面实验[16-18],因素水平编码见表1,以鱼精蛋白得率为响应面的评价指标,进一步优化提取工艺。

表1 Box-Behnken设计的因素编码和水平Table 1 Codes and levels of test factors in Box-Behnken
1.2.5 鱼精蛋白的鉴定 通过坂口反应[19]鉴定。将蛋白粉用适量蒸馏水复溶,取0.5 mL依次加入10% NaOH 5滴、0.2%α-萘酚1滴、次氯酸钠溶液1滴,观察是否显红色。
将蛋白粉溶解液进行SDS-PAGE电泳分析。聚丙烯酰胺凝胶电泳[20-21]条件为分离胶浓度15%,浓缩胶浓度4%。
1.2.6 抑菌实验 将1 g鱼精蛋白粉加入10 mL灭菌水中溶解制成10-1g/mL浓度,在室温下浸泡6 mm滤纸片1 h。将金黄色葡萄球菌菌种活化,且在37 ℃下扩大培养24 h。将第二代扩大培养液稀释10倍进行涂布,印上滤纸片正置20 min后于37 ℃恒温倒置培养24 h后进行观察,此外设置灭菌水浸泡滤纸印在相同金黄色葡萄球菌涂布平板上作为对照组。
1.3 数据处理
单因素实验数据采用Origin 8.0软件处理作图,响应面实验数据采用Design-Expert V8.0.6软件处理分析。
2 结果与分析
2.1 单因素实验
2.1.1 硫酸浓度对鱼精蛋白得率的影响 硫酸浓度对鱼精蛋白得率的影响见图1。较低硫酸浓度范围内,鱼精蛋白提取的不完全,得率受硫酸浓度影响较大,随其上升迅速提高;当浓度达到0.6 mol/L,蛋白的提取接近饱和,得率增加的幅度变得平缓;浓度增大到0.8 mol/L的峰值后只会随浓度增大而降低,此时高浓度的硫酸会破坏蛋白结构,降低鱼精蛋白含量导致得率下降。故而最优硫酸浓度值为0.8 mol/L。
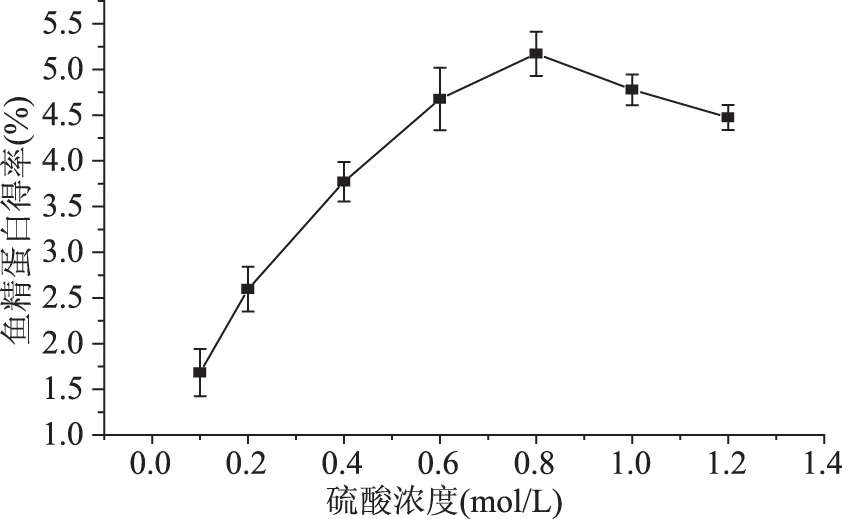
图1 硫酸浓度对鱼精蛋白得率的影响Fig.1 Effect of H2SO4 concentration on the yield of protamine
2.1.2 液料比对鱼精蛋白得率的影响 液料比对鱼精蛋白得率的影响如图2。液料比由2∶1 mL/g增大到8∶1 mL/g,鱼精蛋白得率呈先升高后降低变化趋势,在6∶1 mL/g时得率达到最佳值9.24%,是2∶1 mL/g时平均得率的2.56倍,增长速度接近1 mL/g提高1.41%,得率提升显著,6∶1 mL/g增到8∶1 mL/g,得率仅降低0.65%,减小趋势较缓。硫酸溶液用量过小,鱼精蛋白溶解不完全,用量过大,操作精细度降低,提取步骤转换容器时的蛋白损失增大,不利于蛋白得率的提高。故使得蛋白得率最大化的最佳液料比为6∶1 mL/g。
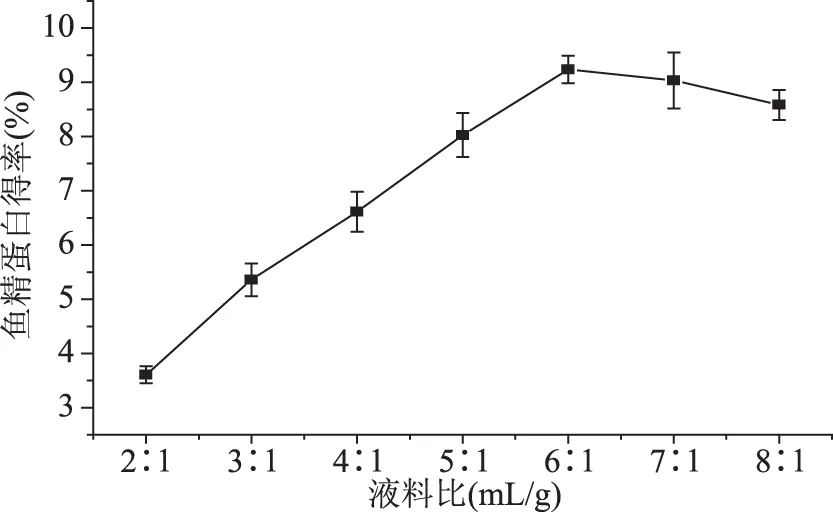
图2 液料比对鱼精蛋白得率的影响Fig.2 Effect of liquid to material ratio on the yield of protamine
2.1.3 提取时间对鱼精蛋白得率的影响 提取时间对鱼精蛋白得率的影响见图3。提取时间在0.5 h内,鱼精蛋白与周围组织中的油脂、不溶性杂蛋白等物质缓慢分离并不断溶解于稀酸溶液,此时提取还不充分,因此得率随时间延长而有增加趋势。稀硫酸既可以增大碱性鱼精蛋白溶解度,另一方面酸度也影响蛋白稳定性[22],会造成蛋白得率损失。随着蛋白的不断溶解与酸液接触面增大,并且水浴会导致继续散失水分,溶液中的硫酸浓度增大,鱼精蛋白的损失会逐渐增多,综合来看0.5 h时鱼精蛋白溶解量与损失量差值达到最大化,得率较高,提取较为充分。整体而言,酸提时间对蛋白得率的影响较弱,变化不大,提取时间为0.5 h为最佳。
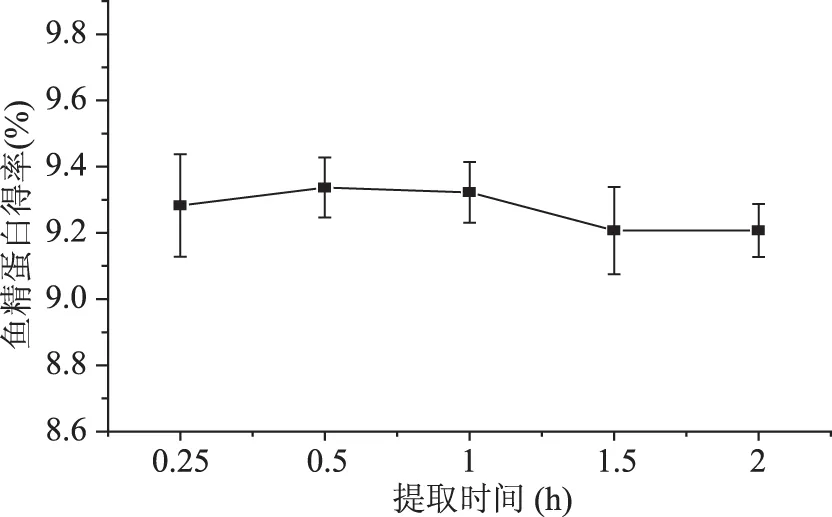
图3 提取时间对鱼精蛋白得率的影响Fig.3 Effect of extraction time on the yield of protamine
2.1.4 提取温度对鱼精蛋白得率的影响 提取温度对鱼精蛋白得率的影响见图4。水浴温度对蛋白得率产生一定影响。温度过高、过低都会降低鱼精蛋白的提取得率。适当提高温度会促进蛋白分子伸展,增大蛋白与水的相互融合,提高溶解效率,但过高后蛋白分子内部非极性疏水基团暴露,可降低蛋白溶解性[23]。鱼精蛋白在35 ℃时得率最高,为9.44%,提取温度从0 ℃升至35 ℃期间鱼精蛋白得率增长较缓慢,达到35 ℃后随温度升高得率急剧下降,65 ℃即降至8.47%。并且温度在65 ℃以下得到的蛋白均为正常白色,大于65 ℃得到的蛋白开始偏黄色,且水溶性不好[24]。综合考虑,提取最佳温度为35 ℃。
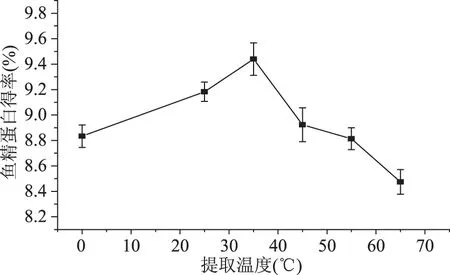
图4 提取温度对鱼精蛋白得率的影响Fig.4 Effect of extraction temperature on the yield of protamine
2.1.5 提取次数对鱼精蛋白得率的影响 提取次数对鱼精蛋白得率的影响见图5。
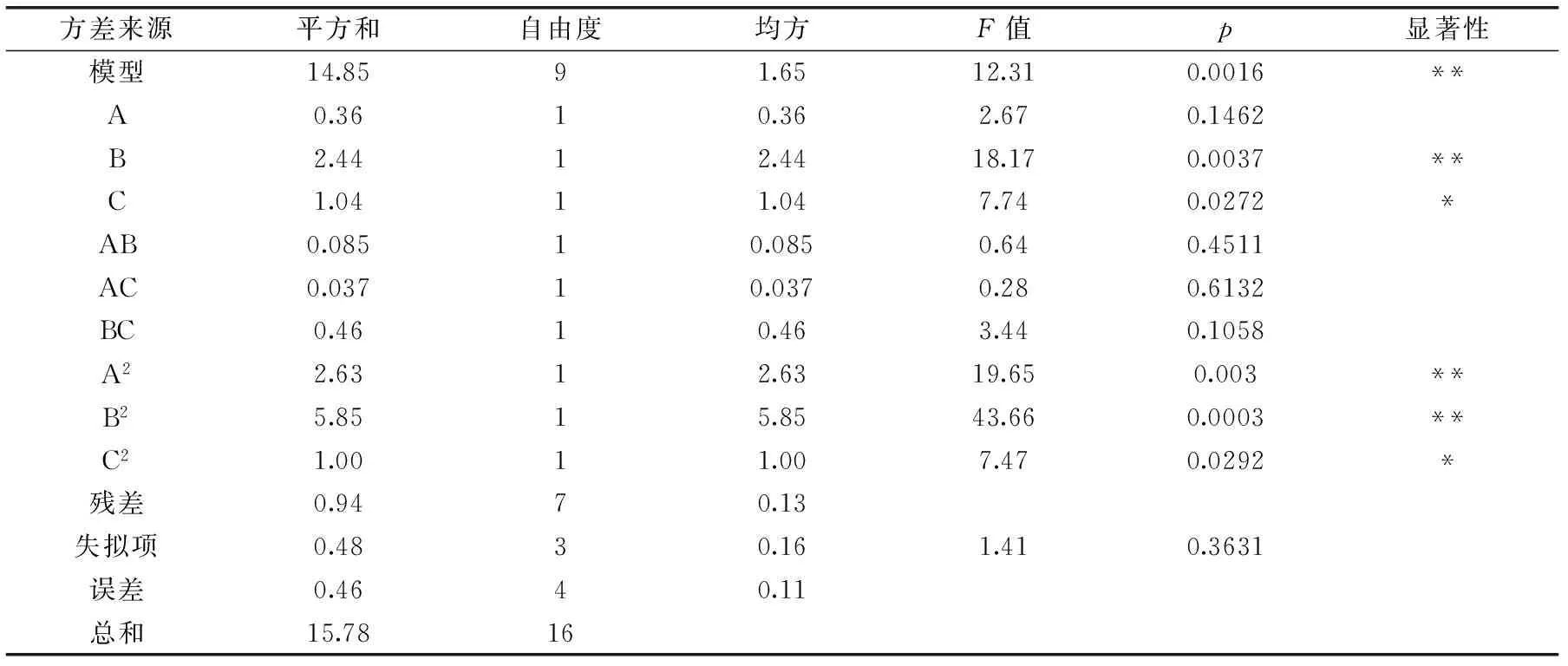
表3 回归模型的方差分析Table 3 ANOVA analysis of regression model
注:**表示差异极显著(p<0.01);*表示差异显著(p<0.05)。
提取4次以内,蛋白得率随重复次数增加显著上升,在第4次鱼精蛋白得率达到最高值11.12%,提取4次以上蛋白得率出现小幅度损失而降至10.4%左右。残渣中可提鱼精蛋白在第4次基本被提取完全,继续重复提取只会增加操作过程中的损失,降低鱼精蛋白得率。因此,提取次数最佳为4次。
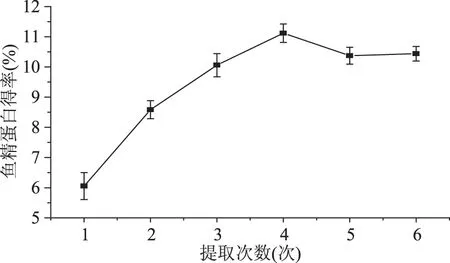
图5 提取次数对鱼精蛋白得率的影响Fig.5 Effect of extraction times on yield of protamine
2.2 响应面实验
响应面实验结果如表2所示。
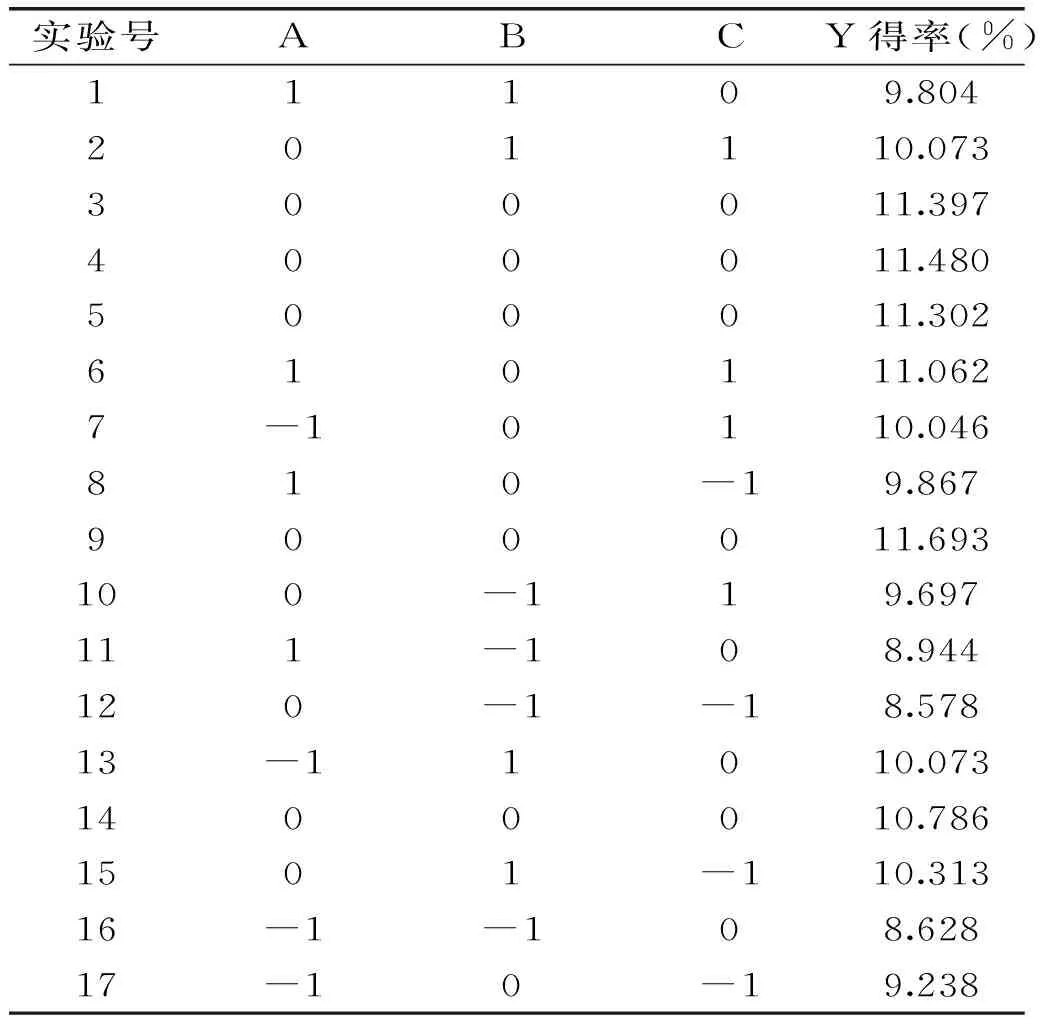
表2 响应面设计方案及结果Table 2 Experimental design and results of response surface methodology
软件得到的鱼精蛋白得率(Y)关于硫酸浓度(A)、液料比(B)和提取次数(C)的模型回归方程为:
Y=-67.2673+35.13582A+16.64113B+5.91139C-0.73038AB+0.48406AC-0.33975BC-19.7701A2-1.17884B2-0.48751C2
2.2.1 预测模型的显著性检验 为了检验方程的有效性,对上述预测模型进行方差分析,结果如表3所示。
由表3分析结果模型p为0.0016<0.01,可知鱼精蛋白得率的回归方程模型极显著,并且模型R2=0.9406,与实际拟合度>90%,模型预测值能较好反映实际值。失拟项的p为0.3631>0.05,失拟不显著,该模型具有统计学意义,回归方程可以比较准确的预测出鱼精蛋白的最优提取工艺条件,且预测值能够较好地与实际值吻合。
液料比(B)p=0.0037<0.01,达到极显著水平;提取次数(C)的p=0.0272<0.05,属于差异显著项;硫酸浓度(A)p=0.1462,对响应值没有显著性影响。此外,硫酸浓度平方项(A2)和液料比平方项(B2)均为对得率影响极显著,提取次数平方项(C2)的影响稍小,但也是显著影响因子。结合表3中F值大小,各因素影响鱼精蛋白得率的主次顺序是液料比>提取次数>硫酸浓度。
2.2.2响应面曲面分析 图6~图8是根据二次多项回归模型作出的各因素交互项的响应面图。
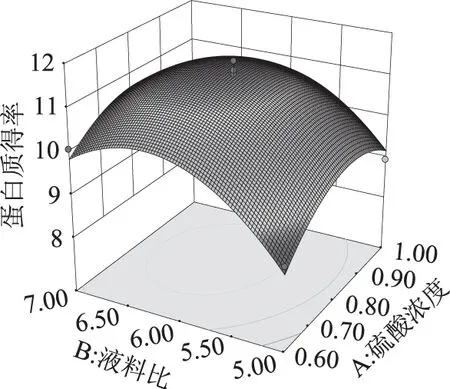
图6 液料比和硫酸浓度对鱼精蛋白得率的影响Fig.6 Effects of the liquid to material ratio on the extraction rate of protamine
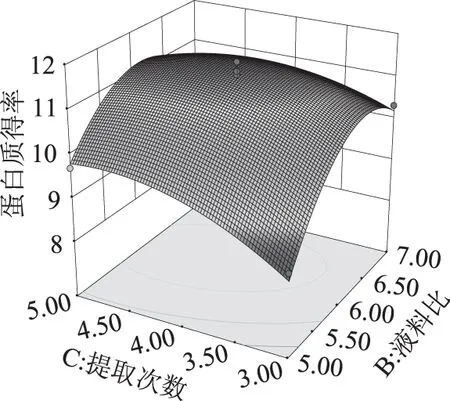
图7 液料比和提取次数对鱼精蛋白得率的影响Fig.7 Effects of liquid to material ratio and extraction times on the extraction rate of protamine
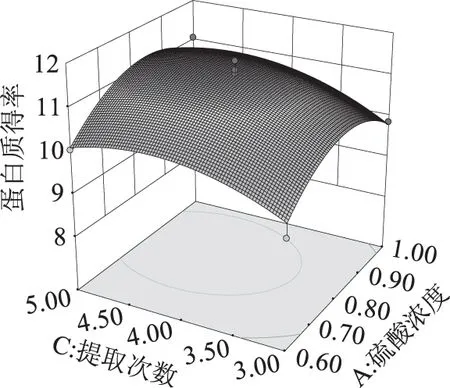
图8 硫酸浓度和提取次数对鱼精蛋白得率的影响Fig.8 Effects of the concentration of H2SO4and extraction times on the extraction rate of protamine
图6曲面模型中,固定提取次数4次时,硫酸浓度和液料比的改变都使得响应值呈倒U型变化趋势。液料比的改变引起的响应面坡度改变比较大,尤其小于6 mL/g时坡度较陡峭,而硫酸浓度的变化所引起的响应面坡度变化相对平缓,表明液料比对蛋白得率的影响大于硫酸浓度。由图7可知,当硫酸浓度(0.8 mol/L)不变时,重复提取次数越多,蛋白得率先是以较快的速度增大,在4次时达到峰值,随后再多次提取得率不再增加。液料比改变的曲面坡度比提取次数大,表明液料比对蛋白得率的影响大于提取次数。图8中,液料比固定6 mL/g时,硫酸浓度和提取次数的改变均引起模型曲面坡度的平缓变化,坡度差异不明显,两者对得率的影响相差不大。根据表3中BC、AB、AC的p值均在0.1以上,说明两两因素之间交互作用不显著。
2.2.3 鱼精蛋白最优提取工艺确定及验证 通过软件处理得到的最优条件是:硫酸浓度0.83 mol/L,液料比6.18∶1 mL/g,提取次数4.32次,此条件下蛋白得率理论值达到11.45%。结合实际调整最优提取工艺,确定为硫酸浓度0.83 mol/L,液料比6.2∶1 mL/g,提取次数4次。按照此工艺条件进行提取验证实验,平行3次,结果实际最优工艺条件下鱼精蛋白得率平均值为11.28%,与理论值11.4532%接近,相对误差为1.55%,证明回归模型比较稳定。
本实验鱼精蛋白得率经优化后远高于刘红玉[7]的大马哈鱼精蛋白得率(7.38%)。原因与多方面因素有关,提取物种来源、提取温度、提取时间、提取次数等不同都会影响蛋白得率的高低。本实验中鲟鱼-甲骨板本身脂质等杂质较少,精蛋白含量高,更容易被提取,且液料比对鱼精蛋白得率影响最显著,本实验采用6.2∶1 mL/g的液料比,高于刘红玉的3.5 mL/g,同时本实验提取次数更多,提取更充分,提取温度较0 ℃更高,加快了鱼精蛋白的溶解过程,因此得率较高。
2.3 鱼精蛋白鉴定
鱼精蛋白主要含有大量精氨酸,坂口反应是精氨酸的特征鉴定反应,实验提取到的鱼精蛋白坂口反应显明显红色,精氨酸含量丰富。粗提产物蛋白经考马斯亮蓝染色比色法测定,蛋白纯度达到86.13%,蛋白含量较高。
进一步的电泳结果见图9,15%的分离胶和4%浓缩胶浓度对产物蛋白电泳效果较好,三条a和两条b泳道样品上样量不同不影响定性分析,可视为平行组。提取蛋白的电泳条带均集中在小分子量区域,约为10 ku,是理想的小分子鱼精蛋白产物。胡晓璐[24]从柔鱼中分离纯化得到的精蛋白分子量为11.0和13.5 ku,上官新晨[8]从鲤鱼中得到的精蛋白分子量为15.3 ku,均与本实验结果相接近,说明提取蛋白分子组成与文献鱼精蛋白差异较小。此外杂蛋白通常分子量较大,往往产生多个条带,而结果显示蛋白条带较为单一,说明杂质蛋白存在极少。
综上,上述工艺粗提产物中鱼精蛋白得率较高、纯度较好。
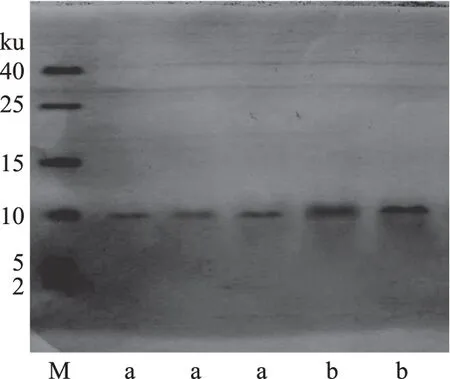
图9 鲟鱼鱼精蛋白的SDS-PAGE电泳图Fig.9 SDS-PAGE electrophoretogram of sturgeon protamine
2.4 鱼精蛋白抑菌实验
图10(a)为在无菌水中浸泡沥干的滤纸片印在金黄色葡萄球菌涂布平板的效果图,作为空白对照,图10(b)为0.1 g/mL鱼精蛋白溶液中浸泡沥干的滤纸片印在金黄色葡萄球菌涂布平板的效果图,作为实验组。对照组滤纸片周围没有抑菌圈出现,而实验组靠近滤纸片处没有菌落生长,远离滤纸片区域菌落生长正常,有明显的抑菌圈,平均直径达15.75 mm。鱼精蛋白由于分子量小渗透到菌体内部与脱氢酶等重要代谢酶结合,阻碍代谢而最终导致菌类自溶死亡,因而具有天然抗菌性[8]。王陆玲[25]使用本实验百分之一浓度(1‰)的鱼精蛋白即得到10 mm抑菌圈,刘燕妮[11]使用0.01 g/mL的鲑鱼精蛋白得到9.5 mm抑菌圈。根据上官新晨[8]、胡晓璐[23]的研究,鱼精蛋白抑菌性受pH、金属离子浓度、酶等影响较大,本实验所提取鱼精蛋白抑菌性能稍弱于王陆玲的实验性结果,类似于刘燕妮的实验性结果,均与这些因素的差异有紧密关系。总体上,所提取的鱼精蛋白抑菌活性良好。
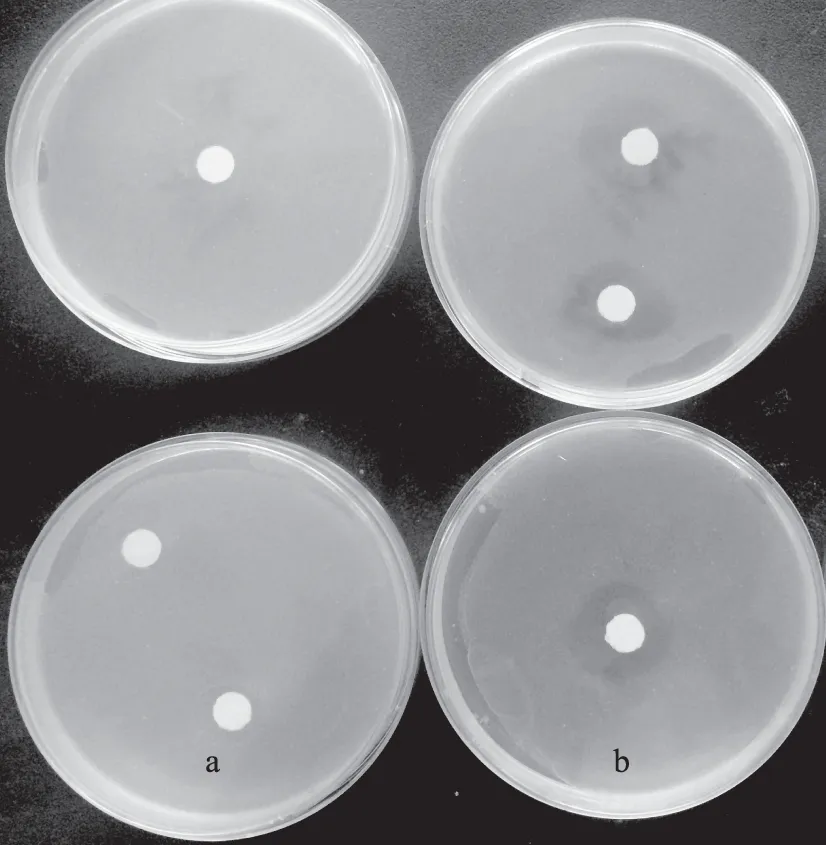
图10 鲟鱼鱼精蛋白抑菌实验Fig.10 Antibacterial experiment of sturgeon protamine
3 结论
在单因素实验基础上用响应面回归模型优化鲟鱼鱼精蛋白提取,得到最佳工艺条件为:硫酸浓度0.83 mol/L,液料比6.2∶1 mL/g,35 ℃水浴提取4次,每次0.5 h,鱼精蛋白实际得率最佳可达11.28%。影响鱼精蛋白得率的因素中按照影响大小排序依次为:液料比>提取次数>硫酸浓度。
粗提产物坂口反应明显,鱼精蛋白含量较高,达到86.13%。SDS-PAGE电泳条带单一,无明显杂质条带,最优工艺下从鲟鱼提取精蛋白不仅得率高,纯度也较高。同时,用金黄色葡萄球菌测试的结果表明,鲟鱼精蛋白抑菌圈明显,0.1 g/mL浓度抑菌圈直径达15.75 mm,抑菌活性良好。本研究为活性鱼精蛋白高效制备提供了良好来源和工艺途径。
[1]王海明,何良强.鱼精核蛋白的营养保健功效及产业应用[J].浙江省医学科学院学报,2000(3):37-38.
[2]Courtens J L,Kistler W S,Plöen L. Ultrastructural immunolocalisation of histones(H2B,H3,H4),transition protein(TP1)and protamine in rabbit spermatids and spermatozoa nuclei. Relation to condensation of the chromatin[J]. Reproduction Nutrition Development,1995,35(5):569-582.
[3]Uyttendaele M,Debevere J. Evaluation of the antimicrobial activity of protamine[J].Food Microbiology,1994,11(5):417-427.
[4]纵伟,刘艳芳.鱼精蛋白的特性及开发利用[J].北京水产,2007(5):12-13.
[5]徐明生,陈锦屏,上官新晨.鲤鱼抗菌精蛋白的分离纯化及鉴定[J].食品工业科技,2001,10(25):51-54.
[6]谢小保,王春华,曾海燕,等.鲤鱼鱼精蛋白的提取及抗菌活性研究[J].生物加工过程,2006,4(3):62-66.
[7]刘红玉,姜学芬,崔洪斌.大马哈鱼鱼精蛋白的提取及抑菌作用的研究[J].食品科学,2007,28(2):37-39.
[8]上官新晨.鲤鱼抗菌精蛋白的提取、分离、抗菌特性研究及抗菌机理探讨[D].西安:陕西师范大学,2004.
[9]Ando T,Watanabe S. A new method for fractionation of protamines and the amino acid sequences of salmine and three components of iridine[J]. International Journal of Protein Research,1969,1(3):221-224.
[10]Mckay D J,Renaux B S,Dixon G H. Rainbow trout protamines[J]. European Journal of Biochemistry,1986,158(2):361-366.
[11]刘燕妮.鱼精蛋白的制备、纯化及其絮凝和抑菌活性研究[D].青岛:中国海洋大学,2015.
[12]黄占旺,上官新晨,沈勇根,等.鲤鱼鱼精蛋白的提取与抗菌稳定性研究[J].农业工程学报,2005,21(2):165-168.
[13]郝淑贤,石红,李来好,等.鲟鱼肉营养成分分析及其应用技术[J].食品科学,2008,29(9):318-320.
[14]任华,蓝泽桥,孙宏懋,等.鲟鱼营养价值及其精深加工产品市场[J].江西水产科技,2015(1):36-39.
[15]赵亚华.生物化学实验技术教程[M].广州:华南理工大学出版社,2000:40-42.
[16]Ren Weixin,Chen Huabing. Finite element model updating in structural dynamics by using the response surface method[J]. Engineering Structures,2010,32(8):2455-2465.
[17]杨玉英,王伟,张玉,等.基于响应面法的蚕蛹蛋白降血脂肽的酶解条件优化[J].食品工业科技,2014,35(16):175-179.
[18]Cescut J,Severac E,Molina Jouve C,et al. Optimizing pressurized liquid extraction of microbial lipids using the response surface method[J]. Journal of Chromatography A,2011,1218(3):373-379.
[19]陆森如,尚灏,谢玉珊.坂口试剂法定量测定生化药物中精氨酸[J].中国生化药物杂志,1991(3):61-66.
[20]冯明珠,何聪芬,赵华,等.燕麦麸蛋白质的Osboren分类及SDS-PAGE电泳分析[J].食品工业科技,2007(1):77-79.
[21]张春晖,李侠,李银,等.低温高湿变温解冻提高羊肉的品质[J].农业工程学报,2013,29(6):267-273.
[22]赵正涛,李全阳,王秀菊,等.不同酸度条件下牛乳乳清蛋白的稳定性[J].食品与发酵工业,2009(8):156-159.
[23]吴晓红,刘经纬,郑月明,等.红松种子水溶性蛋白吸水性、吸油性及溶解性的研究[J].食品工业科技,2010,31(9):140-143.
[24]胡晓璐.柔鱼鱼精蛋白的提取纯化及抑菌特性研究[D].福州:福建农林大学,2012.
[25]王陆玲,金明晓,韩红梅,等.鱼精蛋白抑菌效果及在肠肉制品中的应用研究[J].食品科学,2007,28(12):215-217.
Optimization of extraction process of sturgeon sperm proteinby response surface methodology
RAO Dan-hua1,2,BAI Chan2,GENG Sheng-rong2,DENG Zi-hao2,XU Chen1,2,XIONG Guang-quan2,ZU Xiao-yan2,LI Hai-lan2,JI Fei3,WANG Bao-hua3,LI Xin2,LIAO Tao2,*
(1.College of Chemistry and Environmental Engineering,Wuhan Institute of Technology,Wuhan 430073,China;2.Institute of Agro-Products Processing and Nuclear-Agricultural Technology,Hubei Academy of Agricultural Sciences,Hubei Engineering Research Center for Farm Products Irradiation,Wuhan 430064,China;3.Wuhan Xunlong Biological Technology Co.,Ltd.,Wuhan 430015,China)
The extraction and separation of protamine from sturgeon by H2SO4was studied and the optimal extraction process was set up. Taking the protein yield as the main indicator,the optimal separating conditions were initial determined on the basis of single factor tests on the influence of the concentration and amount of H2SO4,extraction temperature,extraction duration and extraction times. The best extraction conditions were finally confirmed with the Box-Behnken design in Design-Expert software:the concentration of H2SO4was 0.83 mol/L while the amount was 6.2∶1 times volume,the extraction temperature was better at 35 ℃ and extracting 0.5 h for 4 times was recommended. It proved that the mean yield of protamine was 11.28% under the optimal extraction conditions. Moreover,the extracted protamine has been shown to have not only high purity of 86.13% and low molecular weight of 10 ku but also good antibacterial activity against staphylococcus aureus with the inhibition zone diameter of 15.75 mm.
protamine;response surface;extraction;sturgeon
2016-08-16
饶丹华(1990-),女,硕士研究生,主要从事水产品加工与安全方面的研究,E-mail:672629882@qq.com。
*通讯作者:廖涛(1979-),男,博士,副研究员,研究方向:水产品加工与安全研究,E-mail:17418431@qq.com。
湖北省农科院青年科学基金项目(2016NKYJJ28);湖北省重大科技创新计划项目(2015ABA038);湖北省农业科技创新中心项目(2016-620-000-001-036)。
TS254
B
:1002-0306(2017)04-0272-06
10.13386/j.issn1002-0306.2017.04.043
