传统发酵蔬菜中拮抗温和气单胞菌的乳酸菌的筛选与鉴定
2017-03-14马欢欢吕欣然孙梦桐白凤翎励建荣
林 洋,马欢欢,吕欣然,孙梦桐,白凤翎,*,励建荣
(1.渤海大学食品科学与工程学院,辽宁省食品安全重点实验室,生鲜农产品贮藏加工及安全控制技术国家地方联合工程研究中心,辽宁锦州 121013;2.北京林业大学生物科学与技术学院,北京 100083)
传统发酵蔬菜中拮抗温和气单胞菌的乳酸菌的筛选与鉴定
林 洋1,马欢欢1,吕欣然2,孙梦桐1,白凤翎1,*,励建荣1
(1.渤海大学食品科学与工程学院,辽宁省食品安全重点实验室,生鲜农产品贮藏加工及安全控制技术国家地方联合工程研究中心,辽宁锦州 121013;2.北京林业大学生物科学与技术学院,北京 100083)
目的:从传统发酵蔬菜中筛选对温和气单胞菌具有拮抗作用的乳酸菌。方法:采用双层琼脂扩散法筛选,通过生理生化反应和16S rRNA序列分析进行鉴定,研究蛋白酶、pH和温度等因素对乳酸菌无细胞上清液(CFS)抑菌活性的影响,采用扫描电镜分析乳酸菌无细胞上清液对温和气单胞菌细胞结构完整性的影响。结果:从腌渍酸黄瓜中筛选出对温和气单胞菌(106CFU/mL)具有较强抑制活性的菌株LZH2-5,经鉴定为植物乳杆菌(Lactobacillusplantarum)。LZH2-5无细胞上清液经胰蛋白酶、木瓜蛋白酶、中性蛋白酶、碱性蛋白酶和胃蛋白酶处理后其抑菌活性分别丧失29.38%、23.93%、22.30%、19.47%和14.59%;经40、60、80 ℃处理30 min后其拮抗活性基本不变,在100 ℃和121 ℃处理30 min后活性分别下降了16.66%和25.40%,在pH3.0~4.0范围内保持其抑菌活性,粗提物的最小抑菌浓度12.0 mg/mL。扫描电镜表明经LZH2-5 CFS处理使温和气单胞菌的细胞结构破坏并溶解。结论:从腌渍酸黄瓜中筛选的植物乳杆菌LZH2-5对温和气单胞菌具有较强抑制作用,初步分析抑菌活性物质为细菌素类,可作为水产品养殖过程中控制温和气单胞菌的拮抗制剂出发菌株。
传统发酵蔬菜,乳酸菌,拮抗,温和气单胞菌,筛选与鉴定
温和气单胞菌(Aeromonassobria)是一广泛存在于海水和淡水环境中的革兰氏阴性条件性致病菌,感染鱼虾等水产动物后释放溶血素、细胞毒素以及肠毒素等多种致病因子,可引起鲫鱼、鲈鱼、大菱鲆和虾蛄等水产动物类败血症[1-2],造成水产养殖业的巨大经济损失。温和气单胞菌也可通过水产食品感染人,使患者出现腹泻、急性肠胃炎等症状,严重时可导致死亡[3-4]。控制水产养殖过程中温和气单胞菌引起疾病[5]的有效方法是利用抗菌药物和中草药制剂,使用抗菌药物会使水体和水产动物体内形成药物残留,也会导致细菌的耐药性问题,而中草药制剂的成本较高。利用微生态制剂控制水产养殖中致病菌是一种绿色安全和高效的方法,目前主要应用光合细菌、芽孢杆菌和乳酸菌制剂取得良好的效果。徐姗楠等[6]从水体环境中分离的红假单胞菌对嗜水气单胞菌、温和气单胞菌、副溶血弧菌等29株水产养殖病原菌均有拮抗作用。罗璋等[7]研究表明应用1.68×105CFU/mL的枯草芽孢杆菌BHI 344对温和气单胞菌有较强的拮抗作用。
乳酸菌(LAB)主要来源于传统发酵食品、动物肠道、饲料、土壤淤泥等自然环境,主要通过营养物竞争、生态位竞争等方式以及产生乳酸菌素、罗伊菌素、有机酸、羟基脂肪酸等抑菌物质控制微生物的生长繁殖[8-10],作为微生态制剂具有高效、绿色、无残留等优势,广泛应用于水产养殖的疾病预防与控制[11]。庄国宏等[12]利用分离自健康人群肠道的嗜酸乳杆菌Sr-1和Sr-7对温和气单胞菌(107CFU/mL)具有显著的抑制效果,抑菌直径分别为16.20 mm和16.50 mm。苟小兰等[13]采用牛津杯法利用6株鱼源乳酸菌对温和气单胞菌、嗜水气单胞菌和豚鼠气单胞菌等进行抑制作用研究,结果表明菌株SCKJ 0027对温和气单胞菌抑制效果最强,抑菌直径达到25.30 mm。Mohamed等[14]利用分离自罗非鱼和鲤鱼肠道中的乳酸菌,对豚鼠气单胞菌和荧光假单胞菌均有抑制效果,其中对豚鼠气单胞菌最大抑菌直径达到30.00 mm。乳酸菌作为拮抗性细菌对气单胞菌属的细菌具有较强的抑制作用,本文从内蒙古、辽宁和安徽三地的传统发酵蔬菜中分离筛选对温和气单胞菌有拮抗作用的乳酸菌菌株,为控制水产养殖过程中温和气单胞菌污染提供了微生态制剂的菌源。
1 材料和方法
1.1 材料与仪器
传统农家发酵蔬菜 采自内蒙古宁城县腌渍酸辣椒、辽宁彰武县腌渍酸黄瓜、安徽绩溪县腌渍酸豆角和腌雪菜;温和气单胞菌LY-23(Aeromonassobria) 本实验室分离自大菱鲆鱼体;MRS琼脂,LB肉汤 北京奥博星生物技术有限公司;胰蛋白酶(250000 U/g)、木瓜蛋白酶(200000 U/g)、中性蛋白酶(200000 U/g)、碱性蛋白酶200000 U/g)、胃蛋白酶(15000 U/g) 华蓝化学有限公司;DNA Marker-D、Taq PCR Master mix、细菌基因组DNA快速抽提试剂盒 上海生工生物工程有限公司;乳酸菌生化鉴定管 杭州天和微生物试剂有限公司。
DL-CJ-2N型超级洁净工作台 北京市东联哈尔(北京)仪器制造有限公司;SPX-250智能生化培养箱 宁波海曙赛福实验仪器厂;IKA Vortex GENIUS 3振荡器 德国IKA公司;5804R冷冻高速离心机 德国Eppendorf公司;ABI stepone plus PCR仪 德国艾本德股份有限公司;DYY-8C电泳仪 北京市六一仪器厂;Cheimdox XRS凝胶成像仪 美国Bio-Rad公司;GI54DS立式高压蒸汽灭菌锅 致微(厦门)仪器有限公司;RE-2000A旋转蒸发器 上海亚荣生化仪器厂;Labconco Free Zone 2.5台式真空冷冻干燥机 美国LABCONCO公司;S-4800扫描电镜、E-1045镀金仪 日本日立公司。
1.2 实验方法
1.2.1 乳酸菌菌株分离 在无菌条件下,取传统发酵食品10.0 g置于90 mL灭菌生理盐水中,用振荡器充分振荡5 min后,用接种环挑取一环菌悬液在1% CaCO3的MRS培养基上划线接种,37 ℃培养48 h。挑取有溶钙圈的白色菌落进一步分离纯化,挑取单菌落进行革兰氏染色和过氧化氢酶实验。
1.2.2 抗温和气单胞菌性乳酸菌菌株筛选 挑取革兰氏阳性和过氧化氢酶阴性的菌株在MRS液体培养基进行活化,取24 h培养物经4 ℃ 6500 r/min离心5 min,用0.45 μm滤膜过滤获得其无细胞上清液(cell free supernatant,CFS);将温和气单胞菌置于LB肉汤中,在37 ℃下静置培养12 h,活化三代,稀释到106CFU/mL菌悬液作为指示菌。参照文献[15]采用双层琼脂扩散法对供试菌株温和气单胞菌进行拮抗性作用分析,筛选对温和气单胞菌具有拮抗活性的菌株。
1.2.3 拮抗性乳酸菌的鉴定
1.2.3.1 乳酸菌鉴定 参照以上方法,筛选得到拮抗效果较好的乳酸菌菌株。
1.2.3.2 生理生化鉴定 参照《乳酸细菌分类鉴定及实验方法》和《常见细菌系统鉴定手册》中的鉴定方法对筛选出的乳酸菌进行生理生化鉴定[16-17]。
1.2.3.3 16S rRNA鉴定 对筛选出的乳酸菌菌株对数期培养物用DNA快速抽提试剂盒提取菌株DNA。采取通用引物,正向引物为27f(5′-AGAGTTTGATCCTGGCTCAG-3′)反向引物为1492r(5′-TACGGYTACCTTTGTTACGACTT-3′)。PCR采用25 μL扩增反应体系:其中含DNA 2.0 ng/μL的模板1 μL,10 μmol/L的上下游引物各1 μL,Taq PCR Master mix 12.5 μL,用超纯水补足至25 μL。PCR扩增反应程序如下:94 ℃预变性2 min,94 ℃变性1 min,60 ℃退火1 min,72 ℃延伸90 s,循环次数为30次,72 ℃继续延伸10 min,4 ℃保温。PCR产物大小经用1.0%琼脂糖进行凝胶电泳检测,验证后送生工生物工程(上海)股份有限公司进行测序。将得到序列登录GenBank,BLAST进行同源性比对,MEGA5.0构建出系统发育进化树。
1.2.4 乳酸菌生长与抗温和气单胞菌活性曲线 取0.2 mL乳酸菌悬液接种于10 mL MRS液体培养基中,于37 ℃下恒温、静置培养,每隔4 h取菌株的菌悬液测定其pH,并于600 nm测定其OD值,参照1.2.5测定菌株CFS的抑菌活性。

表1 传统发酵蔬菜中乳酸菌对温和气单胞菌的抑制作用Table 1 Antagonistic effects of LAB from Chinese traditional fermented vegetables on A. sobria
注:同列标有不同字母表示显著差异(p<0.05)。
1.2.5 乳酸菌拮抗温和气单胞菌作用研究
1.2.5.1 酶敏感性实验 分别调至各酶适宜pH后,加入胃蛋白酶(pH2.0)、木瓜蛋白酶(pH7.0)、中性蛋白酶(pH7.0)、胰蛋白酶(pH7.5)和碱性蛋白酶(pH10.0),添加蛋白酶使其在乳酸菌CFS中的终浓度为1.0 mg/mL,37 ℃下水浴2 h,按照1.2.2测定抑菌活性,计算乳酸菌CFS的活性丧失率。
式中:φ(对照)为对照组乳酸菌CFS对温和气单胞菌的抑菌直径;φ(酶处理)为酶处理后乳酸菌CFS对温和气单胞菌的抑菌直径。
1.2.5.2 热稳定性实验 将菌株上清液分别在40、60、80、100、121 ℃条件下处理30 min,参照1.2.2测定抑菌活性。
1.2.5.3 pH实验 利用1.0 mol/L NaOH和1.0 mol/L HCl将菌株上清液的pH分别调为3.0、3.5、4.0和4.5按照1.2.2测定抑菌活性。
1.2.6 乳酸菌抑制温和气单胞菌MIC测定
1.2.6.1 有机溶剂萃取 采用乙酸乙酯萃取乳酸菌CFS。取100 mL乳酸菌CFS于分液漏斗中,乙酸乙酯100 mL分5次加入进行萃取,沿同一方向轻轻振荡后静置,待分层明显时收集乳化层,将5次萃取液合并。在45 ℃、120 r/min条件下,将乙酸乙酯萃取的细菌素粗提物真空旋转蒸发至无有机溶剂气味,残存液保存至无菌锥形瓶中。
1.2.6.2 MIC测定 参考文献[18]两倍微量稀释肉汤法并稍作修改进行测定。真空冷冻干燥制成粉末置于-18 ℃冰箱保存备用。用LB液体培养基将粗提物粉末稀释至终浓度为48.0、24.0、12.0、6.0、3.0 mg/mL。取5.0 mL为实验组,以不加粗提物的LB培养基为对照组,分别加入200 μL温和气单胞菌悬液(106CFU/mL),37 ℃恒温静置培养24 h,肉眼观察,无浑浊现象的最低浓度为粗提物的最小抑菌浓度[19],每组重复3次。
1.2.7 乳酸菌CFS作用温和气单胞菌细胞电镜分析 在含有106CFU/mL的菌悬液中加入0.5 MIC和1.0 MIC细菌素粗提物,以不加细菌素粗提物的为对照组,37 ℃静置培养12 h。6500 r/min,10 min离心收集菌体,在2.5%戊二醛溶液中4 ℃固定过夜,用0.1 mol/L(pH7.2)PBS洗涤2次洗去残留戊二醛,分别用40%、70%、90%、100%乙醇对菌体细胞进行脱水处理15 min,将菌体膜涂在盖玻片上,自然晾干,喷金,扫描电镜观察。
1.2.8 实验数据处理 利用软件Origin 8.0进行实验数据处理,数据平行3次,结果用平均值±标准偏差表示,采用SPSS 18.0软件对数据进行统计学分析。
2 结果与讨论
2.1 乳酸菌菌株分离
从传统发酵蔬菜中共分离获得36个菌落,其中革兰氏染色阳性,过氧化氢酶实验为阴性的菌株确定为乳酸菌。经初步鉴定得到23株乳酸菌,纯化后按照来源以及挑取顺序命名。
2.2 拮抗性乳酸菌的筛选
从传统农家发酵蔬菜中分离的23株乳酸菌中筛选出8株对温和气单胞菌具有拮抗作用的乳酸菌,结果见表1,从来自宁城腌渍酸辣椒、彰武酸黄瓜、绩溪酸豆角和腌雪菜中分离获得拮抗温和气单胞菌的乳酸菌菌株。其中,菌株LZH2-5拮抗效果最好,菌悬液和无细胞上清液的抑菌直径分别为19.34 mm和18.35 mm,因此,选取菌株LZH2-5进行后续实验。图1是菌株AJD1-1、LZH1-3和LZH2-5菌悬液和上清液对温和气单胞菌的抑菌效果图,可以看出菌悬液和上清液均具有显著的抑菌作用。
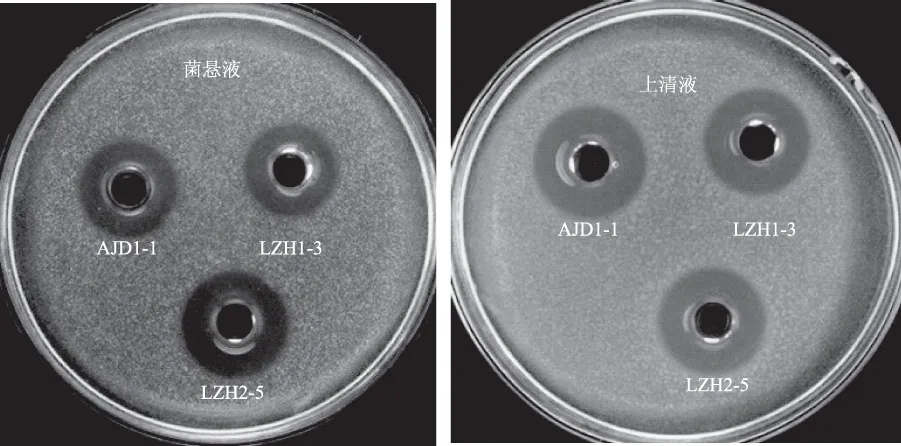
图1 分离菌株菌悬液和无细胞上清液对温和气单胞菌的抑菌效果Fig.1 Inhibitory effects of cell suspension and CFS produced by isolated strains on A. sobria
2.3 拮抗性乳酸菌的鉴定
菌株LZH2-5的生理生化鉴定结果见表2,依照文献[17]可初步判定菌株LZH2-5为乳杆菌属的Lb.plantarum。

表2 菌株LZH2-5的生理生化鉴定结果Table 2 Physiological and biochemical characteristics of strain LZH2-5
注:“+”表示阳性;“-”表示阴性。
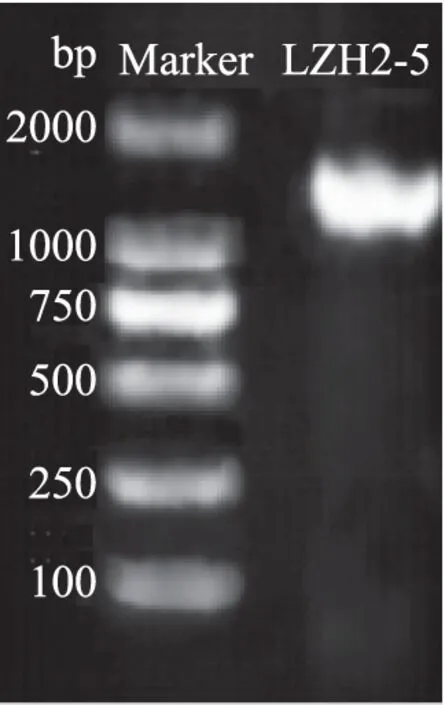
图2 菌株LZH2-5的16S rRNA基因扩增电泳图Fig.2 PCR amplification of 16S rRNA gene of strain LZH2-5

图3 菌株LZH2-5的16S rRNA系统发育树Fig.3 The phylogenetic tree for sequences of strain LZH2-5
图2是菌株LZH2-5的16S rRNA基因扩增电泳图,从图中可以看到特异性亮带出现在1450 bp处,表明目标片段已成功扩增。将扩增后产物送至生物工程公司进行测序,从而获得菌株LZH2-5的16S rRNA核苷酸序列,序列号为KX538921。测序菌株得到的结果与NCBI数据库进行BLAST比对,选取相似性较高的几个菌株的16S rRNA序列,利用MEGA 5.0构建系统发育树,结果见图3。由图3可知,菌株LZH2-5与KC416990.1(Lb.plantarum)在同一个分支上,置信度为99%,因此菌株LZH2-5被鉴定为植物乳杆菌(Lb.plantarum),该结果与生理生化鉴定结果相同。
2.4 乳酸菌生长与拮抗活性曲线
菌株LZH2-5 经37 ℃静置培养40 h的pH、生长曲线及对温和气单胞菌的抑菌活性的动态变化情况如图4所示,由图4可知,菌株LZH2-5对温和气单胞菌抑菌活性与细胞生长量两者之间呈现同步增长的趋势,但在稳定期呈平稳状态。随着抑菌活性与细胞生长量的增加,pH呈现迅速下降在16 h后逐步趋于平稳。LZH2-5对温和气单胞菌的最大抑菌活性为培养28 h的CFS,表明在稳定后期菌株LZH2-5产生了抑菌活性物质,因此菌株28 h发酵液的CFS可作为研究LZH2-5抑菌作用的最佳选择。

图4 菌株LZH2-5生长及拮抗活性曲线Fig.4 The growth and antagonisticactivity curve of strain LZH2-5
2.5 乳酸菌拮抗性能研究结果
2.5.1 酶处理的影响 菌株LZH2-5的CFS经胰蛋白酶、木瓜蛋白酶、中性蛋白酶、碱性蛋白酶和胃蛋白酶37 ℃处理2 h后对温和气单胞菌的抑菌结果见表3,从中可以看出,与对照组相比,经蛋白酶处理后对温和气单胞菌的抑菌活性均降低,对胰蛋白酶的敏感性最高,活性丧失率为29.38%,其次是木瓜蛋白酶,活性丧失率为23.93%,变化最小的为胃蛋白酶。经胃蛋白酶酶处理后,菌株LZH2-5的活性与对照组呈显著性差异。从酶处理的结果来看,可知LZH2-5的抑菌活性物质具有蛋白性质,可初步判定LZH2-5所产生的抑菌物质为细菌素类。
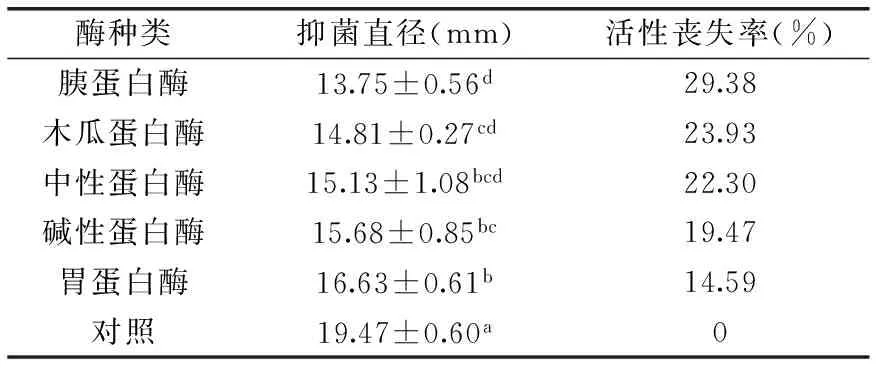
表3 酶处理对菌株LZH2-5抗温和气单胞菌活性的影响Table 3 Effects of enzyme treatment on the antagonistic activity of strain LZH2-5 against A. sobria
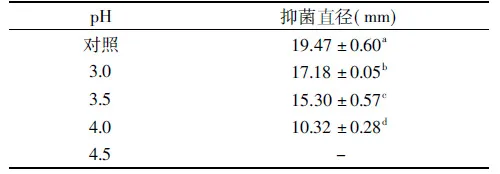
表4 pH处理对菌株LZH2-5 CFS抗温和气单胞菌活性的影响Table 4 Effects of pH on the antagonistic activity of CFS of LZH2-5 against A. sobria
2.5.2 热处理的影响 经过不同温度的热处理后,菌株LZH2-5的CFS抑菌活性变化结果如图5所示。由图5可以看出,菌株LZH2-5的代谢产物经40、60和80 ℃处理30 min后,抑菌活性基本保持不变,表明其代谢产物稳定性良好。这和Miao等[20]的研究结果一致。而经100 ℃、121 ℃处理30 min对温和气单胞菌的抑制活性分别下降了16.66%和25.40%。
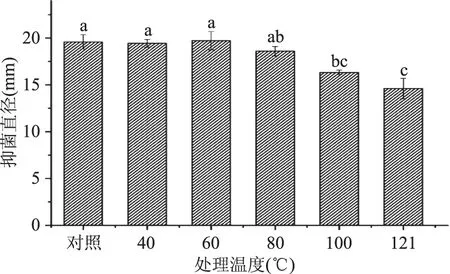
图5 热处理对菌株CFS抗温和气单胞菌活性的影响Fig.5 Effects of thermal treatment on the antagonistic activity of CFS against A. sobria
2.5.3 pH处理的影响 不同pH条件下菌株LZH2-5的CFS对温和气单胞菌的抑菌活性变化情况如表4所示,从表4中可看出,乳酸菌的抑菌活性随着pH的升高呈现逐渐降低趋势,其中,当pH3.0时,抑菌效果最好。表明菌株CFS中除含有乳酸等酸性代谢物质,还具有其他抑菌活性成分,且该抑菌成分在酸性条件下活性较好。LV等[21]研究从中国传统发酵食品中分离的Lb.coryniformisMXJ 32通过产生LactocinMXJ 32A拮抗多种食源性致病菌并且表现出良好的pH耐受性和热稳定性。
2.6 最小抑菌浓度(MIC)的测定结果
肉眼观察12.0 mg/mL及其以上浓度的试管无浑浊现象,确定12.0 mg/mL为粗提物对温和气单胞菌的MIC。该结果与张文青等[22]研究86种中草药对嗜水气单胞菌的最小抑菌浓度为12.5 mg/mL的结果相似。
2.7 菌体细胞扫描电镜
图6是扫描电镜观察到的经LZH2-5处理后温和气单胞菌细胞结构的变化,该图直观的反映出LZH2-5对菌体形态的影响。未经处理的温和气单胞菌(A)细胞完整,胞膜平滑,形态完整,边缘整齐清晰,两端圆润;加入0.5 MIC浓度的LZH2-5处理后(B),菌体细胞塌陷,细胞膜表面不平整失去了圆润的弧状形态。加入1.0MIC浓度的LZH2-5处理后(C),菌体变形出现孔洞并且开始溶胀,细胞壁已经严重变形破裂。说明LZH2-5能够破坏温和气单胞菌的细胞结构,结果与Lu等[23]研究一致。

图6 LZH2-5处理对温和气单胞菌细胞结构的影响Fig.6 Effects of LZH2-5 on the cells structure of A. sobria注A:未经处理的1.00 μm视野下的细胞形态;B:经0.5 MIC处理的1.00 μm视野下的细胞形态;C:经1.0 MIC处理的3.00 μm视野下的细胞形态。
3 结论
从辽宁彰武传统腌渍酸黄瓜中筛选出对温和气单胞菌具有较好拮抗效果的乳酸菌菌株LZH2-5,经生理生化和16S rRNA鉴定为植物乳杆菌(Lb.plantarum)。经37 ℃恒温静置培养28 h后的CFS抑菌活性最强,酸性环境可使抑菌活性增强,在pH4.0以下均能抑制温和气单胞菌生长,该菌的抑菌物质热稳定性好。菌株CFS经不同蛋白酶处理后抑菌活性均有下降,扫描电镜结果表明经LZH2-5CFS处理使温和气单胞菌细胞结构破坏并溶解,可初步推测抑菌活性物质为细菌素类。
[1]王海娟,王利.温和气单胞菌毒力基因的检测及其对鲫鱼致病性实验[J].动物医学进展,2015,36(3):17-20.
[2]陈言峰,冯伟强,张辉华,等.高体革鯻温和气单胞菌的分离鉴定及药敏实验[J].安徽农业科学,2015,43(3):133-135.
[3]Fujii Y,Nomura T,Okamoto K. Hemolysin ofAeromonassobria, stimulates production of cyclic AMP by cultured cells[J]. Federation of European Microbiological Societies Microbiology Letters,1999,176(1):67-72.
[4]Reda R M,Mahmoud R,Selim K M,et al. Effects of dietary acidifiers on growth,hematology,immune response and disease resistance of Nile tilapia,Oreochromisniloticus[J].Fish and Shellfish Immunology,2016,50:255-262.
[5]高桂生,史秋梅,张艳英,等.鲫鱼温和气单胞菌的中药药浴组方研究[J].水产养殖,2016,37(3):43-46.
[6]徐姗楠.光合细菌对水产养殖病害细菌的拮抗功能及机理研究[D].福州:福州大学,2004.
[7]罗璋,贾文平,白晓慧,等.枯草芽孢杆菌对三种水产动物病原菌体外拮抗作用的研究[J].中国饲料,2010(14):18-19.
[8]杜静芳,缪璐欢,马欢欢,等.拮抗阪崎肠杆菌乳酸菌的筛选鉴定及抑菌特性[J].食品科学,2016,37(11):125-130.
[9]Nouri M,Shahhosseini N,Shahhosseini S,et al. Investigation of antagonistic effects of isolated lactic acid bacteria from different cheeses of Gorgan city against main intestinal pathogenic bacteria.[J]. Journal of Food Processing and Technology,2015,8(6):1-4.
[10]白凤翎,励建荣.抗真菌性乳酸菌生物保护剂的研究进展[J].现代食品科技,2014(5):311-319.
[11]王蔚淼,张家学,齐振雄.乳酸菌类微生态制剂在饲料中的应用[J].饲料博览,2008(7):8-11.
[12]庄国宏.嗜酸乳杆菌细菌素高产菌株的诱变选育及其发酵工艺的初步研究[D].扬州:扬州大学,2007.
[13]苟小兰,苏艳秋,石锐,等.鱼源乳酸菌对水产病原菌的抑制作用研究[J].水产科学,2015,34(9):575-579.
[14]Mohamed T,El-Din N A E,Ammar A,et al. Antibacterial activity of lactic acid bacteria(LAB)against significant fish pathogens.[J].International Journal of Veterinary Science,2015,4(2):145-147.
[15]于娜,陈忠军.具有抑菌作用乳酸菌的筛选及其抑菌物质特性的研究[J].食品科技,2011,36(5):13-17.
[16]凌代文.乳酸细菌分类鉴定及实验方法[M].北京:中国轻工业出版社,1999:130-137.
[17]东秀珠,蔡妙英.常见细菌系统鉴定手册[M].北京:科学出版社,2001:289-294.
[18]乔支红,程永强,鲁战会,等.乳酸对三种食源性致病菌的抑菌及杀菌作用[J].食品科技,2008(10):187-191.
[19]高蕙文. 香兰素抑菌活性及在食品中的应用研究[D].南京:南京农业大学,2007.
[20]Miao J,Guo H,Ou Y,et al. Purification and characterization of bacteriocin F1,a novel bacteriocin produced byLactobacillusparacasei,subsp.tolerans,FX-6 from Tibetan kefir,a traditional fermented milk from Tibet,China[J]. Food Control,2014,42:48-53.
[21]Xin L,Yi L,Dang J,et al. Purification of novel bacteriocin produced byLactobacilluscoryniformis,MXJ 32 for inhibiting bacterial foodborne pathogens including antibiotic-resistant microorganisms[J]. Food Control,2014,46:264-271.
[22]张文青,龚一富,金思,等.中草药及其配伍对嗜水气单胞菌的抑菌作用[J].渔业科学进展,2012,33(1):114-121.
[23]Lu X,Hu P,Dang Y,et al. Purification and partial characterization of a novel bacteriocin produced byLactobacilluscaseiTN-2 isolated from fermented camel milk(Shubat)of Xinjiang Uygur Autonomous region,China[J]. Food Control,2014,43(5):276-283.
Screening and identification of lactic acid bacteria with antagonistic activity againstAeromonassobriafrom traditional fermented vegetables
LIN Yang1,MA Huan-huan1,LV Xin-ran2,SUN Meng-tong1,BAI Feng-ling1,*,LI Jian-rong1
(1.College of Food Science and Technology,Bohai University,Food Safety Key Lab of Liaoning Province,National & Local Joint Engineering Research Center of Storage,Processing and Safety Control Technology for Fresh Agricultural and Aquatic Products,Jinzhou 121013,China;2.College of Biology Science and Technology,Beijing Forest University,Beijing 100083,China)
Objective:To screen lactic acid bacteria(LAB)with strong antagonistic activity againstAeromonassobriafrom traditional fermented vegetables. Methods:Cell-free supernatants(CFS)from LAB with inhibitory activity againstA.sobriawas screened using the double agar diffusion methods. The strain was identified by biochemical tests and 16S rRNA sequence analysis. The antibacterial substance was analyzed using protease sensitivity test,acid test and heat-treated test. The integrity of cell structure was observed by scanning electron microscope. Results:Strain LZH2-5 with outstanding antagonistic activity againstA.sobria(106CFU/mL)was screened from pickled cucumbers,and it was identified asLactobacillusplantarum. The antagonistic activity of cell-free supernatants produced by strain LZH2-5 was lost 29.38%,23.93%,22.30%,19.47% and 14.59% by treating with trypsin,papain,neutral protease,alkaline protease and pepsin respectively. The antibacterial activity of CFS was stable after thermal treatment with 40,60,80 ℃ for 30 min,and decreased 16.66% and 25.40% after incubation at 100 ℃ and 121 ℃ for 30 min,respectively,and was effective within pH3.0~4.0. The MIC of inhibitory substance was 12.0 mg/mL. The scanning electron microscope images revealed that the integrity of cell ofA.sobriatreated with LZH2-5 CFS was damaged and dissolving. Conclusion:Lb.plantarumLZH2-5 with strong inhibitory activity againstA.sobriawas screened from pickled cucumbers. The antibacterial substance produced by strain LZH2-5 was preliminarily determined as bacteriocins. It can be used as the antagonism original strain for the controlA.sobriain aquaculture.
traditional fermented vegetables;lactic acid bacteria;antagonism;Aeromonassobria;screening and identification
2016-08-09
林洋(1994-),女,硕士研究生,研究方向:食品安全与质量控制,E-mail:linyang19940109@163.com。
*通讯作者:白凤翎(1964-),男,博士,教授,研究方向:食品安全与质量控制和食品微生物学,E-mail:baifling@163.com。
辽宁省科技厅攻关项目(2015103020)。
TS201.3
A
:1002-0306(2017)04-0231-06
10.13386/j.issn1002-0306.2017.04.035
