HSSPMEGCOMS联用法分析红枣发酵饮料易挥发性成分条件的优化
2017-03-14李树萍许曼筠李美萍张生万
李 凯,焦 娇,李树萍,许曼筠,张 婕,李美萍,张生万
(山西大学生命科学学院,山西太原 030006)

李 凯,焦 娇,李树萍,许曼筠,张 婕,李美萍,张生万*
(山西大学生命科学学院,山西太原 030006)
以红枣发酵饮料为研究对象,利用顶空固相微萃取和气相色谱-嗅闻-质谱联用法分析其易挥发性成分并对其进行了分析,对影响固相微萃取操作条件的萃取头、萃取温度、萃取时间、样品用量、平衡时间和解吸时间进行系统的优化,旨在建立一种分析红枣发酵饮料易挥发性成分的方法,并通过嗅闻检测结合气味活度值和香气强度值确定红枣发酵饮料的特征风味成分,采用草酸二乙酯做内标对特征风味成分进行了含量测定。结果表明:选用50/30 μm DVB/CAR/PDMS固相微萃取头、Rtx-WAX色谱柱、样品用量8.0 mL/20.0 mL样品瓶、加盐量3.00 g、萃取时间70 min、萃取温度70 ℃、平衡时间20 min、解吸时间3 min,分析红枣发酵饮料易挥发性成分,共检出114种组分,确定结构96种,占总易挥发性成分总量的98.86%;气味活度值及香气强度值分析结果表明:乙酸乙酯、戊酸乙酯、己酸乙酯、2-辛酮、2-十一酮、乙酸-2-苯乙酯、苯丙酸乙酯、6-甲基-5-庚烯-2-酮、苯甲醛和3-羟基-2-丁酮为红枣发酵饮料的特征风味成分。
顶空固相微萃取(HS-SPME),气相色谱-嗅闻-质谱(GC-O-MS),红枣发酵饮料,条件优化,易挥发性成分
红枣为鼠李科植物枣树的果实[1],属于药食同源性食物,营养丰富,药用价值高[2-4],人们对红枣的功效成分[5-9]、抗氧化[10]、抗肿瘤[11]和调节内分泌系统[12]等作用做了大量研究,并为增加其附加值、延伸其产业链开发了多种酒、水饮料。其中,以红枣为原料,经枣汁浸提、发酵后,科学调配而成的红枣发酵饮料酸甜可口,是一类独特健康的营养饮品[5]。风味是饮料产品主要的品质指标之一[13]。以红枣为原料发酵而成的饮料能保持红枣的特殊香气,特征风味的组成和含量变化一定程度上决定饮料的品质。
目前对红枣发酵饮料的研究集中在复配[14]、工艺[1,3,9]和生物活性[7,15-16]方面,许倩[14]等以花生、红枣和糯米为原料制得复合型发酵保健饮料;汪长钢[1]等对红枣醋饮料生产工艺过程进行了研究;靳玉红[7]等对红枣乳酸发酵饮料的抗氧化活性进行了研究。对红枣发酵饮料易挥发性成分的研究,仅有杨智[8]通过电子鼻对红枣乳酸发酵饮料的特征香气进行了分析,主要由苯类、氮氧化物、芳香胺类、烷烃、甲基类、硫化物、醇类、硫化氢类组成。但对红枣发酵饮料特征风味成分检测方法的研究鲜有报道。
本实验以红枣发酵饮料为研究对象,采用顶空固相微萃取气相色谱-嗅闻-质谱(Headspace Solid Phase Micro-Extraction and Gas Chromatography-Olfactometry-Mass Spectrometry,HS-SPME-GC-O-MS)联用法对其易挥发性成分及微萃取条件进行了系统的研究,并结合气味活度值(odor activity value,OAV)和香气强度值确定了该饮料特征风味成分及其对总体香味贡献程度,为红枣发酵饮料易挥发性成分的研究提供分析方法和检测手段,并为红枣发酵饮料的特征风味研究提供一定的理论依据。
1 材料与方法
1.1 材料与仪器
红枣发酵饮料 山西省万里红酒业有限公司提供;NaCl 分析纯,天津市光复科技发展有限公司;C7~C40正构烷烃 色谱纯,上海安谱科学仪器有限公司;内标溶液 称取0.0148 g草酸二乙酯,加入10 mL红枣发酵饮料,摇匀即为内标溶液。
50/30 μm DVB/CAR/PDMS、65 μm PDMS/DVB、75 μm CAR/PDMS、100 μm PDMS固相微萃取头及萃取手柄 美国Supelco公司;7890A-5975C气相色谱-质谱联用仪 美国Agilent公司;DF-101S集热式恒温加热磁力搅拌器 郑州长城科工贸易有限公司;ODP3嗅闻仪 德国Gestel公司。
1.2 实验方法
1.2.1 HS-SPME的分离富集方法 移取8.0 mL红枣发酵饮料置于20 mL顶空瓶中,加入3.00 g NaCl,用带有橡胶隔垫的瓶盖密封,置于集热式恒温加热磁力搅拌器中,在70 ℃下搅拌平衡20 min,然后将50/30 μm DVB/CAR/PDMS固相微萃取头插入顶空瓶中距液面1 cm处,萃取70 min,待GC-O-MS分析。
1.2.2 GC-O-MS分析条件 GC条件:进样口温度250 ℃;载气He,流速1.5 mL/min;Rtx-WAX色谱柱(30 m×0.25 mm,0.25 μm);解吸时间3 min;程序升温条件:初温35 ℃,保持6 min,10 ℃/min升至112 ℃,保持2 min,6 ℃/min升至160 ℃,10 ℃/min升至230 ℃,保持5 min。
MS条件:电子电离源(elector ionization,EI);电子电离能量70 eV;离子源温度230 ℃;四极杆温度150 ℃;质量扫描范围m/z 33~500;质谱库为NIST 05;扫描模式为全扫描。
嗅闻方法:ODP3嗅闻仪的传输线温度250 ℃,补充气为N2,接口温度为200 ℃。
1.2.3 定性与定量分析 按1.2.2中气相色谱-嗅闻-质谱联用分析条件,将按1.2.1 HS-SPME分离富集方法萃取后的萃取头插入GC进样口,解吸3 min,进行色谱扫描。
1.2.3.1 定性分析 按1.2.2分析条件对红枣发酵饮料进行测定。定性分析通过对质谱解析结果与标准质谱库(NIST 05)进行对照,并在相同色谱条件下,通过对C7~C40正构烷烃的色谱扫描,按文献方法[17]计算得到各化合物的RI值,并与相应文献值对照,同时,经评价员嗅闻[18]描述的化合物香味特征与文献报道结果对比,验证其定性结果。
1.2.3.2 定量分析 对色谱测定的各组分采用面积归一化法进行相对百分含量分析,并按1.2.2中GC-O-MS分析条件,另外准确移取8 mL样品,加入0.05 mL内标溶液,对红枣发酵饮料中的主体香气成分的含量采用内标法[19]进行定量分析。
1.2.4 香气成分的评价
1.2.4.1 气味活度值的计算 根据内标法对红枣发酵饮料主体香气成分进行的定量分析结果和各化合物在水中的嗅觉阈值,按下式计算OAV[20-21]:
OAV=C/OT
式中:C是根据内标法计算出的该化合物的质量浓度(μg/L);OT是该化合物在水中的嗅觉阈值(μg/L)。
1.2.4.2 香气强度测定方法 由3位评价员在嗅闻仪检测口记录得到香气成分的保留时间、香味特征和强度,强度分为0、1、2、3、4 五个等级,0表示无、1表示微弱、2表示中等、3表示较明显、4表示非常明显,并尽可能地对所感觉到的香味进行描述,与文献报道的化合物香气特征进行对比。
1.2.5 优化实验
1.2.5.1 单因素实验 以色谱分离所得峰个数和总峰面积为主要考察指标,确定实验所用萃取头(50/30 μm DVB/CAR/PDMS、65 μm PDMS/DVB、75 μm CAR/PDMS、100 μm PDMS)、样品用量(2.0、4.0、6.0、8.0、10.0 mL)、萃取温度(30、40、50、60、70 ℃)、萃取时间(40、50、60、70、80 min)、平衡时间(10、20、30、40、50 min)、解吸时间(2、3、4、5、6 min)条件。采用控制变量法,在其他因素条件如1.2.1中所述情况下,考察某一单因素对萃取效果的影响。
1.2.5.2 正交实验 设计如表1所示的四因素三水平的正交实验,最终确定HS-SPME-GC-O-MS分析红枣发酵饮料中易挥发性成分的萃取条件。
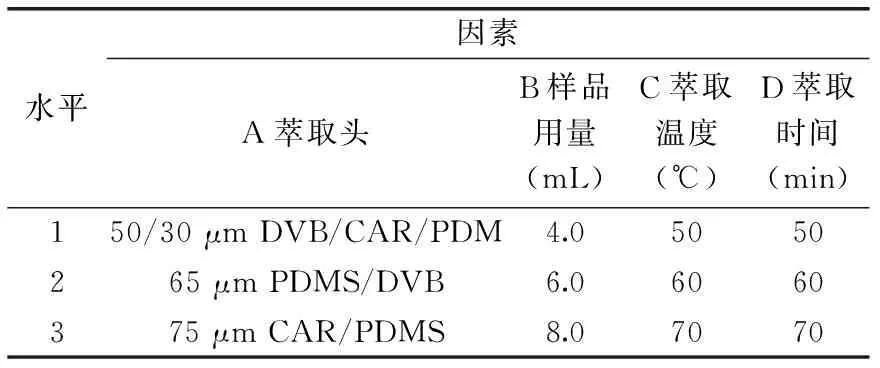
表1 正交实验因素水平表Table 1 The factors and levels of orthogonal experiments
1.3 数据分析
按1.2实验方法进行实验,对所得到的相应的总离子流色谱图进行解析,统计其峰个数和总峰面积,上述数据经Excel软件进行统计分析,同时结合香气强度值和气味活度值评价红枣发酵饮料特征风味成分。
2 结果与分析
2.1 顶空固相微萃取条件的选择
2.1.1 萃取头的选择 按1.2的实验方法,对不同固相微萃取头吸附红枣发酵饮料中易挥发性成分的能力进行测定,测定结果见图1。
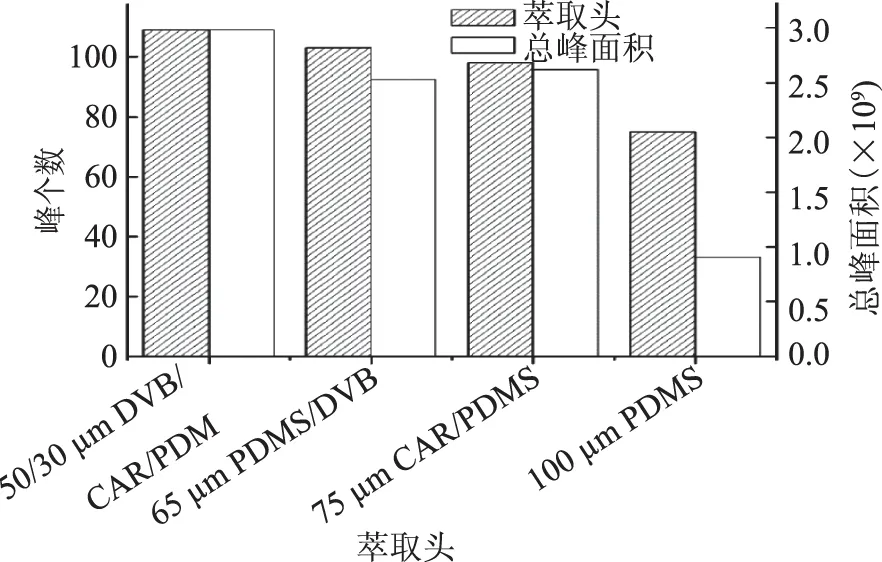
图1 不同萃取头对萃取效果的影响Fig.1 The effect of different SPME fiber types on the extraction
由图1可知,在其他萃取条件一致的前提下,不同萃取头对红枣发酵饮料中易挥发性成分的吸附能力存在较大差异。其中,50/30 μm DVB/CAR/PDMS萃取头吸附得到的易挥发性成分峰个数和总峰面积明显大于其他3种萃取头。故本实验选择该萃取头进行分离富集。
2.1.2 萃取温度的选择 按1.2的实验方法,在其它条件不变的情况下,考察萃取温度对萃取效果的影响。其结果见图2。
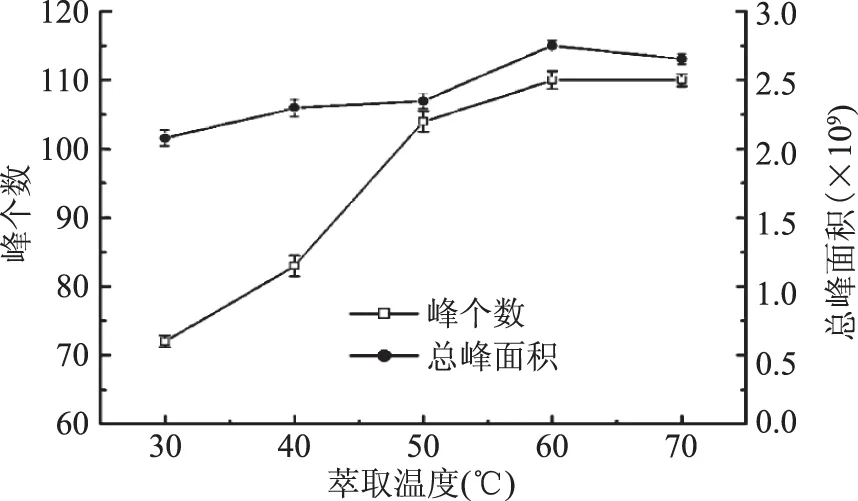
图2 不同萃取温度对萃取效果的影响Fig.2 The effect of different extraction temperature on the extraction effect
从图2中可以看出,随着萃取温度的升高,峰个数及总峰面积均呈上升趋势,直至60 ℃时峰个数及总峰面积达到最大,温度继续升高,峰个数无明显增加,总峰面积却略有下降。萃取温度对萃取头吸附挥发性物质的种类和含量影响较大。温度逐渐升高的过程中,有效峰个数明显增加。在60 ℃时达到最大值,且继续升高温度,峰个数没有明显增加。这是由于温度的增加能促进挥发性物质的扩散,缩短平衡时间,使一些低温下不易挥发的物质挥发出来。继续升高温度,达到萃取头的最大吸附量,萃取头上的挥发性物质达到平衡,故峰个数没有多大改变。峰面积略有所下降,可能是大分子不易挥发的物质吸附在萃取头上,小分子物质的量有所减少,呈现总峰面积下降的趋势。故萃取温度选60 ℃。
2.1.3 萃取时间的选择 按1.2的实验方法,在其它条件不变的情况下,考察萃取时间对萃取效果的影响。其结果见图3。
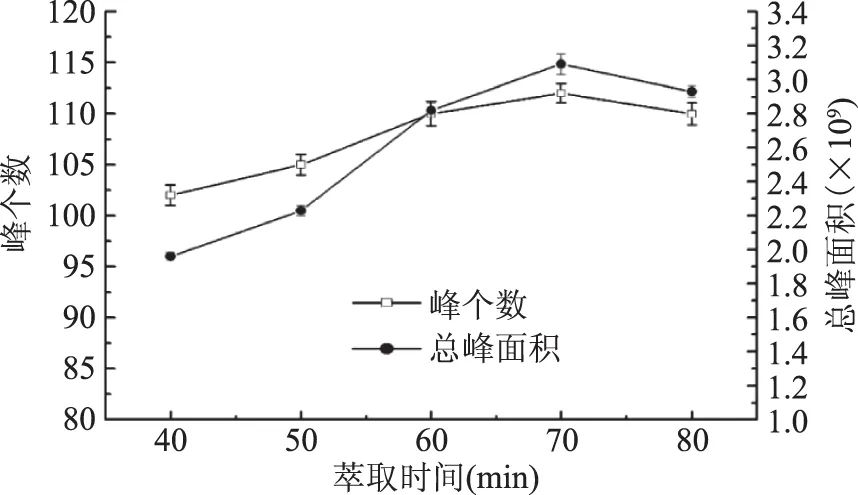
图3 不同萃取时间对萃取效果的影响Fig.3 The effect of different extraction time on the extraction effect
随着萃取时间的延长,峰个数及总峰面积均有所增加。萃取达到平衡的时间受很多因素的影响,如分配系数、扩散速度、萃取头膜厚度等[22]。在其他条件不变的前提下,固相微萃取纤维头在顶空瓶内达到吸附与解吸的动态平衡时有最大吸附量。随着萃取时间的延长,萃取头吸附的物质浓度增加,不易挥发的大分子物质的浓度也在增大,使得在萃取头上吸附的小分子物质有所减少,导致总峰面积有所下降。从图3可知,随着萃取时间的延长,峰个数及总峰面积均有所增加,萃取时间达到70 min时,峰个数及总峰面积最大,故选萃取时间为70 min。
2.1.4 样品用量的选择 按1.2的实验方法,在其它条件不变的情况下,考察样品用量对萃取效果的影响。其结果见图4。

图4 不同样品用量对萃取效果的影响Fig.4 The effect of different sample amount on the extraction effect
样品用量的多少会影响顶空瓶中气相和液相的体积比,影响香气物质在两相的分配比,影响HS-SPME的萃取结果[23]。从图4可知,样品用量少时,不易挥发的物质难以检测到,但样品用量太多时,色谱峰的分离度降低,峰数目降低,同时也不利于萃取操作,故样品用量选8.0 mL。
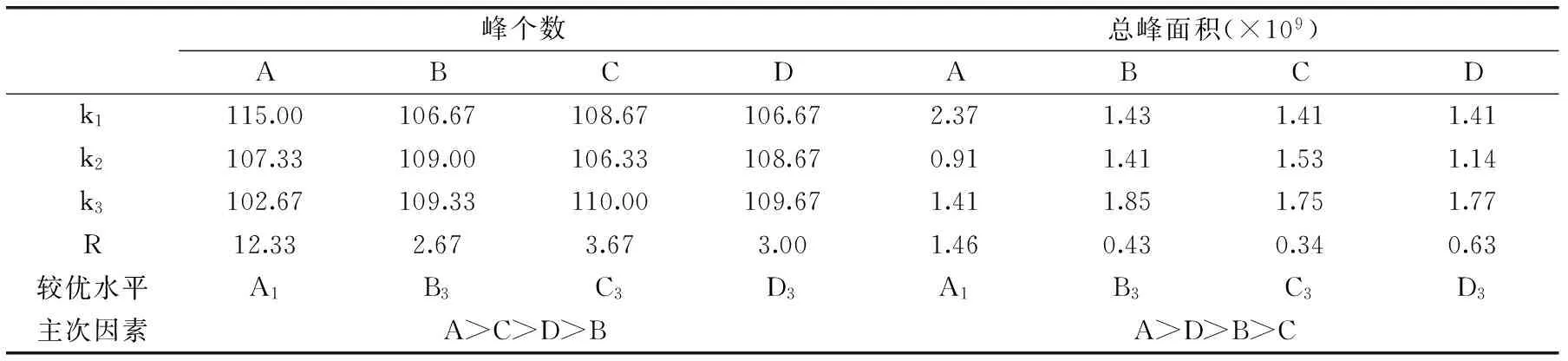
表3 正交实验对峰个数和总峰面积影响极差分析Table 3 Range analysis of peak number and total peak area
2.1.5 平衡时间的选择 按1.2的实验方法,在其它条件不变的情况下,考察平衡时间对萃取效果的影响。其结果见图5。
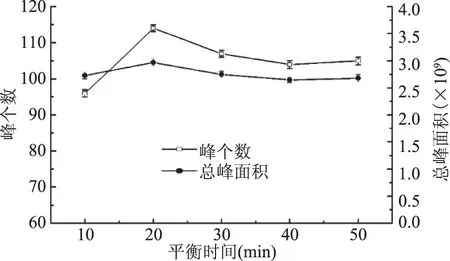
图5 不同平衡时间对萃取效果的影响Fig.5 The effect of different equilibrium time on the extraction effect
从图5可知,在该萃取条件下,平衡时间为20 min时,峰个数及总峰面积达到最大,表明样品中的挥发性物质被萃取头吸附已达到饱和,故平衡时间选为20 min。
2.1.6 解吸时间的选择 按1.2的实验方法,在其它条件不变的情况下,分别考察解吸时间对萃取效果的影响。其结果见图6。
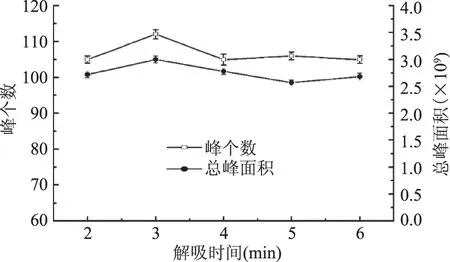
图6 不同解吸时间对萃取效果的影响Fig.6 The effect of different desorption time on the extraction effect
挥发性物质吸附到萃取头后,解吸的时间影响挥发性物质能否完全解吸下来,另一方面萃取头在GC进样口250 ℃停留的时间影响HS-SPME萃取头的使用寿命[23]。高温有利于挥发性物质解吸,但也可能会使萃取纤维头上的一些物质分解,故需选择合适的解吸时间。从图6可知,解吸时间为3 min时总峰个数达到最大,总峰面积也较大。故解吸时间选3 min。
2.1.7 正交实验 因解吸时间、平衡时间对萃取效果影响不太明显,萃取头种类、样品用量、萃取时间及萃取温度对萃取效果有较大影响,所以在单因素实验的基础上,设计了如表1所示的四因素三水平的正交实验。正交实验结果与分析见表2、表3。
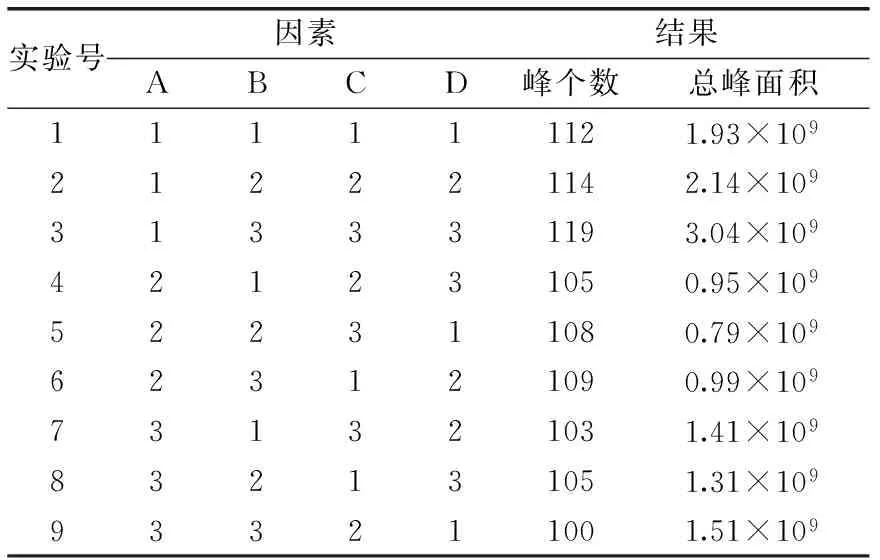
表2 正交实验设计及结果Table 2 The results of orthogonal experiments
由表3极差值可知,以检出峰个数为考察指标时,极差的大小顺序为A>C>D>B,即各因素对萃取效果影响的大小为:萃取头种类>萃取温度>萃取时间>样品用量,较优组合为A1B3C3D3。当考虑对挥发物吸附量的影响时,则选取总峰面积为考察指标,各因素对其影响的大小顺序为A>D>B>C,即各因素对萃取效果影响的大小为:萃取头种类>萃取时间>样品用量>萃取温度,较优组合为A1B3C3D3。经验证实验,最终确定最优组合为A1B3C3D3,即选用50/30 μm DVB/CAR/PDMS萃取头,取样品用量8.0 mL、萃取时间70 min,萃取温度70 ℃。最终确定的最优组合与正交表中第3组实验结果进行比较验证,最优组合得到120个色谱峰,总峰面积为3.04×109,最终确定最优组合效果更好。
2.2 红枣发酵饮料易挥发成分分析
对待测红枣发酵饮料,按实验方法进行测定,其总离子流色谱图如图7所示,解析结果见表4。
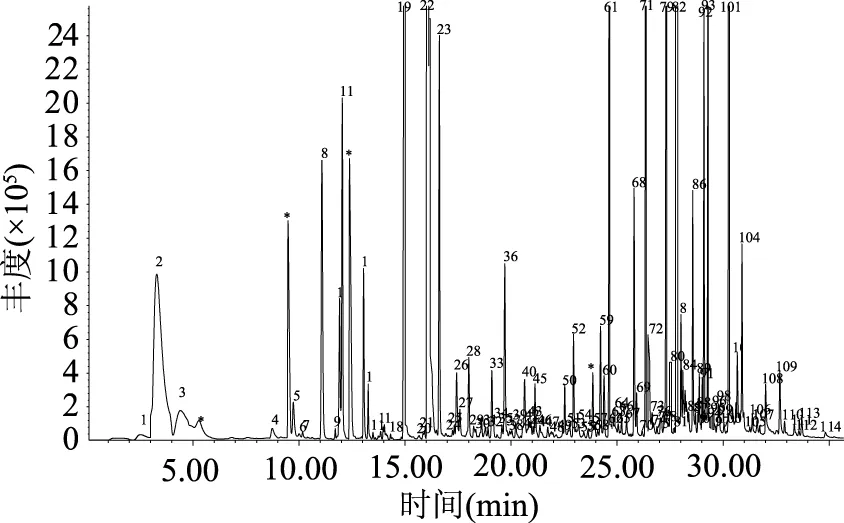
图7 红枣发酵饮料挥发性成分总离子流色谱图Fig.7 Total ion current chromatogram of Chinese jujube fermented beverages
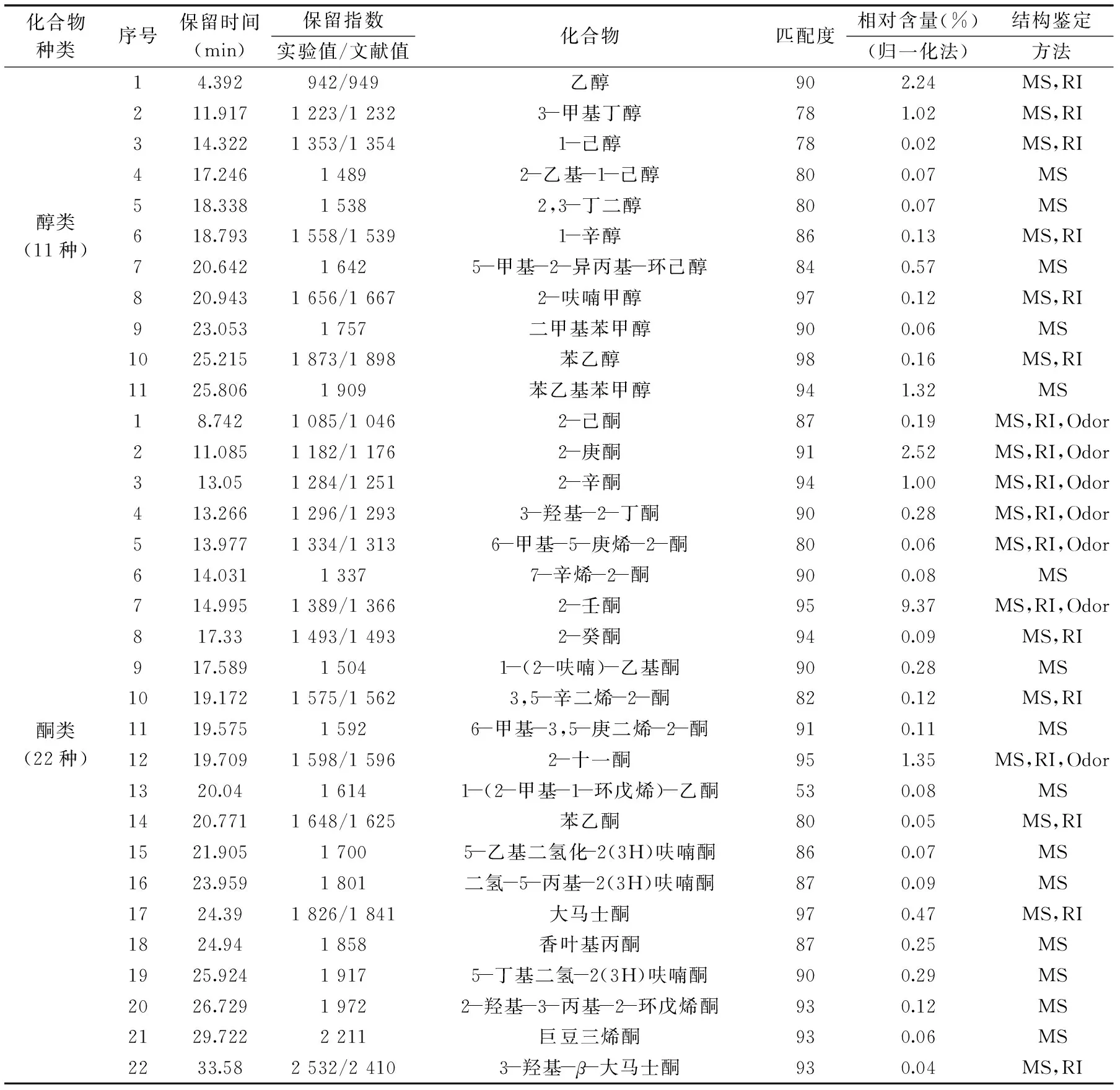
表4 HS-SPME-GC-MS分析红枣发酵饮料易挥发性成分结果Table 4 HS-SPME-GC-MS analysis of the results of volatile components of Chinese jujube fermented beverage
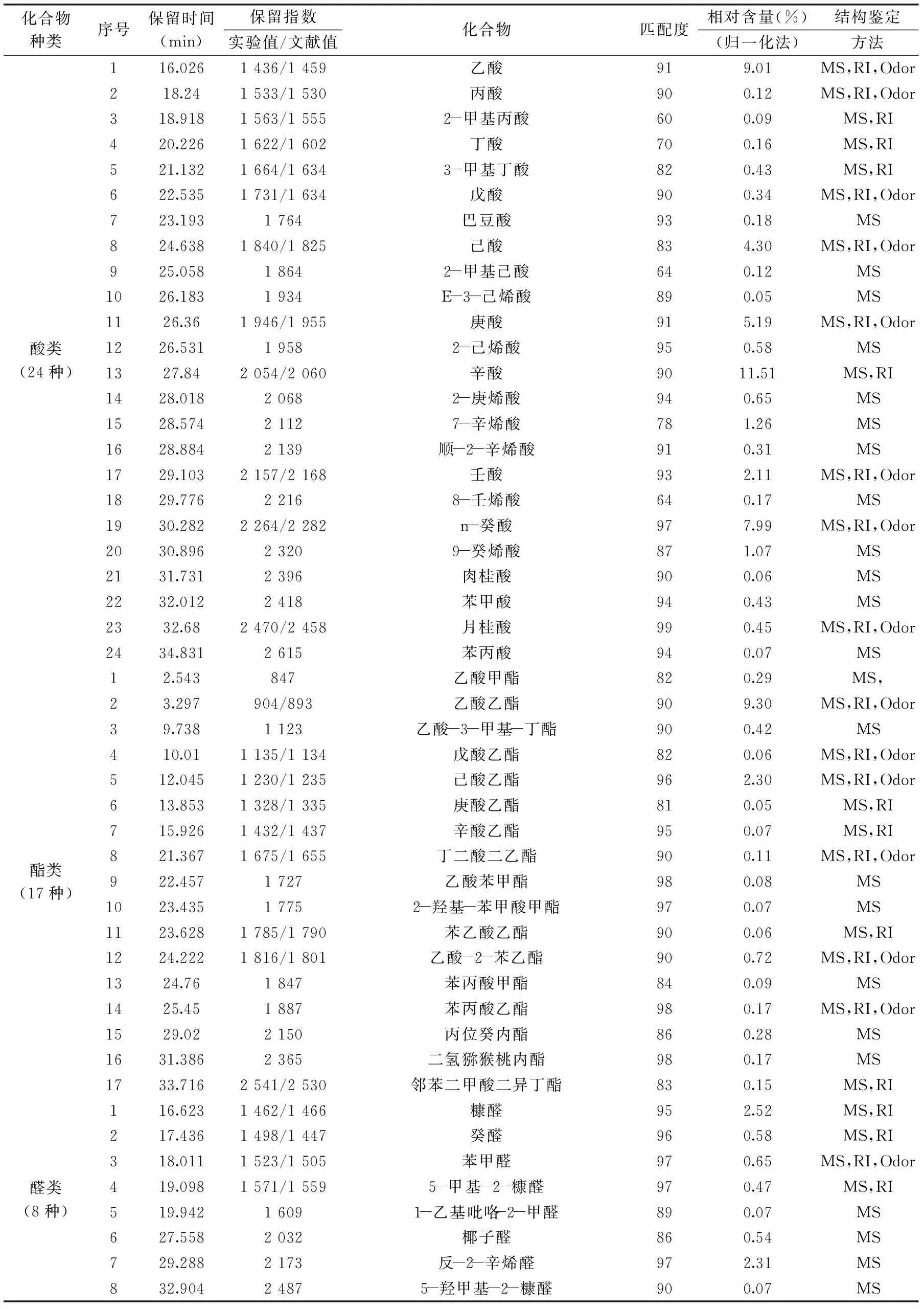
续表
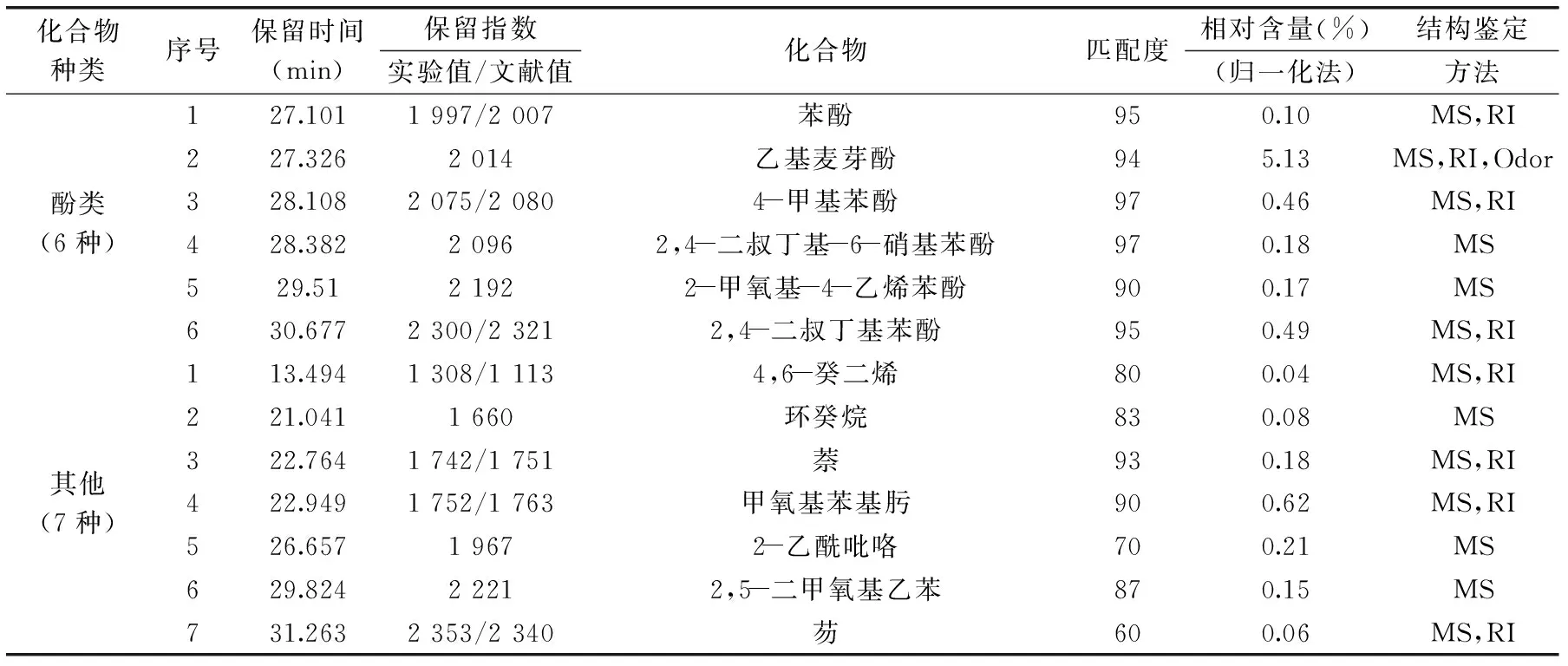
续表
注:MS.化合物通过质谱检测;RI.化合物通过查阅文献报道的保留指数比对确认;Odor.化合物通过闻香确认。
从图7和表4可知,红枣发酵饮料挥发性成分共分离得到114种化合物,确定结构96种,占红枣发酵饮料挥发性成分总量的98.86%。其中醇类化合物11种(含量5.79%)、酮类化合物22种(含量16.99%)、酸类化合物24种(含量46.64%)、酯类化合物17种(含量14.37%),醛类化合物8种(含量7.20%)、酚类化合物6种(含量6.53%)以及其他类化合物7种(含量2.48%)。酸类化合物在红枣香气成分中含量最大,这与邓红[24]研究的清涧红枣香气成分的结果是相吻合的。2,4-二叔丁基苯酚是食品中常用的抗氧化剂[25],丙酸能抑制霉菌的生长[26]。这些物质的存在有助于红枣发酵饮料的稳定性。这些易挥发成分中相对含量在1%以上的是辛酸(11.51%)、2-壬酮(9.37%)、乙酸乙酯(9.30%)、n-癸酸(7.99%)、乙基麦芽酚(5.13%)、己酸(4.30%)、2-庚酮(2.52%)、糠醛(2.52%)、反-2-辛烯醛(2.31%)、己酸乙酯(2.30%)、乙醇(2.24%)、壬酸(2.11%)、2-十一酮(1.35%)、苯乙基苯甲醇(1.32%)、7-辛烯酸(1.26%)、9-癸烯酸(1.07%)、3-甲基丁醇(1.02%)、2-辛酮(1.00%)。
2.3 红枣发酵饮料特征风味分析
根据嗅闻实测香气,与文献[26-37]中相应化合物的描述进行对比,并利用各成分香气特征与其强度绘制红枣发酵饮料主要香气分布雷达图(图8),同时用香气强度值和气味活度值(OAV)确定了红枣发酵饮料的特征香气成分及其贡献程度,其结果见表5。
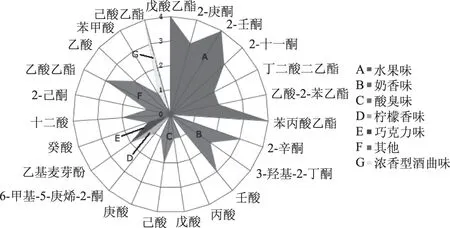
图8 红枣发酵饮料主要香气分布雷达图Fig.8 The radar diagram of Chinese jujube fermented beverages main aroma
从图8各物质的香气强度可知,红枣发酵饮料的香气主要由水果味、奶香味和浓香型酒曲味组成,柠檬香的6-甲基-5-庚烯-2-酮、巧克力味的乙基麦芽酚和花香味的苯甲醛对整体香气有补充、协调气味的作用。酮类挥发性化合物一般呈现奶油味和果香味[25],3-羟基-2-丁酮赋予红枣发酵饮料奶油香味;柠檬香的6-甲基-5-庚烯-2-酮对饮料的香气有一定的调节作用。醛类化合物的风味阈值较低,对香味的形成有重要作用[25]。乙基麦芽酚是优良的香味增效剂,具有用量少,香味浓且持久的特点[34]。另外,酸臭味的丙酸、戊酸、己酸和庚酸,香气强度低,对主体香气影响不大。
由表5和图8可知,通过嗅闻得到的红枣发酵饮料易挥发性成分,其香气强度值和气味活度值基本相符,相互补充。乙酸乙酯、己酸乙酯、2-十一酮在红枣发酵饮料中的含量较高,OAV均大于500,带有典型的水果香味。OAV>1的有10 种,说明对红枣发酵饮料香气有一定程度的贡献[39]。其中,香气强度值最大的物质有:水蜜桃味的戊酸乙酯、浓香酒曲味的己酸乙酯、水果香味的2-壬酮和枣香味的苯丙酸乙酯。OAV值最大的是乙酸乙酯,具有淡淡的甜味。对红枣发酵饮料的香气贡献最大。红枣发酵饮料中的含量最多的是乙酸。乙酸是食醋的主要成分,是酿造醋的醋香特征成分[40]。醋香味乙酸强度不大,对整体香气影响不大。OAV<1的有5种,分别是丙酸、戊酸、壬酸、癸酸和月桂酸,说明其对红枣发酵饮料的香味基本无影响。
酯类化合物是红枣发酵饮料特征风味成分中主要的组成成分。这与夏亚男[37]研究红枣白兰地特征香气成分的结果是一致的,表明酯类是红枣特征风味的主要构成成分。另外,呈现枣香味的苯丙酸乙酯和乙酸-2-苯乙酯是红枣发酵饮料的特有香气成分,对整体的香气成分起到补充的作用。
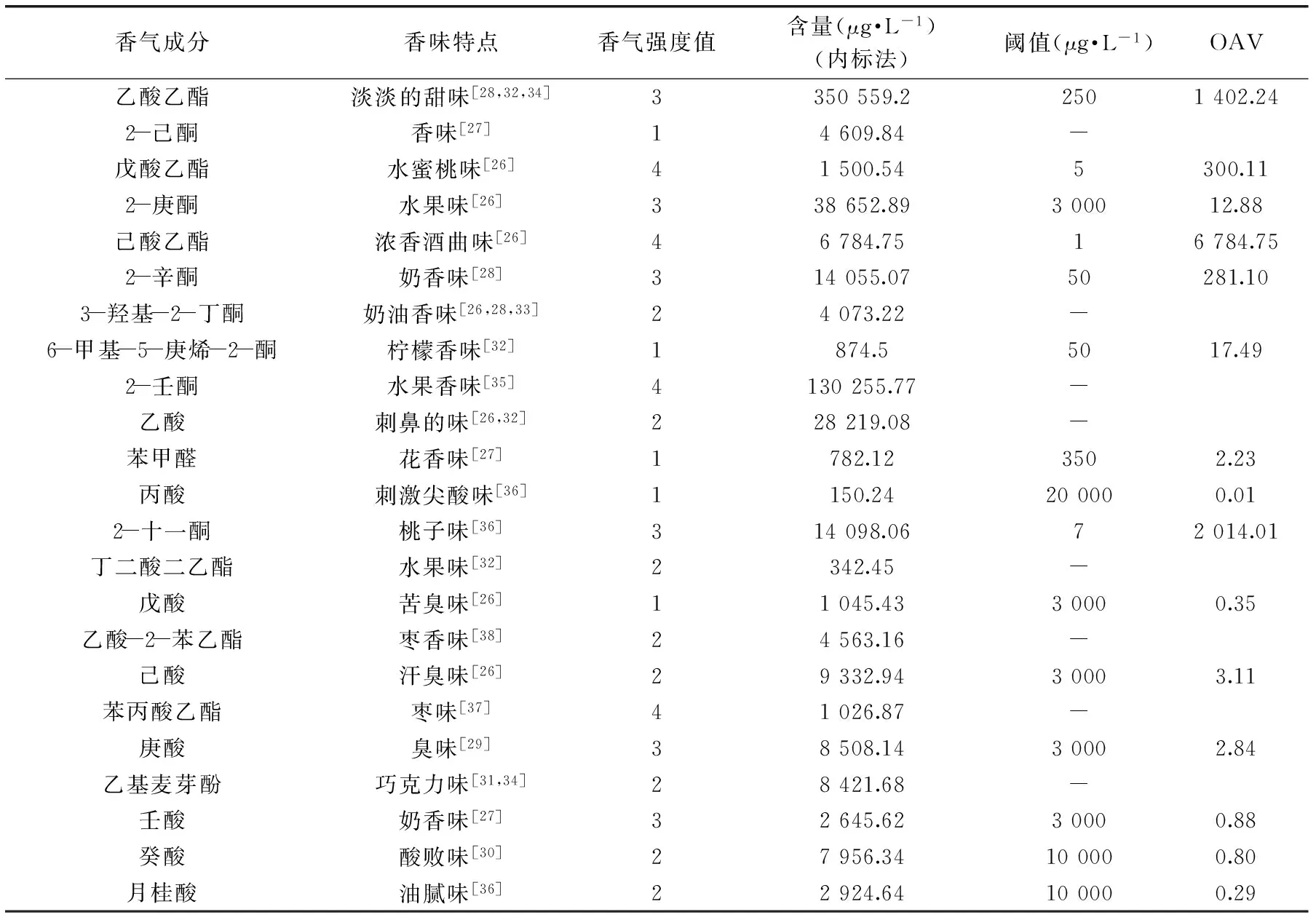
表5 红枣发酵饮料香气成分闻香特点及OAV值Table 5 The aroma characters and OAV of Chinese jujube fermented beverages
3 结论
利用顶空固相微萃取和气相-嗅闻-质谱联用法分析红枣发酵饮料易挥发性成分,对影响固相微萃取的操作条件进行系统的优化,建立了一种红枣发酵饮料易挥发性成分的分析方法,确定的最佳固相微萃取和色谱条件:Rtx-Wax色谱柱、50/30 μm DVB/CAR/PDMS固相微萃取头、样品用量8.0 mL/20.0 mL样品瓶、萃取时间70 min、萃取温度70 ℃、平衡时间20 min、解吸3 min的HS-SPME-GC-O-MS分析红枣发酵饮料中易挥发性成分的方法。共检测到114种化合物,确定结构的96种,占易挥发成分总面积的98.86%。
采用OAV结合香气强度值对红枣发酵饮料的风味成分进行了分析,通过实验可知,红枣发酵饮料的特征风味成分为乙酸乙酯、戊酸乙酯、己酸乙酯、2-辛酮、2-十一酮、乙酸-2-苯乙酯、苯丙酸乙酯、6-甲基-5-庚烯-2-酮、苯甲醛和3-羟基-2-丁酮。另外,呈现枣香味的苯丙酸乙酯和乙酸-2-苯乙酯是红枣发酵饮料的特有风味成分,对整体的香气成分起到补充的作用。该研究结果为红枣发酵饮料香气特征风味及其开发利用提供了一定的理论依据。
[1]汪长钢. 红枣醋饮料的生产工艺研究[D]. 长春:长春工业大学,2011.
[2]宋秀梅. 红枣介绍及其香精调配[C]. 第十五届中国国际食品添加剂和配料展览会学术论文集,2011.
[3]张宝善,陈锦屏,李冬梅. 利用次等红枣生产果醋的工艺研究[J]. 农业工程学报,2004,20(2):213-216.
[4]李红蕊. 枣醋及其功能性研究[D]. 咸阳:西北农林科技大学,2009.
[5]王婷,郭峰,毛亮,等. 红枣乳酸饮料的研究[J]. 现代食品科技,2007,23(6):42-44.
[6]Xiang J L,Chen-Lu L I,Guo S,et al. Protective Effect of Chinese Jujube Vinegar on Alcohol-induced Liver Damage in Mice[J]. Modern Food Science & Technology,2015.
[7]靳玉红,李志西,乔艳霞,等. 红枣乳酸发酵饮料的抗氧化活性[J]. 西北农林科技大学学报:自然科学版,2016,44(1):199-205.
[8]杨智,王楠,梁艳花,等. 电子鼻对红枣乳酸发酵饮料的品质分析[J]. 西北农业学报,2015,24(11):149-156.
[9]罗红波 红枣醋加工工艺研究及风味分析[D].雅安:四川农业大学,2015.
[10]志文. 天天吃红枣 防病抗衰老[J]. 中国气功科学,1999(3):41-41.
[11]雷昌贵,陈锦屏,卢大新. 红枣的营养成分及其保健功能[J]. 现代生物医学进展,2006,3:56-62.
[12]张智维,沈文,缑敬轩. 苹果醋饮料工艺的研究[J]. 食品科学,2005,26(5):273-275.
[13].王建刚,张莉. HS-SPME-GC-MS 测定桃汁饮料中风味成分[J]. 饮料工业,2014,17(6):37-41.
[14]许倩,牛希跃,袁惠娟. 红枣花生糯米复合型发酵饮料的研制[J]. 广西轻工业,2008,24(11):9-10.
[15]梁艳花. 红枣乳酸饮料功能性研究[D]. 咸阳:西北农林科技大学,2015.
[16]杨艳艳. 红枣果醋及其抗氧化性研究[D]. 咸阳:陕西科技大学,2012.
[17]林杰,陈莹,施元旭. 保留指数在茶叶挥发物鉴定中的应用及保留指数库的建立[J]. 茶叶科学,2014,34(3):261-270.
[18]García-González D L,Tena N,Aparicio-Ruiz R,et al. Relationship between sensory attributes and volatile compounds qualifying dry-cured hams[J]. Meat Science,2008,80(2):315-325.
[19]徐世娟. 烟用天然香原料的成分分析[D]. 昆明:云南大学,2012.
[20]Studerus E,Gamma A,Vollenweider F X. Psychometric Evaluation of the Altered States of Consciousness Rating Scale(OAV)[J]. Plos One,2010,5(8):1710-1744.
[21]Nuzzi M,Scalzo R L,Testoni A,et al. Evaluation of fruit aroma quality:comparison between Gas Chromatography-Olfactometry(GC-O)and Odour Activity Value(OAV)aroma patterns of strawberries[J]. Food Analytical Methods,2008,1(4):270-282.
[22]王超先,张雪芹,黄铃. 固相微萃取-气相色谱-红外光谱联用技术分析水处理药剂[J]. 分析实验室,2003(z1):170-170.
[23]张明霞,赵旭娜,杨天佑,等. 顶空固相微萃取分析白酒香气物质的条件优化[J]. 食品科学,2011,32(12):49-53.
[24]邓红,王玉珠,史乐伟,等. 清涧红枣香气成分的分析鉴定[J]. 食品研究与开发,2013(24):201-205 .
[25]张松山,孙宝忠,李海鹏,等.四种发酵牛肉中共有香味物质的研究[J].食品科学,2009,30(z1):239-245.
[26]王然,李蕊,宋焕禄. GC-O-MS 对比两种浓香型白酒中的挥发性成分[J]. 北京工商大学学报:自然科学版,2012(1):41-45.
[27]Robert S.Lgoe食品成分词典[M].北京 科学出版社,2014,3:61.
[28]马晓佩,王立,涂清荣,等. 顶空固相微萃取-气相色谱-质谱-嗅觉检测器联用分析米饮料中香气成分[J]. 食品工业科技,2008(8):143-147.
[29]马永昆,蒋家奎,魏永义,等. 基于 GC-MS 与嗅闻联用的镇江香醋香气指纹图谱研究[J]. 食品科学,2007,28(9):496-499.
[30]卢静茹,林向阳,张如,等. HS-SPME-GC-MS 联用分析美国巴旦木香气成分[J]. 食品科学,2015,2:30.
[31]孙宝国. 食用调香术[M]. 北京:化学工业出版社,2010:20-134.
[32]屈乐轶,马永昆,李祥波. 基于GC-MS和嗅闻联用的不同品种黑莓果酒香气成分分析[J]. 中国酿造,2009,28(6):146-149.
[33]陈臣,牟德华,张哲琦,李艳. 溶剂萃取与顶空固相微萃取检测欧李果酒中香气成分的研究[J]. 酿酒科技,2013,12:89-93.
[34]穆旻,郑福平,孙宝国,等. 麦芽酚和乙基麦芽酚的合成及其在食品工业中的应用[J]. 中国食品学报,2006,6(1):407-410.
[35]庞雪莉,胡小松,廖小军,等. FD-GC-O和OAV方法鉴定哈密瓜香气活性成分研究[J]. 中国食品学报,2012,12(6):174-182.
[36]曹淼,鲁周民,化志秀,等. 红枣醋不同发酵阶段香气成分的变化[J]. 现代食品科技,2014,30(3):233-238.
[37]夏亚男. 红枣白兰地香气成分及影响因素研究[D]. 河北:河北农业大学,2014.
[38]李树萍,邱诗棋,吴宛芹,等. 气相色谱-嗅闻-质谱联用分析红枣白兰地风味成分[J/OL]. 食品科学,http://www.cnki.net/kcms/detail/11.2206.TS.20160828.1854.056.html.
[39]Deng-yong L I U,Guang-hong Z,Xing-lian X U. “ROAV” Method:A New Method for Determining Key Odor Compounds of Rugao Ham[J]. Food Science,2008,7:083.
[40]张峻松,张文叶,谭宏祥,等. 大枣香醋中香味成分的GC-MS分析[J]. 中国酿造,2007,26(2):61-63.
Optimization of volatile compounds in Chinese jujube fermented beverages by headspace solid phase micro-extraction and gas chromatography-olfactometry-mass spectrometry
LI Kai,JIAO Jiao,LI Shu-ping,XU Man-jun,ZHANG Jie,LI Mei-ping,ZHANG Sheng-wan*
(College of Life Sciences,Shanxi University,Taiyuan 030006,China)
The volatile compounds in Chinese jujube fermented bverages were analyzed by HS-SPME and GC-O-MS. Affecting the operation of HS-SPME experimental conditions of extraction head,extraction temperature,extraction time,sample amount,equilibrium time and desorption time were optimized,it is in order to establish a method of analysis of volatile components in Chinese jujube fermented beverages,and the contribution of the main components to the overall aroma of Chinese jujube fermented beverages was evaluated by odor activity value(OAV)combined with aroma intensity value with diethyl oxalate as internal standard substances. The results indicated that the optimal extraction performance analyzing Chinese jujube fermented beverages volatile components was 50/30 μm poly two vinyl benzene/carbon molecular sieve/poly two methyl siloxane(DVB/CAR/PDMS)solid-phase micro extraction head,Rtx-WAX column,8.0 mL of sample add salt at 3 g with extracting at 70 ℃ for 70 minutes,20 minutes equilibrium time and 3 minutes desorption time. The results showed that through the analysis of HS-SPME-GC-O-MS,a total of 114 compounds were isolated,and the structure of 96 in them were identified,accounting for 98.86% of the total volatile substances Evaluation of OAV and aroma intensity values showed that ethyl acetate,pentanoic acid ethyl ester,ethyl hexanoate,2-Nonanone,2-Undecanone,2-phenyl ethyl acetate,Benzoic acid ethyl ester,6-methyl-5-hepten-2-one,benzaldehyde and 3-Hydroxy-2-butanone was the main aroma components of Chinese jujube fermented beverages.
solid-phase micro-extraction(HS-SPME);gas chromatography-olfactometry-mass spectrometry(GC-O-MS);Chinese jujube fermentd beverage;optimization;volatile compounds
2016-09-02
李凯(1991-),男,硕士研究生,研究方向:食品化学,E-mail:308218025@qq.com。
*通讯作者:张生万(1955-),男,大学本科,教授,研究方向:食品化学、化学计量学,E-mail:zswan@sxu.edu.cn。
2014新兴产业领军人才创业项目资助。
TS275.5
A
:1002-0306(2017)04-0054-09
10.13386/j.issn1002-0306.2017.04.002
