一株鹅源鸭甲肝病毒1型的分离及A GP和RT-PCR鉴定
2017-03-14季艳菊张伟王林川
季艳菊,张伟,王林川
(1.惠州工程技术学校,广东 惠州 516001;2.惠东县动物疫病预防控制中心,广东 惠东 516300;3.华南农业大学兽医学院,广东 广州 510642)
一株鹅源鸭甲肝病毒1型的分离及A GP和RT-PCR鉴定
季艳菊1,张伟2,王林川3*
(1.惠州工程技术学校,广东 惠州 516001;2.惠东县动物疫病预防控制中心,广东 惠东 516300;3.华南农业大学兽医学院,广东 广州 510642)
鸭甲肝病毒性肝炎是一种主要针对雏鸭感染的发病急、致死性高和传播迅速的病毒病,以肝脏肿大、出血为主要病变特征。本文从一个鹅鸭混养场的病死雏鹅肝脾脏中分离到1株病毒,进行动物攻毒回归试验,使人工攻毒雏鹅发病复制出与自然发病雏鹅相似的角弓反张及肝脏肿大出血的主要病征,即证实该分离毒株为此次鹅自然发病的致病原。后利用AGP和RT-PCR方法均鉴定出该分离毒株为鸭甲肝病毒1型,从而进一步佐证了国内近些年来先后报道鸭甲肝病毒1型(DHAV-1)可使雏鹅发生与雏鸭相似临床症状和剖检病理变化的鹅源鸭甲肝病毒性肝炎。启示养鹅业以后也要注意鸭甲肝炎的防控,特别是在鸭鹅混养的地区。
鹅源;鸭甲肝病毒I型;分离;鉴定
鸭病毒性肝炎(Duck viral hepatitis,DVH)是一种发病急、致死性高和传播迅速的传染病,为鸭主要传染病之一。该病早先有3个血清型,即DHV-I、DHV-II和DHV-III。后DHV-II和DHV-III被归为星状病毒科成员[1]。而同属于小RNA病毒科的DHV-I、台湾和韩国发现的新型DHV分别被命名DHV-A、DHV-B和DHV-C,其中DHV-B仅台湾有病例报告过,DHV-C目前仅在中国大陆与韩国报告过[2]。为了避免混淆,后又将DHV-A、DHV-B和DHV-C统称鸭甲肝病毒,则又有A型鸭甲肝病毒、B型鸭甲肝病毒和C型鸭甲肝病毒之称[3]。
根据2012年最新出版的国际病毒分类委员会第九次分类报告,将DHV-I、台湾型鸭肝炎病毒、韩国型鸭肝炎病毒分别定名为鸭甲肝病毒1型(DHAV-1)、鸭甲肝病毒2型(DHAV-2)和鸭甲肝病毒3型(DHAV-3),它们同属于微RNA病毒目微RNA病毒科禽肝炎病毒属成员[4]。
鸭甲肝病毒1型(DHAV-1),即经典的DHV-I,现仍呈世界性分布,主要侵害3周龄以内雏鸭,传播迅速,病鸭多呈“角弓反张”姿势,以肝肿大且斑点状出血为特征,死亡率达90%以上,对养鸭业危害极大。而国内近些年来,也先后报道鸭甲肝病毒1型还给同为水禽的鹅产业带来不小的冲击。它常发生于孵化季节,主要侵害 5~30日龄的雏鹅,且传播迅速,成鹅不易感,主要病理特征是肝肿大,并有出血点[5-14]。
2016年4月份,广东省粤东某县的一个鹅鸭混养场的一批19日龄雏鹅出现精神萎靡、不喜走动,2~3d后大批出现“角弓反张”姿势的阵发性抽搐并死亡,第5天达发病死亡高峰期,后统计到此发病率为31%,死亡率19%,对病死鹅剖检病变为肝肿大、点状出血,该场同时饲养有50多日龄和60多日龄番鸭各一批,虽未发病,但了解到场里有鸭甲肝病发病史。通过雏鹅发病的临床症状及解剖病理变化等,初步怀疑雏鹅感染DHAV。本文作者通过采集1份疑似感染DHAV的病鹅肝脏,接种鸭胚,从致死胚中分离获得1株病毒(暂命名为GHZ16),并先后经过AGP和 RT-PCR检测方法对其进行鉴定,确诊造成鹅发病死亡的病原为鹅源鸭甲肝病毒I型。
1 材料
1.1 病料 病料取自广东省粤东某县的一个鹅鸭混养场的疑似鸭甲肝典型临床症状和病理变化的病死鹅的肝、脾脏组织。
1.2 试验动物 9日龄无DVH免疫番鸭胚,购自惠州惠东某种鸭场;1日龄无DVH母源抗体的雏鹅,购自惠州博罗某种鹅场。
1.3 DHAV-1兔高免血清 由广东省动物源性人兽共患病预防与控制重点实验室家禽病毒病研究分室提供。
1.4 试 剂 ViraPrepTM MammalKit: 购 自MaxyBio公司,Trizol Reagent购自 Invitrogen上海有限责任公司,M-MLV反转录酶、Tag DNA聚合酶购自 Fements公司,dNTP Mixture、DNA marker DL2000购自宝生物工程(大连)有限公司,琼脂糖为0XIOD公司产品,DEPC购自北京鼎国公司,磷酸缓冲盐溶液、普通琼脂平板等自行配制。
2 方法
2.1 病毒的分离 将采取的具有疑似DVH典型临床症状和病理变化的病死鹅的肝、脾脏组织,按照 1:5~10(g/ml)比例加入无菌生理盐水,充分剪碎研磨并反复冻融三次,后6000r/min离心10min,取上清,加入2000IU/ml双抗(青、链霉素)处理,置于4℃冰箱过夜,通过尿囊腔接种9日龄无DVH免疫番鸭胚,0.2ml/枚,接种10枚,37℃恒温传代培养,同时设无菌生理盐水注射10枚番鸭胚对照组,每日照胚2次,弃去24h内死亡的,将24h~96h内死亡的放于4℃过夜,回收尿囊液于-20℃保存备用。
2.2 病毒的纯化
2.2.1 病毒的传代 将鸭胚尿囊液经无菌处理,再次接种9日龄的健康番鸭胚(0.2ml/枚),接种10枚,同时设立无菌生理盐水对照组,盲传 3代,将病毒进行初步纯化,收集死胚尿囊液,于-20℃保存备用。
2.2.2 浓缩、纯化试剂处理 将传代的初步纯化病毒尿囊液以3000r/min,4℃离心30min,取上清液;再以10000r/min,4℃离心30min,取上清。后经透析袋透析浓缩为原体积的1/4~1/5。
浓缩病毒液用ViraPrepTM Mammal Kit处理:将一定体积浓缩病毒液,加入等体积的BUFFER 1,反复颠倒混匀;再加入1/4原浓缩病毒液体积的VIRAFFINITY,反复颠倒混匀,于室温放置5min。室温1000r/min离心10min,弃上清;沉淀用原体积的BUFFER 1重悬,室温1000r/min,重复操作两次;加3倍原体积的BUFFER 2,若需要最小的稀释,则用1倍原体积BUFFER 2,反复颠倒混匀,沉淀完全溶解后,用离心机的最大转速离心10min,收集上清;此上清即为纯化好的病毒液。-20℃保存备用。
2.3 病毒的鉴定
2.3.1 动物攻毒回归试验 选择无鸭病毒性肝炎母源抗体的1日龄雏鹅 20只,分为2组,10只/组。A组将2.2.2获得的纯化病毒液采取腿部肌注进行攻毒,攻毒量为0.5ml/只;B组为生理盐水对照。两组试验鸭分开隔离饲养。每日观察记录病死情况,并剖检死鹅且记录剖检变化。
2.3.2 AGP鉴定 取普通琼脂平板,中间孔加入
2.2.2浓缩、纯化的病毒液,周围孔加入依次 20、2-1、2-2、2-3、2-4、2-5稀释的兔高免血清, 后先将琼脂板正放入湿盒并 37℃作用 1h,再倒放于 37℃作用12~36h,观察AGP结果。
2.3.3RT-PCR鉴定
2.3.3.1 引物设计 参照马秀丽[15]的方法由上海生工生物工程技术服务有限公司合成鉴定DHAV-1的引物,其扩增长度为199bp。上游引物为:5'-CACCCATCACCATTCTATAAGC-3';下游引物为:5'-GGGGAGACCAAACGACAA-3'。使用前,用DEPC水溶解成20pmol/μl溶液,小量分装,于-20℃保存备用。
2.3.3.2 病毒RNA提取 参照Trizol法提取。取病毒液200μl,加750μl的Trizol溶液充分振荡,室温作用 10min;后加 200μl氯仿抽提 1次,12, 000rpm离心5min,取上清液;加等体积异丙醇,于室温作用 10min,12,000rpm离心 5min;沉淀用75%乙醇洗涤,12,000rpm离心5min,取沉淀物;加适量的DEPC水溶解沉淀,于-20℃保存备用。
2.3.3.3 RT-PCR反应 RT反应体系 (20μl)按如下表1。置于PCR扩增仪上进行反应,M-MLV(5U/μl)1μl于42℃时加入;反应程序:70℃ 5min,42℃ 30min,94℃ 2min。

表1 RT反应体系
PCR反应体系(50μl)按如下表2。置于 PCR扩增仪进行反应,反应程序:94℃预变性 5min;94℃变性30s、53℃退火30s、72℃延伸30s,35个循环;72℃后延伸7min;4℃保存。

表2 PCR反应体系
PCR产物于1%琼脂糖凝胶(0.5μg/ml EB)中电泳检测。
3 结果与分析
3.1 动物攻毒回归试验 攻毒A组,雏鹅于攻毒后第2天开始发病,病初表现精神不振,离群不愿走动,食欲下降,排黄白或绿色稀粪;第3天出现神经症状,双脚呈痉挛性划动或在地上翻滚、旋转,临死前多呈角弓反张姿势(如图1),数小时后急性死亡。第5天达发病死亡高峰期,最后统计到发病率为30%,死亡率20%,剖检特征病变为肝脏肿大,表面多有弥漫性出血点或出血斑(如图 2)。对照B组,健康未发病。详见表3。

图1 角弓反张

图2 肝脏肿大且有弥漫性出血点斑
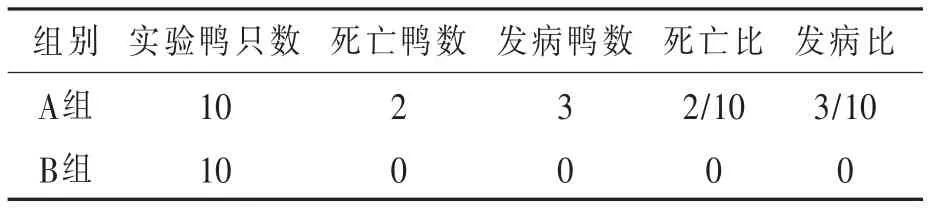
表3 动物回归试验鸭病死情况
攻毒A组发病的系列症状、剖检变化与当初采集病料时鹅的临床发病及剖检结果相似,说明该动物攻毒回归试验成功复制出鹅自然发病病例,即分离毒株为鹅自然发病病例的致病原。
3.2 病毒分离 将病料接种10日龄番鸭胚96h后,番鸭胚全部死亡,阴性对照未死亡。病料接种死亡番鸭胚体的病变表现为:全身出血与水肿,肝脏肿大且明显出血点(如图3)。冻存的胚液继续盲传2代,第3代对番鸭胚的致死率均为100%。确定了该鹅场的致病原是病毒。
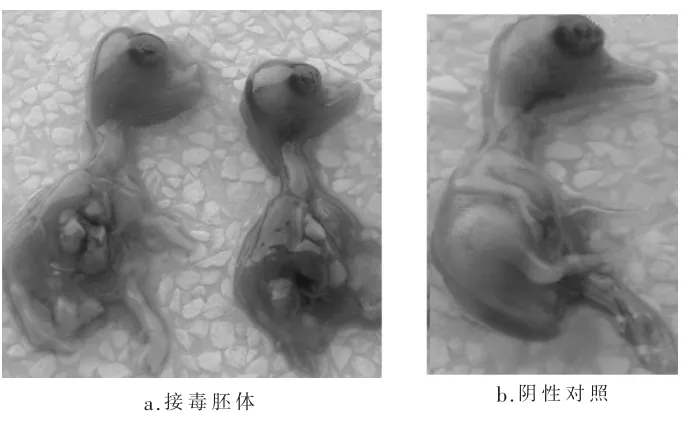
图3 病毒分离试验对照图
3.3 病毒的鉴定
3.3.1 AGP鉴定结果 取琼脂板,中间孔加入疑似DHV尿囊液,周围孔加入依次20、2-1、2-2、2-3、2-4、2-5稀释的兔高免血清,后37℃作用,观察AGP结果,说明疑似DHV为DHAV-1。分离毒株的AGP结果如下图4。

图4 AGP结果
3.3.2 RT-PCR鉴定结果 利用马秀丽鉴定DHAV-1的特异引物,对疑似DHAV毒株进行RTPCR反应,结果能扩增到与预期相符的199bp特异性目的片段(图5)。说明疑似DHAV为DHAV-1。
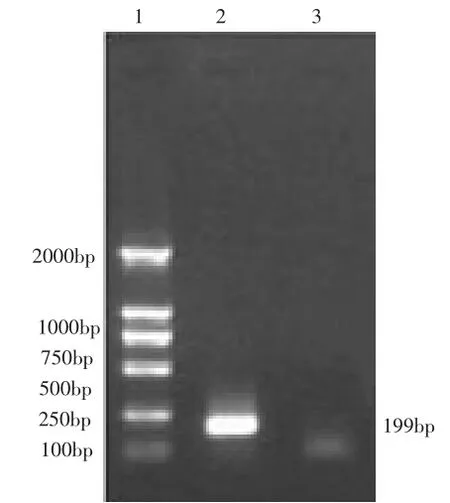
图5 疑似DHAV毒株RT-PCR扩增电泳检测结果
4 讨论
1950年,由Levine与Fabricant首次分离出鸭甲肝病毒(DHAV)[16],之后鸭甲肝病毒在许多国家和地区相继分离出来。近些年来,鸭甲肝病毒性肝炎的流行病学特征及其病毒的基因型等发生了一定的改变,在我国大陆及台湾地区,一些养鸭场有用经典的DHAV-I弱毒疫苗或用其高免卵黄抗体免疫注射鸭群后仍发生典型鸭肝炎的报道。于是,研究学者们从台湾和韩国病死鸭中分别分离到鸭甲肝病毒 2型 (DHAV-2)和鸭甲肝病毒 3型(DHAV-3)[2],鸭甲肝病毒2型(DHAV-2)、鸭甲肝病毒3型 (DHAV-3)与经典的鸭甲肝病毒1型(DHAV-1)现同属于微RNA病毒目微RNA病毒科禽肝炎病毒属成员,为3个鸭甲肝病毒不同的基因型[4]。
鸭甲肝炎一般常见发生于雏鸭,成年种鸭即使在污染的圈舍中也无临床症状,产蛋正常。而国内近些年来,也先后报道鸭甲肝病毒1型(DHAV-1)还可使雏鹅发生与雏鸭相似临床症状和剖检病理变化的鹅源鸭甲肝炎[5-14]。
本文利用AGP和RT-PCR检测方法,从疑似发生鹅源病毒性肝炎的病死鹅肝脾脏组织中检测到DHAV-1型病毒,用鸭胚分离纯化得到鸭甲肝炎病毒GHZ16株(DHAV-1型),及GHZ16株病毒人工感染雏鹅能复制出与临床自然病例相似的病例,由此可确诊:2016年 4月份,广东省粤东某县的一个鹅鸭混养场的一批19日龄雏鹅暴发的疾病由DHAV-1型感染所致。
本文证实鸭甲肝炎病毒1型能自然感染雏鹅发病,从而进一步佐证了国内近些年来先后报道鸭甲肝病毒1型(DHAV-1)可使雏鹅发生与雏鸭相似临床症状和剖检病理变化的鹅源鸭甲肝病毒性肝炎,也导致雏鹅较高的发病率和死亡率。因此,在雏鹅养殖过程,除加强小鹅瘟等疾病的防控外,也不可忽视鸭甲肝炎病毒感染的危害,特别是在有鸭鹅混养的地区,以给养鹅业带来重要启示。
[1] Todd D,smyth V J,Ball N W,et al.Identification of chicken enteroviruslike viruses,duck hepatitis virus type 2 and duck hepatltis virus type 3 as astroviruses[J].AvlanPathl,2009,38:21-30.
[2] Wang Liyan,Pan Meng,Fu Yu,et al.Classification of duck hepatitis virus Into three genotypes based on molecular evolutionary analysis[J].Virus Genes,2008,37:52-59.
[3] Fu Y,Pan M,Wang x,et al.Molecular detection and typing of duck hepatitis A virus directly from clinicalspecimens[J].vctMicrobiol,2008,131:247-257.
[4] 张忠信.ICTV第九次报告对病毒分类系统的一些修改[J].病毒学报,2012,28(5):595-599
[5] 孙泉云,周锦萍,张苏华,等.雏鹅鸭肝炎病毒的分离与鉴定[J].中国家禽,2002,24(14):19
[6] 许国强,廖成莹,张洪培.一例雏鹅感染鸭病毒性肝炎的诊治 [J]。中国禽业导刊,2004,21(21):33.
[7] 曲丽萍,阎德平,吴红波,等.鹅病毒性肝炎的诊治[J].水禽世界,2008,(4):25-26.
[8] 许家荣,郭俊清,高金宝.雏鹅病毒性肝炎的诊治[J].畜牧与兽医,2009,41(1):74-75.
[9] LIU M,FANYI M,LI X J,et a1.Goose haemorrhagic hepatitis caused by a new subtype duck hepatitis type 1 virus[J].VetMicrobiol,2011,152(3/4):280-283.
[12] 傅光华,陈红梅,黄瑜,等.雏番胰腺型鸭l型甲肝病毒分离鉴定及VP1基因分析 [J].福建农业学报,2012,27(9):945-950.
[13] 唐妤,甘艳君,陈思怀等.重庆地区雏鹅暴发鸭病毒性肝炎[J].中国兽医杂志,2012,48:12-15.
[14] 陈珍,陈红梅,傅光华,等.种鹅源鸭甲肝病毒1型的分离鉴定及其 VP1l基因分析[J].畜牧与兽医,2015,47(8):81-84.
[15] 马秀丽,宋敏训,黄兵,等.I型鸭病毒性肝炎病毒RT-PCR检测方法的建立 [J].家禽科学,2006,(11):11-13.
[16] SAIF Y M.苏敬良,高福,索勋,译.禽病学(第 12版)[M].北京:中国农业出版社,2012:431-436.
Solation and Identification of Duck Hepatitis Virus A type 1 with Goose-origin
JI Yan-ju1,ZHANG Wei2,WANG Lin-chuan3
(1.Huizhou Engineering and Technology School,Huizhou 516000,China;2.HuidongAnimal Disease Control Center,Huidong 516300,China;3.South China Agricultural University,Guangzhou,510642,China)
Duck hepatitis virus A hepatitis is a major disease in ducks infected with acute and lethal and viral disease spread rapidly, with the enlargement of the liver, bleeding as the main pathological syndrome. In this paper, isolated from a goose and duck polyculture field in the spleen of the dead young goose 1 virus strains were inoculated,animal regression test,the artificial inoculation of gosling incidence to replicate the majorsymp to mssimilarto natural incidence of gosling opposthotonis and enlargement of the liver hemorrhage, which confirmed the pathogen strains for the natural occurrence of goose the.After using AGP and RT-PCR methods were identified in the isolate of duck hepatitis virus Atype 1. Further evidence of China in recent years has reported duck hepatitis virusA type 1(DHAV-1)can make the occurrence of gosling goose duck hepatitis virus hepatitis and ducklings similar clinical symptoms and pathological pathological changes.After the revelation of goose industry should also pay attention to the prevention and control of duck hepatitis A, especially in the area of polyculture duck goose.
goose-origin;Duck Hepatitis Virus A type 1;isolation;identification
S858.332.65
B
1673-1085(2017)02-0030-05
2017-01-14
季艳菊(1980-),女,畜牧兽医讲师,在读在职兽医专业博士,从事兽医教学和科技研究工作。研究方向:动物传染病研究,邮箱:weiran809@163.com。
*通讯作者:王林川(1965-),男,教授,博士,研究方向:畜禽疫病病原及其防控研究。
