羟基蛋氨酸钴配合物的合成、表征与热分析
2017-03-14陈玲吴治先钟国清
陈玲+吴治先+钟国清
摘要以羟基蛋氨酸和氯化钴为原料合成配合物羟基蛋氨酸钴,用元素分析、红外光谱(FTIR)、粉末X射线衍射(XRD)、热分析(TGDTADTG)等进行表征.红外光谱证实钴(II)与羟基蛋氨酸中的羧基氧原子、羟基氧原子及甲硫基硫原子配位.XRD数据指标化结果表明该配合物晶体结构属于单斜晶系,晶胞參数为:a=0.829 6 nm,b=0.656 9 nm,c=1.631 1 nm,β=92.65°.热分析结果表明,配合物在200 ℃以上开始分解,残余物为CoS.用Kissinger法和FlynnWallOzawa法计算羟基蛋氨酸钴的热分解动力学参数:活化能Ea和指前因子A.
关键词羟基蛋氨酸;钴(II)配合物;合成;热分解
蛋氨酸羟基类似物国内也称为羟基蛋氨酸,它与蛋氨酸有等同的生物效价,其配合物在消化道内采用氨基酸途径吸收,吸收速度快,吸收率高[1].作为一类饲料添加剂,羟基蛋氨酸配合物能提供动物生长发育所必需的微量元素及蛋氨酸源,具有稳定的化学性质、无毒性、对动物刺激性小等优点[23].羟基蛋氨酸微量元素配合物与天然氨基酸微量元素配合物功能相似,但它比天然氨基酸微量元素配合物因价格等方面的优势而更易满足市场的需要[4].目前,羟基蛋氨酸微量元素配合物的制备报道不多[56],其单晶结构研究也很少[7].本文报道羟基蛋氨酸钴的合成方法与结构表征,并研究了其热分解过程和热分解动力学,为其深入研究和应用开发提供依据.
1实验部分
1.1仪器与试剂
BS124S电子天平(感量0.1 mg,北京塞多利斯仪器系统有限公司);恒温磁力搅拌器;Vario EL CUBE元素分析仪(德国元素分析系统公司);Nicolet 5700型傅里叶变换红外光谱仪(美国Nicolet仪器公司);D/maxⅡ型X射线粉末衍射仪(日本理学公司);SDT Q600同步热分析仪(美国TA仪器公司).
羟基蛋氨酸(含水量12%的棕色液体,工业品,本文缩写为H2MHA),氯化钴、氢氧化钠、无水乙醇及其他化学试剂均为分析纯.
1.2Co(HMHA)2·H2O的合成
取20 mmol羟基蛋氨酸和10 mmol氯化钴于50 mL烧杯中,加适量蒸馏水并加热搅拌使其完全溶解,搅拌下逐滴加入20 mmol氢氧化钠的水溶液,此时溶液pH约为4~5,无沉淀物形成.继续加热并搅拌,当溶液浓缩至约10 mL时,有粉红色沉淀物生成.然后静置、冷却、结晶,抽滤,并用少量无水乙醇洗涤,将滤饼放入置有P2O5的干燥器中干燥1周,得粉红色固体粉末2.73 g,产率72.3%.
2结果与讨论
2.1元素分析及组成
产物中钴的含量用二甲酚橙作指示剂EDTA配位滴定法测定,C,H,S,O的质量分数用元素分析仪测定.实验结果为:w(Co)=15.60%(15.70%),w(C)=31.96%(32.00%),w(H)=5.15%(5.37%),w(S)=17.34%(17.08%),w(O)=29.53%(29.84%),括号内数据为理论计算值.从元素的实验测定值可推出产物的化学式为Co(C5H9O3S)2·H2O(Mr=375.31),其理论计算值与测定值很接近,即配合物的组成为Co(HMHA)2·H2O.该配合物在空气中很稳定,不吸潮,易溶于水.
2.2粉末X射线衍射分析
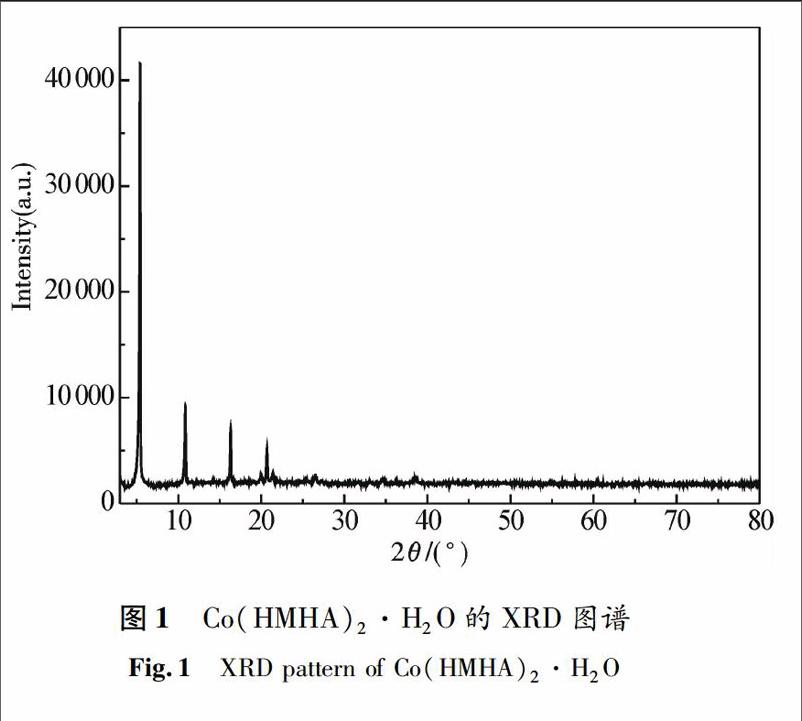
用X射线粉末衍射仪对所合成配合物进行扫描,测试条件Cu Kα射线(λ=0.154 06 nm),工作电压35 kV,电流60 mA,扫描速度8°/min,室温下收集3°~80°衍射数据,XRD图谱见图1.
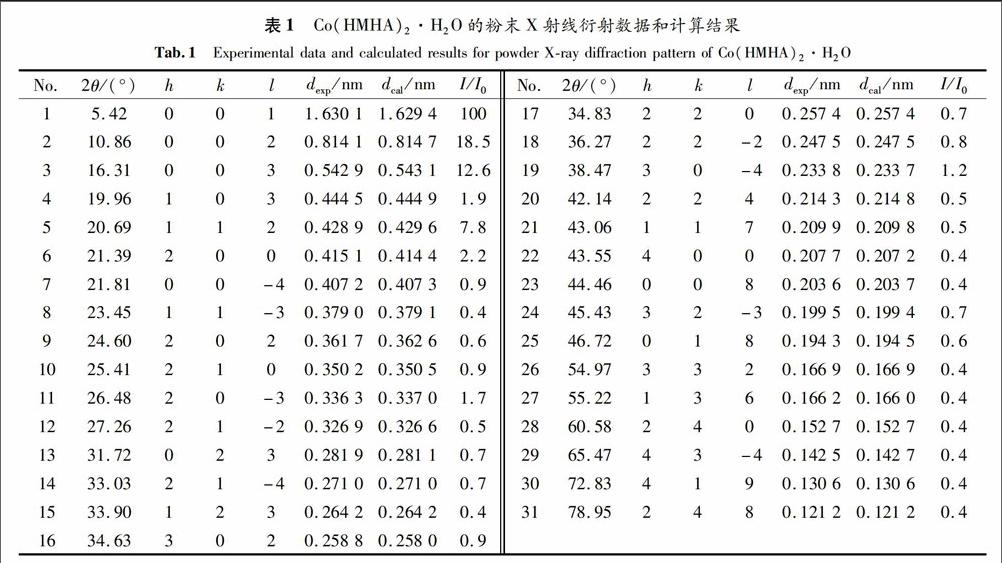
由图1可知,羟基蛋氨酸钴在2θ=5.42°,10.86°和16.31°处出现三强峰,与氯化钴在2θ=35.76°,15.24°和51.54°处(JCPDS 850446)的三强峰不同.XRD图谱本底小,衍射峰强而尖锐,表明产物的晶形很好.配合物的衍射角2θ及衍射强度与氯化钴完全不同,说明形成了羟基蛋氨酸钴.同时,用计算机程序对其XRD数据进行指标化计算[8],结果见表1.从计算结果可知,所有衍射数据能以一套晶胞参数按单斜晶系进行指标化计算,计算晶面间距dcal和实验值dexp接近,最大相对误差小于0.3%,表明该产物为单一物相,晶胞参数为:a=0.829 6 nm,b=0.656 9 nm,c=1.631 1 nm,β=92.65°.
2.3红外光谱分析
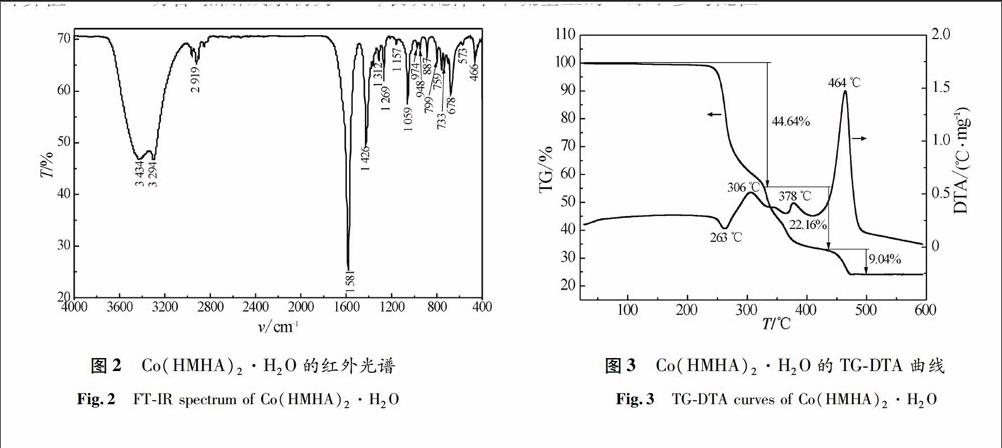
用KBr压片法在400~4 000 cm-1测试配合物红外光谱,如图2所示.2 919,1 426和1 312 cm-1的吸收峰为CH3S—的特征吸收峰.3 434 cm-1为—OH在3 650~3 200 cm-1内中等强度且较宽的伸缩振动吸收峰,同时1 059 cm-1出现了仲醇C—O的特征伸缩振动吸收峰,说明配合物分子间存在缔合现象,形成了分子间氢键.1 581和1 426 cm-1分别为COO-的反对称和对称伸缩振动吸收峰,差值为155 cm-1,说明羧基氧原子以双齿形式与Co2+配位[9].1 600 cm-1附近只有一个强的吸收峰,与含结晶水的羟基蛋氨酸锌吻合[7],说明该配合物中含结晶水.573 cm-1为Co—O的伸缩振动吸收峰,466 cm-1出现Co—S的伸缩振动吸收峰[10].
2.4热分解过程
研究配合物的热分解过程,有助于了解其配位结构和热分解机理[11].空气氛围中于室温至600 ℃对羟基蛋氨酸钴的热稳定性进行测试,试样量约3.5 mg,升温速率10 ℃/min的TGDTA曲线如图3所示,升温速率分别为5.0,10.0,15.0和20.0 ℃/min的TGDTG曲线如图4所示.由图3和图4可知,该配合物的热分解包括4个阶段,随着升温速率的增加,DTG曲线向高温方向移动,每个阶段对应的分解峰温Tp也向高温方向移动,说明改变升温速率对每个失重阶段的温度范围略有影响.第一阶段失重率在不同升温速率时基本保持不变,但最后的残余量随着升温速率的增加而有所减少.由图3可知,配合物在空气中较稳定,当温度超过200 ℃才开始分解,其热稳定性好.DTA曲线在263 ℃有一个吸热峰,在306 ℃有一个放热峰,对应TG曲线失重44.64%,经推断为配合物失去一分子的H2O和一个羟基蛋氨酸C5H10O3S分子被氧化分解,剩余物为脱去2个质子的1∶1的羟基蛋氨酸钴螯合物[Co(MHA)],与其计算值44.82%吻合.DTA曲线在378 ℃和464 ℃有2个连续的放热峰,为2个脱质子羟基蛋氨酸配体的氧化分解过程,TG曲线对应失重率为3120%.大约480 ℃失重恒定,得到稳定的黑色粉末状残余物,残余量为24.16%,与残余物为CoS的理论计算值24.24%吻合.热解残余物为CoS,表明配体中甲硫基上的S原子参与配位.
2.5热分解动力学
为了得到羟基蛋氨酸钴的热分解反应动力学参数,用Kissinger法和FlynnWallOzawa法两种动力学分析方法分别计算配合物第一、三阶段的表观活化能Ea,指前因子A和相關系数r,见图5,图6和表2所示.采用Kissinger[1213]法和FlynnWallOzawa[1416]法的基本公式为
式中:β为升温速率,K/min;A为指前因子,s-1;R是气体摩尔常量,8.314 J/(K·mol);Ea为表观活化能,J/mol;α为转化率;Tp为不同的升温速率β下各热谱峰的温度,K;G(α)为积分机理函数.
因失重第二阶段和失重第四阶段的峰值温度Tp没有随规律变化,作图时线性相关性小,故作为实验数据分析结果不可取.第一失重阶段,在Kissinger法中,各升温速率所对应的TGDTG曲线得到分解峰的峰温Tp,用ln(β/Tp2)对1/Tp作图,并用线性最小二乘法回归处理,如图5(a)和图6(a),由直线的斜率和截距可计算得到对应的表观活化能Ea及指前因子A,并可求出线性相关系数r. FlynnWallOzawa法中,不同β下配合物质量损失20%时,温度接近各热谱峰温度TP,且质量损失相同的情况下α值近似相等,用lg β对1/T作图,通过最小二乘法对数据进行线性拟合,见图5(b)和图6(b),同样可求出活化能Ea及线性相关系数r.由表2可知,两种方法计算得到的羟基蛋氨酸钴在两个热分解阶段的活化能很接近.
3结论
以羟基蛋氨酸和氯化钴为原料合成了羟基蛋氨酸钴Co(HMHA)2·H2O,并用EA,FTIR,XRD和TGDTA等方法对配合物进行了组成和结构表征.XRD数据的指标化结果表明,该配合物属于单斜晶系,晶胞参数为:a=0.829 6 nm,b=0.656 9 nm,c=1.631 1 nm,β=92.65°.Co(II)与羟基蛋氨酸中的羧基O,羟基O及甲硫基S配位.配合物在常温下稳定,在200 ℃以上开始分解,残余物为CoS.用非等温动力学原理和方法计算得到了该配合物的活化能和指前因子等热分解动力学参数.
参考文献:
[1]PREDIERI G, TEGONI M, CINTI E, et al. Metal chelates of 2hydroxy4methylthiobutanoic acid in animal feeding: preliminary investigations on stability and bioavailability [J]. J Inorg Biochem, 2003,95(23):221224.
[2]龙丽娜,谢春艳,朱年华,等. 羟基蛋氨酸螯合锰/锌对产蛋鸡蛋壳品质及微量元素沉积的影响[J]. 动物营养学报, 2015,27(9):26922698.
[3]李寰旭,王芬. 羟基蛋氨酸螯合态铜对奶牛生产性能和血液生化指标的影响[J]. 饲料研究,2015(12):2935.
[4]PREDIERI G, ELVIRI L, TEGONI M, et al. Metal chelates of 2hydroxy4methylthiobutanoic acid in animal feeding, part 2: further characterizations, in vitro and in vivo investigations [J]. J Inorg Biochem, 2005,99(2):627636.
[5]吴治先,李春春,钟国清,等. 羟基蛋氨酸铜螯合物的制备与表征[J]. 人工晶体学报, 2014,43(2):474479.
[6]WANG M L, WU Z X, ZANG Q, et al. Synthesis, characterization and thermal decomposition kinetics of manganese complex of methionine hydroxy analogue [J]. Int J Chem Eng, 2015, 2015(4).DOI: 10.1155/2015/874340.
[7]PREDIERI G, BELTRAMI D, PATTACINI R, et al. Structural studies in solution and in the solid state on the zinc chelate of 2hydroxy(4methylthio) butanoic acid, an effective mineral supplement in animal feeding [J]. Inorg Chim Acta, 2009,362(4):11151121.
