Ⅰ型血管紧张素Ⅱ受体在ADPC向AIPC转变过程中的作用及机制
2017-03-13张红刘念李征
张红,刘念,李征
(郑州大学附属南阳市中心医院,河南南阳473400)
Ⅰ型血管紧张素Ⅱ受体在ADPC向AIPC转变过程中的作用及机制
张红,刘念,李征
(郑州大学附属南阳市中心医院,河南南阳473400)
目的 探讨Ⅰ型血管紧张素Ⅱ受体(AT1R)在雄激素依赖性前列腺癌(ADPC)向雄激素非依赖性前列腺癌(AIPC)转变过程中的作用及机制。方法 取ADPC组织26例份、AIPC组织4例份、正常前列腺组织15例份,良性前列腺增生组织15例份,采用免疫组化法检测各组织AT1R、TGF-β蛋白表达,采用实时荧光定量PCR法检测LNCaP、C4-2系列细胞(C4、C4-2及 C4-2B细胞株)给予0、1×10-8、1×10-7、1×10-6mol/L血管紧张素Ⅱ(Ang Ⅱ)刺激(分别设为对照组及低、中、高剂量组)后AT1R、TGF-β mRNA的相对表达量。结果 正常前列腺组织、良性前列腺增生组织、ADPC组织、AIPC组织AT1R蛋白的相对表达量分别为1 337.49±229.85、3 683.55±251.51、6 408.50±318.00、7 088.17±410.22,两两比较P均<0.05;TGF-β蛋白的相对表达量分别为467.49±67.43、1 875.62±134.23、8 964.38±743.92、12 194.62±1 106.48,两两比较P均<0.01。LNCaP细胞和C4-2系列细胞中剂量、高剂量组 AT1R mRNA、TGF-β mRNA的相对表达量均高于同细胞对照组及同指标LNCaP细胞(P均<0.05),其中C4-2B细胞低剂量组 AT1R mRNA、TGF-β mRNA的相对表达量均高于同细胞对照组及同指标LNCaP细胞(P均<0.05)。结论 AT1R表达升高可促进ADPC转化为AIPC;其作用机制可能与增加TGF-β表达有关。
雄性激素依赖性前列腺癌;雄性激素非依赖性前列腺癌;Ⅰ型血管紧张素Ⅱ受体
近年来随着生活方式改变和人口老龄化加剧,我国前列腺癌的发病率呈明显上升趋势[1,2]。雄激素去势疗法是目前治疗前列腺癌的最有效方法[3],但适用于雄激素依赖性前列腺癌(ADPC)。研究发现,雄激素被阻断20个月左右,绝大多数ADPC会发展为雄激素非依赖性前列腺癌(AIPC)[4],但其机制尚不完全清楚。血管紧张素Ⅱ(Ang Ⅱ)与肿瘤细胞的增殖、迁移、侵袭和血管生成有关[5~9],在前列腺癌hPCPs细胞有丝分裂过程中发挥重要作用[9]。Ⅰ型血管紧张素Ⅱ受体(AT1R)是AngⅡ引起细胞增殖、血管生成等最重要的一类受体[8~11]。本研究探讨AT1R在ADPC向AIPC转变过程中的作用及机制。
1 材料与方法
1.1 材料 ①前列腺组织:选取2013年1月~2015年12月南阳市中心医院收治的30例前列腺癌患者手术切除标本,术后均经组织病理检查确诊。患者年龄50~77(69.2±6.8)岁,其中ADPC 26例、AIPC 4例;Gleason评分8~10分7例,7分11例,6分12例;TNM分期T1期5例,T2期21例,T3~4期3例。行前列腺癌根治性切除术1例,姑息性经尿道前列腺癌电切手术2例(T3bN3M1、T4bN0M0各1例),其余患者行前列腺癌内放射治疗。同期纳入15例份正常前列腺组织,15例份良性前列腺增生组织。②前列腺组织细胞:雄激素依赖低转移性细胞株LNCaP、雄激素非依赖高转移性C4-2系列细胞(包括C4、C4-2及C4-2B细胞株)均为本院实验室留存。③其他:AT1R单克隆抗体、TGF-β单克隆抗体、Smad-7单克隆抗体(美国Santa Cruz公司),AngⅡ(美国Sigma公司),TRIzol(美国Invitrogen公司),RPMI 1640培养基(美国Gibco公司),缬沙坦(瑞士诺华制药有限公司)。
1.2 前列腺组织AT1R、TGF-β蛋白表达检测 取所有前列腺组织,4%多聚甲醛固定,石蜡包埋,4 μm厚连续切片,采用免疫组化SP法检测前列腺组织AT1R、TGF-β蛋白表达。PBS替代一抗作为阴性对照。以细胞质或细胞膜出现棕黄色或棕色颗粒为阳性表达,采用Image ProPlus7.0软件分析图像,每张组织切片随机选取5个高倍镜(×200)视野,计数阳性细胞积分光密度(IOD)值。以IOD值表示目的蛋白的相对表达量。
1.3 LNCaP细胞、C4-2系列细胞AT1R mRNA、TGF-β mRNA表达检测
1.3.1 细胞培养与药物处理 将LNCaP细胞、C4-2系列细胞进行常规培养,取对数生长期细胞,调整细胞密度为1×106个/mL,分别接种于50 mL培养瓶中,每瓶加入含10% FBS、100 U/mL青链霉素、1 mmol/L L-谷氨酰胺的RPMI 1640基础培养液,5% CO2培养箱培育48 h。吸弃培养液,换用不含FBS的培养液5 mL,将LNCaP细胞及C4-2系列细胞均随机分为4组,每组6瓶。对照组加正常培养基,另外3组分别加入1×10-8、1×10-7、1×10-6mol/L的Ang Ⅱ(分别设为低、中、高剂量组)。各组继续培养48 h,收集细胞。
1.3.2 AT1R mRNA、TGF-β mRNA表达检测 采用实时荧光定量PCR法。取上述各组细胞,采用TRIzol法提取总RNA,逆转录得到cDNA。采用SYBR染料法进行实时荧光定量PCR,模版cDNA 0.5 μL、引物(20 mmol/L)0.5 μL、ddH2O 9 μL、SYBR Mix(2×)10 μL。采用2-ΔΔCt法计算各组AT1R mRNA、TGF-β mRNA的相对表达量。引物序列见表1。

表1 各基因的引物序列
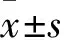
2 结果
2.1 各前列腺组织AT1R和TGF-β蛋白表达比较 AT1R蛋白在正常前列腺组织、良性前列腺增生组织、ADPC组织、AIPC组织中均有阳性表达,弥散分布于基质细胞和上皮细胞。正常前列腺组织、良性前列腺增生组织、ADPC组织、AIPC组织AT1R蛋白的相对表达量分别为1 337.49±229.85、3 683.55±251.51、6 408.50±318.00、7 088.17±410.22。各组织AT1R蛋白的相对表达量两两比较P均<0.05。TGF-β蛋白在正常前列腺组织、良性前列腺增生组织、ADPC组织、AIPC组织中均有阳性表达,弥散分布于细胞基质。正常前列腺组织、良性前列腺增生组织、ADPC组织、AIPC组织TGF-β蛋白的相对表达量分别为467.49±67.43、1 875.62±134.23、8 964.38±743.92、12 194.62±1 106.48。各组织TGF-β蛋白的相对表达量两两比较P均<0.01。
2.2 各前列腺细胞AT1R mRNA、TGF-β mRNA表达比较 LNCaP细胞和C4-2系列细胞中剂量、高剂量组 AT1R mRNA、TGF-β mRNA的相对表达量均高于同细胞对照组及同指标LNCaP细胞(P均<0.05),其中C4-2B细胞低剂量组 AT1R mRNA、TGF-β mRNA的相对表达量高于同细胞对照组及同指标LNCaP细胞(P均<0.05)。见表2。

表2 LNCaP细胞、C4-2系列细胞AT1R mRNA、TGF-β mRNA的相对表达量比较
注:与同细胞对照组比较,*P<0.05;与同指标LNCaP细胞比较,#P<0.05。
3 讨论
ADPC发展为AIPC的原因主要包括两个方面[4]:一方面部分前列腺癌患者癌组织中含有少量AIPC细胞,雄激素去势后,ADPC细胞被杀灭,AIPC细胞存活并生长;另一方面,绝大多数前列腺癌患者在雄激素去势后,一部分未被杀死的ADPC细胞转化为AIPC细胞[12]。但目前关于ADPC发展为AIPC的机制尚不完全清楚。有研究发现,AngⅡ与其受体AT1R结合可介导组织增生、肿瘤血管生成[6,11],AngⅡ本身具有类生长因子的作用,通过与AT1R结合而促进细胞的分裂与增殖,且可与多种原癌基因和抑癌基因相互作用[13]。本研究结果显示,AT1R和TGF-β蛋白在正常前列腺组织、良性前列腺增生组织和前列腺癌组织中均有阳性表达,弥散分布于基质细胞和上皮细胞胞,在前列腺癌组织中阳性表达更高,且AIPC组织AT1R和TGF-β蛋白表达明显高于ADPC组织。提示AT1R和TGF-β可能参与ADPC向AIPC的转变过程,且其表达变化与转化趋势一致。
AngⅡ参与多种病理生理进程,如间质纤维化[14]、炎症[15,16]、肿瘤[17]等,TGF-β是AngⅡ关键的下游分子之一[15]。Lanz等[16]研究发现,Ang Ⅱ刺激星形胶质细胞和小胶质细胞的炎症反应,激活血小板吸附蛋白1激酶促进TGF-β表达可能是其作用机制。Nataatmadja等[17]研究发现,AT1R可促进胸主动脉瘤进展,促进TGF-β 和Smad3表达是其作用机制。有研究发现,TGF-β大量分泌和再分布能够促进ADPC细胞向AIPC细胞转化[18,19]。ADPC向AIPC转化过程是一个渐变的过程[20]。本研究采用ADPC细胞LNCaP和雄激素不同程度依赖性前列腺癌细胞C4、C4-2和C4-2B细胞模拟前列腺癌的临床进展过程;结果显示,中剂量组和高剂量组均可促进LNCaP细胞和C4-2细胞系列AT1R mRNA、TGF-β mRNA的表达,其中C4-2细胞AT1R mRNA、TGF-β mRNA的表达明显高于LNCaP细胞,且C4-2B细胞株对Ang Ⅱ最为敏感。
综上所述,AT1R表达升高可促进ADPC向AIPC转化;其作用机制可能与促进TGF-β表达有关。
[1] Scher HI. Defining new standards of care for men with prostate cancer[J]. Lancet, 2016,387(10024):1135-1137.
[2] Dai X, Fang X, Ma Y, et al. Benign prostatic hyperplasia and the risk of prostate cancer and bladder cancer: a meta-analysis of observational studies[J]. Medicine (Baltimore), 2016,95(18):e3493.
[3] Kushnir T, Gofrit ON, Elkayam R, et al. Impact of androgen deprivation therapy on sexual and hormonal function in patients receiving radiation therapy for prostate cancer[J]. Isr Med Assoc J, 2016,18(1):49-53.
[4] Li J. PTEN, a putative protein tyrosine phosphatase gene mutated in human brain, breast, and prostate cancer[J]. Science, 2012, (275):1943-1947.
[5] Osumi H, Matsusaka S, Wakatsuki T, et al. Angiotensin Ⅱ type-1 receptor blockers enhance the effects of bevacizumab-based chemotherapy in metastatic colorectal cancer patients[J]. Mol Clin Oncol, 2015,3(6):1295-1300.
[6] Oh E, Kim JY, Cho Y, et al. Overexpression of angiotensin Ⅱ type 1 receptor in breast cancer cells induces epithelial-mesenchymal transition and promotes tumor growth and angiogenesis[J]. Biochim Biophys Acta, 2016,1863(6 Pt A):1071-1081.
[7] Singh A, Nunes JJ, Ateeq B. Role and therapeutic potential of G-protein coupled receptors in breast cancer progression and metastases[J]. Eur J Pharmacol, 2015,763(Pt B):178-183.
[8] Kinoshita J, Fushida S, Harada S, et al. Local angiotensin Ⅱ-generation in human gastric cancer: correlation with tumor progression through the activation of ERK1/2, NF-kappaB and survivin[J]. Int J Oncol, 2009,34(6):1573-82.
[9] Wennemuth G, Aumüller G. Angiotensin Ⅱ-mediated calcium signals and mitogenesis in human prostate stromal cell line hPCPs [J]. Br J Pharmacol, 2005,144(1):3-10.
[10] Molteni A, Ward WF, Tsao CH, et al. Cytostatic properties of some angiotensin I converting enzyme inhibitors and of angiotensin Ⅱ type Ⅰ receptor antagonists[J]. Curr Pharm Des, 2013,2(9):751.
[11] Inuzuka T, Fujioka Y, Tsuda M, et al. Attenuation of ligand-induced activation of angiotensin Ⅱ type 1 receptor signaling by the type 2 receptor via protein kinase C[J]. Sci Rep, 2016,(6):21613.
[12] 潘寿华,阎家峻,郑专.前列腺癌雄激素依赖转化后雄激素受体基因表达变化的研究[J].中国癌症杂志,2011,21(4):287-289.
[13] Huang W, Yu LF, Zhong J, et al. Angiotensin Ⅱ type 1 receptor expression in human gastric cancer and induces MMP2 and MMP9 expression in MKN-28 cells[J]. Dig Dis Sci, 2008,53(1):163-168.
[14] Sakurai T, Kudo M, Fukuta N, et al. Involvement of angiotensin Ⅱ and reactive oxygen species in pancreatic fibrosis[J]. Pancreatology, 2011(Suppl 2):7-13.
[15] 晏平,侯婧瑛,郑韶欣,等.心肌干细胞调控ANG Ⅱ/AT1R/TGF-β1/SMAD/CX43通路改进心电生理学稳定性和室颤阈值[J].中国组织工程研究,2016,20(28):4226-4233.
[16] Lanz TV, Ding Z, Ho PP, et al. Angiotensin Ⅱ sustains brain inflammation in mice via TGF-β[J]. J Clin Invest, 2010,120(8):2782-2794.
[17] Nataatmadja M, West J, Prabowo S, et al. Angiotensin Ⅱ receptor antagonism reduces transforming growth factor beta and smad signaling in thoracic aortic aneurysm[J]. Ochsner J, 2013,13(1):42-48.
[18] Zhang X, Ni Z, Duan Z, et al. Overexpression of E2F mRNAs associated with gastric cancer progression identified by the transcriptionfactor and miRNA coregulatory network analysis[J]. PLoS One, 2015,10(2):e0116979.
[19] Tang J, Xiao L, Cui R, et al. CX3CL1 increases invasiveness and metastasis by promoting epithelial-to-mesenchymal transition through the TACE/TGF-α/EGFR pathway in hypoxic androgen-independent prostate cancer cells[J]. Oncol Rep, 2016,35(2):1153-1162.
[20] 王海峰,刘武江,金杰,等.雄激素受体在前列腺癌细胞激素非依赖转化中的表达及调控[J].北京大学学报(医学报),2011,43(4):490-495.
河南省基础与前沿技术研究计划项目(142300410034)。
10.3969/j.issn.1002-266X.2017.08.027
R737.25
B
1002-266X(2017)08-0083-03
2016-04-06)
