糖尿病大鼠视网膜组织醛脱氢酶活性与表达量变化及其意义
2017-03-13田静廖荣丰韩惠杰
田静,廖荣丰,韩惠杰
(1安徽医科大学第一附属医院,合肥230022;2淮北市人民医院)
糖尿病大鼠视网膜组织醛脱氢酶活性与表达量变化及其意义
田静1,2,廖荣丰1,韩惠杰2
(1安徽医科大学第一附属医院,合肥230022;2淮北市人民医院)
目的 探讨醛脱氢酶(ALDH)在糖尿病视网膜病变发生、发展中的作用。方法 选择SD大鼠40只,随机分为模型组、对照组各20只。模型组采用腹腔注射链脲佐菌素建立糖尿病模型,对照组同期腹腔注射等体积柠檬酸钠缓冲液。两组分别于建模3天及建模8、16周检测体质量及血糖;建模8、16周各处死10只,检测视网膜组织ALDH活性和表达量,采用免疫组化法检测视网膜组织bcl-2、bax表达,采用TUNEL法检测视网膜神经细胞凋亡指数。结果 两组体质量随建模时间延长均明显增加(P均<0.05),但血糖变化不明显;与对照组比较,模型组建模8、16周体质量明显低于对照组同期(P均<0.05),而血糖水平明显高于对照组同期(P均<0.05)。与对照组比较,模型组建模8、16周ALDH活性和表达量均明显升高(P均<0.05);模型组建模16周ALDH活性和表达量均低于建模8周(P均<0.05);对照组建模8、16周ALDH活性和表达量变化不明显(P均>0.05)。模型组建模8、16周bcl-2、bax表达及视网膜神经细胞凋亡率均高于对照组同期,且建模16周明显高于建模8周(P均<0.05),而对照组变化不明显(P>0.05)。结论 糖尿病大鼠视网膜组织ALDH活性与表达量升高,其活性与表达量变化可促进糖尿病大鼠视网膜神经细胞凋亡,且与凋亡严重程度有关。
糖尿病视网膜病变;醛脱氢酶;细胞凋亡;bcl-2;bax
糖尿病视网膜病变(DR)的发病机制尚未完全清楚,多数学者认为可能与脂质过氧化反应和细胞凋亡有关[1,2]。高血糖可导致机体代谢异常并诱发一系列的病理生理变化,产生多种氧自由基和细胞因子,进而导致眼组织细胞的功能和代谢异常,其中脂质过氧化物的产生在这一过程中发挥着重要作用[3]。醛脱氢酶(ALDH)能将有毒性的醛类氧化降解为相应的酸,进而降低其对机体细胞的毒性作用,但糖尿病眼部并发症的发生是否与ALDH活性变化有关尚不完全清楚[4]。2013年3月~2016年3月,本研究观察了糖尿病大鼠视网膜组织ALDH活性与表达量变化,并探讨其意义。
1 材料与方法
1.1 材料 健康雄性SD大鼠40只,SPF级,7~8周龄,体质量160~180(170±6)g,购自南京中医药大学实验动物中心,动物合格证号:SCXK(沪)2008-0033。所有大鼠分笼饲养,5只/笼,自由饮水、摄食,室温22~25 ℃,相对湿度45%~46%,光照/黑暗12 h交替。Well Reader便携式酶标仪,德国R-Biopharm公司;5417R型高速离心机,德国Eppendorf公司;Stemi DR型动物立体显微镜,德国Zeiss公司;超声粉碎仪、匀浆器,宁波新芝生物股份有限公司。链脲佐菌素(STZ)、无菌辅酶Ⅰ、磷酸钠、乙二胺四乙酸(EDTA)和二硫苏糖醇(dTT),美国Sigma公司;ALDH ELISA试剂盒,武汉优尔生科技股份有限公司;三诺GA-3血糖仪、血糖试纸,长沙三诺生物传感股份有限公司。兔抗大鼠bcl-2、bax单克隆抗体和羊抗兔IgG抗体,南京金斯瑞生物科技有限公司。TUNEL试剂盒,上海哈灵生物科技有限公司。
1.2 动物分组及模型制备 所有大鼠适应性饲养1周,随机分为模型组、对照组,每组20只。模型组参照文献[5,6]建立糖尿病模型,注射3天尾静脉血糖水平为16.7~22.2 mmol/L,即造模成功。对照组仅注射等体积的柠檬酸钠缓冲液。模型组给予高脂饲料、对照组给予常规饲料,连续喂养16周。
1.3 相关指标观察
1.3.1 体质量及血糖 模型组建模第3天及建模第8、16周,对照组同期,称量体质量,断尾取血约0.5 mL,置于抗凝处理的EP管中,12 000 r/min离心10 min,取血浆,保存备检。采用三诺GA-3血糖仪及配套试纸检测血糖。
1.3.2 视网膜组织上清液 ALDH活性及表达量 ①ALDH活性:模型组建模第8、16周,对照组同期,随机处死10只,快速摘除双侧眼球,取部分视网膜组织置于Eppendorf管中,加入一定量的匀浆液(20 mmol/L磷酸钠缓冲液、2.0 mmol/L EDTA和1.0 mmol/L dTT),充分匀浆后超声破碎30 s,12 000 r/min离心10 min,取上清液。取视网膜上清液25 μL置于96孔板,加入含1 mmol/L dTT的焦磷酸钠缓冲液(100 mmol/L,pH 8.0) 175 μL、20 mmol/L无菌辅酶Ⅰ 25 μL、丙醛25 μL,室温反应5 min,酶标仪检测340 nm波长下吸光度(A)值。以不加蛋白的缓冲液作为空白对照。以A值表示ALDH活性。试验重复3次,取平均值。②ALDH表达量:取部分视网膜上清液,采用ELISA法检测ALDH。所有操作严格按试剂盒说明书进行。
1.3.3 视网膜组织bcl-2、bax表达 采用免疫组化法。取视网膜组织,制备石蜡切片。切片常规脱蜡,3% H2O2室温孵育,微波抗原修复,正常山羊血清封闭,依次加入兔抗大鼠bcl-2或bax单克隆抗体(1∶50)、生物素化羊抗兔IgG二抗(1∶100),以PBS代替一抗作为阴性对照,DAB显色,复染,脱水,透明,中性树胶封片,显微镜下观察。bcl-2、bax阳性表达均定位于细胞质,呈棕色或黄色颗粒。随机选取5个200倍视野,计数阳性细胞及总细胞数,计算阳性表达率。阳性表达率=阳性细胞/总细胞数×100%。
1.3.4 视网膜神经细胞凋亡指数 取视网膜组织,制备石蜡切片。切片常规脱蜡、水化,按TUNEL试剂盒说明进行处理,DAB显色,苏木素复染,显微镜下观察。凋亡细胞的细胞核呈棕色或棕褐色。每张切片随机取5个视野,计数阳性细胞及总细胞数,计算凋亡指数。凋亡指数=凋亡细胞数/细胞总数×100%。

2 结果
2.1 两组体质量及血糖水平变化 见表1。
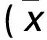
表1 两组体质量及血糖水平变化±s)
注:与同组建模3天比较,*P<0.05;与同组建模8周比较,#P<0.05;与对照组同期比较,△P<0.05。
2.2 两组视网膜组织ALDH活性及表达量比较 见表2。
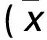
表2 两组视网膜组织ALDH活性及表达量变化±s)
注:与同组建模8周比较,*P<0.05;与对照组同期比较,#P<0.05。
2.3 两组视网膜组织凋亡相关因子及神经细胞凋亡指数比较 见表3。
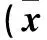
表3 两组视网膜组织凋亡相关因子及神经细胞凋亡指数比较±s)
注:与同组建模8周比较,*P<0.05;与对照组同期比较,#P<0.05。
3 讨论
DR是糖尿病最严重的并发症之一,可严重影响患者的生活质量[7,8]。DR的临床表现主要为视力下降、视网膜微血管瘤和点状出血、视网膜出血斑、视网膜静脉扩张等。目前认为,DR是糖尿病致盲的主要原因[9],但其发病机制仍不完全清楚。大多数学者认为,DR至少包含视网膜毛细血管微动脉瘤形成、血管渗透性增加、血管闭塞、新生血管、纤维组织增生和纤维血管膜收缩等病理过程,神经细胞凋亡以及脂质过氧化物增多可能始终伴随DR的发生和发展过程[10,11]。
有研究表明,糖尿病患者高血糖及其代谢过程可促使大量的氧自由基和脂质过氧化产物生成,如脂质衍生的醛类,其通过结构中异常活跃的碳碳不饱和键与体内的谷胱甘肽、赖氨酸、组氨酸和半胱氨酸等蛋白质成分结合,干扰细胞信号转导并破坏正常蛋白质与DNA合成,进而产生细胞毒性,导致眼组织病变[12]。ALDH是体内重要的抗氧化应激保护因子,通过参与多种脂肪族及芳香族醛类的物质代谢或解毒过程而减轻氧化应激反应;体内的ALDH对氧化应激导致的神经细胞及内皮细胞损伤均有较强的拮抗作用。正常眼组织可依靠ALDH降解有毒性的脂质衍生的醛类,降低醛类对机体细胞的毒性作用,保持角膜与晶状体的透明性并能防止视网膜病变的发生[13,14];而ALDH基因突变者不仅空腹血糖升高,视网膜病变亦随之发生。随着糖尿病病情发展,机体抗脂质过氧化物酶的抗氧化能力会代偿性增强,ALDH的活性和表达量亦随之升高,但随着时间延长而逐渐降低[15,16]。本研究模型组视网膜ALDH活性和表达量在建模8周时明显升高,建模16周时虽高于对照组,但与建模8周时比较,其活性和表达量已明显降低,与以往研究结果基本一致。
DR不仅仅是微血管病变,还是一种神经变性性疾病,而视网膜神经细胞凋亡是其早期病理性表现之一。bcl-2是依赖线粒体凋亡通路的调控基因,主要分布于线粒体外膜、核周膜和内质网,通过抑制线粒体细胞色素C释放而发挥抗凋亡作用;bax存在于细胞质中,受凋亡信号刺激后,使线粒体外膜通透性和细胞色素C的释放增加,诱导细胞凋亡。二者是bcl-2家族最主要的抑制凋亡和促进凋亡蛋白[17,18]。本研究发现,与对照组比较,模型组视网膜组织bax、bcl-2表达均明显升高,随着建模时间延长,其表达亦随之升高;但与bcl-2表达相比,bax表达升高更明显,即bcl-2/bax随着时间延长显著降低;此外,本研究还发现,随着建模时间延长,模型组视网膜神经细胞凋亡指数明显升高,而对照组变化不明显。提示糖尿病大鼠视网膜细胞存在凋亡现象,且随着血糖水平升高,其凋亡程度逐渐加重,这可能是导致其视力下降的主要原因之一。有研究显示,通过基因转导使ALDH基因高表达可使细胞对体外化学毒性物质具有防护作用,还能通过抗氧化应激作用对抗细胞凋亡[19]。由此推测,糖尿病大鼠视网膜神经细胞凋亡程度增加可能与ALDH活性降低有关。
综上所述,糖尿病大鼠视网膜组织ALDH活性与表达量升高,但随着时间延长而降低;ALDH活性与表达量升高可促进DR的发生,且与视网膜神经细胞凋亡的严重程度有关。
[1] Cunha-Vaz J, Ribeiro L, Lobo C. Phenotypes and biomarkers of diabetic retinopathy[J]. Prog Retin Eye Res, 2014(41):90-111.
[2] Mastropasqua R, Toto L, Cipollone F, et al. Role of microRNAs in the modulation of diabetic retinopathy[J]. Prog Retin Eye Res, 2014(43):92-107.
[3] 胡丽叶,宋光耀,朱旅云,等.2型糖尿病大鼠肝脏LOX-1、eNOS、PPARγ蛋白表达及罗格列酮的干预作用[J].临床误诊误治,2015,28(6):109-113.
[4] 张文龙,王江飞,张伟.ALDH与恶性肿瘤干细胞相关研究进展[J].中国微侵袭神经外科杂志,2014,19(4):184-186.
[5] 魏占英,沈丽,冯晓慧,等.高脂饲料喂养时间和STZ剂量对建立2型糖尿病大鼠模型的影响[J].医学研究杂志,2014,43(2):42-46.
[6] 段惠惠,黄建梅,于素云,等.STZ糖尿病大鼠视网膜病变模型的再评价[J].中国比较医学杂志,2013,23(5):12-18.
[7] Park SW, Yun JH, Kim JH, et al. Angiopoietin 2 induces pericyte apoptosis via α3β1 integrin signaling in diabetic retinopathy[J]. Diabetes, 2014,63(9):3057-3068.
[8] Chew EY, Davis MD, Danis RP, et al. The effects of medical management on the progression of diabetic retinopathy in persons with type 2 diabetes: the action to control cardiovascular risk in diabetes (ACCORD) eye study[J]. Ophthalmology, 2014,121(12):2443-2451.
[9] 王叶楠,卢海,刘大川,等.2型糖尿病患者增生性糖尿病视网膜病变玻璃体切割术后玻璃体再积血原因分析[J].中华实验眼科杂志,2014,32(11):1021-1024.
[10] 韩丽媛,俞梅,华启航,等.糖尿病性视网膜病变与脂联素的研究进展[J].宁波大学学报(理工版),2014,27(2):113-116.
[11] 张凤俊,易敬林,李晶明,等.糖尿病视网膜病变发病机制研究进展[J].眼科新进展,2016,36(6):584-587.
[12] 刘文浩,张树风,程丽霞,等.甘精胰岛素联合拜糖平对老年2型糖尿病氧自由基代谢的影响[J].中国医药导报,2015,12(1):71-74.
[13] 张丽,杨文婷,郑鹏生.ALDH1在宫颈癌组织中的表达及临床意义[J].中国妇幼健康研究,2016,27(1):45-48.
[14] 王明玲,胡淑芳,曹建雄,等.糖尿病大鼠眼组织中醛脱氢酶活性及表达量的变化及其意义[J].中华实验眼科杂志,2013,31(1):70-74.
[15] 张瑞,王甲莉,陈玉国.ALDH2在糖尿病及其并发症中作用的研究进展[J].生理科学进展,2015,46(3):229-232.
[16] 谢学军,宋明霞,张梅,等.补肾活血中药复方对高糖及糖基化终末产物条件下视网膜MÜller细胞的影响[J].中国中西医结合杂志,2015,35(6):735-740.
[17] 旷劲松,赵玉蓉,赵玉岩,等.福辛普利联合非诺贝特对糖尿病小鼠视网膜病变干预作用的研究[J].天津医药,2016,44(3):322-326.
[18] 法利,裴存文,金约西.羟苯磺酸钙对糖尿病大鼠视网膜细胞凋亡的影响[J].中国临床药理学杂志,2016,32(14):1314-1317.
[19] 徐丹令,孙爱军,王时俊,等.乙醛脱氢酶2抑制剂大豆甙对缺氧心肌细胞的MAPK信号转导作用[J].解剖学报,2009,40(2):256-259.
廖荣丰(E-mail: babytoo99@163.com)
10.3969/j.issn.1002-266X.2017.08.015
R587.2
A
1002-266X(2017)08-0050-03
2016-11-09)
