杜仲叶绿原酸提取物联合西红花苷对肝癌细胞胆固醇代谢的影响
2017-03-13赖玲林肖苑彭小芳冷恩念莫镇涛李文娜陈阳李意奇
赖玲林,肖苑,彭小芳,冷恩念,莫镇涛,李文娜,陈阳,李意奇
(1遵义医学院珠海校区,广东珠海519041;2广东省第二人民医院;3贵州省人民医院)
杜仲叶绿原酸提取物联合西红花苷对肝癌细胞胆固醇代谢的影响
赖玲林1,2,肖苑3,彭小芳1,冷恩念1,莫镇涛1,李文娜1,陈阳1,李意奇1
(1遵义医学院珠海校区,广东珠海519041;2广东省第二人民医院;3贵州省人民医院)
目的 观察杜仲叶绿原酸提取物(CAEF)联合西红花苷对人肝癌细胞HepG2胆固醇代谢的影响,并探讨其可能的作用机制。方法 将人肝癌细胞HepG2随机分为空白对照组、油酸诱导组、辛伐他汀组、CAEF组、联合用药组。油酸诱导组、辛伐他汀组、CAEF组、联合用药组分别加入油酸诱导脂肪变性模型;同时,辛伐他汀组加入10 μmol/L的辛伐他汀10 μL,CAEF组加入25 mg/L 的CAEF 10 μL,联合用药组加入含1 μmol/L西红花苷、30 μmol/L绿原酸、10 μmol/L京尼平苷、10 μmol/L槲皮素的混合液10 μL;空白对照组仅加入等体积培养基。取各组干预48 h细胞,行油红O染色,检测细胞内中性脂滴含量。取干预24、48 h细胞上清液,检测TC、TG含量。采用RT-PCR法检测胆固醇代谢相关基因(ABCA1、SREBP2、CYP7A1、LXRα、AMPK2α、HMGCR)表达,免疫细胞化学法和Western blotting法检测HMGCR蛋白表达。结果 辛伐他汀组、CAEF组、联合用药组干预48 h,细胞内中性脂滴含量明显降低,其作用强度依次为联合用药组>CAEF组>辛伐他汀组(P均<0.05);与对照组比较,CAEF组、联合用药组干预24、48 h时细胞外液TC、TG含量明显增加,细胞外液TC、TG含量依次为联合用药组>CAEF组>辛伐他汀组(P均<0.05)。CAEF组、联合用药组ABCA1、CYP7A1、AMPK2α mRNA表达明显升高,SREBP2、HMGCR mRNA表达明显降低(P均<0.05);此外,联合用药组LXRα mRNA表达明显降低(P<0.05)。辛伐他汀组、CAEF组、联合用药组HMGCR蛋白表达明显降低,以联合用药组降低最明显(P均<0.05)。结论 CAEF联合西红花苷可协同抑制肝癌细胞脂质积聚,其作用机制可能与调控肝癌细胞胆固醇代谢相关基因和蛋白的表达有关。
脂类代谢紊乱;肝癌细胞;杜仲叶;绿原酸提取物;西红花苷
药用杜仲是杜仲科植物杜仲的干燥树皮,具有补益肝肾、强筋壮骨、调理冲任、固经安胎等功效,是中国名贵的滋补药材,早在《神农本草经》里就有记载。杜仲皮含有绿原酸、槲皮素、京尼平苷等多种活性成分,杜仲叶中亦含有类似的活性成分,由于杜仲皮资源较匮乏,而杜仲叶资源丰富且容易取得,故杜仲叶取代杜仲皮已被认可[1]。现代药理学研究表明,杜仲叶具有降压、调脂等作用,这些作用可能与其含有绿原酸、槲皮素、京尼平苷等有关[2]。西红花苷主要存在于西红花、栀子等植物中,具有保护心血管、抗肿瘤等作用,同时能降低胰脂酶活性,促进胆汁酸排泄,抑制胆固醇合成[3]。但目前国内外鲜见关于二者联合应用的报道。2013年1月~2016年1月,我们观察了杜仲叶绿原酸提取物(CAEF)联合西红花苷对人肝癌细胞HepG2胆固醇代谢的影响,并初步分析其可能的作用机制。
1 材料与方法
1.1 材料 人肝癌HepG2细胞,由遵义医学院珠海校区中心实验室提供,储存于液氮中。主要药品:CAEF(绿原酸含量>42.4%)、西红花苷(含量>98%),由本课题组前期制备;绿原酸(含量>98%),上海金穗生物科技有限公司。主要仪器:PCR仪,杭州博日科技有限公司;紫外分光光度计,日本岛津公司;核酸蛋白测定仪,德国Eppendorf公司;电泳仪,上海天能科技有限公司;全自动酶标仪,美国BioTek公司。相关引物及试剂:全部引物设计及合成,上海生工生物工程股份有限公司;TC、TG试剂盒,北京北化康泰临床试剂有限公司;TRIzol Reagent RNA提取试剂盒、DAB显色试剂盒,北京中杉金桥生物技术有限公司;免疫组化染色试剂盒、羟甲基戊二酸单酰辅酶A还原酶(HMGCR)一抗,北京博奥森生物技术有限公司;油红O,美国Sigma公司。
1.2 HepG2细胞内中性脂滴含量及细胞外液TC、TG含量检测 ①细胞内中性脂滴含量:采用油红O染色法。取HepG2细胞制备细胞悬液,调整密度为1×105个/mL,接种于6孔板,每孔3 mL。随机将细胞分为空白对照组、油酸诱导组、辛伐他汀组、CAEF组、联合用药组。37 ℃ 5% CO2培养箱培养24 h,待细胞完全贴壁后,除空白对照组外,其余各组分别加入油酸10 μL诱导脂肪变性模型,同时辛伐他汀组加入10 μmol/L的辛伐他汀10 μL,CAEF组加入25 mg/L的 CAEF 10 μL,联合用药组加入含1 μmol/L的西红花苷、30 μmol/L的绿原酸、10 μmol/L的京尼平苷、10 μmol/L的槲皮素混合液10 μL[4~6];空白对照组仅加入培养基10 μL。各组均干预48 h,弃培养基,PBS冲洗2次,4%多聚甲醛固定10 min,加入油红O工作液(三蒸水∶油红=2∶3)染色,镜下观察拍照。采用Image软件分析图像,以图像光密度(OD)值表示细胞内中性脂滴的含量。②细胞外液TC、TG含量:取空白对照组、辛伐他汀组、CAEF组、联合用药组干预24、48 h细胞培养液,采用全自动酶标仪检测TC、TG含量。所有操作严格按试剂盒说明进行。
1.3 胆固醇代谢相关基因的表达检测 采用RT-PCR法[5]。取空白对照组、辛伐他汀组、CAEF组、联合用药组干预48 h细胞,按TRIzol法提取细胞总RNA,根据PrimeScriptTMRT Reagent Kit试剂盒说明逆转录为cDNA。在GenBank上查询ATP结合盒转运子A1(ABCA1)、固醇调节元件结合蛋白2(SREBP2)、胆固醇7α-羟化酶(CYP7A1)、肝X受体α(LXRα)、腺苷酸活化蛋白激酶α2(AMPK2α)、HMGCR基因序列。引物序列:ABCA1上游引物:5′-AGGCCCAGACCTGTAAATGC-3′,下游引物:5′-CTCACCAACCTTGCCAACTTC-3′,产物长度450 bp;SREBP2上游引物:5′-CAGACGCCAAGATGCACAAG-3′,下游引物:5′-TGGCTCATCTTTGACCTTTGC-3′,产物长度323 bp;CYP7A1上游引物:5′-CATTTGGGCACAGAAGCATTG-3′,下游引物:5′-AGGCAGCGGTCTTTGAGTTAG-3′,产物长度174 bp;LXRα上游引物:5′-AAGAAACTGAAGCGGCAAGA-3′,下游引物:5′-AGCAATGAGCAAGGCAAACT-3′,产物长度555 bp;AMPK2α上游引物:5′-TCAATCG->TTCTGTCGCCAC-3′,下游引物:5′-ATACGGTTTGCTCTGACTTCG-3′,产物长度530 bp;HMGCR上游引物:5′-CTCCGCAGGCTATTTGTTCAG-3′,下游引物:5′-GCTAAGAGCGTTCGTGGGTC-3′,产物长度620 bp;GAPDH上游引物:5′-ACTCCTCCACCTTTGACGCTG-3′,下游引物:5′-CTCTCTTCCTCTTGTGCTCTTGC-3,产物长度182 bp。PCR反应体系共10 μL:2×Premix EX TaqTM5.0 μL,PCR Forward Primer(10 μmol/L) 1.0 μL,PCR Reverse(10 μmol/L) 1.0 μL,cDNA templates 0.5 μL;dH2O 2.5 μL;反应条件:95 ℃ 3 min,95 ℃ 20 s,56 ℃ 30 s(SREBP2、NR1H3)、57 ℃ 30 s(ABCA1、PRKAA2、HMGCR)或58 ℃ 30 s(CYP7A1),72 ℃ 45 s,共32个循环,最后72 ℃延伸5 min。琼脂糖凝胶电泳检测PCR产物,紫外透射仪上观察照相,采用Quality One软件对图像进行灰度值分析。以GAPDH为内参,计算ABCA1、SREBP2、CYP7A1、LXRα、AMPK2α、HMGCR mRNA的相对表达量。
1.4 HMGCR蛋白表达检测 ①免疫细胞化学法。取空白对照组、辛伐他汀组、CAEF组、联合用药组干预48 h细胞,甲醛固定,0.5% TritonX-100孵育15 min,3%过氧化氢孵育10 min,山羊血清封闭液孵育10 min,1∶50稀释的HMGCR一抗4 ℃孵育过夜,生物素化二抗孵育30 min,辣根酶标记链霉卵白素孵育30 min,室温DAB显色25 min,苏木素复染,流水冲洗返蓝,梯度乙醇脱水干燥,二甲苯透明,中性树胶封片,镜下观察拍照,使用Image软件分析图像。②Western blotting法。取空白对照组、辛伐他汀组、CAEF组、联合用药组干预48 h细胞,按照试剂盒说明提取细胞蛋白,BCA法定量。蛋白变性后,经SDS-PAGE电泳分离并转膜,封闭后分别加入一抗、二抗孵育,ECL显色,暗室压片。采用Quantity One软件分析图像。

2 结果
2.1 各组细胞内中性脂滴及细胞外液TC、TG含量比较 见表1。
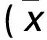
表1 各组细胞内中性脂滴及细胞外液TC、TG含量比较±s)
注:与空白对照组比较,*P<0.05;与油酸诱导组比较,#P<0.05;与辛伐他汀组比较,△P<0.05;与CAEF组比较,▲P<0.05;与同指标作用24 h比较,▽P<0.05。
2.2 各组ABCA1、SREBP2、CYP7A1、LXRα、AMPK2α、HMGCR mRNA表达比较 见表2。

表2 各组ABCA1、SREBP2、CYP7A1、LXRα、AMPK2α、HMGCR mRNA的相对表达量比较
注:与空白对照组比较,*P<0.05;与辛伐他汀组比较,#P<0.05;与CAEF组比较,△P<0.05。
2.3 各组HMGCR表达比较 免疫细胞化学法结果显示,空白对照组HMGCR的相对表达量为0.020±0.020,辛伐他汀组为0.008±0.010,CAEF组为0.011±0.010,联合用药组为0.010±0.010;Western blotting法结果显示,空白对照组HMGCR的相对表达量为0.760±0.090,辛伐他汀组为0.450±0.060,CAEF组为0.650±0.050,联合用药组为0.520±0.050。与对照组相比,辛伐他汀组、CAEF组、联合用药组HMGCR的相对表达量明显降低,但联合用药组降低效果最明显(P均<0.05)。
3 讨论
杜仲叶含有多种有效成分,本课题组前期研究表明,CAEF在体外抑制胰脂酶活性、抗氧化等作用均强于绿原酸纯品,故推测CAEF的药效可能为多种有效组分综合作用的结果[5]。有研究报道,杜仲叶发挥调脂作用的主要活性物质可能为绿原酸、槲皮素、京尼平苷[7]。栀子的主要有效成分为西红花苷,具有较好的调脂活性。但二者联合应用是否具有协同效应相关研究较少。
油红O染色发现,联合用药组和CAEF组均能使HepG2细胞内中性脂滴含量降低,且作用明显强于辛伐他汀组。进一步研究发现,联合用药对HepG2细胞作用48 h,可显著增加TC、TG外排量,其作用明显强于单用CAEF或辛伐他汀,且对TC的抑制作用强于TG,与油红O染色结果基本一致。
ABCA1可参与胆固醇逆转运(RCT)的初始阶段,即将细胞内的胆固醇通过跨膜转运运输到HDL,在HDL-C合成和RCT中发挥重要作用。增加ABCA1的活性不仅可使巨噬细胞中胆固醇外流增加,提高RCT;还可使肠黏膜细胞中胆固醇分泌增加,胆固醇吸收减少[8]。CYP7A1是胆汁酸合成经典途径的限速酶,增加其活性,可促进胆固醇向胆汁酸转化,进而降低体内胆固醇的含量[9]。AMPK是调控体内能量代谢的重要蛋白激酶,催化活性部位AMPK2α亚单位与体内TC、TG的代谢密切相关[10]。正常肝细胞脂质含量的稳定依赖SREBPs的调节,SREBPs位于细胞内质网上,可调控体内胆固醇、自由脂肪酸(FFA)和TG等合成。其中SREBP1主要调控FFA和TG合成,SREBP2主要调控胆固醇代谢,其靶基因包括与TC合成相关的一系列酶,如HMGCR[11]。HMGCR是体内合成胆固醇的限速酶,该酶主要存在于肝脏、小肠等组织细胞中,能将HMG-CoA转化为甲羟戊酸,通过甲羟戊酸途径最终生成胆固醇,降低其活性可直接减少体内胆固醇的合成[12]。LXRα作为转录因子,其靶基因包括HMGCR、ABCA1、CYP7A1和SREBP2等基因,抑制其活性可降低体内脂质含量[13]。本研究CAEF组和联合用药组SREBP2、HMGCR mRNA表达均降低, ABCA1、CYP7A1、AMPK2α mRNA表达均升高。提示CAEF联合西红花苷可能通过上调ABCA1 mRNA表达使肝细胞中TC外排增加;上调CYP7A1 mRNA表达而促进肝脏内TC转化;上调AMPK2α mRNA表达而改善脂质水平,进而起到调节血浆TC的作用;二者还能通过SREBP2信号通路抑制体内成脂相关基因的表达,减少细胞内脂质积聚。本研究联合用药组还能下调LXRα mRNA表达,而CAEF组和辛伐他汀组LXRα mRNA表达无明显变化,说明CAEF联合西红花苷可能通过活化AMPK抑制其下游靶基因LXRα-SREBPs-HMGCR的表达,减少细胞内TC和TG合成,从而发挥调脂作用。
目前临床上最常用的调脂药物是HMGCR抑制剂,即他汀类药物(如辛伐他汀),其对LDL-C、TC等调节作用较强,目前对其机制的研究主要集中于对HMGCR表达的调控上。本研究CAEF组和联合用药组HMGCR表达降低,以联合用药组降低更明显。由此推测,在脂代谢调控中西红花苷发挥了重要作用,西红花苷与CAEF具有良好的协同作用。
综上所述,CAEF联合西红花苷可协同抑制肝癌细胞脂质积聚,其机制可能与调控肝癌细胞胆固醇代谢相关基因和蛋白的表达有关。
[1] Zhang Y, Peng M, Liu L, et al. Screening, identification, and potential interaction of active compounds from Eucommia ulmodies leaves binding with bovine serum albumin[J]. J Agric Food Chem, 2012,60(12):3119-3125.
[2] 袁天翊,方莲花,吕扬,等.杜仲叶的药理作用研究进展[J].中国中药杂志,2013,38(6):781-785.
[3] Asdaq SM, Inamdar MN. Potential of crocus sativus (saffron) and its constituent, crocin, as hypolipidemic and antioxidant in rats[J]. Appl Biochem Biotechnol, 2010,162(2):358-372.
[4] Duchnowicz P, Broncel M, Podsedek A, et al. Hypolipidemic and antioxidant effects of hydroxycinnamic acids, quercetin, and cyanidin 3-glucoside in hypercholesterolemic erythrocytes (in vitro study)[J]. Eur J Nutr, 2012,51(4):435-443.
[5] Hao S, Xiao Y, Lin Y, et al. Chlorogenic acid-enriched extract from Eucommia ulmoides leaves inhibits hepatic lipid accumulation through regulation of cholesterol metabolism in HepG2 cells[J]. Pharm Biol, 2015,54(2):251-259.
[6] Kobayashi Y, Hiroi T, Araki M, et al. Facilitative effects of Eucommia ulmoides on fatty acid oxidation in hypertriglyceridaemic rats[J]. J Sci Food Agric, 2012,92(2):358-365.
[7] Wong RW, Rabie AB. Effect of quercetin on preosteoblasts and bone defects[J]. Open Orthop J, 2008(2):27-32.
[8] Du XM, Kim MJ, Hou L, et al. HDL particle size is a critical determinant of ABCA1-mediated macrophage cellular cholesterol export[J]. Circ Res, 2015,116(7):1133-1142.
[9] Chow EC, Magomedova L, Quach HP, et al. Vitamin D receptor activation down-regulates the small heterodimer partner and increases CYP7A1 to lower cholesterol[J]. Gastroenterology, 2014,146(4):1048-1059.
[10] Pan CH, Tsai CH, Lin WH, et al. Ethanolic extract of vitis thunbergii exhibits lipid lowering properties via modulation of the AMPK-ACC pathway in hypercholesterolemic rabbits[J]. Evid Based Complement Alternat Med, 2012,2012:436786.
[11] Seo YK, Jeon TI, Chong HK, et al. Genome-wide localization of SREBP-2 in hepatic chromatin predicts a role in autophagy[J]. Cell Metab, 2011,13(4):367-375.
[12] Stormo C, Kringen MK, Grimholt RM, et al. A novel 3-hydroxy-3-methylglutaryl-coenzyme a reductase (HMGCR) splice variant with an alternative exon 1 potentially encoding an extended N-terminus[J]. BMC Mol Biol, 2012(13):29.
[13] Zhong D, Zhang Y, Zeng YJ, et al. MicroRNA-613 represses lipogenesis in HepG2 cells by downregulating LXRα[J]. Lipids Health Dis, 2013(12):32.
Influence of chlorogenic acid extracted from Folium eucommiae and crocin on cholesterol metabolism of hepatoma carcinoma cells
LAILinglin1,XIAOYuan,PENGXiaofang,LENGEnnian,MOZhentao,LIWenna,CHENYang,LIYiqi
(1ZunyiMedicalCollegeZhuhaiCampus,Zhuhai519041,China)
Objective To observe the influence of chlorogenic acid extracted from Folium eucommiae (CAEF) and crocin on cholesterol metabolism in human hepatoma carcinoma HepG2 cells and to discuss the possible mechanism. Methods The HepG2 cells were randomly divided into five groups: the control group, the oleic acid group, the simvastatin group, the CAEF group and the combined administration group. In the oleic acid group, simvastatin group, CAEF group and combined administration group were added with oleic acid to induce steatosis models. At the same time, the simvastatin group was treated with 10 μmol/L simvastatin 10 μL , CAEF group was added with 25 mg/L CAEF 10 μL, the combined administration group was treated with 10 μL mixed solution including 1 μmol/L crocin, 30 μmol/L chlorogenic acid, 10 μmol/L geniposide and 10 μmol/L quercetin, and the control group was added with an equal volume of medium. The content of intracellular lipid droplets of HepG2 cells was observed by the oil red O staining after 48 h. The levels of triglyceride (TG) and total cholesterol (TC) in HepG2 cells were detected after 24 and 48 h. The expression of cholesterol metabolism-related genes, including ABCA1, SREBP2, CYP7A1, LXRα, AMPK2α, and HMGCR was measured by RT-PCR. The protein expression of HMGCR was detected by immunocytochemistry and Western blotting. Results The content of intracellular lipid droplets in the simvastatin group, the CAEF group and the combined administration group was significantly decreased after 48 h (the combined administration group > the CAEF group > the simvastatin group). Compared with the control group, the content of TC and TG was significantly increased in the other three groups after 24 h and 48 h (the combined administration group > the CAEF group> the simvastatin group, allP<0.05). The mRNAs expression of ABCA1, CYP7A1 and AMPK2α was significantly increased, while the mRNAs expression of SREBP2 and HMGCR was significantly decreased in the combined administration group and in the CAEF group after 48 h (allP<0.05). The mRNAs expression of LXRα was significantly decreased in the combined administration group (P<0.05). The protein expression of HMGCR in the three groups was significantly decreased and the combined administration group showed the strongest inhibitory effect (allP<0.05). Conclusions CAEF and crocin have synergistic inhibition effect on the lipid accumulation in HepG2 cells. The regulation of cholesterol metabolism-related genes and protein expression may be one of the mechanisms.
lipid metabolism disorders; hepatoma carcinoma cells; Folium eucommiae; chlorogenic acid extract; crocin
贵州省中药现代化科技产业研究开发专项项目(黔科合ZY字[2013]3018号);珠海市优势学科建设计划。
赖玲林(1985-),女,硕士,研究方向为心血管药理学及新药研发。E-mail: 369027702@qq.com
李文娜(1977-),女,教授,研究方向为心血管药理学及新药研发。E-mail: lielizabeth@126.com
10.3969/j.issn.1002-266X.2017.08.005
R589
A
1002-266X(2017)08-0017-04
2016-10-10)
