多烯紫杉醇联合反义miR-21对人胰腺癌细胞增殖和凋亡的影响
2017-03-13赵欣王春立李楠马涛尤胜义
赵欣,王春立,李楠,马涛,尤胜义
(天津医科大学总医院,天津300052)
多烯紫杉醇联合反义miR-21对人胰腺癌细胞增殖和凋亡的影响
赵欣,王春立,李楠,马涛,尤胜义
(天津医科大学总医院,天津300052)
目的 探讨多烯紫杉醇(DTX)联合反义miR-21(AS-miR-21)对胰腺癌细胞增殖及凋亡的影响及其可能的作用机制。方法 采用7种浓度 DTX筛选对人胰腺癌MiaPaCa-2细胞增殖抑制最佳的IC50(15 μmol/L)进行后续试验。随机将MiaPaCa-2细胞分为空白对照组、无义序列组、DTX组、AS-miR-21组、DTX+AS-miR-21组。AS-miR-21组、DTX+AS-miR-21组转染AS-miR-21,无义序列组转染Lipofectamine2000,均转染24 h;DTX+AS-miR-21组转染后予15 μmol/L的DTX作用48 h;空白对照组未行任何处理,DTX组加入15 μmol/L的DTX作用48 h。收集各组细胞,RT-PCR法检测miR-21的相对表达量,克隆形成实验检测细胞增殖能力,流式细胞仪检测细胞早期凋亡率,Western blotting法检测细胞周期依赖性蛋白激酶5(CDK5)的相对表达量。结果 与无义序列组、空白对照组比较,AS-miR-21组、AS-miR-21+DTX组miR-21的相对表达量均明显降低(P均<0.05)。与空白对照组、无义序列组比较,DTX组、AS-miR-21组、DTX+AS-miR-21组克隆数目明显降低、早期凋亡率明显升高、CDK5的相对表达量明显降低,以DTX+AS-miR-21组变化最明显(P均<0.05)。结论 DTX联合AS-miR-21可明显抑制胰腺癌细胞增殖并促进其早期凋亡,其机制可能与CDK5表达下降有关。
胰腺癌;多烯紫杉醇;微小RNA-21;细胞增殖;细胞凋亡
胰腺癌是最常见的致死性肿瘤之一,恶性程度高,其病死率居所有恶性肿瘤的第4位[1,2]。化疗虽然不是胰腺癌首选的治疗方式,但在临床治疗中占重要地位。目前,胰腺癌整体的化疗效果不甚理想,探索新的治疗靶点和干预方式以提高胰腺癌的化疗效果是目前亟需解决的难点[3]。多烯紫杉醇(DTX)为一种新型的紫杉烷类抗肿瘤药物,抗肿瘤活性明显高于紫杉醇,具有细胞内滞留时间长、局部浓度高等优点[4]。有研究发现,在胰腺癌中miR-21的下游靶点可参与激活或抑制多条信号通路,特别在肿瘤细胞的增殖、凋亡等生物学行为调控方面发挥重要作用[5,6]。2016年3~9月,我们观察了DTX联合反义miR-21(AS-miR-21)对胰腺癌细胞增殖和凋亡的影响,并探讨其可能的作用机制。
1 材料与方法
1.1 材料 人胰腺癌细胞株MiaPaCa-2,由天津医科大学南开医院中西医结合研究所提供。DTX,江苏恒瑞医药股份有限公司。LightCycler 480定量PCR仪,德国Roche公司;FACSCalibur流式细胞仪,美国BD公司。FBS,杭州四季青生物工程材料有限公司;DMEM培养基,美国Hyclone公司;胰蛋白酶,北京雷根生物技术有限公司;TRIzol、Lipofectamine 2000,美国Invitrogen公司;AS-miR-21寡核苷酸序列(5′-GUCAACAUCAGUCUGAUAAGCUA-3′)及无义序列(5′-AAGGCAAGCUGACCCUGAAGU-3′),由广州锐博生物科技有限公司合成。2×miRNA qPCR Master Mix、目的基因(miR-21)、内参基因(U6),上海生工生物工程股份有限公司;四甲基噻唑蓝(MTT)、二甲基亚砜(DMSO),北京索莱宝科技有限公司;细胞凋亡检测试剂盒,美国BD公司。
1.2 DTX最佳剂量筛选 取人胰腺癌细胞MiaPaCa-2,置于DMEM完全培养基(含10% FBS、1%青-链霉素),37 ℃、5% CO2、饱和湿度条件下常规培养。细胞融合70%~80%时,用含EDTA的胰酶消化,待细胞变圆、尚未漂起时加入适量完全培养液,反复吹打后加入10%冻存液,逐步降温,液氮中保存。复苏细胞时,在37 ℃水浴中迅速解冻细胞并加入适量的完全培养液。3~5天更换完全培养液,常规1∶4传代培养。取对数生长期人胰腺癌细胞MiaPaCa-2,消化后计数,调整细胞密度为5×104个/mL,接种于96孔板,每孔100 μL。待细胞贴壁后去除培养基,分别加入含5、10、20、40、60、80、120 μmol/L DTX的DMEM完全培养基,每个浓度设5个复孔。37 ℃ 5% CO2培养箱内常规培养24、48、72 h,加入MTT 20 μL,继续培养4 h。吸弃上清液,每孔加入DMSO 150 μL,振荡10 min,使结晶充分溶化。采用酶标仪检测每孔490 nm波长处的吸光度(A)值,计算细胞增殖抑制率。细胞增殖抑制率(%)=[(对照组A值-空白组A值)-(药物组A值-空白组A值)]/(对照组A值-空白组A值)×100%。实验重复3次,取平均值。采用GraphPad PRISM5.0软件计算IC50。结果显示,随DTX浓度升高及作用时间延长,细胞增殖抑制率逐渐升高(P均<0.05),呈浓度和时间依赖性(见表1)。培养72 h时细胞增殖抑制率虽然高于培养48 h时,但显微镜下观察细胞形态差,故取DTX作用48 h计算IC50,此时IC50为15 μmol/L。以此作为有效剂量进行下一步试验。
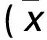
表1 不同浓度DTX作用24、48、72 h时MiaPaCa-2细胞的增殖抑制率±s)
1.3 细胞转染及miR-21表达检测 取对数生长期MiaPaCa-2细胞,常规消化后接种于6孔板中,随机分为空白对照组、无义序列组、DTX组、AS-miR-21组、DTX+AS-miR-21组。培养24 h至细胞融合70%~80%,弃去完全培养基,用无血清的DMEM清洗2次,每孔加入2 mL无血清、无抗生素的DMEM培养基,培养箱中饥饿培养。取Lipofectamine2000、AS-miR-21各5 μL,分别与250 μL无血清DMEM混匀后,室温放置20 min,即无义序列转染液、AS-miR-21转染液。无义序列组加入无义序列转染液,AS-miR-21组、DTX+AS-miR-21组加入AS-miR-21转染液,混匀。转染24 h,无义序列组、AS-miR-21组更换为含10% FBS的完全培养基继续培养48 h,DTX+AS-miR-21组更换为含10% FBS的完全培养基后加入15 μmol/L DTX作用48 h。空白对照组未行任何处理,DTX组加入15 μmol/L DTX作用48 h。收集各组细胞,采用TRIzol法提取细胞总RNA,按照荧光定量PCR试剂盒说明将其逆转录为cDNA。miR-21及U6引物由上海生工生物工程股份有限公司合成。反应条件:95 ℃ 10 min,95 ℃ 15 s,65 ℃ 30 s,共40个循环。以U6 snRNA作为内参,按照2-ΔΔCt法计算miR-21的相对表达量。以空白对照组miR-21的相对表达量为1,无义序列组、DTX组、AS-miR-21组、DTX+AS-miR-21组miR-21的相对表达量分别为0.818 2±0.055 8、0.365 3±0.031 4、0.285 2±0.019 6、0.172 9±0.016 6。与无义序列组、空白对照组比较,DTX组、AS-miR-21组、DTX+AS-miR-21组miR-21的相对表达量均明显降低(P均<0.05),AS-miR-21+DTX组miR-21的相对表达量较DTX组、AS-miR-21组明显降低(P均<0.05),其余组间比较差异均无统计学意义(P均>0.05)。说明转染成功。
1.4 相关指标观察
1.4.1 细胞增殖能力 采用克隆形成实验。取各组转染48 h细胞,胰酶消化,细胞计数后接种于细胞培养皿中,1 000个/皿,吹打均匀,显微镜下观察各细胞间不相连且均匀分布于皿底。常规培养14天,倒置显微镜下观察克隆形成情况,弃去培养基,PBS洗涤2次。1%结晶紫甲醇溶液固定染色5 min,PBS溶液洗去染料,倒置显微镜下观察。多于50个细胞的细胞团计为一个克隆,以克隆数目表示细胞增殖能力。
1.4.2 细胞早期凋亡率 采用AnnexinV-FITC法。取各组转染48 h细胞,接种于6孔板,每孔1×105个。待细胞贴壁,胰酶消化后加入1 mL培养基,轻轻吹打,并将细胞悬液收集于EP管中,4 ℃,800~1 000 r/min低速离心3~5 min,管底可见细胞形成白色沉淀,小心弃去上清。加入PBS 500 μL,轻轻吹打均匀,洗涤并重复以上步骤3次,立即按照AnnexinV-FITC细胞凋亡检测试剂盒说明书进行操作。采用流式细胞仪检测,激发波长488 nm,发射波长530 nm。应用CellQuest软件采样并将结果录入计算机存储。应用Modifit软件绘制不同染色状态细胞的象限分布图(散点图)。Annexin-V染色阳性、PI染色阴性细胞所占的比例即为细胞的早期凋亡率。
1.4.3 细胞周期依赖性蛋白激酶5(CDK5)表达 采用Western blotting法。收集各组转染48 h细胞,用预冷的PBS洗涤2次,置于6孔板中,每孔加入预冷的蛋白裂解液(RIPA∶PMSF=100∶1)100 μL,冰上裂解30 min,待细胞充分裂解。用细胞刮刀收集6孔板中的蛋白,4 ℃ 12 000 r/min离心15 min,取上清液,吹打均匀后分光光度法测定蛋白浓度合格。取部分蛋白,与等体积2×蛋白上样缓冲液混匀,100 ℃水浴15~20 min,冰上冷却。再次吹打均匀,取20 μL上样行琼脂糖凝胶电泳,常规转膜、封闭后加入CDK5一抗(1∶1 000),4 ℃孵育过夜,二抗(1∶1 000)室温下摇床慢摇1 h,显色曝光。采用Quantity One图像分析软件分析蛋白电泳条带的灰度值,计算CDK5的相对表达量。以β-actin为内参,CDK5的相对表达量=CDK5灰度值/β-actin灰度值。实验至少重复3次,取平均值。

2 结果
2.1 各组细胞克隆数目及早期凋亡率比较 见表2。
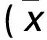
表2 各组细胞克隆数目及早期凋亡率比较±s)
注:与空白对照组比较,*P<0.05;与无义序列组比较,#P<0.05;与DTX组比较,△P<0.05;与AS-miR-21组比较,▲P<0.05。
2.2 各组CDK5表达比较 空白对照组CDK5的相对表达量为0.793 5±0.048 2,无义序列组为0.763 2±0.016 8,DTX组为0.616 2±0.026 6,AS-miR-21组为0.548 5±0.026 6,DTX+AS-miR-21组为0.099 1±0.006 9。与空白对照组、无义序列组比较,DTX组、AS-miR-21组、DTX+AS-miR-21组CDK5的相对表达量均明显降低(P均<0.05);与DTX组、AS-miR-21组比较,DTX+AS-miR-21组CDK5的相对表达量下降最为明显(P均<0.05)。
3 讨论
miRNA是一类在细胞和组织中特异性表达的非编码RNA,在很多细胞生物学进程中具有重要作用[7]。miR-21是miRNA家族中的一员,在转录后水平扮演促癌角色,通过与其3′非编码区互补配对的靶基因结合,抑制相应蛋白的表达。有研究发现,miR-21在胰腺癌中明显高表达,并且在细胞的增殖与凋亡及肿瘤的侵袭与转移中扮演重要角色,发挥癌基因作用[8]。有研究亦证实,化疗联合抑制miR-21的表达可明显抑制肿瘤细胞的增殖[8]。
DTX作为新型紫杉烷类化疗药物,在肺癌、乳腺癌、前列腺癌以及消化系统肿瘤化疗中发挥了重要作用[9]。DTX的抗癌机制是通过加强微管蛋白聚合,抑制微管解聚,将细胞阻滞于G2/M期,干扰肿瘤细胞有丝分裂的正常进行,进而促进肿瘤细胞凋亡[10,11]。有文献报道,特异性抑制miR-21的表达能够明显抑制肿瘤细胞增殖,且可在阻滞细胞周期的进程中发挥作用[12]。但抑制miR-21表达增加DTX作用效果的机制目前尚未完全阐明。CDK5作为周期依赖性蛋白激酶(CDK)家族中比较特殊的成员,虽然不能被细胞周期蛋白(如cyclinD、cyclinE)激活,也不直接参与细胞周期的调控,但可参与多种肿瘤细胞的病理过程,如神经胶质细胞瘤、肝细胞癌、前列腺癌和胰腺癌等[13,14]。研究发现,CDK5在胰腺癌的发生、发展中起重要作用,其促癌作用是通过Ras-CDK5-Ral信号途径来实现的[15];胰腺癌小鼠异种移植模型皮下注射CDK inhibitor可抑制CDK的表达,明显抑制肿瘤生长同时提高化疗药物的疗效[16]。因此推测,AS-miR-21联合DTX能够改变胰腺癌细胞的生物学行为,在抑制细胞增殖、促进细胞凋亡方面发挥作用;AS-miR-21增加DTX对胰腺癌细胞增殖抑制作用的机制可能与CDK5表达降低有关。
本研究结果显示,DTX作用后对MiaPaCa-2细胞的增殖抑制率逐渐升高,具有浓度和时间依赖性;转染AS-miR-21后,AS-miR-21组、DTX+AS-miR-21组miR-21的相对表达量较空白对照组明显降低,表明转染成功。本研究发现,DTX+AS-miR-21组细胞克隆数目明显少于其他各组,且其早期凋亡率明显高于其他各组,说明DTX联合AS-miR-21可明显抑制MiaPaCa-2细胞增殖,并促进其凋亡。有研究证实,CDK5调节亚基相关蛋白1(CDK5RAP1)是miR-21下游的直接靶点;CDK5RAP1可抑制CDK5激酶活性,进而抑制CDK5表达[17,18]。本研究DTX组、AS-miR-21组、DTX+AS-miR-21组CDK5的相对表达量明显低于空白对照组、无义序列组,以DTX+AS-miR-21组降低最明显;而DTX组与AS-miR-21组CDK5的相对表达量比较差异无统计学意义。说明CDK5可能是DTX和AS-miR-21抑制胰腺癌细胞的共同作用因子,应用AS-miR-21后CDK5表达进一步下降,提示DTX单独应用对胰腺癌的疗效有限,联合应用AS-miR-21可明显提高疗效。
综上所述,DTX联合AS-miR-21可明显抑制胰腺癌细胞增殖并促进其早期凋亡,其机制可能与抑制CDK5表达有关。
[1] Mcguire S. World cancer report 2014. Geneva, switzerland: world health organization, international agency for research on cancer, WHO press, 2015[J]. Adv Nutr, 2016,7(2):418-419.
[2] Song F, He M, Li H, et al. A cancer incidence survey in Tianjin:the third largest city in China-between 1981 and 2000[J]. Cancer Causes Control, 2008,19(5):443-450.
[3] Burris HA 3rd, Moore MJ, Andersen J, et al. Improvements in survival and clinical benefit with gemcitabine as first-line therapy for patients with advanced pancreas cancer: a randomized trial[J]. J Clin Oncol, 1997,15(6):2403-2413.
[4] Herbst RS, Khuri FR. Mode of action of docetaxel-a basis for combination with novel anticancer agents[J]. Cancer Treat Rev, 2003,29(5):407-415.
[5] Hwang JH, Voortman J, Giovannetti E, et al. Identification of microRNA-21 as a biomarker for chemoresistance and clinical outcome following adjuvant therapy in resectable pancreatic cancer[J]. PLoS One, 2010,5(5):e10630.
[6] Kadera BE, Li L, Toste PA, et al. MicroRNA-21 in pancreatic ductal adenocarcinoma tumor-associated fibroblasts promotes metastasis[J]. PLoS One, 2013,8(8):e71978.
[7] Erson AE, Petty EM. MicroRNAs in development and disease[J]. Clin Genet, 2008,74(4):296-306.
[8] Frampton AE, Castellano L, Colombo T, et al. MicroRNAs cooperatively inhibit a network of tumor suppressor genes to promote pancreatic tumor growth and progression[J]. Gastroenterology, 2014,146(1):268-277.
[9] Han K, Cao W, Che J, et al. First line chemotherapy with weekly docetaxel and cisplatin in elderly patients with advanced non-small cell lung cancer: a multicenter phase Ⅱ study[J]. J Thorac Oncol, 2009,4(4):512-517.
[10] Schiff PB, Horwitz SB. Taxol stabilizes microtubules in mouse fibroblast cells[J]. Proc Natl Acad Sci U S A, 1980,77(3):1561-1565.
[11] Bissery MC, Nohynek G, Sanderink GJ, et al. Docetaxel (Taxotere): a review of preclinical and clinical experience. Part Ⅰ: preclinical experience[J]. Anticancer Drugs, 1995,6(3):339-355,363-368.
[12] Shi Z, Zhang J, Qian X, et al. AC1MMYR2, an inhibitor of dicer-mediated biogenesis of Oncomir miR-21, reverses epithelial-mesenchymal transition and suppresses tumor growth and progression[J]. Cancer Res, 2013,73(17):5519-5531.
[13] Dhariwala FA, Rajadhyaksha MS. An unusual member of the Cdk family: Cdk5[J]. Cell Mol Neurobiol, 2008,28(3):351-369.
[14] Contreras-Vallejos E, Utreras E, Gonzalez-Billault C. Going out of the brain: non-nervous system physiological and pathological functions of Cdk5[J]. Cell Signal, 2012,24(1):44-52.
[15] Feldmann G, Mishra A, Hong SM, et al. Inhibiting the cyclin-dependent kinase CDK5 blocks pancreatic cancer formation and progression through the suppression of ras-ral signaling[J]. Cancer Res, 2010,70(11):4460-4469.
[16] Feldmann G, Mishra A, Bisht S, et al. Cyclin-dependent kinase inhibitor Dinaciclib (SCH727965) inhibits pancreatic cancer growth and progression in murine xenograft models[J]. Cancer Biol Ther, 2011,12(7):598-609.
[17] Ren Y, Zhou X, Yang JJ, et al. AC1MMYR2 impairs high dose paclitaxel-induced tumor metastasis by targeting miR-21/CDK5 axis[J]. Cancer Lett, 2015,362(2):174-182.
[18] Deng X, Kohanfars M, Hsu HM, et al. Combined phosphoproteomics and bioinformatics strategy in deciphering drug resistant related pathways in triple negative breast cancer[J]. Int J Proteomics, 2014,2014:390781.
Effect of docetaxel combined with antisense miR-21 on proliferation and apoptosis of human pancreatic cancer cell
ZHAOXin,WANGChunli,LINan,MATao,YOUShengyi
(TianjinMedicalUniversityGeneralHospital,Tianjin300052,China)
Objective To investigate the effect of docetaxel combined with antisense miR-21 on proliferation and apoptosis of human pancreatic cancer cell line MiaPaCa-2, and to discuss its possible mechanism. Methods Seven concentrations of docetaxel (DTX) were selected to detect their proliferation inhibition rates on human pancreatic cancer MiaPaCa-2 cells to choose the best IC50(15 μmol/L) which was then used to do the following experiment. Human pancreatic cancer MiaPaCa-2 cells were divided into the control group, antisense miR-21 group, DTX group, AS-miR-21 group, and DTX+AS-miR-21 group. Cells in the AS-miR-21 group and DTX+AS-miR-21 group were transfected by AS-miR-21, and the antisense miR-21 group was transfected by Lipofectamine2000 for 24 h. Cells in the DTX+AS-miR-21 group were treated with DTX, and DTX group was treated with 15 μmol/L DTX for 48 h. RT-PCR was used to detect the expression of miR-21 in each group. The proliferation capacity of cells was detected by the cloning formation assay. The apoptosis rate was measured by flow cytometry. The expression of cyclindependent kinase 5 (CDK5) in each group was evaluated by Western blotting. Results The relative expression of miR-21 in the AS-miR-21 group and DTX+AS miR-21 group was significantly lower than that in the control group, and antisense miR-21 group, which indicated that the transfection was successful. Compared with the control group and antisense miR-21 group, the number of clones in the DTX group, AS-miR-21 group and DTX+AS-miR-21 group was significantly decreased, the early apoptosis rate was significantly increased, and the relative expression of CDK5 protein was significantly decreased, and the most significant changes were found in the DTX+AS-miR-21 group (allP<0.05). Conclusion DTX combined with AS-miR-21 can significantly inhibit the proliferation of human pancreatic cancer cells and induce the apoptosis, which may be associated with the decrease of CDK5 protein expression.
pancreatic carcinoma; docetaxol; miR-21; cell proliferation; apoptosis
天津市科技计划项目(12ZCZDSY03500)。
赵欣(1991-),女,硕士在读,研究方向为消化道肿瘤的基础与临床。E-mail: pwkzhaoxin@qq.com
尤胜义(1955-),男,主任医师,研究方向为消化道肿瘤的基础与临床。E-mail: shengyiyou126@126.com
10.3969/j.issn.1002-266X.2017.08.004
R735.9
A
1002-266X(2017)08-0013-04
2016-10-25)
