乙肝前S1抗原在乙肝诊疗中的临床价值以及与HBV-DNA相关性研究
2017-03-13陈华宏洪洁华林玉叶
陈华宏,陈 谋,洪洁华,林玉叶
(揭阳市人民医院检验科,广东揭阳522000)
乙肝前S1抗原在乙肝诊疗中的临床价值以及与HBV-DNA相关性研究
陈华宏,陈 谋,洪洁华,林玉叶
(揭阳市人民医院检验科,广东揭阳522000)
目的研究慢性乙肝患者血清中乙肝前S1抗原(PreS1-Ag)、HBeAg、HBV-DNA之间相关性,探讨其在慢性乙型肝炎病情监测上的临床价值。方法⑴分析不同载量HBV-DNA慢性乙型肝炎患者中PreS1-Ag、HBeAg阳性率的差异;⑵根据HBeAg的检测结果,把1219个病例分为阳性组和阴性组,探讨两组中PreS1-Ag、HBV-DNA之间阳性率的差别。结果⑴PreS1-Ag和HBe-Ag阳性率都随着HBV-DNA载量的增加而增加,且PreS1-Ag阳性率比HBe-Ag阳性率高;⑵在HBe-Ag阳性的病例中,PreS1-Ag和HBV-DNA的阳性率分别为89.42%、87.76%,两者之间无统计学差异(χ2=1.55,P>0.05),而在HBe-Ag阴性的病例中,PreS1-Ag和HBV-DNA的阳性率分别为60.4%、52.4%,两者之间有统计学差异(χ2=247.6,P<0.01)。结论HBV-PreS1抗原在对乙肝病毒复制及传染性的提示作用中与HBV-DNA有较高的相关性,有效补充了目前乙肝诊疗以HBV-DNA和HBeAg为主要的检测手段,联合检测能更全面判断体内乙肝病毒的活跃程度及变异状况,在慢性乙肝诊疗中有着较高的临床价值,值得临床推广。
慢性乙型肝炎;PreS1-Ag;HBV-DNA;HBe-Ag
慢性乙型肝炎(CHB)是指乙肝病毒检测为阳性,病程超过半年或发病日期不明确而临床有慢性肝炎表现者。其病理机制错综复杂,易形成慢性状态,与肝硬化,肝癌关系密切,是一种发病率高,难治愈,易反复的常见病,监测并清除乙肝病毒是慢性乙型肝炎(CHB)治疗的关键。长期以来临床主要通过检测HBV-DNA和HBeAg来监测体内乙肝病毒的复制状况和抗病毒治疗疗效。但是从近期的研究中显示,即使以上两个指标结果均为阴性,也不能完全排除乙肝病毒在体内已停止复制的可能。另外由于检测HBV-DNA所依赖的基因扩增技术(PCR),其实验条件高,设备和试剂昂贵,目前能够开展的医疗单位非常少[1],且基因扩增技术(PCR)技术受病毒滴度、实验室污染等因素影响易产生假阴性或假阳性结果,因此迫切需要寻找更加简单快捷,同时特异性和敏感性好的检测指标来协助慢性乙肝的诊断和治疗。PreS1-Ag作为乙肝dane颗粒的一种衣壳蛋白,含有肝细胞膜受体,具有很强的免疫原性,在乙肝病毒感染肝细胞和机体免疫应答中起着重要的作用[2,3]。研究表明,PreS1-Ag是反映乙肝病毒感染、装配、复制的重要指标[4],再加上其检测方法简单,结果稳定,无需大型仪器等优点,正受到临床越来越多的关注[5]。
1 材料与方法
1.1 一般资料选择自2015年6月到2016年9月在广东省揭阳市人民医院进行慢性乙肝治疗的患者1219例,其中男性患者646例,女性患者573例,年龄在15~68岁之间,平均年龄是39.1岁。乙型肝炎诊断依据为中华医学会肝病学分会和中华医学会感染病分会联合发布的2010版《中国乙型肝炎防治指南》的标准。所有参与研究的患者均属自愿。
1.2 方法所有标本均在清晨空腹抽血3ml送检,于37度水浴10min,离心后吸取血清上机检测PreS1-Ag、HBV-DNA和“乙肝二对半”三个(组)项目。其中,PreS1-Ag和“乙肝二对半”二个项目均采用酶联免疫法(ELISA)进行检测,使用上海科华生物技术有限公司试剂,仪器为Tecan前处理及FAME全自动酶联免疫分析仪,所有实验均上机操作,实行标准化管理,以确保结果的准确性;HBVDNA采用基因扩增技术(PCR)进行定量检测,使用中山大学达安基因股份公司DA7600实时荧光定量PCR扩增仪,试剂为中山大学达安基因股份公司生产的HBV-DNA PCR试剂盒,所有实验严格按试剂说明书进行操作。
1.3 统计学分析将HBV-DNA阳性的病例根据拷贝数从低到高分成四组,分别统计出各组中PreS1-Ag和HBe-Ag两者各自的阳性率;再将所有乙型肝炎研究对象分为HBe-Ag阳性和阴性两组,统计出两组中PreS1-Ag和HBV-DNA各自的阳性例数;最后采用SPSS 19.0统计学软件处理相关的数据,用四格表卡方检验计数资料,应用χ2检验组间差异,P<0.05表示差异有统计学意义。
2 结果
2.1 不同HBV-DNA载量中PreS1-Ag、HBe-Ag的阳性率比较在819例HBV-DNA阳性患者中,PreS1-Ag的阳性率高达89.0%,而HBe-Ag的阳性率仅为55.2%,可见相对于HBe-Ag,PreS1-Ag和HBV-DNA在阳性率方面有着更高的吻合率;另外在500~<103、104~105、106~107、≥108从低到高的四组HBV-DNA载量中,PreS1-Ag对应的阳性率分别为76.2%、83.8%、91.2%、100%,而HBe-Ag对应的阳性率是27.6%、32.1%、57.2%、98.0%,这显示随着HBV-DNA载量的不断增加,PreS1-Ag和HBe-Ag的阳性比例都逐渐增大[6],表明两者与HBV-DNA均有明显的相关性;同时在每个载量组中,PreS1-Ag的阳性率都明显高于HBe-Ag的阳性率,这也进一步说明HBV-PreS1抗原和HBVDNA的吻合度明显优于HBe-Ag。见表1,图1。

表1 不同HBV-DNA载量中PreS1-Ag、HBe-Ag的阳性率比较[n(%)]

图1 不同HBV-DNA载量PreS1-Ag和HBe-Ag阳性率对比
2.2 HBe-Ag阴、阳性与PreS1-Ag、HBV-DNA的检出率比较表2可见在所统计的总共1219例慢性乙肝患者中,PreS1-Ag和HBV-DNA的阳性率分别为72.68%、67.19%,在482例HBe-Ag阳性的病例中,PreS1-Ag和HBV-DNA的阳性率分别为89.42%、87.76%,两者之间无统计学差异(χ2=1.55,P>0.05),见表3;而在737例HBe-Ag阴性的病例中,PreS1-Ag和HBV-DNA的阳性率分别为60.4%、52.4%,两者之间有统计学差异(χ2=247.6,P<0.01),见表4。
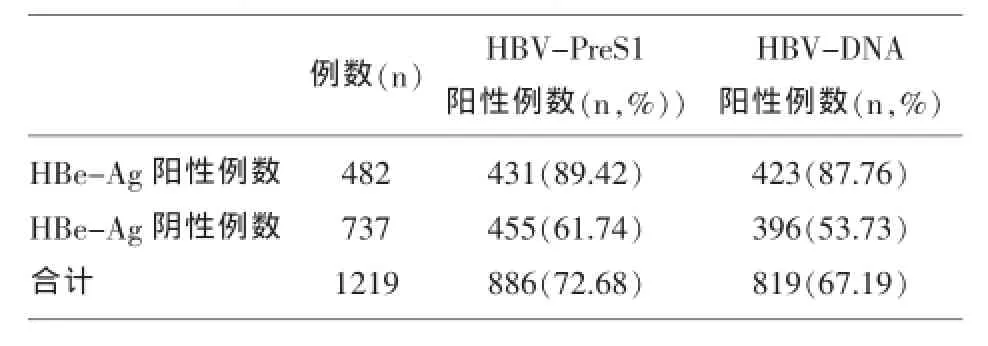
表2 HBe-Ag阴、阳性与PreS1-Ag、HBV-DNA的检出率比较

表3 HBe-Ag阳性组PreS1-Ag和HBV-DNA的阳性率关系

表4 HBe-Ag阴性组PreS1-Ag和HBV-DNA的阳性率关系
3 讨论
乙型肝炎病毒(HBV)的感染是一个在全球范围内都得到高度关注的健康话题,它也是导致患者慢性肝脏问题的最常见病因。据统计,在我国大概有10%的HBV携带患者,其中约有25%的的患者最终会发展成为慢性乙肝、原发性的肝癌以及肝硬变。目前,临床上对HBV病毒的主要检查方法是进行“乙肝二对半”的检测,同时再通过检测HBV-DNA来监测患者体内的乙肝病毒复制状况。但因检测HBV-DNA所依赖的基因扩增技术(PCR),其实验条件要求高,同时所使用的仪器设备及实验试剂都比较昂贵,导致其在基层单位的普及度不广泛,从而在一定程度上影响了乙肝防治工作的开展进行。近年来我院开展了HBVPreS1抗原的检测,在协助慢性乙肝的诊断治疗中取得了良好的效果。
本文的研究结果显示,在表1和图1所统计的从低到高的四组HBV-DNA载量中,PreS1-Ag和HBe-Ag两者对应的阳性率分别为76.2%、27.6%;83.8%、32.1%;91.2%、57.2%;100%、98.0%,即随着HBV-DNA拷贝数的不断增加,PreS1-Ag和HBe-Ag的阳性比例都逐渐增大[6],提示两者均与HBV-DNA存在正相关[7],这也说明PreS1-Ag、HBe-Ag和HBV-DNA三者在监测乙肝病毒复制方面有一致性;同时我们也观察到,在全部819例HBV-DNA阳性患者中,PreS1-Ag和HBe-Ag的阳性率分别为89.0%、55.2%,可见无论在总的HBVDNA阳性患者中,还是细分到各个不同HBVDNA载量组中,PreS1-Ag的阳性率都要明显高于HBe-Ag的阳性率,这也说明PreS1-Ag与HBVDNA的相关性优于HBe-Ag,其在反映病毒复制和传染性上比HBe-Ag更有价值,可弥补因乙肝病毒C区缺失而致HBe-Ag不表达所造成的诊断和治疗困难。
表2和表3结果显示,在所统计的总1219例慢性乙肝患者中,PreS1-Ag和HBV-DNA的阳性率分别为72.68%、67.19%,两者的阳性率接近,尤其是在HBe-Ag阳性的标本中,PreS1-Ag和HBVDNA的阳性率分别高达为89.42%、87.76%(χ2= 1.55,P>0.05),两者之间无统计学差异[8],显示在HBe-Ag阳性患者中,两者对于监测乙肝病毒复制方面有高度的一致性,即当患者HBe-Ag和PreS1-Ag同时呈阳性时,直接提示乙肝病毒在该体内复制活跃,可见,PreS1-Ag作为判断体内乙肝病毒复制的新标志,在监测乙肝病毒感染和复制中有重要价值。
表4结果则显示在HBe-Ag阴性的病例中,PreS1-Ag和HBV-DNA的阳性率分别为60.4%、52.4%,两者之间有统计学差异(χ2=247.6,P<0.01),这说明PreS1-Ag虽然对于部分因为乙肝病毒C区基因变异而导致HBe-Ag检测呈阴性的乙肝患者的诊断治疗有重要意义,但在监测病毒复制方面,PreS1-Ag并不能完全代替HBV-DNA[9],因为相对于作为最直接的分子生物学指标的HBV-DNA[10],PreS1-Ag是乙肝病毒血清学标志物,其阴阳性转化会滞后于HBV-DNA的载量变化,从而出现HBV-DNA已转阴性而PreS1-Ag暂时呈阳性结果的现象;另外,当乙肝病毒虽存在复制但前S区缺失或变异时,则会导致PreS1-Ag呈阴性而HBV-DNA呈阳性结果[11];而当乙肝病毒在极低拷贝状态复制时也会因PCR方法学上的极限而导致HBV-DNA未能检测出,可见PreS1-Ag、HBe-Ag和HBV-DNA虽然都是监测病毒复制的指标,但检测方法学有所不同,表达的意义也有所区别,单项独立检测,容易出现漏诊或误判,而三者联合检测,有助于提高HBV检测的敏感性,能更早期且更全面的对乙肝病毒的活动性进行判断和疗效评估,避免误判病情,贻误治疗[12,13]。
总之,乙肝PreS1-Ag作为判断体内乙肝病毒存在的新标志,在监测乙肝病毒感染和复制中与HBe-Ag、HBV-DNA有密切的相关性,再加上其检测方法简单方便,结果稳定,无需大型仪器等优点,非常适合在没有条件进行基因扩增技术(PCR)检测的基层单位开展[14];而在有条件开展HBVDNA检测的单位,开展PreS1-Ag检测是对目前临床常用的以HBV-DNA及HBeAg为主要的乙肝病毒监测指标进行了有效的补充,能更全面地监测乙肝病毒在体内的复制和变异情况,在慢性乙型肝炎(CHB)的诊断治疗、判断预后及疾病转归中有着重要的临床阶值[15],值得临床推广。
[1]陈立章,薛静,刘立亚,李战战,等.血清HBV-DNA定量检测与凝血指标对乙肝患者病情诊断的研究[J].中国现代医学杂志,2013,23(30):31-36.
[2]Kessler HH,preininger S,Stelzl E,et al.ldentification of different states of hepatitis B virus infection with a quantitative PCR assay [J].Clin Diagn Lab Immunol,2000,26(8):129-131.
[3]Funk ML,Rosenberg DM,Lok AS.World-wide epidemiology of HBeAg-negative chronic hepatitis B and associated precore and core promoter variants[J].J Viral Hepat,2002,23(9):637-638.
[4]周红波,周美英.乙型肝炎HBeAg阴性患者前S1抗原与HBVDNA定量检测的相关性探讨[J].实验与检验医学,2012,30(3):312-314.
[5]杨玉洁,张绪署,苏丽君,等.应用Pre-S1 Ag诊断HBV感染的可能性研究[J].实验与检验医学,2013,31(1):15-17.
[6]柳枝,黄欣.前S1抗原在诊疗乙肝病毒复制时的临床价值[J].实验与检验医学,2009,27(4):353.
[7]王书华,张立平,陈六生.乙型肝炎病毒前S1抗原阳性在乙型肝炎病情诊断及预后判断中的应用[J].国际检验医学杂志,2016,37(1):101-102.
[8]李文波,雷毅,高武,等.HBV-DNA Pres1-Ag与乙型肝炎HBeAg联合检测的意义及相关性分析[J].国际检验医学杂志,2015,36(22):3311-3313.
[9]李彩东,吴斌,陈锡莲,等.乙型肝炎病毒前S1抗原与HBV DNATKG HBV-M及肝功能的相关性探讨[J].国际检验医学杂志,2015,36(7):936-938.
[10]朱红英.乙肝S1前蛋白和乙肝DNA的相关性研究[J].实验与检验医学,2013,31(6):629-630.
[11]陈康.乙肝病毒PreS1抗原和HBV-DNA检测在病毒感染和复制中的意义[J].淮海医药,2008,9(5):430-431.
[12]窦亚玲,李永哲,刘志肖,等.乙型肝炎病毒前S1抗原检测的临床阶值[J].中华检验医学杂志,2006,11(8):714-716.
[13]Sugauchi F,Ohno T,Orito E,et al.Influence of hepatitis B virus genotypes on the development of pro-S deletions and advanced liver disease[J].J Med Viral,2003,70(4):537-539.
[14]栾琳,苑司生.HBV前S1抗原与血清标志物联合检测的临床意义[J].实用医药杂志,2010,27(04):326-327.
[15]徐肖丁,张义文,周锦霞,等.联合检测乙肝五项、前S1抗原与乙肝DNA的临床应用[J].实验与检验医学,2011,29(4):366-368.
R512.6+3,R446.62
A
1674-1129(2017)01-0102-03
10.3969/j.issn.1674-1129.2017.01.034
2016-10-10;
2016-11-24)
