二次回归正交设计在灰楸离体培养中的应用1)
2017-03-13于永明吕寻韩云花王军辉张宋智马建伟李平英
于永明 吕寻 韩云花 王军辉 张宋智 马建伟 李平英
(国家林业局林木培育重点实验室(中国林业科学研究院林业研究所)) (甘肃省栎类次生林生态系统重点实验室(甘肃省小陇山林业科学研究所))(甘肃省栎类次生林生态系统重点实验室(甘肃省小陇山林业科学研究所),天水,741022)
二次回归正交设计在灰楸离体培养中的应用1)
于永明 吕寻 韩云花 王军辉 张宋智 马建伟 李平英
(国家林业局林木培育重点实验室(中国林业科学研究院林业研究所)) (甘肃省栎类次生林生态系统重点实验室(甘肃省小陇山林业科学研究所))(甘肃省栎类次生林生态系统重点实验室(甘肃省小陇山林业科学研究所),天水,741022)
为建立灰楸离体繁殖体系,应用二次回归正交设计与SPSS软件分析,建立灰楸组培继代培养增殖系数、增殖芽长度、增殖芽数、愈伤组织横向膨大、愈伤组织纵向膨大、叶数,生根培养生根率、根长、发根数、发芽数、芽长等回归方程,通过对各方程进行模拟寻求,确定6-BA、IBA、NAA在继代与生根培养中的用量范围。结果表明:灰楸组培继代培养6-BA用量的最佳范围为1.343~1.356 mg·L-1,IBA用量在0.11~0.294 mg·L-1;一定质量浓度的6-BA在继代培养中起主要的诱导分化作用;IBA对诱导分化芽数有显著的回归关系,与其它指标无显著关系;分化芽叶数的多少与6-BA与IBA无显著关系。灰楸组培生根培养IBA用量的最佳范围为0.272~0.329 mg·L-1,NAA为0.027~0.033 mg·L-1;一定质量浓度的IBA主要促使根系与芽长生长,对生根率与发芽数无显著作用,NAA起着主要的诱导根系发生作用,与生根率、发芽数有显著的回归关系;生根苗叶数的多少与6-BA与IBA无显著关系;IBA用量在0.272~0.329 mg·L-1、NAA在0.027~0.033 mg·L-1范围内,灰楸组培生根率可达96%以上,可靠性为95%。灰楸离体培养适宜的继代培养基为DKW+6-BA 1.343~1.356 mg·L-1+IBA 0.11~0.294 mg·L-1+琼脂4.5 g·L-1+蔗糖25 g·L-1(pH=5.8);生根培养基为1/2MS+IBA 0.272~0.329 mg·L-1+NAA 0.027~0.033 mg·L-1+琼脂5.0 g·L-1+蔗糖10 g·L-1(pH=5.8)。
灰楸;二次回归正交设计;方差分析;模拟寻求
We used quadratic regressive factorial experiment and SPSS software to analyze growth coefficient, bud length, proliferation bud number, callus enlargement and leaf number ofCatalpafargesiiduring subculture, and optimize concentrations of IBA and 6-BA in subculture medium. We obtained a serial regression equations, and found the best dosage of IBA and 6-BA to subculture the callus ofC.fargesiithrough simulation and search of the equations. A certain concentration of 6-BA could promote the bud differentiation in subculture ofC.fargesii, and the best dosage range of 6-BA was 1.343-1.356 mg·L-1. IBA had a significant regression relationship with bud differentiation, and the best dosage range of IBA was 0.11-0.294 mg·L-1, but there was no significant relationship with other indicators. The number of bud differentiation had no significant relationship with 6-BA and IBA. We also built regression equations through the analyzing the rooting rate, root length, root number, sprouting number and bud length in rooting medium ofC.fargesii. We obtained the best dosage of IBA and NAA using simulation and search of these equations. The best dosage range of IBA was 0.272-0.329 mg·L-1, and the best dosage range of NAA was 0.027-0.033 mg·L-1in rooting medium ofC.fargesii. A certain concentration of IBA mainly promoted the growth of root and bud length, but there was no significant effect with root number and sprouting number. NAA mainly induced the root, and had a significant regression relationship with the rooting rate and sprouting number. However, the leaf number of rooted seedlings had no significant relationship with 6-BA and IBA. When the dosage range of IBA was 0.272-0.329 mg·L-1, and NAA was 0.027-0.033 mg·L-1, the rooting rate ofC.fargesiitissue culture reached more than 96% and the reliability was 95%.
灰楸(CatalpafargesiiBureau)为紫葳科(Bignoniaceae)梓树属(CatalpaScop)高大落叶乔木,是我国传统栽培的珍贵优质用材及园林树种,其分布广泛,主要分布于我国中西部,以渭河、泾河、汾河流域及秦岭山地为集中区,散生于村庄周边及山谷中。灰楸根系发达,生长速度快,抗风、固土能力强,耐旱耐寒,材质纹理通直、坚韧致密,是优质速生经济林树种[1]。
目前,灰楸主要采用分根与嫁接繁殖,繁殖系数低,特别是对优良无性系,由于繁殖材料少,限制了灰楸优良无性系的生产应用[2]。灰楸嫁接繁殖需要培育大量的砧木与接穗,培育过程中,由于接穗生长量较大,接穗与砧木粘结口极易脱离,抗风性差,同时砧木基部多会产生大量萌发,需要不断抹芽除萌,增加了管理成本。组培繁殖是解决灰楸嫁接繁殖这一实际问题的重要手段。国内有关灰楸优良无性系的组织培养研究较少,严重限制了相关研究的进展。
二次回归正交设计是利用数理统计学与正交性原理,用正交表来合理安排试验,在样本数极少的情况下建立二次正交回归模型[3-4],采用组合设计,对实验结果用方程进行模拟,从而求得最优解和相应的最优组合。本研究以灰楸组培增殖分化芽为材料,应用二次回归正交设计优选继代、生根培养基中添加的6-BA、IBA与NAA的质量浓度,优化培养基配方,以提高灰楸组培苗的成苗率,为灰楸遗传转化提供良好的受体系统。
1 材料与方法
材料为中国林科院林业所楸树课题组研究筛选的灰楸优良无性系LH组培苗;培养温度为22~26 ℃,光照每日14 h,光照强度为2 000 lx。
1.1 继代培养
因素为6-BA、IBA,分别以x1、x2表示,x1的用量上限Z21=2.0 mg·L-1、下限Z11=0 mg·L-1,零水平Z01=(Z21+Z11)/2=1.0 mg·L-1;x2的用量上限Z22=0.4 mg·L-1,下限Z12=0 mg·L-1,零水平Z02=0.2 mg·L-1;变化区间Δ1=(Z21-Z01)/λ=0.76,Δ2=0.15,λ值为1.32[5],因素水平编码见表1。
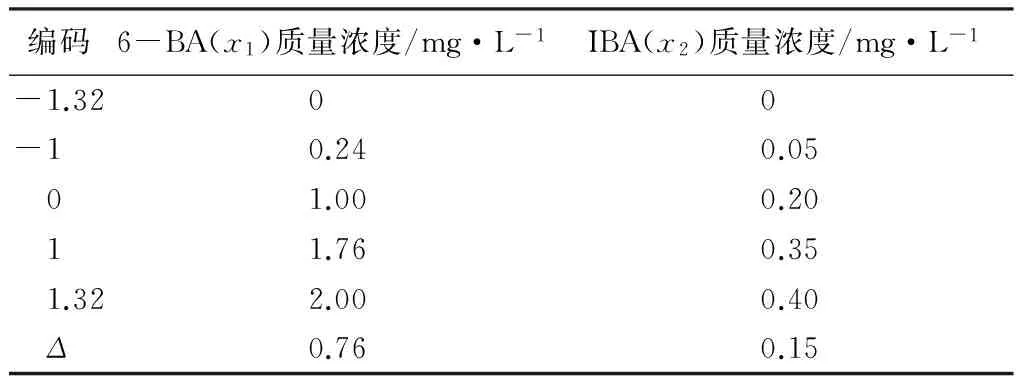
表1 继代培养试验因素水平编码
注:Δ为变化区间,其公式为:Δj=(Z2j-Z0j)/λ。
依设计激素6-BA与IBA组合质量浓度添加于基础培养基DKW+琼脂4.5 g·L-1+蔗糖25 g·L-1(pH=5.8)中,每个处理接种10瓶,每瓶接种3个茎段外植体,茎段长度约为1.0 cm,确保茎段只带一个腋芽,以保证在同一分化水平,培养35 d后统计观测增殖芽数、增殖芽长度、愈伤组织横向膨大、愈伤组织纵向膨大、叶数。
1.2 生根培养
因素为IBA、NAA,分别以x1、x2表示,x1的用量上限Z21=1.0 mg·L-1、下限Z11=0 mg·L-1,零水平Z01=(Z21+Z11)/2=0.5 mg·L-1;x2的用量上限Z22=0.1 mg·L-1、下限Z12=0 mg·L-1,零水平Z02=0.05 mg·L-1;变化区间Δ1=(Z21-Z01)/λ=0.38,Δ2=0.038,因素水平编码见表2。

表2 生根培养试验因素水平编码
注:Δ为变化区间,其公式为:Δj=(Z2j-Z0j)/λ。
将激素IBA与NAA组合质量浓度添加于基础培养基1/2MS中,每个处理接种10瓶,每瓶3个茎段,茎段长度为1.5 cm,确保插入培养基茎段部位没有腋芽,以免影响根系的诱导,培养35 d后统计生根率及观测指标。
统计分析软件采用SPSS 16.0。
2 结果与分析
2.1 继代培养各指标测定
灰楸继代培养35 d后的增殖系数(为增殖芽数与增殖芽长度的积除以转接茎段长度(1 cm)而得)及增殖芽数、增殖芽长度、愈伤组织横向膨大、愈伤组织纵向膨大、叶数测定结果见表3,参照续九如[5]等的统计方法和王颉[6]的SPSS应用分析方法,得出各指标回归系数(表4)。表4可知灰楸继代培养的各指标各系数均达到显著或极显著水平,未达到显著水平的各项系数在回归分析过程中软件已自动剔除。灰楸继代培养的各指标二元二次回归方程如表5。
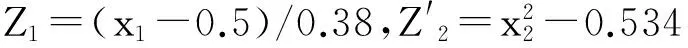

表3 继代培养各处理观测指标均值
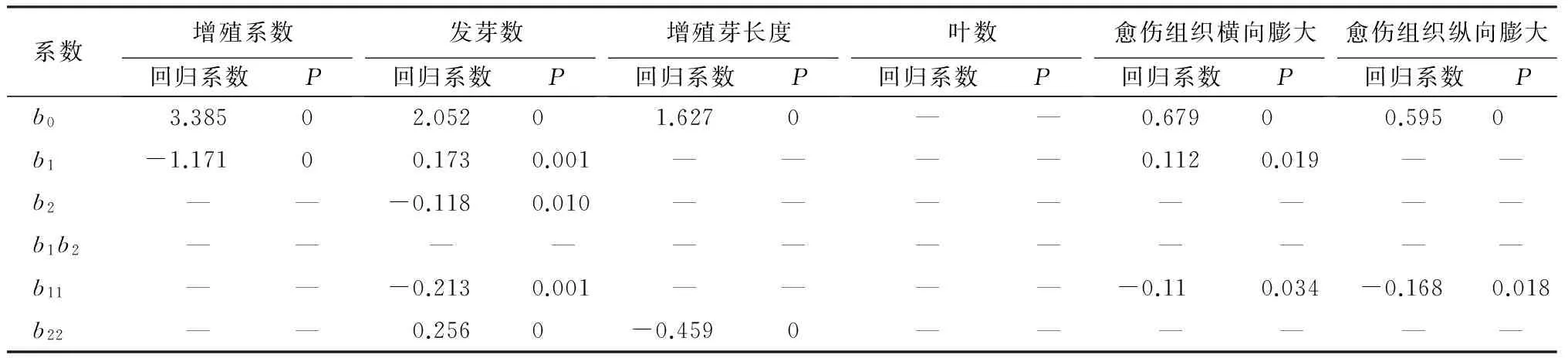
表4 继代培养各指标回归系数的显著性检验
注:表中b0代表各指标回归方程中常数项,b1、b2为一次项回归系数,b11、b22分别为因素6-BA和因素IBA的二次方效应回归系数。

表5 继代培养各指标回归方程显著性检验及回归模型的拟合测验
2.2 继代培养各指标模拟寻求
根据建立的回归方程,以求函数极值的方法对每个自变量求一阶偏导数,以获取观测指标最大时激素的用量,并进一步用因素水平频率分布法进行模拟寻求[5],确定各激素的最佳用量范围(表6)。结果表明,灰楸组培继代培养一定质量浓度的6-BA起主要的诱导分化作用,指标增殖系数、增殖芽长度、愈伤组织膨大主要受6-BA的调控,与IBA无显著作用;分化芽数的多少受着6-BA与IBA的共同作用;灰楸组培继代培养6-BA用量的最佳范围为1.343~1.356mg·L-1,IBA用量在0.110~0.294mg·L-1;分化芽叶数的多少与6-BA与IBA无显著关系。
2.3 生根培养各指标测定
灰楸生根培养35d后的生根率、发根数及其他观测指标统计数据见表7,统计方法同继代培养。表8可知灰楸生根培养的各指标各系数均达到显著或极显著水平,未达到显著水平的各项系数在回归分析过程中软件已自动剔除。灰楸生根培养的各指标二元二次回归方程如表9。
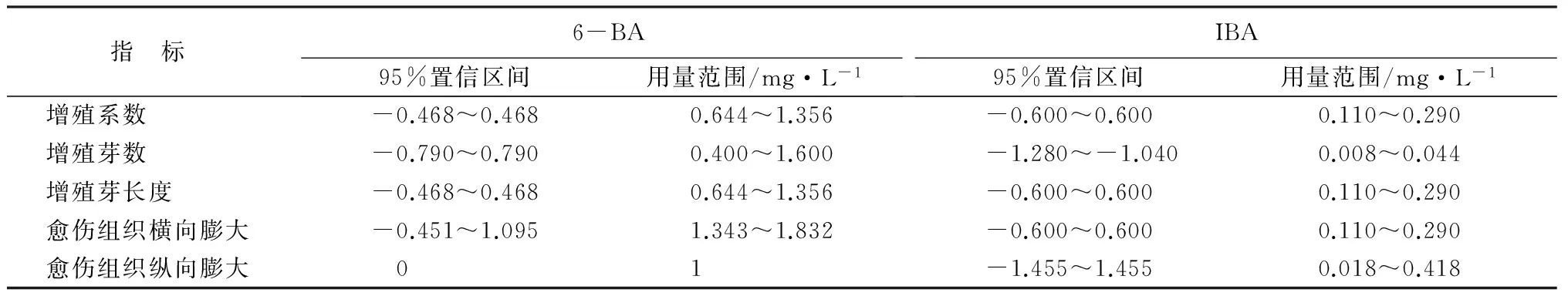
表6 继代培养各指标95%置信区间及用量范围
注:各指标预期目标为增殖系数>2.8,增殖芽数>2.3个,增殖芽长度>1.4cm,愈伤组织横向膨大>0.5cm,愈伤组织纵向膨大>0.5cm。
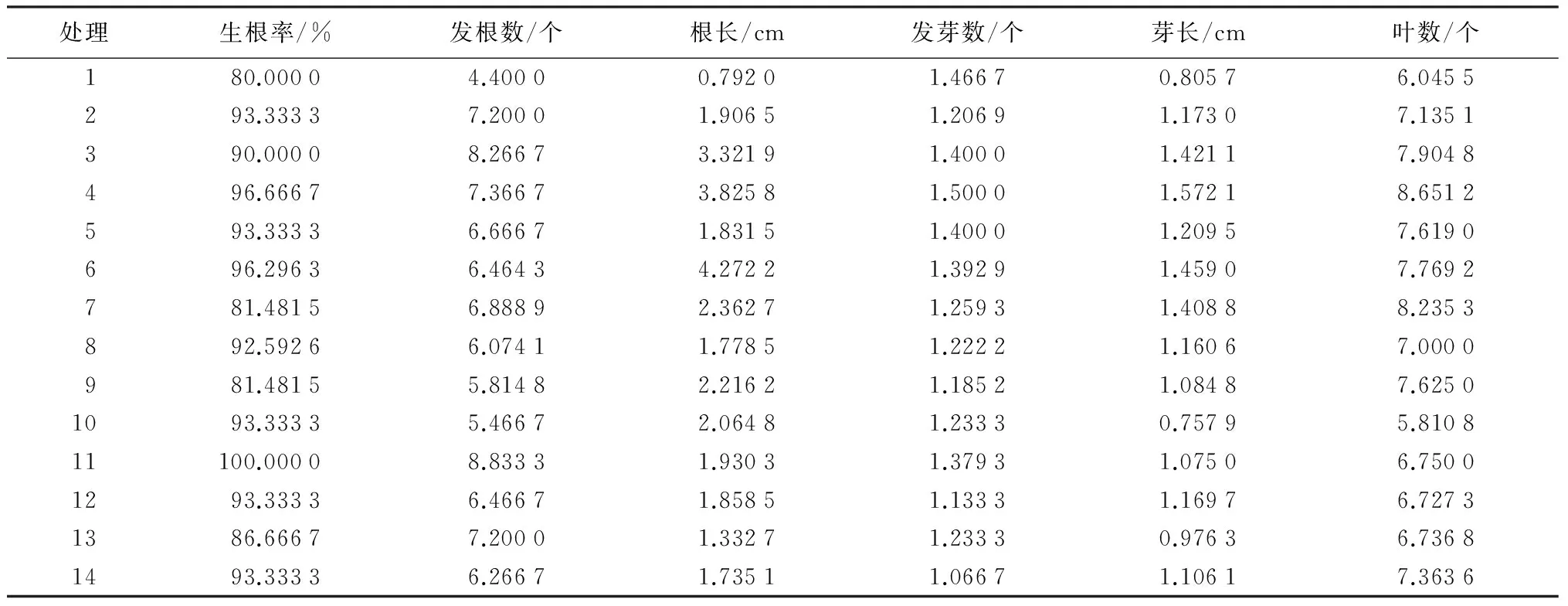
表7 生根培养各处理观测指标均值

表8 生根培养各指标回归系数的显著性检验
注:表中b0代表各指标回归方程中常数项,b1、b2为一次项回归系数,b11、b22分别为因素IBA和因素NAA的二次方效应回归系数。
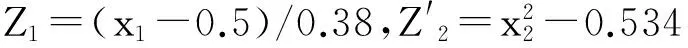
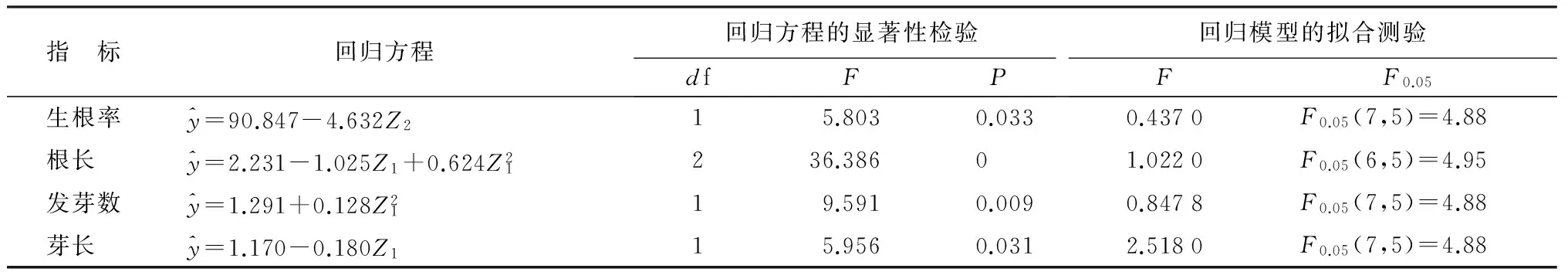
表9 生根培养各指标回归方程、方程的显著性检验及回归模型的拟合测验
2.4 生根培养各指标模拟寻求
根据建立的回归方程,以求函数极值的方法对每个自变量求一阶偏导数,以获取观测指标最大时激素的用量,并进一步用因素水平频率分布法进行模拟寻求,确定各激素的最佳用量范围(表10)。结果表明,与IBA配比使用,NAA主要诱导灰楸根系的发生,IBA主要促使根系的伸长生长及生根苗芽长的生长。当IBA用量在0.272~0.728mg·L-1、NAA在0.027~0.033mg·L-1范围内,各指标都处于最佳生长状态。
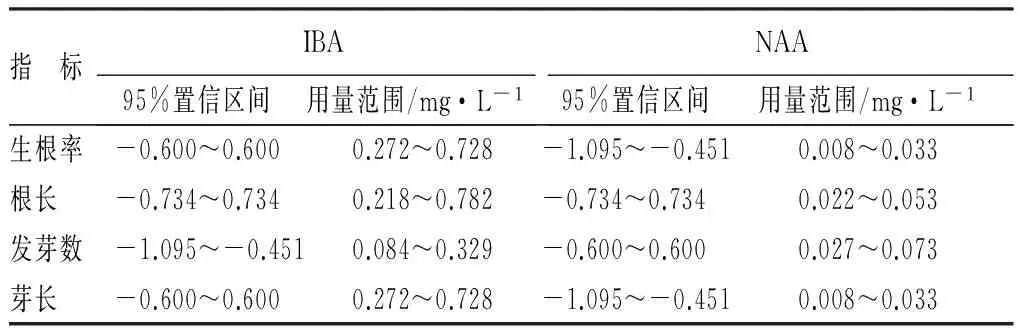
表10 生根培养各指标95%置信区间及用量范围
注:各指标预期目标为生根率>96%,根长>2.5cm,发芽数>1个,芽长>1.4cm。
3 结论与讨论
在植物组织培养过程中,不同的细胞分裂素和生长素配比会对植物组培的分化、生根诱导和次生代谢产生不同的影响[7-10]。本研究选用细胞分裂素6-BA和生长素IBA配比,诱导灰楸继代芽的分化与增殖;进一步应用生长素IBA与NAA配比,诱导灰楸继代分化芽生根,获得了良好的增殖和生根效果。结果表明,灰楸离体培养适宜的继代培养基为DKW+6-BA1.343~1.356mg·L-1+IBA0.11~0.294mg·L-1+琼脂4.5g·L-1+蔗糖25g·L-1(pH=5.8);生根培养基为1/2MS+IBA0.272~0.329mg·L-1+NAA0.027~0.033mg·L-1+琼脂5.0g·L-1+蔗糖10g·L-1(pH=5.8);6-BA在灰楸继代培养过程中起主要的诱导分化作用,分化芽数的多少受6-BA与IBA的共同作用;而在灰楸继代分化芽生根过程中,NAA主要诱导灰楸根系的发生,IBA主要促使根系的伸长生长及生根苗芽长的生长。
回归正交设计是依据数理统计学与正交性原理,对试验处理多个因素用正交表来合理安排试验,以较少的试验处理获得充分、有用的信息,寻求最优因素组合。本研究在灰楸组织培养的基础上,建立了灰楸继代和生根培养的各指标回归方程,确定了激素用量,结果表明灰楸继代培养6-BA用量的最佳范围为1.343~1.356mg·L-1,IBA用量在0.11~0.294mg·L-1;生根培养IBA用量在0.272~0.329mg·L-1、NAA在0.027~0.033mg·L-1。在其他相关二次回归正交设计应用于植物组织培养配方优化选择的研究中,韩秀慧等[3]以微型月季为材料,优选出在MS培养基中添加1.93mg·L-16-BA与0.33mg·L-1NAA,增殖系数为6.9;刘彩霞等[11]以香石竹叶片为材料,在MS培养基中添加1.15mg·L-1KT与1.79mg·L-12,4-D,增殖系数高于2.0;章莉等在MS培养基中添加1.93mg·L-16-BA与0.33mg·L-1NAA诱导增殖苦马豆愈伤组织的分化,可获得每块愈伤组织鲜质量0.975 2mg[12]。此外,应用二次回归正交旋转组合设计在优化白(红)皮蒜、梨组织培养的研究中,也取得了一定的进展[13-15]。
植物组织培养受着众多因素的影响,外植体、基础培养基、激素种类等的正确选择及处理是首要环节,同时温度、光照等环境因素也起着重要的调控作用,这些因素中培养基的筛选是关键。培养基的特点在于,植物外界环境生长需要的矿物质、气体、生理活性物质都要在培养基中含有,以供植物生命过程中光合作用、呼吸作用、核酸合成、蛋白质合成及能量的储存、转化与释放等重要的生理过程,植物生长调节物质是其中重要的关键的添加成分,用量虽小,但对植物组培植物材料起着重要和明显的调节作用,一般认为植物器官分化的倾向取决于内源激素的平衡,外源激素通过改变内源激素的平衡而产生作用,要使内源激素达到平衡,外加的细胞分裂素及生长素必须达到一定质量浓度和比例,才能使器官发生达到预期目的[3]。激素的这种特殊作用促使了植物组培的发展,也在研究实施过程中增加了难度与周期。近年来,二次回归正交设计的应用在组培领域报道逐渐增多,这一应用的开拓与发展,能够极大的缩小植物组培培养基配方研究的试验处理数,并精确确定激素用量的最佳范围,这在一定的程度上可促进植物组培研究进程,缩短研究周期。植物组培研究过程中,在不同培养材料与培养阶段,可针对性的对培养基基础成分、培养温度等进一步应用二次回归正交设计优化筛选,以提高研究效率与进程,加速组培研究的发展。
[1] 赵秋玲,马建伟,王军辉,等.灰楸不同流域种质变异与多样性研究[J].植物遗传资源学报,2012,13(5):803-809.
[2] 王军辉,贠慧玲,冯小芹,等.不同砧木对灰楸生长和光合特性的影响[J].东北林业大学学报,2013,41(10):40-45.
[3] 韩秀慧,尹伟伦,王华芳.二次回归正交设计在微型月季组织培养中的应用[J].林业科学,2004,40(4):189-192.
[4] 周一玲.组合工艺中的正交试验设计与二次正交回归分析[J].矿业工程研究,2004,26(2):10-12.
[5] 续九如,黄智慧.林业试验设计[M].北京:中国林业出版社,1995.
[6] 王颉.试验设计与SPSS应用[M].北京:化学工业出版社,2007.
[7]COLLINH.Secondaryproductformationinplanttissuecultures[J].PlantGrowthRegul,2001,34(1):119-134.
[8]RAJD,KOKOTKIEWICZA,DRYSA,etal.EffectofplantgrowthregulatorsontheaccumulationofindolizidinealkaloidsinSecurinega suffruticosacalluscultures[J].PlantCellTissOrganCult,2015,123(1):1-7.
[9]LUCZKIEWICZM,CISOWSKIW.OptimisationofthesecondphaseofatwophasegrowthsystemforanthocyaninaccumulationincallusculturesofRudbeckia hirta[J].PlantCellTissOrganCult,2001,65(1):57-68.
[10] WANG H, LI M, YANG Y, et al. Histological and endogenous plant growth regulators changes associated with adventitious shoot regeneration from in vitro leaf explants of strawberry (Fragaria×ananassacv.‘Honeoye’)[J]. Plant Cell Tiss Organ Cult,2015,123(3):479-488.
[11] 刘彩霞,孙振元,刘军,等.利用二次回归正交设计优化香石竹叶片再生体系中6-BA和NAA的浓度组合[J].核农学报,2008,22(1):45-48.
[12] 章莉,刘慧,邹建,等.利用二次回归正交设计建立苦马豆愈伤组织高效培养体系[J].西华师范大学学报(自然科学版),2013,34(3):246-251.
[13] 董瑞,唐明磊,林辰壹,等.二次回归正交旋转组合设计优化新疆白皮蒜鳞茎盘组织培养的研究[J].新疆农业科学,2011,48(12):2266-2272.
[14] 董瑞,唐明磊,吴玉霞,等.二次回归正交旋转组合设计优化伊宁红皮蒜鳞茎盘组织培养的研究[J].新疆农业科学,2012,49(4):646-652.
[15] 鲁敏,汤浩茹,余世杰,等.二次回归正交旋转组合设计在梨子叶不定梢再生研究中的应用[J].果树学报,2011,28(1):171-175.
Application of Quadratic Regressive Factorial Experiment to in vitro Culture ofCatalpafargesii//
Yu Yongming, Lü Xun, Han Yunhua(Key Laboratory of Oak Secondary Forest Ecosystem of Gansu Province, Xiaolongshan Research Institute of Forestry of Gansu Province, Tianshui 741022, P. R. China); Wang Junhui(Research Institute of Forestry, Chinese Academy of Forestry; Key Laboratory of Tree Breeding and Cultivation, State Forestry Administration); Zhang Songzhi, Ma Jianwei, Li Pingying(Key Laboratory of Oak Secondary Forest Ecosystem of Gansu Province, Xiaolongshan Research Institute of Forestry of Gansu Province)//
Journal of Northeast Forestry University,2017,45(2):29-33,38.
Catalpafargesii; Quadratic regressive factorial experiment; Variance analysis; Simulation and search
1)“十二五”国家科技计划课题(2012BAD21B03);甘肃省小陇山林业实验局局列科研计划项目;甘肃省天水市科技支撑计划项目(201509)。
于永明,男,1979年7月生,甘肃省栎类次生林生态系统重点实验室(甘肃省小陇山林业科学研究所),工程师。E-mail:xiaoyuerlovers@163.com。
吕寻,甘肃省栎类次生林生态系统重点实验室(甘肃省小陇山林业科学研究所),高级工程师。E-mail:648257249@qq.com。
2016年6月1日。
Q813.1+2
责任编辑:潘 华。
