秋茄(Kandeliacandel L.)响应重金属胁迫的数字基因表达谱1)
2017-03-13袁柳娇傅梦妮余如凤黎海利袁长春陈燕刘锴栋
袁柳娇 傅梦妮 余如凤 黎海利 袁长春 陈燕 刘锴栋
(岭南师范学院,湛江,524048)
秋茄(KandeliacandelL.)响应重金属胁迫的数字基因表达谱1)
袁柳娇 傅梦妮 余如凤 黎海利 袁长春 陈燕 刘锴栋
(岭南师范学院,湛江,524048)
基于高通量测序的数字基因表达谱(DGE)技术,对重金属污水胁迫处理组和对照组秋茄材料进行转录组测序分析。结果表明,重金属污水胁迫处理样品与对照样品相比,共筛选出的3 097个差异表达基因,其中2 202个表达上调,895个表达下调。GO功能显著性富集分析出38个GO分类条目,大量与生长发育,代谢调控,环境刺激响应相关的基因表现为富集。进一步的KEGG代谢途径分析表明,差异表达基因主要与糖类、核酸、蛋白质和脂质等生物大分子代谢、能量代谢以及次生代谢过程有关。转录因子分析发现bHLH,MYB,NAC和WRKY在重金属胁迫中发挥重要作用。此外,重金属胁迫还促进萜类、黄酮类化合物生物合成的关键酶基因(牻牛儿基焦磷酸合酶(Unigene0029352)、黄酮醇合成酶(Unigene0010384))的表达,进而促进秋茄有效成分的积累;显著诱导细胞分裂素相关基因type-b响应调节子ARR2(Unigene0033740)的表达、抑制油菜素内酯的信号转导组分基因BSK(Unigene0008986)的表达,进而提高秋茄对重金属胁迫的适应能力。实验选取了5个与环境刺激响应密切相关的基因,通过qRT-PCR验证了它们在重金属污水胁迫处理下的表达差异,结果与数字基因表达谱分析的结果较为一致,证实了差异表达基因数据的有效性。说明在重金属胁迫处理下,秋茄通过调节基因表达提高自身对污染胁迫的耐受能力。
秋茄;重金属;污水胁迫处理;数字基因表达谱(DEG);差异表达基因
Digital Gene Expression Profiling (DGE) technique was used to analyze the differences in gene expressions ofKandeliacandelunder artificial heavy metal treatment. A total of 3097 differential expressed genes (DEGs) were screened. Compared with the control treatment samples, 2202 DEGs were up-regulated and 895 DEGs were down-regulated in the heavy metal water treatment samples. By gene ontology (GO), 38 DEGs were enriched in the processes of growth, metabolism regulation and environmental stimuli response. KEGG pathway enrichment analysis showed that these DEGs were involved in various pathways of biological macromolecules metabolism, energy metabolism and secondary metabolism, such as sugar, protein, nucleic acid and lipid biosynthesis pathways. By transcription factor analysis, bHLH, MYB, NAC and WRKY played vital role in response to heavy metal stress. The geranyl pyrophosphate synthase (Unigene0029352) and flavonol synthase (Unigene0010384) involved in terpenoid and flavonoid biosynthesis were up-regulated by heavy metal stress might be the reason for the enhancement for the active ingredients accumulation inK.candel. The significantly promotion of the type-b response regulatorARR2 (Unigene0033740) involved in the signal transduction of cytokinins by heavy metal stress, and the inhibition of serine/threonine-protein kinase BSK (Unigene0008986) involved in the signal transduction of brassinolide by heavy metal stress might enhance the stress tolerance inK.candel. Five randomly selected ‘responses to stimulus’ related genes were used to confirm the accuracy of DGE.
红树林为木本植物,分布于热带与亚热带海岸潮间带,在维护生态平衡和保护环境有着不可或缺的作用[1]。秋茄(KandeliacandelL.),又名水笔仔、茄行树,是红树植物中为数众多的物种之一,在植物学分类中为红树科秋茄属的唯一物种,其株高为1~2 m,其树皮呈现红褐色而且比较光滑。在一定的地理条件下,秋茄可以形成单优势种灌木群落[2]。
随着我国沿海地区工农业的快速发展以及城市化区域的不断扩大,工农废水和生活污水的排放量越来越大。大量污水涌入江河海湾造成了很大的环境压力[3]。作为一个典型的热带、亚热带带生态系统,海岸红树林湿地对泥滩中的污染物和有毒物质有着较强的耐受及吸附作用。成片的红树林可以通过汲取、蓄积各种重金属离子来净化水体和湿地土壤[4-5]。然而,污水排放对红树林植物造成的正负影响在学术界一直存在争议的。红树植物一方面可以从排放的污水中摄取营养物质,有利于植物的生长;但是另一方面,污水中的重金属离子也会对红树植物造成毒害[6]。因此,研究红树植物污水胁迫机理,对沿海滩涂的造林绿化、植被恢复以及林木作物抗污性育种具有重要的理论及指导意义。从20世纪80年代开始,一些研究人员对秋茄在污染胁迫下的生理学及次级代谢物质的变化进行了研究,发现总酚、单宁和缩合单宁参与了秋茄根和叶对镉的螯合,增强了秋茄对镉的耐性,同时秋茄幼苗通过改变体内类黄酮和叶绿素含量促进秋茄对生活污水胁迫的耐性[7-8],但是从分子层面分析重金属污水胁迫对秋茄的影响以及秋茄的耐受机制尚少见报道。
数字基因表达谱(digital gene expression profiling,DGE)是一种高通量测序技术,可以全面、快速检测某一物种特定组织在特定状态下基因表达情况。转录组测序不依赖于基因组序列,是研究无参考基因组物种基因表达与调控的一把利器。随着新一代测序平台的研发及市场化,基于转录组测序的DGE技术大量被应用于不同处理下差异基因的检测与功能基因的挖掘。目前已有学者利用该技术分析了凤丹[9]、白桦[10]、长白落叶松[11]、坛紫菜[12]、花生[13]等植物在不同胁迫环境下转录水平的差异。本文采用基于高通量测序的数字基因表达谱技术研究重金属污水胁迫处理下秋茄的基因表达变化,从分子的层面分析秋茄对重金属污染胁迫的耐受机制,为深入研究重金属污水胁迫对红树植物生长的影响机制提供理论基础。
1 材料与方法
实验试剂:Hoagland营养液;Trizol试剂盒(TaKaRa,大连,中国);琼脂糖;寡聚(dT)-纤维素;片段化缓冲液(fragmentation buffer);dNTPs;六碱基随机引物;RNase H;DNA polymerase I;QiaQuick PCR试剂盒;EB缓冲液;PrimeScriptTMRT Master Mix (TaKaRa,大连,中国);SYBR Green supermix;仪器:PCR仪型Bio-Rad CFX96 touchTM。
1.1 材料处理和收集
2015年3月在湛江雷州附城镇红树林育苗场采集秋茄幼苗,选取株高约20~30 cm,具有3~4对叶片的秋茄幼苗。将株高相近、长势旺盛、完好无损的36株秋茄幼苗随机分成重金属处理组和对照组,每组设置3个重复。随后加入1/2 Hoagland营养液于室温条件下进行复壮培养(室温约20 ℃),30 d后处理组进行人工重金属污染胁迫处理。人工重金属污水胁迫处理参照Zhang et al[14]中的方法,其中Pb2+、Cd2+、Hg2+作为外界胁迫因素,它们的质量浓度分别为10、2、2 mg·L-1。对照组用等量的1/2 Hoagland营养液处理。对照组和处理组在相同的环境下继续培养2 d后分别摘取无缺损、完全开展的嫩叶。将所得秋茄叶片保存于液氮中备用。
1.2 总RNA提取和基因表达谱测序
污水胁迫处理组和对照组的秋茄叶片样品总RNA抽取采用Trizol法。对照和处理各3份生物学重复。然后将对照和处理的各自3份RNA样品等量混合,由广州基迪奥公司构建测序文库,采用Illumina HiSeqTM 2000平台进行转录组测序。
1.3 序列比对及差异表达基因的筛选
预处理后序列与胡杨、麻风树参考基因组数据库进行比对。根据与参考基因组比对情况计算序列的全基因组覆盖情况并计算RNA的表达量。在RNA-seq分析中,利用定位到基因表达区域测序序列的序列计数对该基因的表达水平进行估计,用edgeR软件对基因表达水平分析中得到的序列计数数据进行差异分析,并以P<0.05,|lbx|>1(x为差异倍数)的筛选阈值筛选出差异表达基因,其中差异倍数为重金属污水胁迫处理样本与对照样本中各基因表达量的比值。对于差异表达基因,其lbx>1时,则认为该差异表达基因是上调的,反之,若lbx<-1,认为该差异表达基因是下调的。
1.4 Gene Ontology(GO)基因功能注释和KEGG代谢通路分析
采用GO数据库(http://www.geneontology.org/)对重金属污水胁迫后的红树秋茄植物进行GO功能显著性富集分析,并对筛选得到的差异表达基因进行聚类分析。通过GOseq方法假设验证得到一个特定的P,并以此界定差异表达基因在特定GO中的富集程度。一般校正后的P<0.05,则表明差异表达基因在该功能GO中出现了富集。使用KOBAS(2.0)进行Pathway富集分析,当错误发现率<0.05时,表示差异表达基因在该通路中显著性富集。
1.5 qRT-PCR验证
选取植物环境刺激响应相关的差异表达基因,利用qRT-PCR技术,验证数字基因表达谱测序的可靠性。表1为相关引物。

表1 引物序列
利用Premier primer 5软件设计红树植物秋茄中各基因的RT引物,扩增平均长度在200~250 bp。以秋茄组成型表达基因tubulin作为内参基因。秋茄对照样本及重金属污水胁迫处理样本各取1 μg总RNA,采用PrimeScriptTMRT Master Mix(TaKaRa,大连,中国)试剂盒进行逆转录,逆转录得到的cDNA用于实时荧光定量检测。反应体系如下:总体系为10 μL,含有SYBR Green supermix(2×)5 μL,上游引物0.2 μmol/L,下游引物0.2 μmol/L,cDNA 1 μL,ddH2O 3.6 μL。本试验共进行3次独立的生物学重复,并采用2-ΔΔCt的方法计算相关的差异表达基因相对表达量。
2 结果与分析
2.1 测序质量分值
对转录组测序得到的数据分析表明,对照样本和重金属污水胁迫处理样本经过除杂后获得的有效序列与原始序列比例接近,对照样本的有效序列为99.19%,重金属污水胁迫处理样本的有效序列为99.14%,说明构建cDNA文库和测序数据的质量比较高。因为受到红树植物秋茄的遗传背景不同和注释信息量差异的限制,对照样本有效序列中基因并未完全被注释,大约89.06%的基因被注释,剩下的10.94%的有效序列未能注释到对应的功能基因,重金属污水胁迫处理样本的有效序列的注释情况与对照样本具有较高的一致性。另外,大部分注释基因只有一种序列(占对照样本的74.92%,重金属污水胁迫处理样本的74.26%)。根据测序随机性分析可知,在基因中序列的分布具有较好的均一性,说明测序样本的mRNA没有被降解。
本试验利用测序饱和度来检验红树植物秋茄的测序量与检测到的基因数量之间的协同性。在试验中,当测序量达到60百万以上时,检测到的基因数目趋于饱和。比较对照样本与重金属污水胁迫处理样本的差异发现,对照样本的被检测基因量趋于饱和的曲线比较平缓,重金属污水胁迫处理样本的被检测基因量趋于饱和的曲线相对更快达到饱和。
通过样品基因覆盖度的分析可知,对照组样品基因覆盖度主要在80%~100%,共39 298个基因,占总基因数的89.93%;重金属污水胁迫处理组样品共有42 140个基因的覆盖度在80%~100%,占总基因96.43%,这说明物种内遗传变异相对比较保守。另外进一步对对照样本的差异表达基因与重金属污水胁迫处理样本差异表达基因相比较,发现重金属污水胁迫处理组样本的差异表达基因的覆盖程度更广泛根据样品表达量丰度分布分析可知,对照样品和重金属污水胁迫处理样品的基因表达最集中的区域在lgx(x表示基因表达量值)的值为0~1.5,而且比较2组不同处理样本的差异基因表达量,发现重金属污水胁迫处理组样品的差异表达基因的表达量更为丰富。
2.2 差异表达基因筛选
差异基因筛选基于两组样本所有基因的表达量值,利用MeV软件对样本和基因间的关系进行层级聚类,并使用热图来呈现聚类结果。结果表明两组样品中部分基因表达量水平有着较大的差异。通过比较对照样本与重金属污水胁迫处理样本基因表达谱,共筛选到3097个表达量发生显著变化的基因,其中上调基因有2 202个,下调基因895个。进一步,我们通过针对差异基因的火山图(Volcano plot)分析发现,差异基因的呈现正态分布。
2.3 差异表达基因的GO显著性富集分析
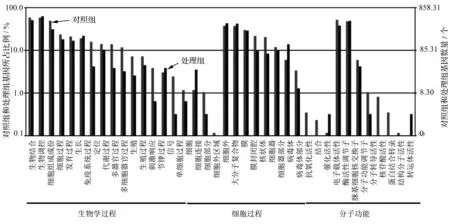
在GO功能显著性富集分析中,通过与参考基因相比较,将筛选出的差异表达基因富集于不同的GO分类条目中,得到与差异表达基因相关的主要生物学功能分类。通过GO基因功能分类体系对重金属污水胁迫处理组和对照组间差异表达的基因进行注释后,发现38个GO分类条目,其中生物学过程、细胞组分过程和分子功能的相关条目的GO条目分别是19、11、8条,分别占50.00%、28.95%和21.05%。其中生物过程中差异基因的上调基因2 681个、下调基因745个;细胞组分过程中差异基因的上调基因1 442个,下调基因489个;分子功能中差异基因的上调基因925个,下调基因285个。另外我们发现生物学过程中被注释的差异表达基因主要包括有机代谢、细胞代谢、初级代谢以及次生代谢等不同代谢过程。与细胞组分相关的差异表达基因主要包括细胞、细胞外组分和细胞内组分等。与分子功能有关的差异表达基因主要涉及催化活性、结合活性、和转移酶活性等功能(图1)。
2.4 差异基因Pathway显著性富集分析
利用KEGG数据库对差异表达基因进行注释和分类,并根据KEGG pathway富集分析可知差异表达基因主要参与的生化代谢途径和信号转导途径。结果表明秋茄在重金属污水胁迫处理下的差异表达基因广泛涉及物质代谢、能量代谢和新陈代谢等不同代谢与信号途径。其中有关核糖体(7.99%)、噬菌体(2.46%)、植物激素信号转导(5.84%)、DNA复制(2%)、糖类转换(1.69%)、卟啉与叶绿素代谢(2%)、苯丙氨酸代谢(2.15%)、苯丙氨酸合成(3.69%)、类黄酮合成(3.07%)和双萜类合成(0.77%)的基因大量富集。除了基本代谢途径外,还有16.28%的基因参与了次生代谢物的生物合成及表达调控。
2.5 重金属污水胁迫下的转录因子分析
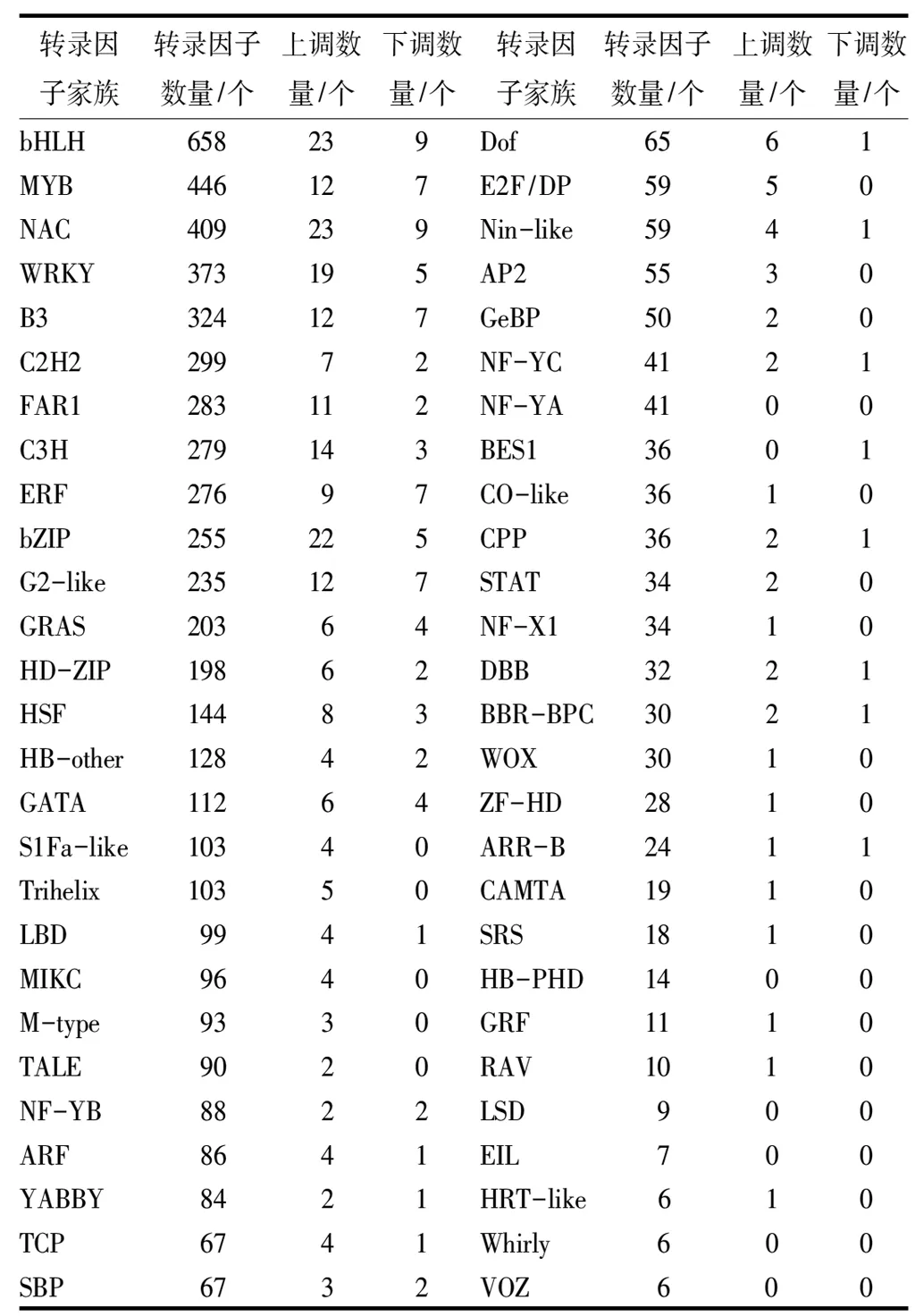
在秋茄转录组注释信息中,一共鉴定得到了分属于54个家族的6 460个转录因子(表2)。通过对这些转录因子的深入分析,发现bHLH,MYB,NAC和WRKY是秋茄中成员最多的转录因子家族。除此之外,其他一些已知与环境胁迫响应相关的转录因子家族也都得到了鉴定,如bZIP,ARR-B和ARF等家族。众多的转录因子调控下游功能基因,形成一个完整的网络,共同参与秋茄对污水胁迫的响应。
前1条线为对照组;后1条线为重金属污水胁迫处理组。
转录因子家族转录因子数量/个上调数量/个下调数量/个转录因子家族转录因子数量/个上调数量/个下调数量/个bHLH658239Dof6561MYB446127E2F/DP5950NAC409239Nin-like5941WRKY373195AP25530B3324127GeBP5020C2H229972NF-YC4121FAR1283112NF-YA4100C3H279143BES13601ERF27697CO-like3610bZIP255225CPP3621G2-like235127STAT3420GRAS20364NF-X13410HD-ZIP19862DBB3221HSF14483BBR-BPC3021HB-oth-er12842WOX3010GATA11264ZF-HD2810S1Fa-like10340ARR-B2411Trihelix10350CAMTA1910LBD9941SRS1810MIKC9640HB-PHD1400M-type9330GRF1110TALE9020RAV1010NF-YB8822LSD900ARF8641EIL700YABBY8421HRT-like610TCP6741Whirly600SBP6732VOZ600
注:转录因子总数量6 460个,上调基因总数270个,下调基因总数为94个。
2.6 重金属污水胁迫处理对秋茄中植物激素相关基因表达的调控
前面根据KEGG pathway富集分析得知秋茄在重金属污水胁迫处理下的差异表达基因在植物激素信号转导(5.84%)中富集。而植物激素是植物中的重要化学物质,它们参与绝大部分和植物生长发育和环境适应相关的生物学过程[15]。通过对秋茄转录组DEGs的分析,我们发现了重金属污水胁迫处理对生长素,乙烯,细胞分裂素,脱落酸,赤霉素和油菜素内酯等一系列植物内源激素的生物合成,体内运输和信号转导的相关基因都有一定的影响(表3)。
在污水胁迫处理下,生长素运输载体AUX1基因(Unigene0007561)的表达受到上调,而一个SAURfamily protein(Unigene0028568)的表达受到显著抑制。此外,在乙烯信号途径中,两个乙烯响应转录因子ERF1(Unigene0030198)、ERF5(Unigene0041579)都受到诱导。多个细胞分裂素相关的基因得到了鉴定,它们的表达水平都受到污水胁迫处理的诱导,如细胞分裂素水解酶CKX7(Unigene0017080),type-b响应调节子ARR2(Unigene0033740),一个含有组氨酸的磷酸转移蛋白AHP1(Unigene0018785)和一个双组份响应因子ARR5(Unigene0015908)。其中ARR2受到显著诱导。另一个内源细胞分裂素相关基因玉米黄质环氧化酶ZEP(Unigene0000118)在污水胁迫处理下表达水平上升了数十倍。多个脱落酸基因也得到了鉴定,一个脱落酸不敏感基因ABI5(Unigene0025625)的表达受到显著的下调而它的一个受体蛋白编码基因PYL8(Unigene0016779)受到轻微诱导。有趣的是,油菜素内脂的一个信号转导组分基因BSK(Unigene0008986)的表达受到极大的抑制,而油菜素内脂受体基因BRI1(Unigene0011111)的表达却受到极大的诱导,它们的变化都达到几十倍差异。
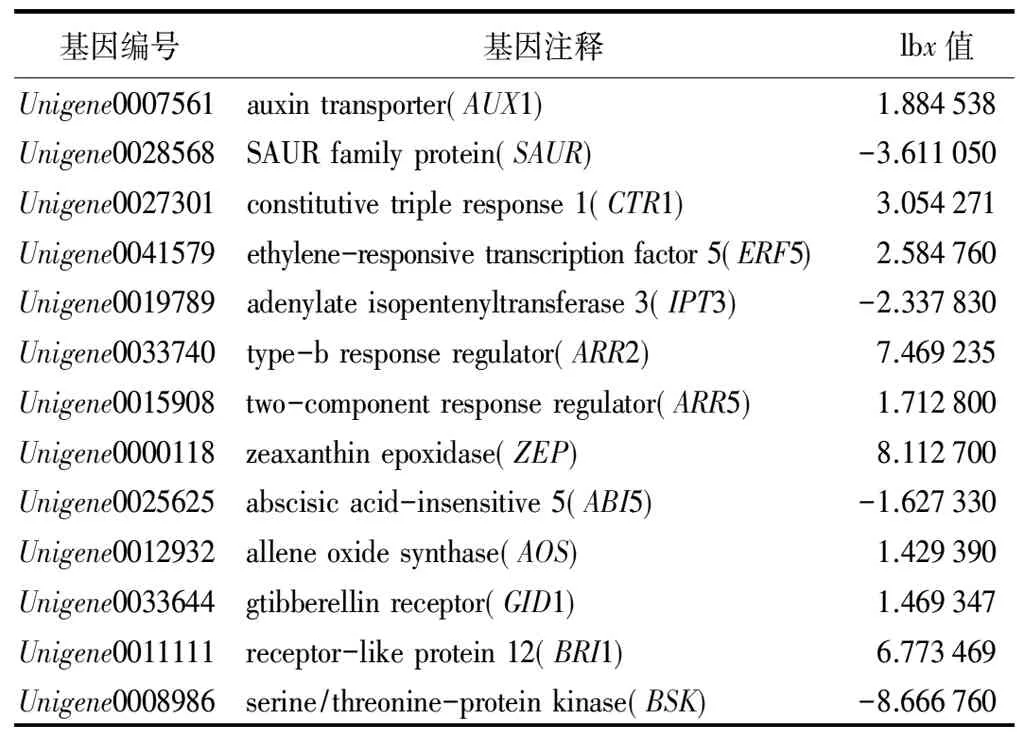
表3 激素相关基因在污水胁迫下的表达差异
注:lbx中x表示差异倍数。
2.7 重金属污水胁迫处理对秋茄次级代谢重要酶编码基因的差异表达
前面根据KEGG pathway富集分析得知秋茄在重金属污水胁迫处理下的差异表达基因在类黄酮合成(3.07%)和双萜类合成(0.77%)中富集。我们通过对秋茄转录组中的DEGs进行KEGG分类发现,污水胁迫处理可显著地诱导秋茄中萜类和黄酮类基因的表达,具体见表4。其中,萜类物质生物合成的限速酶甲基赤藓醇磷酸胞苷酰转移酶(Unigene0019445),牻牛儿基焦磷酸合酶(Unigene0029352)和牻牛儿基转移酶(Unigene0003919)的表达都受到污水胁迫的诱导。另外,黄酮类生物合成的几个关键酶。如:查尔酮合成酶(Unigene0033021),黄酮醇合成酶(Unigene0010384)和黄酮醇磺基转移酶(Unigene0007965)的编码基因表达水平也受到不同程度的诱导,尤其是黄酮醇合成酶的表达显著提高。

表4 响应污水胁迫的次生代谢相关基因
注:lbx中x表示差异倍数。
2.8 差异基因的qRT-PCR验证
为了进一步筛选秋茄污水胁迫响应的关键基因,我们对显著富集的GO分类条目“response to stimulus”(GO:0050896)中的5个差异表达基因进行qRT-PCR分析,以验证数字基因表达谱的可靠性。这5个基因分别为:Unigene0006285,Unigene0017050,Unigene0002022,Unigene0007043和Unigene0016871,它们都是植物响应外界刺激的关键基因。实验表明,这5个基因的qRT-PCR结果与数字基因表达谱中检测到的表达趋势有着较高的一致性。上述5个基因的表达都受到污水处理的诱导,其中Unigene0007043被诱导超过10倍以上。
3 结论与讨论
在重金属污水胁迫处理下,红树植物秋茄可以通过自身调控改变基因的表达,从而在转录和翻译等不同水平上作出相应的反应,进而调控不同代谢和信号转导途径。通过数字基因表达谱分析在转录水平上获得39 480个基因的真实序列信息,大多数基因的覆盖率较高,注释基因的覆盖度在80%~100%,占总基因96.43%,说明物种内基因组的遗传变异相对保守。根据注释基因拷贝数的不同,可以直接反映相应基因的表达差异结果。进一步分析上述基因的拷贝数,发现3 097个差异表达基因在表达量上发生显著的变化,这些基因为我们在分子水平研究红树科植物秋茄提供了可能和深入研究秋茄的污水胁迫耐受特性提供了基础。
相较之于对照样本,重金属污水胁迫处理组样品的差异表达基因表现出广泛的功能多样性。根据GO功能分析,我们发现差异表达基因涉及的范围十分广,几乎包括整一个生物生化过程,其中还包括糖类、蛋白质、核酸等生物大分子以及各种分子功能,这说明秋茄的转录系统是一个高度灵敏的开放式表达调控体系,转录调控是秋茄污水胁迫耐受性的遗传基础。通过对GO分类的深入研究,我们发现“response to stimulus”(GO:0050896)相关基因的表达在对照与处理样本之间存在显著差异。其中,164个环境刺激响应基因显著上调,68个基因显著下调。通过对五个随机选择的环境刺激响应基因的qRT-PCR检测,我们验证了上述差异的可靠性。污水胁迫作为一种强烈的环境刺激,秋茄可能通过调控大量刺激响应基因的表达来实现增强对污水胁迫的耐受性。
污水中含有大量氮、磷等营养物质,秋茄可以通过吸收污水中的营养物质以供自身生长发育[16]。许多有关重金属污水胁迫处理秋茄方面的研究表明,低浓度重金属污水胁迫处理下可以促进红树植物的生长,在一定程度内,随着污水胁迫浓度增加促进作用加强;达到顶点后,随着污水胁迫浓度升高促进作用下降,最后抑制红树植物的生长[8]。这表明,随着污水胁迫浓度的升高,重金属的毒害作用超过了营养物质的促进作用。进一步研究重金属对红树植物生理代谢的影响发现,经过正常浓度重金属污水胁迫处理后,发现秋茄等红树植物的超氧化物歧化酶(SOD)、过氧化物酶(POD)等抗氧化酶系统的活力得到了提高,说明秋茄等红树植物本身具有一定的污染耐受性[17]。本试验通过KEGG Pathway富集分析数据可知,大量差异表达基因与植物激素信号(生长素,乙烯,细胞分裂素,脱落酸,赤霉素和油菜素内酯)及次生代谢调控(黄酮类、萜类、卟琳)等有关,表明红树植物可能通过改变体内植物激素的生物合成、体内运输和信号转导,并增加次生代谢物的积累来抵抗污水胁迫。大量研究表明,植物激素参与植物的抗逆反应[18]。针对秋茄转录组的分析,得到了一系列激素相关基因的编码和转录差异信息,这为我们分析激素参与秋茄重金属污水胁迫耐受性形成的分子机制打下了基础。在模式植物中,生长素运输载体参与植物激素与胁迫响应的机制得到了初步揭示。在盐和干旱胁迫下,水稻的LAX和ABCB家族基因普遍上调,这与秋茄中的AUX1(Unigene0007561)的表达差异相一致[19]。在拟南芥和苜蓿中,镉、铜或者汞胁迫显著诱导了ERF家族基因的表达[20-21]。本研究中,2个乙烯响应转录因子ERF1(Unigene0030198)、ERF5(Unigene0041579)都受到诱导,这与模式植物的表达情况一致。细胞分裂素具有促进细胞分裂的作用,在拟南芥中,细胞分裂素相关基因type-b响应调节因子ARR2基因的过量表达促进了主根的生长和下胚轴的伸长[22],而本研究中,秋茄的type-b响应调节因子ARR2基因(Unigene0033740)在重金属胁迫下被显著诱导,说明胁迫可能促进根细胞的增殖,以此来缓解胁迫带来的影响。在拟南芥中,脱落酸受体蛋白PYL5被证实与植物的环境胁迫抗性有关,而另一个脱落酸受体蛋白PYL4则通过茉莉酸信号途径来发挥其功能[23-24]。在我们的研究中,秋茄的脱落酸受体蛋白PYL8得到了鉴定,它的表达受到污水胁迫处理的诱导,这说明脱落酸也参与了秋茄对污水胁迫的响应。此外,在植物组织的非酶抗氧化系统中,类黄酮发挥重要的作用,可以清除植物体内的自由基和抑制脂质的过氧化,类黄酮化合物的积累与代谢对植物产生应答逆境胁迫具有重要的作用[25]。本研究中类黄酮合成酶基因及萜类合成酶基因表达增加,特别是黄酮醇合成酶(Unigene0010384)和牻牛儿基焦磷酸合酶(Unigene0029352)受到显著诱导,这些基因的诱导表达能够促进秋茄萜类、类黄酮类等次级代谢产物的积累。这些化学成分具有渗透调节、清除自由基等功能,有利于秋茄适应重金属胁迫。
众多的转录因子家族参与了植物环境胁迫的快速响应[26]。在拟南芥中,镉胁迫诱导了许多转录组因子的表达,其中主要包括bHLH,WRKY,MYB和AP2/EREBP等家族[27]。水稻中过量的铜离子影响WRKY,MYB和NAC等基因的表达量,这些基因参与了铜毒害的耐受性[28]。在小麦中,TabHLH13的全长序列得到了克隆,它的表达水平在盐,PEG,低温胁迫等处理下,表现出显著的差异[29]。秋茄转录组中注释为bHLH家族的成员多达658个,大大超过拟南芥的140个和水稻的160个,这说明秋茄的基因组具有更高的复杂性[30]。从陆地棉晋棉—19中分离到了6个NAC型胁迫相关转录因子GhNAC1-GhNAC6,它们在非生物胁迫的信号调控中起着重要的作用[31]。而秋茄中,第二大的转录因子家族NAC也有446个成员得到了初步的分析。WRKY53在镉处理的遏蓝菜中差异表达,这个基因也能被盐胁迫和旱胁迫调控,同时参与胁迫相关的信号传导途径[32]。同时,WRKY在麻风树响应镉胁迫中发挥重要作用[33]。依据秋茄转录组数据,一共373个WRKY家族成员得到了鉴定。这些都在一定程度上说明bHLH,MYB,NAC和WRKY在秋茄响应重金属胁迫中发挥重要作用。本试验分析得到的转录因子家族成员为未来进一步深入研究提供了一定的候选基因,为揭示秋茄污水胁迫耐受性形成的分析机制打下了基础。
总结而言,通过对秋茄进行转录组测序分析,比较了污水处理组和对照组之间的差异,我们发现大量与生长发育,代谢调控,环境刺激响应相关的基因及代谢途径参与了秋茄对污水胁迫的响应。以上研究结果初步探讨了重金属污染胁迫对秋茄次级代谢和生长发育调控的分子机制,也表明了秋茄对重金属胁迫响应机制的复杂性。对其中一些关键基因进行深入研究将有助于全面了解其分子机制,并进一步通过基因工程手段推动植物修复的发展。
[1] WANG L Y, WANG Y S, ZHANG J P, et al. Molecular cloning of class III chitinase gene fromAvicenniamarinaand its expression analysis in response to cadmium and lead stress[J]. Ecotoxicology,2015,24(7):1697-1704.
[2] HUANG G Y, WANG Y S, YING G G, et al. Analysis of type 2 metallothionein gene from mangrove species (Kandeliacandel)[J]. Trees,2012,26(5):1537-1544.
[3] 丘耀文,余克服.海南红树林湿地沉积物中重金属的累积[J].热带海洋学报,2011,30(2):102-108.
[4] 张凤琴,王友绍,李小龙,等.复合重金属胁迫对秋茄幼苗某些生理特性的影响[J].生态环境,2008,17(6):2234-2239.
[5] LI R L, CHAI M W, QIU G Y. Distribution, fraction, and ecological assessment of heavy metals in sediment-plant system in Mangrove forest, South China Sea[J]. PLoS One,2016,11(1):860-868.
[6] ZHANG Z W, XU X R, SUN Y X, et al. Heavy metal and organic contaminants in mangrove ecosystems of China: a review[J]. Environmental Science and Pollution Research,2014,21(20):11938-11950.
[7] 汪文云,张琼,杜静娜,等.镉和芘交互胁迫下红树植物秋茄体内酚类化合物的应答[J].厦门大学学报(自然科学版),2014,53(6):867-874.
[8] 张苏玮.不同浓度生活污水对秋茄(Kandeliacandel)幼苗生长的影响[J].佳木斯教育学院学报,2014(3):439-441.
[9] WANG Y J, DONG C L, XUE Z Y, et al. De novo transcriptome sequencing and discovery of genes related to copper tolerance inPaeoniaostii[J]. Gene,2016,576(1):126-135.
[10] THERIAULT G, MICHAEL P, NKONGOLO K. Comprehensive transcriptome analysis of response to Nickel stress in White Birch (Betulapapyrifera)[J]. PLoS ONE,2016,11(4):1623-1629.
[11] 赵佳丽,张磊,张素芳,等.基于转录组学测序的长白落叶松材性表达基因[J].东北林业大学学报,2016,44(4):8-12.
[12] 赖晓娟,严小军,杨锐,等.高温胁迫下坛紫菜的数字基因表达谱研究[J].海洋学报,2014,36(6):104-111.
[13] 孙爱清,张杰道,万勇善,等.花生干旱胁迫响应基因的数字表达谱分析[J].作物学报,2013,39(6):1045-1053.
[14] ZHANG F Q, WANG Y S, LOU Z P, et al. Effect of heavy metal stress on antioxidative enzymes and lipid peroxidation in leaves and roots of two mangrove plant seedlings (KandeliacandelandBruguieragymnorrhiza)[J]. Chemosphere,2007,67(1):44-50.
[15] 张春荣,桑雪雨,渠萌,等.基于转录组测序揭示适度干旱胁迫对甘草根基因表达的调控[J].中国中药杂志,2015,40(24):4817-4823.
[16] 张志永,郑志伟,彭建华,等.淡水环境下3种红树植物对氮磷的去除效应[J].水生态学杂志,2013,34(5):47-53.
[17] 程皓,陈桂珠,叶志鸿.红树林重金属污染生态学研究进展[J].生态学报,2009,29(7):3893-3900.
[18] VERMA V, RAVINDRAN P, KUMAR P P. Plant hormone-mediated regulation of stress responses[J]. BMC Plant Biology,2016,16(1):1-10.
[19] CHAI C, SUBUDHI P K. Comprehensive analysis and expression profiling of theOsLAXandOsABCBauxin transporter gene families in Rice (Oryzasativa) under phytohormone stimuli and abiotic stresses[J]. Frontiers in Plant Science,2016,7(2):148-153.
[20] MONTERO P M B, MARTINBARRANCO A, ESCOBAR C, et al. Early transcriptional responses to mercury: a role for ethylene in mercury-induced stress[J]. New Phytologist,2014,201(1):116-130.
[21] SCHELLINGEN K, STRAETEN D V, VANDENBUSSCHE F, et al. Cadmium-induced ethylene production and responses inArabidopsisthalianarely onACS2 andACS6 gene expression[J]. BMC Plant Biology,2014,14(1):1-14.
[22] KIM K, HWANG I. Attenuation of cytokinin signaling via proteolysis of a Type-B response regulator[J]. Plang Signaling & Behavior,2012,7(7):756-759.
[23] SANTIAGO J, RODRIGUES A, SAEZ A, et al. Modulation of drought resistance by the abscisic acid receptorPYL5 through inhibition of clade APP2Cs[J]. Plant Journal,2009,60(4):575-588.
[24] LACKMAN P, GODZALE M, TILLFMAN S, et al. Jasmonate signaling involves the abscisic acid receptorPYL4 to regulate metabolic reprogramming inArabidopsisandtobacco[J]. Proceedings of the National Academy of Sciences of the United States of America,2011,108(14):5891-5896.
[25] 邹凤莲,寿森炎,叶纨芝,等.类黄酮化合物在植物胁迫反应中作用的研究进展[J].细胞生物学杂志,2004,26(1):39-44.
[26] 王计平,史华平,毛雪,等.转录因子网络与植物对环境胁迫的响应[J].应用生态学报,2006,17(9):1740-1746.
[27] WEBER M, TRAMPCZYNSKA A, CLEMENS S. Comparative transcriptome analysis of toxic metal responses inArabidopsisthalianaand the Cd2+-hypertolerant facultative metallophyteArabidopsishalleri[J]. Plant Cell and Environment,2006,29(5):950-963.
[28] LIN C Y, TRINH N N, FU S F, et al. Comparison of early transcriptome responses to copper and cadmium in rice roots[J]. Plant Molecular Biology,2013,81(4/5):507-522.
[29] 符思路,刘国祥,张立超,等.小麦盐胁迫相关基因TabHLH13的克隆与分析[J].植物遗传资源学报,2014,15(5):1006-1011.
[30] LI X, DUAN X, JIANG H, et al. Genome-wide analysis of basic/helix-loop-helix transcription factor family in rice andArabidopsis[J]. Plant Physiology,2006,141(4):1167-1184.
[31] MENG C M, CAI C P, ZHANG T Z, et al. Characterization of six novel NAC genes and their responses to abiotic stresses inGossypiumhirsutumL[J]. Plant Science,2009,176(3):352-359.
[32] WEI W, ZHANG Y, HAN L, et al. A novel WRKY transcriptional factor fromThlaspicaerulescensnegatively regulates the osmotic stress tolerance of transgenic tobacco[J]. Plant Cell Reports,2008,27(4):795-803.
[33] 苏稚喆,王雪华,杨华,等.镉胁迫下麻疯树转录组测序分析[J].中国生物工程杂志,2016,36(4):69-77.
Digital Gene Expression Profiling Analysis ofKandeliacandelL. in Response to Artificial Heavy Metal Stress//
Yuan Liujiao, Fu Mengni, Yu Rufeng, Li Haili, Yuan Changchun, Chen Yan, Liu Kaidong(Lingnan Normal University, Zhanjiang 524048, P. R. China)//
Journal of Northeast Forestry University,2017,45(2):22-28.
Kandelia candel; Heavy metals; Sewage treatment; Digital gene expression profiling; Differential expressed gene
1)广东省林业科技创新项目(2013KJCX011-03,2015KJCX025);国家级大学生创新创业项目(201510579277);岭南师范学院自然科学研究项目(LZL1507);岭南师范学院协同创新中心项目(CIL1503);湛江市热带特色资源植物技术开发重点实验室项目(2014A06008)。
袁柳娇,女,1997年3月生,岭南师范学院生命科学与技术学院,在读本科生。E-mail:415592550@qq.com。
刘锴栋,岭南师范学院生命科学与技术学院,副研究员。E-mail:liukaidong2001@126.com。
2016年8月25日。
S718.4
责任编辑:潘 华。
