LINGO-1在脊髓神经干细胞向少突胶质细胞分化中的作用研究
2017-03-13赵晨光许刚琚芬孙玮袁华牟翔
赵晨光,许刚,琚芬,孙玮,袁华,牟翔
LRR结构和免疫球蛋白结构域Nogo受体作用蛋白(LRR and Ig Domain Containing,Nogo Receptor Interacting Protein,LINGO-1)是髓鞘源性抑制因子(Myelin-Associated Inhibitory Factors,MAIFs)复合受体中最为重要的组成部分之一[1]。当脊髓损伤后,Nogo-A、髓磷脂相关糖蛋白(Myelin Associated Glycoprotein,MAG)等髓鞘源性抑制因子大量释放,并通过与NgR/P75/LINGO-1或NgR/P75/LINGO-1复合受体结合来介导多种生物效应,在脊髓损伤后的神经修复中扮演了极其重要的角色[2]。LINGO-1是由614个氨基酸构成的跨膜生物蛋白,由15号染色体编码而成,定位于15q24.3,其可以通过调控RhoA途径,终使生长锥塌陷而使轴突再生受阻[3];也可以参与并下调表皮生长因子受体(Epidermal Growth Factor Receptor,EGFR),从而影响Akt通路而调控神经元存活[4]。瑞典Frisen小组研究证实在小鼠室管膜区存在着“静止”状态的神经干细胞(Neural Stem Cells, NSCs),在脊髓损伤等特定因素下被激活从而出现增殖进而分化的现象[5],本研究旨在观察LINGO-1调控脊髓神经干细胞(Spinal Cord Derived Neural Stem Cells,SpNSCs)向少突胶质细胞分化及成熟的生物学作用,为进一步调控其促进脊髓损伤后神经修复带来新思路。
1 材料与方法
1.1 材料 试验用Fisher344(10周龄)大鼠(160~180g)由第四军医大学实验动物中心提供,共3只,进行3次生物学试验重复。细胞培养用DMEM/F12、B27添加剂、N2添加剂、GlutaMAX添加剂及胎牛血清等均为Gibco公司产品;bFGF和EGF购于Peprotech公司,Accutase、Poly-L-Lysine及Laminin购于Sigma公司;LINGO-1、A2B5、O4、髓鞘碱性蛋白(Anti-Myelin Basic Protein,MBP),荧光二抗FITC-conjugated Goat anti-mouse,FITC-conjugated Goat anti-rabbit及Texas Red-conjugated Goat anti-mouse IgG购自STEMCELL公司。
1.2 方法 ①成年大鼠SpNSCs的分离培养:生长10周Fischer344大鼠处死后,椎板减压暴露脊髓,取C3至T12节段脊髓置于预冷的Hanks液中,小心用眼科剪剥离硬脊膜,将脊髓剪碎后加入Accutase中于37°C中消化30 min,加入NSCs培养基终止消化,离心后用NSCs培养基重悬,用火焰抛光的巴斯德吸管反复吹打成单细胞悬液并用40μm滤网过滤后,胎盘蓝计数,按105/ml密度植于NSCs培养基(DMEM/F12+2%B27+1%N2+20ng/ml EGF+20ng/mlbFGF)中,每3天半量换液一次。生长至第7天时机械吹打法传代处理。每7天传代,大于3代后进行实验。② LINGO-1 shRNA慢病毒表达载体构建及包装由上海吉凯生物基因公司提供。体外培养的大鼠脊髓来源神经干细胞分为对照组及干扰组,干扰组通过LINGO-1 shRNA慢病毒感染SpNSCs下调LINGO-1表达,对照组表达Scramble-shRNA的慢病毒,shRNA插入序列为:Sense5`-TGCTGTAGTCTAGCAGGA-TGACGATCGTTTTGGCCACTGACTGACGATC-GTCACTGCTAGACTA-3 `, Antisense 5 `-CCTG-TAGTCTAGCAGTGACGATCGTCAGTCAGTGG-CCAAAACGATCGTCATCCTGCTAGACTAC-3`。③免疫荧光染色:吸弃培养基用PBS清洗1次以彻底去除残留的培养基,4%多聚甲醛固定30min后用PBS清洗3次,每次5min;加入0.3%Triton X-100通透5min,PBS清洗2次。加入稀释好的一抗4℃孵育过夜,次日吸弃一抗,PBS洗3次,每次5min。加入稀释好的荧光二抗37℃避光孵育2h,PBS洗3次,每次5min,之后滴加DAPI封片剂,室温孵育30min。镜下观察荧光染色的少突胶质细胞形态及数量,并使用Image-Pro Plus 5.0软件进行测量分析A2B5、O4阳性细胞和LINGO-1双染阳性细胞比例。④Westernblot蛋白定量检测:分别在分化第7天取蛋白,吸弃培养液,用预冷的PBS清洗2次,以彻底去除残留的培养液。加入预冷的RIPA裂解细胞并转移入预冷的离心管中,离心后将上清转移至预冷的离心管中,用BCA对提取的蛋白进行定量。取蛋白样品,加入蛋白上样缓冲液,SDS-PAGE分离蛋白,湿转法将蛋白质转移至PVDF膜上。将PVDF膜转移至含有5%脱脂奶粉的TBST封闭液中封闭1h,加入一抗的稀释液,4℃过夜,次日TBST洗膜3次,每次10min。将PVDF膜放入含稀释二抗的10cm皿中,孵育1h,在增强化学发光反应混合液中反应2~3min后,拍片显影,条带灰度采用Imege J软件进行分析MBP蛋白的相对灰度比值。

2 结果
2.1 LINGO-1在少突胶质细胞分化过程中表达情况
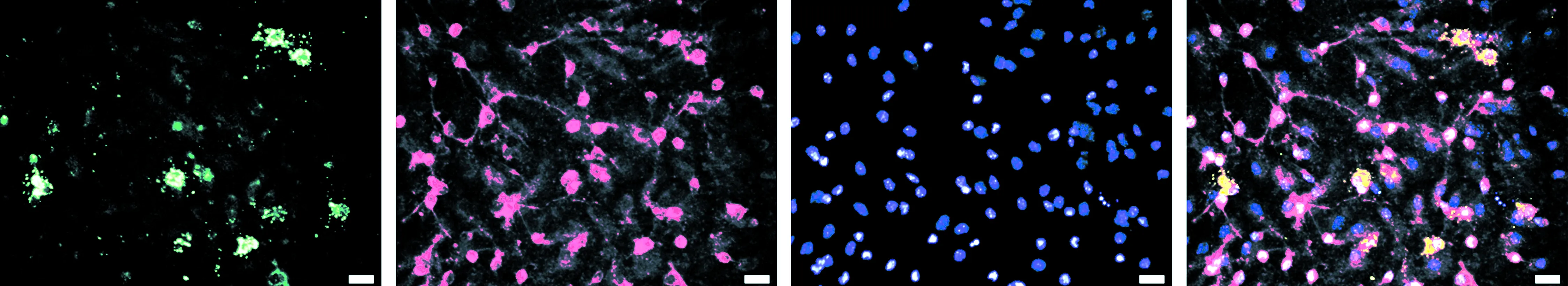
分别采用少突胶质细胞标志物A2B5及O4和LINGO-1抗体进行双染色。结果表明在诱导分化后,部分脊髓神经干细胞向少突胶质细胞分化,细胞有双极或三极突起,胞体较规则。LINGO-1抗体(图1B、F)和A2B5抗体(图1A)、O4抗体(图1E)以及细胞核Hoechst染色(图C、G)显示分别共表达于培养分化细胞中(图1D、H),说明LINGO-1在脊髓神经干细胞分化成为少突胶质细胞的过程中持续表达。
2.2 LINGO-1促进少突胶质细胞分化成熟 为了进一步了解LINGO-1对少突胶质细胞分化成熟的影响,我们在分化第7天应用O4抗体对神经元进行免疫荧光染色。结果提示LINGO-1干扰组的少突胶质细胞(图2D-F)比对照组(图2A-C)的数量更多,成熟度更高,主要表现在LINGO-1干扰组少突胶质细胞分化更为彻底,细胞突起更长,并且有更多的片状髓鞘结构。定量分析成熟少突胶质细胞比例显示对照组为5.3%,而LINGO-1干扰组则高达17.4%,是对照组细胞的3.28倍,2组比较差异有统计学意义(P<0.05)。
2.3 LINGO-1对MBP蛋白表达的影响 相比对照组,LINGO-1干扰组的MBP表达量明显升高(图3),MBP条带采用Image J软件进行灰度值分析比较,转化为数值进行量倍比较,进一步半定量分析显示LINGO-1干扰组的MBP表达量为对照组的5.31倍(56.8±3.3、0.7±0.5,P<0.05)。

A.A2B5 B.LINGO-1 C.Hoechst D.Merge
E.O4 F.LINGO-1 G.Hoechst H.Merge
图1LINGO-1在少突胶质细胞分化过程中表达情况。LINGO-1抗体(B,F)与A2B5抗体(A)、O4抗体(E)以及细胞核Hoechst染色(图C、G)共表达在培养细胞中(D,H)(×40)。
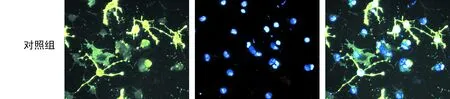
A.O4 B.Hoechst C.Merge
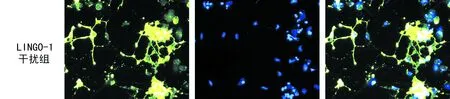
D.O4 E.Hoechst F.Merge
图2LINGO-1对少突胶质细胞分化成熟的影响:荧光倒置显微镜下观察LINGO-1干扰组(D-F)和对照组(A-C)少突胶质细胞的成熟状况,绿色细胞表示O4阳性细胞(×40)。

图3 LINGO-1对MBP蛋白表达的影响
3 讨论
本实验中成功从成年大鼠脊髓中提取培养了神经干细胞,诱导分化后利用免疫荧光染色发现LINGO-1分别与A2B5及O4共表达,证实LINGO-1表达于少突胶质细胞成熟的各阶段。然后利用RNAi对LINGO-1的表达进行下调,发现下调LINGO-1的表达可以促进脊髓神经干细胞向少突胶质细胞分化,并同时促进其成熟,进一步检测成熟少突胶质细胞表达的MBP蛋白时也发现LINGO-1干扰组MBP蛋白表达量明显高于对照组。以上实验结果为脊髓损伤后早期干预促进内源性脊髓神经干细胞向少突胶质细胞分化并促进其成熟提供活体体外证据,也为进一步促进脊髓损伤后神经修复带来希望。
脊髓损伤后大量神经元坏死、神经传导束崩解,少突胶质细胞包裹轴突形成的髓鞘分解,形成大量的髓鞘源性抑制因子(Myelin-Associated Inhibitory Factors,MAIFs),这其中包括Nogo-A、MAG和OMgp为代表抑制因子,其中Nogo-A通过其复合受体之一LINGO-1(LRR and Ig Domain Containing,Nogo Receptor Interacting Protein)介导了多种生物学效应,这包括阻止轴突再生及影响神经元存活[6-7]。脊髓损伤后位于中央水管周围的具有多种分化潜能的神经干细胞被激活,但是大部分却分化成为星形胶质细胞,所以如何调控其分化便成为目前神经修复研究的热点问题。
本实验中我们发现分离培养的脊髓神经干细胞经诱导分化后,LINGO-1分别与少突胶质细胞标志物A2B5及O4共表达于分化细胞中。A2B5及O4同为少突胶质细胞特异性标志物,但是二者的表达时间却不尽相同[8]。A2B5在少突胶质细胞的早期表达,即在少突胶质-2型星形胶质细胞(Oligodendrocyte-Type2 Astrocyte Progenitor,O-2A Progenitor)及成少突胶质细胞中表达,而O4的表达则较为靠后,分别在成少突胶质细胞、未成熟少突胶质细胞及成熟少突胶质细胞中表达。本实验中发现LINGO-1可以分别与以上2个标志物分别共表达,这说明LINGO-1在由脊髓神经干细胞分化为成熟少突胶质细胞的整个过程中持续表达,也提示其可能会在这一过程中持续发挥重要作用。
为了验证LINGO-1对少突胶质细胞分化的作用,我们进一步下调LINGO-1的表达,结果发现干预后少突胶质细胞分化成熟比例有明显提高,达到17.4%,是对照组的3倍之多。此外LINGO-1干扰组的少突胶质细胞还表现为细胞突起更长,并且有更多的片状髓鞘结构。Lööv[9]也检测过LINGO-1对皮层来源NSCs向少突胶质细胞分化的影响,其发现下调LINGO-1后,少突胶质细胞分化成熟有轻微的升高,但是并无统计学意义,这可能与不同来源的NSCs的本身特性有一定关系。
MBP蛋白是成熟少突胶质细胞中表达的蛋白,是构成髓鞘的主要成分之一,其表达量的多少可以间接反映出少突胶质细胞的成熟情况,试验中LINGO-1干扰组的MBP表达量明显升高,为对照组的5倍之多,这与前面的实验结果是一致的,都反应出LINGO-1对NSCs向少突胶质细胞分化成熟的负性调控作用。
本研究没有进一步检测LINGO-1影响少突胶质细胞成熟后对轴突成髓鞘作用的影响及分化成熟可能涉及的通路,这也是本研究下一步所努力的方向。明确LINGO-1在脊髓NSCs分化过程中在少突胶质细胞中的表达特征及其对少突胶质细胞分化成熟的影响可以使我们更加广泛的了解LINGO-1的生物学功能,也为进一步促进脊髓损伤后神经修复提供可能的作用靶点,为治疗脊髓损伤带来更多的希望。
[1] Mi S, Lee X, Shao Z, et al. LINGO-1 is a component of the Nogo-66 receptor/p75 signaling complex[J]. Nat Neurosci, 2004, 7(3): 221-228.
[2] GrandPré T, Nakamura F, Vartanian T, et al. Identification of the Nogo inhibitor of axon regeneration as a Reticulon protein[J]. Nature, 2000, 403(6768): 439-444.
[3] Ji B, Li M, Wu WT, et al. LINGO-1 antagonistpromotes functional recovery and axonal sprouting after spinal cord injury[J]. Mol Cell Neurosci, 2006, 33(3): 311-320.
[4] Zhao XH, Jin WL, Wu J, et al. Inactivation of glycogen synthase kinase-3beta and up-regulation of LINGO-1 are involved in LINGO-1 antagonist regulated survival of cerebellar granular neurons[J]. Cell MolNeurobiol, 2008, 28(5): 727-735.
[5] Sabelström H, Stenudd M, Frisén J. Neural stemcells in the adult spinal cord[J]. ExpNeurol, 2014, 260(1): 44-49.
[6] Mi S, Hu B, Hahm K, et al. LINGO-1 antagonist promotes spinal cord remyelinationand axonal integrity in MOG-induced experimentalautoimmune encephalomyelitis[J]. Nat Med, 2007, 13(10): 1228-1233.
[7] WangF, Zhu Y. Theinteraction of Nogo-66 receptor with Nogo-P4 inhibits the neuronal differentiation of neural stem cell[J]. Neuroscience, 2008, 151(1): 74-81.
[8] Armstrong R. Isolation and Characterization of Immature Oligodendrocyte Lineage Cells[J]. Methods, 1998, 16(3): 282-292.
[9] Lööv C, Fernqvist M, Walmsley A, et al. Neutralization of LINGO-1 during in vitro differentiation of neural stem cells results in proliferation of immature neurons[J]. PLoS One, 2012, 7(1): 29771-29789.
