木质素分解复合菌系LDC的分解特性与细菌组成多样性
2017-03-10李莹艾士奇曹文悦王海鹏熊志强王国兴王伟东
李莹,艾士奇,曹文悦,王海鹏,熊志强,王国兴,王伟东
(黑龙江八一农垦大学生命科学技术学院,大庆 163319)
木质素分解复合菌系LDC的分解特性与细菌组成多样性
李莹,艾士奇,曹文悦,王海鹏,熊志强,王国兴,王伟东
(黑龙江八一农垦大学生命科学技术学院,大庆 163319)
利用细菌复合菌系LDC对木质纤维素进行生物处理,研究其分解及产酶特性、细菌组成多样性,为秸秆类木质纤维素资源的生物利用提供依据。用范氏纤维素测定方法测定复合菌系LDC在降解芦苇的过程中木质纤维素含量变化,同时检测分解过程中的发酵液的pH及酶活力变化趋势;运用高通量技术对LDC的16SrDNA基因的V3-V4区进行测序,分析其细菌组成多样性。LDC具有较强的木质素、半纤维素分解能力,而很少分解纤维素;LDC能够分泌木质素降解酶,漆酶、木质素过氧化物酶、锰过氧化物酶的最大酶活分别为136.7、1 206.5、3 933.3 U·L-1。LDC秸秆周围的液态培养物(S1)及LDC处理后的秸秆表面(S2)两个样品的细菌组成没有差异、菌属组成丰度存在很大差异。S1中相对量最高的优势菌属为索氏菌属(Thauera,22.32%);S2中相对量最高的优势菌属为:假单胞菌属(Pseudomonas,26.99%)。LDC不分解纤维素且具有较高效的木质素分解能力,对研究木质素的生物降解具有非常重要的意义。
木质素分解;复合菌系;木质素降解酶;多样性
木质素是一种结构复杂、广泛存在于植物中的高分子化合物,是构成植物细胞壁的主要成分,是由苯基丙烷结构单元构成的具有三维空间结构的高分子芳香族聚合物[1],是难降解的有机化合物,木质素的预处理是木质纤维素利用的主要瓶颈[2],其在自然界的彻底矿化需要真菌、细菌及相应微生物群落的共同作用。真菌降解木质素能力强,研究结果多且较深入[3],但是生产上应用规模不大。细菌来源广泛、生长快速、对环境变化耐受性强易大规模应用[4-5],但是,目前关于细菌对木质素分解的报道较少。已有研究表明,木质素分解酶类产生于细菌生长的初级代谢阶段,细菌产木质素过氧化物酶(LiP)和锰过氧化物酶(MnP)和漆酶(Lac)能力较真菌弱[7],细菌分解木质素的研究主要集中在单一细菌菌株对木质素的分解途径方面;单一菌株对木质纤维素的分解效果没有多种细菌菌株协同分解的作用强,复合菌系对木质纤维素的分解效果远高于单一菌株[8-9]。因此,如何利用微生物复合菌系组分之间的协同作用高效分解木质素并分析其分解机理具有重要意义。
试验以实验室自己组建的木质素分解复合菌系LDC为研究对象,运用高通量测序技术分析其微生物组成多样性,研究复合菌系分解木质素的特性,为开发分解木质素微生物资源提供新的方法,为研究复合菌系分解木质素机理提供前期基础数据。
1 材料与方法
1.1 菌种
试验自行筛选的木质素分解复合菌系,命名为LDC[10]。
1.2 培养基
MSM培养基:NaNO32.5 g;KH2PO41.0 g;NaCl 0.5 g;MgSO4·7H2O 0.5 g;CaCl20.1 g;微量元素混合液1 mL;蒸馏水1 000 mL,pH为8.3,添加芦苇2%(W/V),1×105Pa灭菌30 min后,冷却后待用。
微量元素混合液(g·L-1):FeCl3·6H2O 0.16 g;Zn SO4·7H2O 1.5 g;CoCl2·6H2O 0.16 g;CuSO4·5H2O 0.15 g;MnSO4·H2O 1.5 g;H3BO30.3 g;Na2MoO4·2H2O 0.1 g。
芦苇:试验所用芦苇均采自黑龙江大庆市芦苇湿地秋季成熟芦苇,经3%NaOH浸泡处理24 h,冲洗至pH为7,80℃烘干备用。
1.3 试验方法
将复合系LDC接种到50 mL的MSM培养基中,接种量为10%(v/v),30℃恒温静置培养,于接种后的0~15 d每天定时取适量的液态培养物,检测其pH变化规律、测定木质纤维素含量,测定漆酶、木质素过氧化物酶和锰过氧化物酶酶活每个处理重复3次,在接种后第5 d取样采用高通量测序方法测定细菌多样性。
1.4 参数测定
1.4.1 pH测定
用HORIBA-212型酸度计(日本)检测培养体系的pH。
1.4.2 木质纤维素含量的测定
用ANKOM220半自动纤维素测定仪(USA)测定芦苇中的木质纤维素,测定方法[10]参照范氏纤维素测定法。
1.4.3 酶活的测定
复合系LDC接种后的1~15 d每天定时取适量的液态培养物离心(12 000 r·min-1,10 min),离心所得上清液为待测的粗酶液。漆酶(Lac):采用ABTS法[11],一个酶活单位(U)定义为每分钟氧化1 μmol ABTS所需的酶量;木质素过氧化物酶(LiP):采用藜芦醇法[12],一个酶活力单位(U)定义为每分钟氧化藜芦醇产生1 μmol藜芦醛所需的酶量;锰过氧化物酶(MnP)[13];一个酶活力单位(U)定义为每分钟氧化Mn2+产生1 μmol Mn3+所需的酶量。
1.4.4 高通量测序
1.4.4.1 测序样品采集
S1:LDC培养第5 d液态培养物
S2:LDC处理后的芦苇秸秆:取10 gLDC处理第5 d的芦苇秸秆,用适量的PBS冲洗秸秆表面,3 000 r·min-1离心10 min后将秸秆取出后,置于50 mL锥形瓶中,加入100 mL PBS,200 r·min-1振荡60 min,40 KHz超声5 min,再200 r·min-1振荡60 min;取上清液到50 mL离心管,先15 000 r·min-1离心1 min,将上清液转移到另一个50 mL离心管中,12 000 r·min-1离心10 min得菌体[14]。
1.4.4.2 总DNA的提取
分别取适量的S1,S2,用氯化苄法提取其总DNA[15]。
1.4.4.3 16srDNA基因V3-V4区PCR扩增及测序
提取样品总DNA后,根据细菌V3+V4区设计得到引物,合并引物接头,进行PCR扩增并对其产物进行纯化、定量和均一化形成测序文库,建好的文库先进行文库质检,质检合格的文库用Illumina MiSeq PE300进行测序[16]。
1.4.4.4 细菌多样性数据分析
对序列进行聚类,将97%相似性的序列聚类成为OTUs(Operational Taxonomic Units)。按众数原则对序列进行注释,对序列进行物种注释。统计每个样品在各分类水平上的构成,用柱状图进行可视化。统计每个样品中在属分类水平上的菌群做聚类,用相同颜色表示该属类所含的OTU序列丰度的相对高低[14]。
2 结果与分析
2.1 复合菌系LDC的分解特性
2.1.1 LDC分解过程中芦苇中木质纤维素含量的变化
图1显示了LDC利用芦苇秸秆为唯一碳源的培养过程中,对纤维素、半纤维素、木质素的分解情况。
LDC主要分解芦苇中木质素、半纤维素,且分解主要发生在培养的前3 d,在第2天时,半纤维素的分解率为32.3%,第3 d时木质素分解量分别为59.9%,最终木质素和半纤维素分解率分别达到60.9%和43.0%。而在培养的过程中纤维素分解率极低,最终为2.0%。
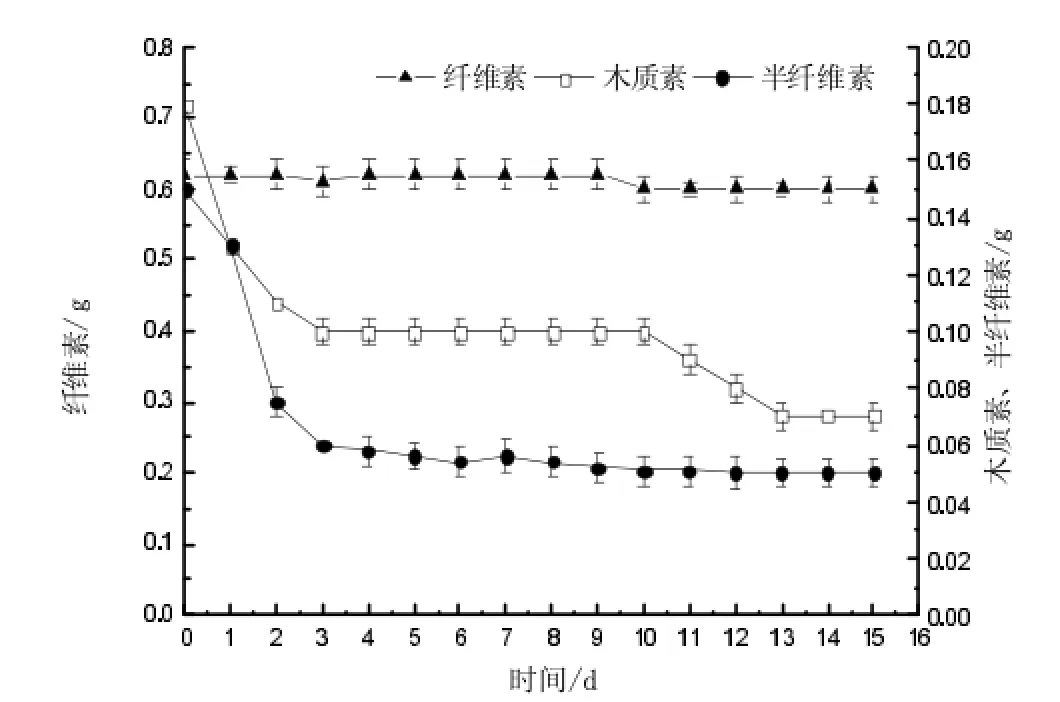
图1 LDC分解过程中芦苇中木质纤维素含量变化规律Fig.1The variation rule of ligncellulose contents during reeds decomposed process by LDC culturing
2.1.2 LDC分解过程中体系的pH变化规律
培养基初始pH以及发酵过程中pH控制是发酵成功与否的关键,碱性条件下有利于细菌对木质素的分解[17-18]。在LDC接种后体系内pH呈先下降后上升趋势,接种后1 d培养体系的pH下降到6.9,第3天回升至7.7,随后回升趋势缓慢,在培养的11 d,维持pH为8.3不变,与培养基初始pH相同。LDC分解木质素、半纤维素的产物为酸性物质,所以体系的pH在培养的前2 d迅速降低,随着木素分解情况趋于平缓,其体系内的pH逐渐恢复至初始水平。王伟东等[19]在研究木质纤维素分解复合菌系WSC-6培养过程中pH的变化时发现,WSC-6在分解稻杆过程中,培养体系内的pH在培养的第3天由初始pH为7.8降至6.0,而后恢复至8.0,说明菌系内多菌株之间协同作用可以调节发酵体系的pH并有利于微生物发挥作用。
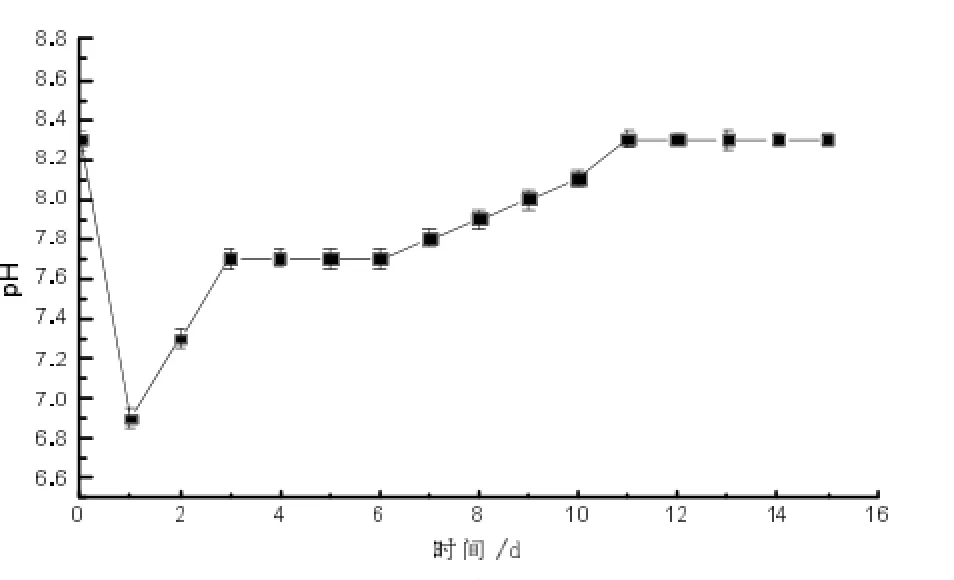
图2 LDC分解木质纤维素过程中体系pH的变化Fig.2The variation of pH during reeds decomposed process by LDC culturing
2.2 LDC分解芦苇过程中酶活性的变化
已有的报道中,最主要、最有效的木质素降解酶分别为:漆酶(Lac)、锰过氧化物酶(MnP)、木质素过氧化物酶(LiP),这三种酶共同构成白腐菌的木质素降解酶系[20]。研究表明细菌也能产生以上三种酶对木质素进行降解[21],但分解木质素的细菌的研究相对较少。图3结果表明,LDC在降解芦苇中的木质素的过程中也能产生与真菌类似的3种木质素降解酶,整个分解周期漆酶的活力较低,仅在第1天达到136.7 U·L-1,随后快速下降直到培养末期都维持在40.0 U·L-1左右;锰过氧化物酶以及木质素过氧化物酶的活力较高且变化趋势也相似,在分解的第1天锰过氧化物酶以及木质素过氧化物酶的活力分别为3 451.9 U·L-1和1 206.5 U·L-1,分别在分解的第2天下降至最低值,从分解的第3天开始两种酶的活力均开始回升,并且锰化物过氧化物酶的活力在第3天达到最大值3 933.3 U·L-1,之后随着分解的进行直到培养的末期酶活力的变化趋于平缓。

图3 LDC分解木质纤维素过程中产木质素降解酶的变化Fig.3The variation of ligninolytic enzyme during reeds decomposed process by LDC
2.3 LDC细菌组成多样性分析
对S1、S2高通量测序后共获得有效序列98 180条,按相似度97%进行聚类分析,2个样品一共获得122个OUTs。其中S1获得43 233条序列(118个 OTUs),S2获得54 947条序列(119个OTUs),S1和S2共有115个OTUs,S1和S2样品细菌组成在属的水平上比较丰富。在97%相似度水平下,各样品Alpha多样性指数值统计如表1所示:

表1 S1、S2细菌组成丰度和多样性指数Table 1Richness and diversity index of bacterial community for S1,S2
在门的分类水平上对相对丰度统计结果为:拟杆菌门(Bacteroidetes)S1:28.38%,S2:38.93%;厚壁菌门(Firmicutes)S1:12.07%,S2:13.56%;变形菌门(Proteobacteria)S1:57.39%,S2:46.75%。S1和S2样品细菌组成在属的水平上包含92个属的细菌,相对丰度高于1%的可分类菌属共有17个,将属的分类水平上的菌群结构的组成绘制成柱状图(图4)。S1中相对量较高的占优势的菌属为索氏菌属(Thauera,22.32%);假单胞菌属(Pseudomonas,8.80%);Proteiniphilum,5.56%;脱硫微菌属(Desulfomicrobium,4.36%)。S2中相对量较高的占优势的菌属为:假单胞菌属(Pseudomonas,26.99%);固氮螺菌属(Azospirillum,4.61%);索氏菌属(Thauera,3.99%)。
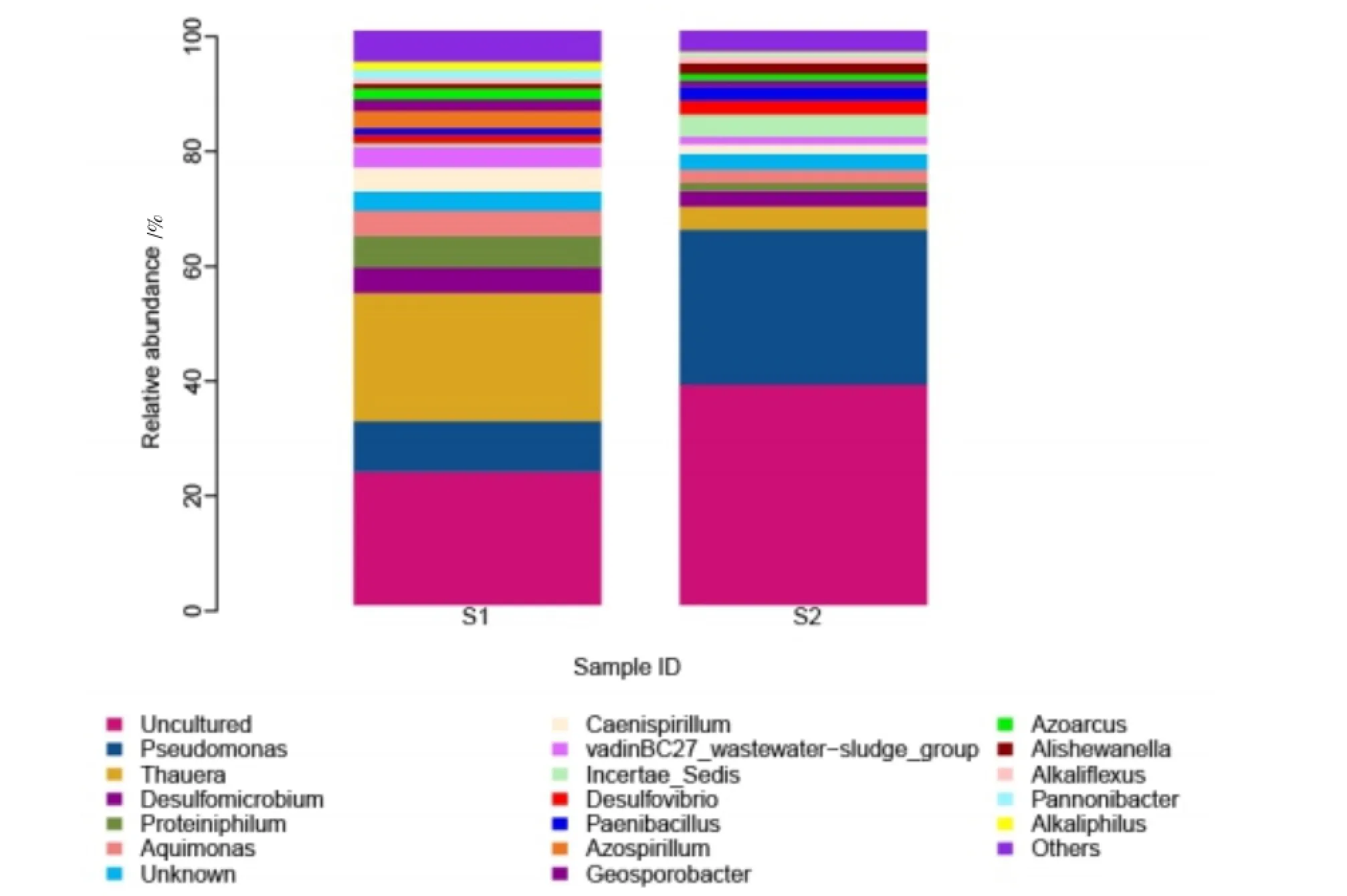
图4 S1和S2在属的分类水平上物种分布柱状图Fig.4Bacteria composition and relative abundance at genus level of S1 and S2
3 讨论
由于木质素是难降解的有机化合物,是生物制浆、乙醇生物转化等纤维素资源利用及木质素污染的环境治理的主要屏障,以限制性培养法筛选出的一组木质素分解复合菌系LDC,其对芦苇秸秆的分解主要发生在培养的前3 d,不但能够去除木质素而且能够保留秸秆中的纤维素很少被分解。木质素的分解需要其他碳源和能源来提供微生物的生长和代谢,王宏勋等[22]在研究木质纤维素降解规律时发现,在秸秆在分解过程中先将其小分子碳源和半纤维素降解为小分子酸类和酯类,再降解半纤维素,最后降解木质素。LDC分解过程中发现木质素分解的同时也伴随着半纤维素的分解,在LDC的培养过程中半纤维素分解主要在培养的前3 d,最终分解率高达43.0%;复合系LDC中与半纤维的分解相关的菌属为类芽孢杆菌属,此细菌能够产生木聚糖酶[23],由于禾本科植物秸秆的半纤维素结构主要是木聚糖,半纤维素可以被微生物分泌胞外酶降解,释放木糖和其他单糖[24]。半纤维素降解产生的糖类可以为体系中的微生物提供生长代谢的能源,有利于难降解的木质素进行分解。
细菌对木质素的降解主要在其生长的初级代谢阶段,细菌产生木质素降解酶,使木质素在分解的初期发生改性,目前对细菌来源的木质素降解酶的种类、结构、机制尚不明确,但有大量研究表明细菌也可以分泌漆酶、木质素过氧化物酶、锰过氧化物酶三种酶[21]。LDC在分解过程中监测产这三种酶情况发现,LDC产漆酶的能力很差,而木质素过氧化物酶、锰过氧化物酶的活力在整个分解过程中都保持很高的活性且酶活力高于已报道的能够降解木质素的单个纯菌株[25],证明LDC是主要产过氧化物酶的。反常的是这三种酶的活力在第1 d就达到较高水平后没有维持下去而是在第2 d下降到了最低值,这可能是体系的pH的变化导致的。孔倩等研究发现高pH利于碱性木质素的分解[17],而LDC体系的pH值在培养1 d后由初始的8.3下降到6.9,pH值的变化对微生物的活动有较大的影响,适宜的pH有利于菌体生长,木质素的分解,同时也影响酶的合成、酶活力的大小[26]。
木质素分解是由不同种类的微生物共同作用完成的,目前关于细菌分解木质素的研究都是针对纯培养菌株展开的,但是对细菌复合菌系对木质素分解的研究几乎没有,试验通过对S1及S2的高通量测序技术分析木质素复合分解菌系LDC的细菌组成与多样性。高通量测序技术相比于传统的分子生物学手段更加全面、准确,可以揭示不同种类的细菌在木质素分解过程中的功能,分析不同菌种之间存在的协同关系。从对液态培养物S1及秸秆表面S2的组成多样性分析来看,两个样品的各菌属组成一致但丰度存在很大差异,同一体系中不同基质上的细菌丰度存在差异,可能是不同菌属的功能造成了分布的不同。S1、S2相对量较高的占优势的菌属为索氏菌属、假单胞菌属、Proteiniphilum、脱硫微菌属、固氮螺菌属。
假单胞菌属可以分解木质素以及芳香族化合物,且被认为是细菌中分解木质素作用最强的微生物[27-28],可以分解分子量从大到小、聚合度从高到低的木质素或芳香族化合物,在S2中所占的比例最大为26.99%,为LDC分解木质素的关键菌群。固氮弓菌属与索氏菌属均具有分解如苯酚类低聚合芳香族化合物的能力[27],可能具有分解分子量较小、聚合度较低的木质素或芳香族化合物的作用,且索氏菌属在S1中所占的比例高达22.32%,推测其在木素分解的过程中代谢大分子木质素分解的中间产物。Proteiniphilum与脱硫微菌属均为严格厌氧菌,Proteiniphilum属于拟杆菌门,其近缘种是在废水反应器中分离得到的,是一种产氢产甲烷菌共生的烃类降解菌[29],在体系中能够协同参与大分子木质素的降解。脱硫微菌属是少数能够降解木质素的厌氧菌之一[21],其能够利用硫酸盐、亚硫酸盐、硫代硫酸盐作为其自身的电子受体产生硫化氢。未培养细菌:所占比例极大,因此其在木质纤维素的分解的过程起的作用较大,而其具体为何种细菌、在LDC体系中的作用都有待于进一步研究。
微生物复合菌系对木质纤维素的分解效果远高于单一菌株[31],说明多种细菌协同作用是木质纤维素高效分解的关键,也符合自然状态下物质的分解规律。
[1]Vanholme R,Demedts B,Morreel K,et al.Lignin biosynthesis and structure[J].Plant Physiology,2010,153(3):895-905.
[2]刘甲峰,李力,陈慧君,等.水稻秸秆腐解复合菌系RSS-4的选育及其腐解特性[J].微生物学通报,2010,37(9):1293-1298.
[3]孙宪昀,曲音波,刘自勇.青霉木质纤维素降解酶系研究进展[J].应用与环境生物学报,2007,13(5):736-740.
[4]Fang X,Shen Y,Zhao J,et al.Status and prospect of lignocellulosic bioethanol production in China[J].Bioresource Technology,2010,101(13):4814-4819.
[5]Bugg T D H,Ahmad M,Hardiman E M,et al.ChemInform Abstract:Pathways for Degradation of Lignin in Bacteria and Fungi[J].Natural Product Reports,2011,28(12):1883-1896.
[6]Ahmad M,Taylor C R,Pink D,et al.Development of novel assays for lignin degradation:comparative analysis of bacterial and fungal lignin degraders[J].Molecular Biosystems,2010,6(5):815-821.
[7]张晓琰,彭学,政井英司.木质素芳香族化合物降解菌Sphingobium sp.SYK-6的研究进展[J].微生物学报,2014,54(8):854-867.
[8]Lei Y,Gao Y,Wang Y,et al.Diversity of a mesophilic lignocellulolytic microbial consortium which is useful for enhancement of biogas production[J].Bioresource Technology,2012,111(5):49-54.
[9]Wang W,Lei Y,Cui Z,et al.Characterization of a microbial consortium capable of degrading lignocellulose[J]. Bioresource Technology,2011,102(19):9321-9324.
[10]Wang Y,Quan L,Lei Y,et al.A novel lignin degradation bacterial consortium for efficient pulping[J].Bioresource Technology,2013,139(7):113-119.
[11]Archibald F S.A new assay for lignin-type peroxidases employing the dye azure B[J].Applied&Environmental Microbiology,1992,58(9):3110-3116.
[12]Ming T,Kirk T K.Lignin peroxidase of Phanerochaete chrysosporium[J].Methods in Enzymology,1988,161(1):238-249.
[13]Datta A,Bettermann A,Kirk T K.Identification of a specific manganese peroxidase among ligninolytic enzymes secreted by Phanerochaete chrysosporium during wood decay[J].Applied&Environmental Microbiology,1991,57(5):1453-1460.
[14]吕昌勇.普洱茶渥堆发酵过程中微生物宏基因组学的测定与分析[D].昆明:昆明理工大学,2013.
[15]Zhu H,Qu F,Zhu L H.Isolation of genomic DNAs from plants,fungi and bacteria using benzyl chloride[J].Nucleic Acids Research,1993,21(22):5279-5280.
[16]Coil D,Jospin G,Darling A E.A5-miseq:an updated pipeline to assemble microbial genomes from Illumina MiSeq data[J].Bioinformatics,2015,31(4):587-589.
[17]孔倩.碱木质素溶液行为的研究[D].广州:华南理工大学,2011.
[18]罗宇煊,张甲耀,龚利萍,等.正交实验选择嗜碱细菌分解木质素的最优综合培养条件[J].环境科学,2001(22):95-98.
[19]王伟东,王小芬,刘长莉,等.木质纤维素分解菌复合系WSC-6分解稻秆过程中的产物及pH动态[J].环境科学,2008,29(1):219-224.
[20]唐菊,段传人,黄友莹,等.白腐菌木质素降解酶及其在木质素降解过程中的相互作用[J].生物技术通报,2011(10):32-36.
[21]徐炳政,王颖,梁小月,等.乳酸菌细菌素应用研究进展[J].黑龙江八一农垦大学学报,2015,26(1):60-63.
[22]王宏勋,杜甫佑,张晓昱.白腐菌对稻草秸秆中木质纤维素降解规律的研究[J].中国造纸学报,2007,22(4)18-22.
[23]Ko C H,Lin Z P,Tu J,et al.Xylanase production by Paenibacillus campinasensis BL11 and its pretreatment of hardwood kraft pulp bleaching[J].Int.Biodeterior. Biodegrad,2010,64:13-19.
[24]杨茜,李维尊,鞠美庭,等.微生物降解木质纤维素类生物质固废的研究进展[J].微生物学通报,2015,42(8):1569-1583.
[25]Yan S,Chai L,Tang C,et al.Characterization and genomic analysis of kraft lignin biodegradation by the betaproteobacterium Cupriavidus basilensis B-8[J].Molecular&Cellular Biology,2012,15(9):5017-5029.
[26]管筱武,张甲耀,罗宇煊,等.嗜碱木素分解菌分解能力的初步研究[J].中国造纸,1999(6):19-22.
[27]Yang J S,Ni J R,Yuan H L,et al.Biodegradation of three different wood chips by Pseudomonas,sp.PKE117[J].InternationalBiodeterioration&Biodegradation,2007,60(2):90-95.
[28]Das M T,Budhraja V,Mishra M,et al.Toxicological evaluation of paper mill sewage sediment treated by indigenousdibenzofuran-degradingPseudomonas,sp[J]. Bioresource Technology,2012,110(2):71-78.
[29]Mechichi T,Stackebrandt E,Gad’On N,et al.Phylogenetic and metabolic diversity of bacteria degrading aromatic compounds under denitrifying conditions,and descriptionofThaueraphenylacetica,sp.nov.Thauera aminoaromatica sp.nov.and Azoarcus buckelii,sp.nov[J].Archives of Microbiology,2002,178(1):26-35.
[30]Chen S,Dong X.Proteiniphilum acetatigenes gen.nov. sp.nov.from a UASB reactor treating brewery wastewater[J].International Journal of Systematic&Evolutionary Microbiology,2005,55(6):2257-2261.
[31]蒋荣清,袁兴中,曾光明,等.一组高效木质素降解复合菌的筛选[J].应用与环境生物学报,2010,16(2):247-251.
Decompostion Characterization and Diversity of Bacterial Composition of Lignin Deragdation Community LDC
Li Ying,Ai Shiqing,Cao Wenyue,Wang Haipeng,Xiong Zhiqiang,Wang Guoxing,Wang Weidong
(College of Life Science and Technology,Heilongjiang Bayi Agricultural University,Daqing 163319)
In order to better use the compound bacteria strains LDC to treat lignocellulose resources,it was important to research its characteristics of decomposition,producing enzyme and the diversity of bacteria composition.The change of lignocellulose content during the process of reed degradation with LDC was detected by using the Fann cellulose determination method.The change tendency of pH and enzyme activity of fermentation liquid in the process of reed degradation was detected.The V3-V4 region of 16SrDNA gene of LDC was sequenced by using high throughput technology to analyze the diversity of bacteria composition.The LDC had strong ability of lignin and hemicellulose decomposition,but weak ability of cellulose decomposition.The LDC could secrete lignin degradation enzymes and the maximal enzyme activity of laccase,lignin peroxidase and manganese peroxidase was 136.7,1 206.5 and 3 933.3 U·L-1respectively.There was no difference in the bacteria composition of the two samples consisting liquid cultures(S1)and the surface of straw treated by LDC(S2).However,there was a big difference in the composition abundance of bacteria genus both S1 and S2.The dominant bacterium of the highest relative amount was Thauera in the S1(Thauera,22.32%). The dominant bacterium of the highest relative amount was Pseudomonas in the S2(Pseudomonas,26.99%).The LDC had very important significance for the study of lignin biodegradation in cellulose decomposition with high efficiency.
lignin degradation;bacterial community;lignocellulolytic enzymes;diversity of bacterial composition
Q939
A
1002-2090(2017)01-0083-06
2015-11-12
国家科技支撑计划(2015BAD21B04,2012BAD12B05-3);黑龙江省高校科技创新团队项目(2012TD006);黑龙江农垦总局攻关项目(HNK125B-11-06A,HNK125B-11-11A)。
李莹(1990-),女,黑龙江八一农垦大学生命科学技术学院2013级硕士研究生。
王伟东,男,教授,博士研究生导师,E-mail:wwdccy@126.com。
