不同分子分型乳腺癌新辅助化疗对TopⅡα蛋白表达的影响
2017-03-09杨良权娄欢欢周东光李明雷
杨良权,娄欢欢,周东光,李明雷
(1.河北省秦皇岛市妇幼保健院乳腺科,河北 秦皇岛 066000;2.河北省秦皇岛市开发区医院外科,河北 秦皇岛 066004)
·论 著·
不同分子分型乳腺癌新辅助化疗对TopⅡα蛋白表达的影响
杨良权1,娄欢欢2,周东光1,李明雷1
(1.河北省秦皇岛市妇幼保健院乳腺科,河北 秦皇岛 066000;2.河北省秦皇岛市开发区医院外科,河北 秦皇岛 066004)
目的探讨不同分子分型乳腺癌新辅助化疗(neoadjuvant chemotherapy,NAC)对TOPⅡα蛋白表达的影响。方法选取114例经NAC前后的乳腺癌患者病理标本,采用免疫组织化学方法检测其TOPⅡα蛋白表达的变化,并观察疗效。结果141例浸润性乳腺癌标本中,在病理学Ⅰ级、Ⅱ级、Ⅲ级间TopⅡα阳性率差异有统计学意义(P<0.05),但Ⅰ级、Ⅱ级、Ⅲ级间两两比较差异无统计学意义(P>0.05)。化疗反应有效者TopⅡα阳性率高于无效者,差异有统计学意义(P<0.05)。而不同年龄、是否有家族史、是否绝经、肿瘤大小、是否淋巴结转移患者TopⅡα表达阳性率差异无统计学意义(P>0.05)。141例乳腺癌患者分为Luminal A型、Luminal B1型、Luminal B2型、HER-2表达型、三阴性5型,NAC前三阴性TopⅡα表达阳性率高于Luminal A型(P<0.05),NAC后各型之间差异无统计学意义(P>0.05)。 NAC后Luminal B2型和HER-2表达型TopⅡα表达阳性率低于NAC前,差异有统计学意义(P<0.05)。结论TopⅡα能客观反映乳腺癌的增殖活性,可作为判断乳癌患者预后及指导化疗的有效指标。
乳腺肿瘤;新辅助化疗;DNA拓扑异构酶类,Ⅱ型
近年来,我国乳腺癌发病率逐年升高,尤其在发达城市的发病率已超过宫颈癌,成为了女性恶性肿瘤的第一大疾病,化疗是控制其复发转移的主要手段之一,而新辅助化疗(neoadjuvant chemotherapy,NAC)通过抗癌药可有效调控癌细胞的生命活动,对癌细胞的增殖、分化具有较高的抑制作用[1],目的是降低肿瘤分期、提高手术的切除率和保乳率,并且可以了解新辅助药物的敏感性,减少耐药细胞出现,如能达到病理完全缓解则可有较好的生存获益。影响乳腺癌NAC疗效的重要原因是肿瘤细胞的多药耐药性[2]。DNA拓扑异构酶Ⅱα(topoisomerase Ⅱα,Top Ⅱα)是耐药蛋白之一,是参与细胞复制、转录、基因重组及有丝分裂等重要的功能酶,TopⅡα抑制剂选择性抑制增殖期DNA复制细胞,集中杀伤肿瘤细胞,可大大延长患者无进展生存期和总生存期[3-4]。目前,蒽环类药物是乳腺癌新辅助治疗最主要的药物之一,有研究发现,TopⅡα是蒽环类药物的作用靶点,其过表达则对蒽环类药物敏感[5-6]。本研究对141例乳腺癌患者采用以蒽环类为基础的NAC,观察其化疗前后TopⅡα的变化,结果报告如下。
1 资料与方法
1.1 一般资料 选取2012年1月—2014年10月河北省秦皇岛市妇幼保健院乳腺科收治的乳腺癌患者141例。所有患者均为女性,年龄31~61岁,中位年龄42岁,肿瘤临床分期Ⅱ期86例,Ⅲ期55例。所选标本均为巴德针穿刺活组织检查或外科术后病理及免疫组织化学证实为浸润性导管癌。穿刺前均未行化疗、放疗和内分泌治疗。NAC方案为表柔比星、环磷酰胺(EC)4个周期序贯多西他赛(T)4个周期(每3周为1个周期)。2周期后进行疗效评估,其间评估无效(疾病稳定和疾病进展)者中转手术、有效(完全缓解和部分缓解)者完成所有周期化疗后14~21 d接受手术治疗。分型按2013中国抗癌协会乳腺癌诊治指南与规范的定义分类标准[7]。
1.2 方法 取其化疗前穿刺及化疗后手术石蜡标本进行4 μm连续切片,用涂有3-氨丙基-3-甲氧基硅烷的载玻片置于切片盒子备用。采用即用型二步法(非生物素法)进行TopⅡα免疫组织化学检测:①石蜡切片于烤箱60 ℃烤20 min,二甲苯脱蜡,梯度酒精(100%、95%、85%)脱二甲苯,每瓶2 min,蒸馏水冲洗,PBS冲洗;②3%双氧水室温孵育5 min,以消除内源性过氧化物酶的活性,磷酸盐缓冲液冲洗,烤箱37 ℃,20 min,92~98 ℃微波修复30~40 min,室温自然冷却,TBS冲洗;③玻片滴加TopⅡα一抗50 μL,4 ℃过夜,次日取出,甩去玻片表面液体,TBS冲洗;④滴加二抗50 μL,37 ℃孵育30 min,甩去玻片表面液体,TBS冲洗;⑤根据DAB显色试剂盒配置显色剂,根据背景颜色控制反应5~15 min,自来水冲洗,苏木精染色5 min,在1%盐酸中涮洗数秒,再用清水涮洗,自来水返蓝5 min;⑥梯度酒精(85%、95%、100%)脱水,每瓶2 min,二甲苯原液2瓶脱酒精,各1 min。鼠抗人TopⅡα单抗及二抗均购自丹麦DAKO公司,免疫组织化学染色用PBS代替一抗作阴性对照,以已知阳性组织作阳性对照。DAB显色,苏木精复染,操作步骤严格按照说明书进行。
1.3 结果判断 由2位专业病理科医师在在显微镜下进行双盲半定量计数,TopⅡα均根据2012年美国临床肿瘤协会阳性判断标准进行判定:在肿瘤细胞核内有黄色或棕黄色着色颗粒为阳性,阳性细胞<5%为(-),5%~10%为可疑(±),>10%~50%为(+),>50%~75%为(++),>75%为(+++),其中(+)~(+++)者为TopⅡα阳性患者,(-)及(±)者为TopⅡα阴性患者。
1.4 临床判断 根据实体瘤评价标准,采用化疗前后测量肿瘤最大直径改变进行评估,判断肿瘤对NAC是否有反应。目标病灶的治疗反应分为完全缓解(所有肿瘤完全消失)、部分缓解(肿瘤最大直径缩小≥30%)、疾病进展(肿瘤最大直径增加≥20%或出现新病灶)、疾病稳定(肿瘤最大直径改变不大,达不到部分缓解和进展的标准)。完全缓解和部分缓解为有效,疾病稳定和疾病进展为无效,有效率=(完全缓解+部分缓解)例数/总例数×100%。
1.5 统计学方法 应用SPSS 17.0统计软件处理数据,计数资料比较采用χ2检验。P<0.05为差异有统计学意义。
2 结 果
2.1 TopⅡα在乳腺癌各临床病理指标中的表达及对化疗的反应情况 本研究141例浸润性乳腺癌标本中,在病理分级Ⅰ级、Ⅱ级、Ⅲ级间TopⅡα阳性率差异有统计学意义(P<0.05),但病理分级Ⅰ级、Ⅱ级、Ⅲ级间两两比较差异无统计学意义(P>0.05)。化疗反应有效者TopⅡα阳性率高于无效者,差异有统计学意义(P<0.05)。而不同年龄、是否有家族史、是否绝经、肿瘤大小、是否淋巴结转移患者TopⅡα阳性率差异均无统计学意义(P>0.05)。见表1。
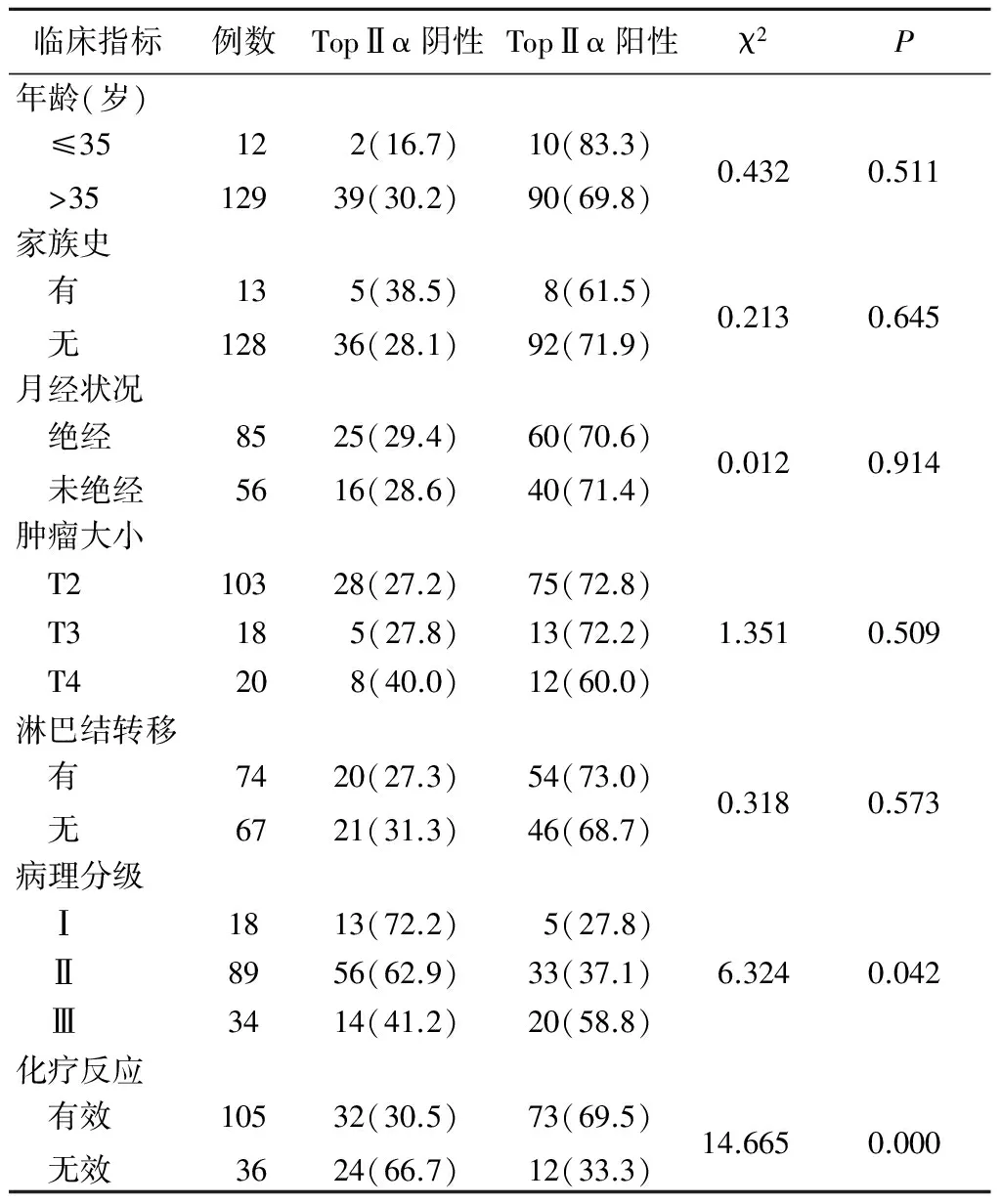
表1 TopⅡα表达与乳腺癌临床病理、化疗疗效的关系 (例数,%)
2.2 不同型别乳腺癌NAC前后TopⅡα的变化 141例乳腺癌患者分为Luminal A型、Luminal B1型、Luminal B2型、HER-2表达型、三阴性5型。NAC前三阴性TopⅡα表达阳性率高于Luminal A型(P<0.05),NAC后各型之间差异无统计学意义(P>0.05)。 NAC后Luminal B2型和HER-2表达型TopⅡα表达阳性率均低于NAC前,差异有统计学意义(P<0.05)。 见表2。
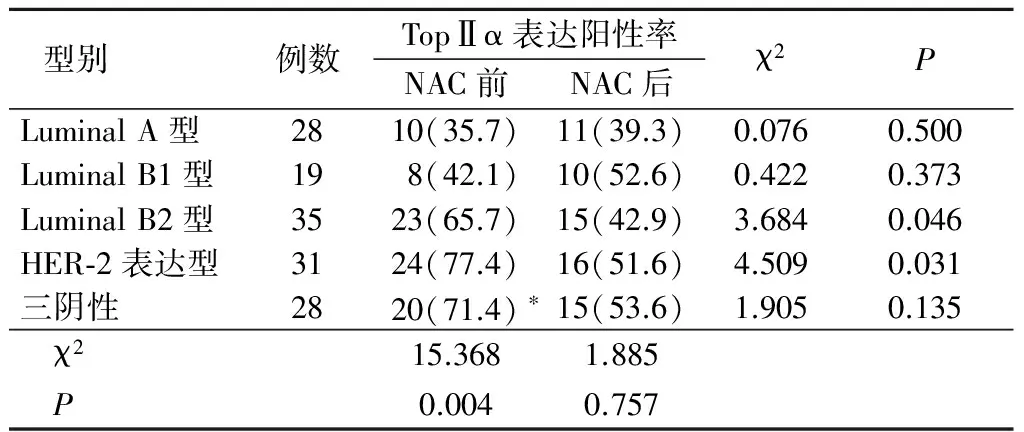
表2 不同分型乳腺癌患者NAC前后TopⅡα表达阳性率比较 (例数,%)
*P<0.05与Luminal A型比较(χ2检验)
3 讨 论
乳腺癌的发生是多基因、多步骤参与的一个复杂的过程,无论在分子生物学特征、免疫表型、组织形态、基因特点,还是对治疗的反应上都存在着极大的差异,而这种异质性提示其在分子水平上可能具有不同的分子亚型。随着分子生物学的发展,因子表达在NAC疗效及预后预测方面逐渐显示出重要的临床意义和价值,具有一定的化疗方案指导作用[8-9]。其分型的金标准是基因芯片分析,但由于其标本制作困难、操作复杂及其耗费昂贵等原因,使其应用受到很大限制,目前免疫组织化学法作为一项较为成熟的技术成为替代基因芯片法的理想手段。DNA拓扑异构酶分为TopⅠ和TopⅡ 2种类型,并各包含若干亚型。其中,TopⅡ能同时切断DNA的2条链,与断链的5′端结合,形成酶-DNA共价中间物,改变DNA螺旋结构以后,再连接2条链,然后与DNA分离,因此TopⅡ不仅与DNA复制、转录、染色分离有关,而且还与DNA重组、修复有关[10]。本研究采用免疫组织化学法检测141例乳腺癌患者TopⅡα表达特点,结果显示病理分级为Ⅰ级的TopⅡα阳性率为27.8%,Ⅱ级的TopⅡα阳性率为37.1%,Ⅲ级的TopⅡα阳性率为58.8%,差异有统计学意义(P<0.05)。表明病理分级越高,TopⅡα表达水平也越高。TopⅡα基因产物为同型二聚体蛋白质,是客观反映细胞恶性程度的指标之一。理论上癌细胞的分裂增殖越快,恶性程度越高,所需核酶TopⅡα也就越多[11]。TopⅡα蛋白的高表达提示肿瘤的增殖率越高,恶性度更高。Petit等[12]研究显示,TopⅡα在乳腺癌中的表达与病理学分级呈正相关,与雌激素受体、完全缓解呈负相关,且临床Ⅱ期、Ⅲ期患者如伴有TopⅡα高表达,其预后较低表达者差。说明TopⅡα的表达水平与增殖活性的病理分级相关,故TopⅡα能够客观地反映乳腺癌的增殖活性,对预后有一定的预测作用。
目前,乳腺癌主要的化疗方案是以蒽环类为基础或辅助紫杉类,TopⅡα表达是药敏基础,有研究显示经蒽环类药物治疗后的乳腺癌患者,其肿瘤局部TopⅡα的表达阳性率降低,而且TopⅡα表达阳性率降低的患者其化疗效果也明显更好。本研究结果显示,NAC前后TopⅡα蛋白的表达确实发生一定程度的变化,阳性转阴性率为60.3%(85/141)。这是因为TopⅡα主要分布于细胞核浆,可有效与抗肿瘤药物结合,故TopⅡα阳性表达患者在进行化疗时,化疗药物可更有效地杀灭癌变细胞;同时在化疗过程中,化疗药物诱导肿瘤细胞重新表达受体,肿瘤细胞形成选择性克隆,致使受体阳性或者阴性的细胞选择性存活。肿瘤细胞多药耐药基因的扩增,使其对药物产生耐药性,故TopⅡα表达由阳性转阴性,表明化疗药物杀灭大量肿瘤细胞,致使TopⅡα表达水平下降。而TopⅡα阳性转为阴性在Luminal B-like型和HER-2表达型中尤为明显,与HER-2与TopⅡα在基因定位上非常邻近有关,均位于17q12-22,故两者在基因表达和变化上存在某种联系。
总之,NAC可改善某些乳腺癌患者的预后,分子标记物TopⅡα可成为预测NAC疗效和预后的参考指标。但还存在一个不可忽视的问题,由于穿刺标本取材有限,取到的组织不一定能代表肿瘤的全部特性而影响其准确判断。手术后切除标本评价应再次复习穿刺标本的常规病理切片,以便作出客观的治疗后评价。
[1] 桑果,王本忠.乳腺癌新辅助化疗不同方案近期疗效观察及化疗前后Ki-67的表达变化[J].安徽医科大学学报,2011,46(11):1181-1184.
[2] 袁磊,时冉冉,饶淑梅,等.沉默AEG-1基因逆转乳腺癌MCF-7/ADM细胞耐药性[J].生理学报,2014,66(5):625-630.
[3] 冯庆梅,陈刚,裴月湖.DNA拓扑异构酶Ⅰ抑制剂的研究进展[J].沈阳药科大学学报,2015,32(11):900-910.
[4] Jacobsen RG,Mazloumi Gavgani F,Mellgren G,et al. DNA topoisomerase Ⅱα contributes to the early steps of adipogenesis in 3T3-L1 cells[J]. Cell Signal,2016,28(10):1593-1603.
[5] Ishikawa T,Sasaki T,Tanabe M,et al. The pathological response to anthracycline is associated with topoisomerase Ⅱα gene amplification in the HER2 breast cancer subset[J]. J Surg Sci,2014,2(1):10-12.
[7] 中国抗癌协会乳腺癌专业委员会.中国抗癌协会乳腺癌诊治指南与规范(2013版)[J].中国癌症杂志,2013,23(8):637-684.
[8] 丁婕,戴旭,孟宪运,等.实体瘤疗效评价标准的研究进展[J].中国肿瘤临床与康复,2015,22(9):1150-1152.
[9] Waldrep AR,Avery EJ,Rose FF Jr,et al.Breast cancer subtype influences the accuracy of predicting pathologic response by imaging and clinical breast exam after neoadjuvant chemotherapy[J]. Anticancer Rse,2016,36(10):5389-5395.
[10] Naylor RM,Jeganathan KB,Cao X,et al. Nuclear pore protein NUP88 activates anaphase-promoting complex to promote aneuploidy[J]. J Clin Invest,2016,126(2):543-559.
[11] 秦尚尧,袁一旻,胡昕,等.拓扑异构酶Ⅱ的结构、功能及作用机制研究进展[J].生理学报,2016,68(1):98-106.
[12] Petit T,Wilt M,Velten M,et al. Comparative value of tumour grade,hormonal receptors,Ki-67,HER-2 and topoisomerase Ⅱ alpha status as predictive markers in breast cancer patients treated with neoadjuvant anthracycline-based chemotherapy[J]. Eur J Cancer,2004,40(2):205-211.
(本文编辑:许卓文)
2016-11-04;
2016-12-25
杨良权(1980-),男,山西应县人,河北省秦皇岛市妇幼保健院主治医师,医学硕士,从事乳腺外科疾病诊治研究。
R737.9
B
1007-3205(2017)02-0230-04
10.3969/j.issn.1007-3205.2017.02.027
