运动和饮食调整对内质网应激介导非酒精性脂肪肝大鼠模型肝细胞凋亡的影响
2017-03-09李军汉苏全生孙君志张仲阳
李军汉苏全生孙君志张仲阳
1成都体育学院运动医学系(四川 成都 610041)2北京体育大学研究生院(北京 100081)
运动和饮食调整对内质网应激介导非酒精性脂肪肝大鼠模型肝细胞凋亡的影响
李军汉1,2苏全生1孙君志1张仲阳1
1成都体育学院运动医学系(四川 成都 610041)2北京体育大学研究生院(北京 100081)
目的:探讨运动和饮食调整对内质网应激介导非酒精性脂肪肝大鼠模型肝细胞凋亡的影响及其机制。方法:70只雄性SD大鼠中随机抽取20只为对照组,其余50只为模型组,对照组予普通饲料喂养,模型组予高脂饲料喂养。实验第8周,对照组和模型组各取10只做肝脏病理切片。确定NAFLD模型成功后,模型组随机分为4组:模型组(M组)、运动组(EM组)、饮食调整组(FM组)和运动结合饮食调整组(EFM组),每组各10只,对照组剩余10只大鼠编为C组。C组继续普通饲料喂养,M组和EM组继续高脂饲料喂养,FM组和EFM组由高脂饲料改为普通饲料喂养;EM组、EFM组给予有氧游泳运动干预,每周运动6 d,每天1次,每次60 min,连续8周,直至第16周实验结束。油红O染色观察肝脏病理形态变化,TUNEL法测肝细胞凋亡,western blot检测C/EBP同源蛋白(CHOP)、C-Jun氨基末端激酶(JNK)和Caspase12蛋白表达,免疫组化检测CHOP、JNK和Caspase12蛋白阳性表达。结果:(1)M组肝细胞脂滴数量显著高于C组,各干预组脂滴数量介于C组和M组之间;(2)M组肝细胞凋亡指数高于C组,CHOP、Caspase12、JNK蛋白表达及阳性表达较C组高;各干预组肝细胞凋亡指数低于M组,CHOP、Caspase12、JNK蛋白表达及阳性表达较M组低;(3)M组、EM组、FM组、EFM组4组双因素方差结果示:运动和饮食对CHOP、Caspase12、JNK蛋白表达具有主效应,且二者具有叠加交互效应。结论:内质网应激介导细胞凋亡参与NAFLD的发展,运动和饮食调整可延缓NAFLD的发展,且二者联合作用效果更佳,其机制与运动和饮食调整降低内质网应激介导细胞凋亡蛋白CHOP、JNK和Caspase12在肝细胞的表达,抑制肝细胞凋亡有关。
内质网应激;细胞凋亡;非酒精性脂肪肝;运动;饮食调整
非酒精性脂肪肝(non-alcoholicfattyliver disease,NAFLD)是由酒精和其他明确的肝损伤以外因素所致的临床病理综合征,以弥漫性肝细胞脂肪变为主要特征,包括单纯性脂肪肝、脂肪性肝炎和肝硬化等[1]。近年来,NAFLD发病率呈上升趋势,严重危害人们健康,但其发生机制仍不清楚[2]。
研究表明肝细胞凋亡在NAFLD的发生发展中扮演了非常重要的角色[3]。目前普遍认为细胞凋亡包括三条途径:死亡受体途径、线粒体介导途径和内质网应激介导细胞凋亡途径[4]。内质网应激介导细胞凋亡途径的核心内容是内质网应激(endoplasmic reticulum stress,ERS)[5]。ERS介导细胞凋亡途径是由ERS引发的完全独立于死亡受体途径和线粒体途径之外的另一条细胞凋亡途径[6]。随着对ERS的研究深入,ERS在细胞凋亡中起着重要作用已明确。ERS介导的细胞凋亡途径日益受到人们的重视。
NAFLD在临床治疗上尚无特效药物[7]。目前,NAFLD的治疗主要采用体重控制、饮食调整、胰岛素致敏剂、降脂药、肾素血管紧张素阻断剂、熊去氧胆酸、肉碱药物和运动治疗等方法[8]。文献[9,10]认为改变生活方式可以改善肝脂肪病变,生活方式干预为治疗NAFLD的首选方法。饮食调整被认为是治疗NAFLD的基本方法,也是预防和控制NAFLD进展的重要措施之一[11]。有研究[12]报道NAFLD与活动量少呈正相关。但迄今为止,运动和饮食调整对NAFLD的细胞分子机制还不明确。本研究通过高脂饲料喂养诱导大鼠NAFLD动物模型,并采用运动和饮食调整单独或联合干预,探讨运动和饮食调整对内质网应激介导NAFLD细胞凋亡的影响。
1 材料与方法
1.1 实验动物
8周龄SD雄性大鼠70只,SPF/VAF级,体重196. 16±6.96克,购于成都达硕实验动物技术有限公司,许可证编号:SCCD(川)2012-0001。SD大鼠在成都体育学院实验中心小动物房内饲养和训练。分笼饲养,自由饮食饮水,室温18~22℃,相对湿度45%~55%,12小时光照和12小时熄灯模拟昼夜交替。
1.2 动物分组
所有大鼠适应性喂养3天后,按体重编号,随机抽取20只为对照组,其余50只为模型组。对照组予以普通饲料喂养,模型组予以高脂饲料喂养。实验第8周,对照组和模型组各取10只做肝脏冰冻切片,油红O染色观察肝脏脂滴生成情况,确定NAFLD模型造模成功后,模型组剩余大鼠随机分为4组:模型组(M组)、运动组(EM组)、饮食调整组(FM组)和运动结合饮食调整组(EFM组),每组各10只,对照组剩余大鼠编为C组。C组继续普通饲料喂养,M组和EM组继续高脂饲料喂养,FM组和EFM组由高脂饲料改为普通饲料喂养;EM组、EFM组给予有氧游泳运动干预,连续8周,直至第16周实验结束。
1.3 饲料及配方
高脂饲料[13]配方:基础饲料71.8%、猪油18%、胆固醇2.0%、胆盐0.2%、蛋黄粉8%。基础饲料和高脂饲料均由成都达硕实验动物有限公司配制。基础饲料供能3.1 kcal/g,其中脂肪供能占12.5%;高脂饲料供能4.74 kcal/g,其中脂肪供能占50.95%。
1.4 运动方法
运动方式参照文献报道[14],干预前,EM、EFM组先进行3 d适应性游泳练习,每天1次,每次15 min,每天递增10~20 min,经1周增加至60 min,以后各周都维持此运动量,直至实验结束。训练时驱赶不游泳大鼠,以防漂浮水面。正式运动期间每周运动6 d,每天1次,每次60 min。运动条件:长150 cm×宽60 cm×高70 cm的游泳池,水温31±1℃,水深60 cm,超过大鼠身长的2倍。
1.5 样本采集与处理
对照组、模型组各取10只在实验第8周取材,C组、M组、EM组、FM组和EFM组在实验第16周取材。大鼠处死前先禁食12 h,称体重后以2%戊巴比妥钠溶液4 ml/kg腹腔内注射麻醉后,新洁尔灭消毒皮肤,以腹部正中切口打开腹腔,肉眼观察肝脏情况,迅速取出肝脏,置于4℃ 生理盐水中反复漂洗。在肝左叶中部切取1 cm×1 cm×1 cm,放置于液氮中速冻,转入-80℃冰箱储存,用于Western bolt检测。取肝右叶一部分用4%多聚甲醛固定,用于免疫组化及TUNEL检测,另一部分固定包埋,用于冰冻切片和油红O染色。
1.6 测试指标与方法
1.6.1 油红 OO染色观察肝组织脂滴分布
油红O染色方法:肝脏冰冻切片(5 μm厚度)用于脂质染色。脂滴为红色,每张切片在200倍光镜显微镜下随机取5个视野,采用Image-Pro plus 6.0图像分析系统进行半定量分析,计算每个视野下红色脂滴光密度,每张切片5个视野下红色脂滴光密度相加后取平均值,用每组平均光密度表示红色脂滴的多少,单位以AIOD.μm2表示。
1.6.2 TTUUNNEELL法检测肝细胞凋亡
TUNEL试剂盒购自美国Sigma公司。石蜡切片常规脱蜡,用流水冲洗,以20 μg/ml蛋白酶K在37℃ 下20 min孵育,去除组织蛋白。3次PBS浸洗,每次3 min;在样本区域上滴加100 μl的Equilibration Buffer,5~10 min室温平衡;于样本区域上滴加100 μl的TdT酶反应液,37℃,60 min避光孵育;将100 μl的2倍SSC溶液终止反应滴加在反应样本区域,15 min室温放置。3次PBS浸洗,每次3 min;滴加DAPI复染,5 min避光孵育;3次PBS洗,每次3 min;缓冲甘油封片后,在荧光显微镜下观察。凋亡细胞胞核显示绿色荧光,复染DAPI的所有细胞胞核为蓝色。从每张切片上随机选择3个视野计算凋亡细胞百分比,取平均值,拍照。凋亡指数(AI%)=肝细胞凋亡数/肝细胞总数×100%。
1.6.3 western bblloott法测CCHHOOPP、Cassppaassee1122、JJNNKK蛋白的表达
将50 mg的冰冻肝组织置于匀浆器中,用剪刀尽量将组织块剪碎,加入500 ml组织裂解液,反复研磨使组织尽量碾碎,30 min的裂解后,以2000 r/min,4℃离心组织匀浆10 min,取上清液,再以12,000 r/min,4℃ 离心30 min,回收上清液,取小部分上清液用BCA法测定蛋白浓度。等量蛋白样品(50 μg)经12.5% SDS聚丙烯酞胺凝胶电泳分离后,电转移至硝酸纤维素膜上。经5%脱脂奶粉室温下封闭1 h,分别用兔单抗CHOP(1∶4000,abcam公司)、兔单抗Caspase12(1∶2000,abcam公司)、兔单抗JNK(1:1000,abcam公司)和兔单抗β-actin(1∶1000,abcam公司)室温孵育1 h后,4℃过夜,TBST洗膜3次,每次10 min,分别加入相应的HRP结合的羊抗兔IgG(1∶2000,abcam公司)室温孵育1 h,TBST洗膜3次,每次10 min,加入ECL发光液,1 min后于暗室内进行胶片曝光、显影、定影、晾干。βactin作为内参,并用Gelpro32图像分析软件进行分析,蛋白表达量用光密度比值(OD ratio)表示,蛋白表达量用“目的蛋白/β-actin”计算。
1.6.4 免疫组化方法测CCHHOOPP、Cassppaassee1122、JJNNKK蛋白的平均光密度
免疫组化实验严格按照SABC免疫组化染色试剂盒说明书操作步骤进行。切片脱蜡至水,PBS清洗,3% H2O2浸泡10 min以消除内源性过氧化物酶,微波抗原修复,山羊血清封闭液37℃孵育30 min,甩去血清,滴加兔单抗Caspase12(1∶200,abcam公司)、CHOP(1∶200,abcam公司)、JNK(1∶100,abcam公司)于组织上,37℃ 下45 min孵育;孵育结束后,3次PBS冲洗切片,每次3 min,4℃过夜,次日室温复温30 min,滴加二步法抗兔/鼠通用型免疫组化检测试剂盒中的A液50-100 μl于组织上,37℃下45 min孵育,3次PBS冲洗切片,每次3 min,滴加生物素标记的山羊抗兔抗体,37℃下30 min孵育,滴加SABC复合物,37℃ 孵育30 min,DAB显色,蒸馏水洗涤终止反应,常规脱水、透明,中性树胶封片。光学显微镜下观察,棕黄色或棕褐色颗粒为阳性,每张切片最少20个高倍视野观察阳性颗粒的染色程度,用IPP6.0免疫组化分析软件将图片阳性区域转换为平均光密度值进行定量分析。
1.7 数理统计方法
数据采用统计软件SPSS 16.0进行处理,计量资料以平均值士标准差(x¯±s)表示,采用单因素方差分析(One way ANOVA)对多组样本均数进行比较,先对数据进行方差齐性检验,若方差齐性,用LSD法进行两两比较;若方差不齐,用Dunnett T3法进行两两比较。M组、EM组、FM组和EFM组4组比较采用双因素方差分析(two-way ANOVA),P<0.05为具有显著性差异,P<0.01为具有非常显著性差异。
2 研究结果
2.1 各组肝组织病理形态比较
肝脏肉眼形态观察:C组肝脏无异常变化,呈红褐色或红黄相间,被膜光滑,边缘锐利,质地中等,切面光洁;M组大鼠肝脏包膜紧张,边缘圆钝,呈淡黄色,体积增大,质地变软,切面油腻,EM组、FM组、EFM组肝脏形态介于C组和M组之间。
油红O染色结果显示(见图1):C组肝细胞见少量脂滴,其余各组肝细胞胞浆内脂滴数量明显增加;M组脂滴数量最多,大小不一,以小泡性脂肪滴为主;EM组和FM组脂滴数量其次,EFM组脂滴数量最少。油红O脂滴光密度值(见表1)结果显示:与C组比较,M组、EM组和FM组油红O脂滴光密度值明显升高,具有非常显著性差异(P<0.01);EFM组不具显著性差异(P>0. 05);与M组比较,各干预组油红O脂滴光密度降低,具有非常显著性差异(P<0.01)。
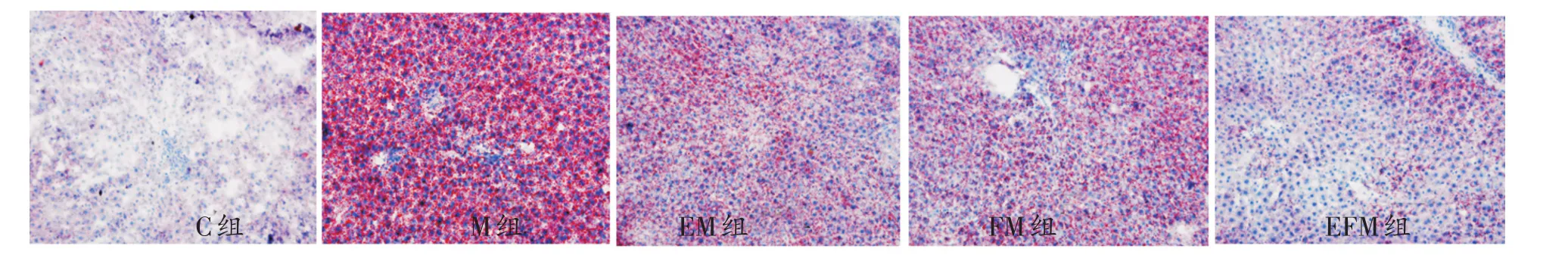
图1 第16周各组油红O染色病理变化(×200)

表1 第16周各组大鼠肝细胞油红O脂滴光密度值和凋亡指数比较
2.2 各组肝细胞凋亡比较
TUNEL法检测肝细胞凋亡(如图2)显示:荧光显微镜下观察正常肝细胞核呈蓝色,凋亡肝细胞细胞核呈明亮黄绿色。C组可见少量凋亡细胞,M组凋亡细胞明显增多,EM组、FM组凋亡细胞数量较少,EFM组凋亡细胞数量最少。肝细胞凋亡指数(如表1)结果显示:与C组比较,M组和FM组大鼠肝细胞凋亡指数升高,具有非常显著性差异(P<0.01);EM组、EFM组不具显著性差异(P>0.05);与M组比较,各干预组大鼠肝细胞凋亡指数降低,具有非常显著性差异(P<0. 01)。M组、EM组、FM组、EFM组4组双因素方差分析结果显示,运动或饮食调整对肝细胞凋亡具有主效应(P<0.01),运动和饮食调整对肝细胞凋亡具有交互作用(P<0.01)。

图2 各组肝细胞凋亡变化(×200)
2.3 各组大鼠肝脏CCHHOOPP、Cassppaassee1122和JJNNKK蛋白表达比较
2.3.1 Westernnbblloott法测各组大鼠肝脏CCHHOOPP、Cassppaassee1122和JJNNKK蛋白表达比较
Western blot结果显示(见表2):与C组比较,其余各组CHOP、Caspase12和JNK蛋白表达升高,M组、EM组、FM组具有非常显著性差异(P<0.01),EFM组不具显著性差异。与M组比较,各干预组CHOP、Caspase12和JNK蛋白表达降低,具有非常显著性差异(P<0. 01)。M组、EM组、FM组、EFM组4组采用双因素方差分析结果显示,运动和饮食调整对CHOP、Caspase12和JNK蛋白表达变化具有主效应(P<0.01);运动和饮食调整对CHOP、Caspase12和JNK蛋白表达变化具有交互作用(P<0.01)。
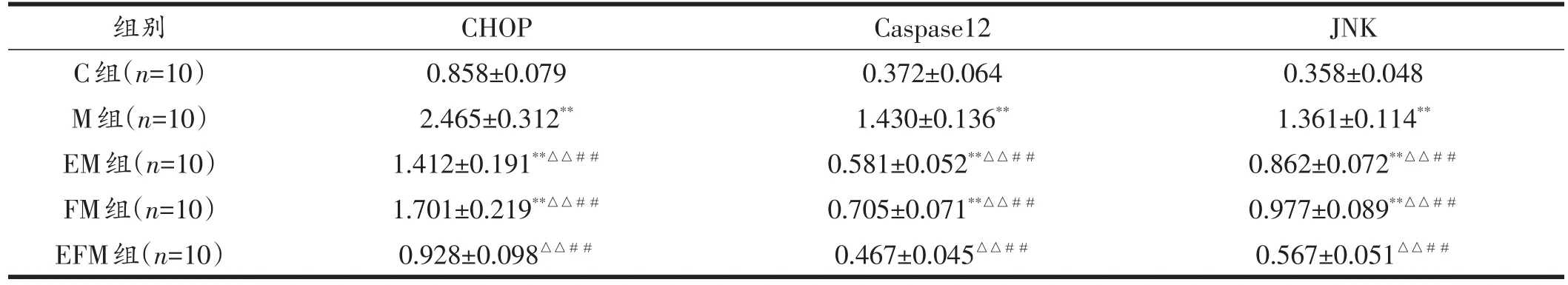
表2 各组大鼠肝脏CHOP、Caspase12和JNK蛋白表达比较
2.3.2 免疫组化法测各组大鼠肝脏CCHHOOPP、Cassppaassee1122和JJNNKK阳性表达比较
免疫组化结果显示(见图3~5):光镜下观察胞浆阳性细胞呈棕黄色者,CHOP、Caspase12和JNK在肝细胞胞浆内呈阳性表达。C组可见各蛋白少量表达,范围小,着色浅;M组各蛋白表达范围广,着色深;EM组、FM组各蛋白表达比C组多,较M组少;在干预组别中,EFM组各蛋白表达数量最少。各蛋白平均光密度值结果(见表3)显示:与C组比较,其余各组CHOP、Caspase12和JNK蛋白平均光密度增加,具有非常显著性差异(P<0.01),与M组比较,各干预组CHOP、Caspase12和JNK蛋白平均光密度减少,具有非常显著性差异(P<0.01)。M组、EM组、FM组、EFM组4组采用双因素方差分析结果显示,运动和饮食调整对各蛋白平均光密度的影响具有主效应(P<0.01);运动和饮食调整对各蛋白平均光密度具有交互作用(P<0.01)。

图3 各组大鼠肝脏CHOP蛋白阳性表达比较

图4 各组大鼠肝脏Caspase12蛋白阳性表达比较

图5 各组大鼠肝脏JNK蛋白阳性表达比较
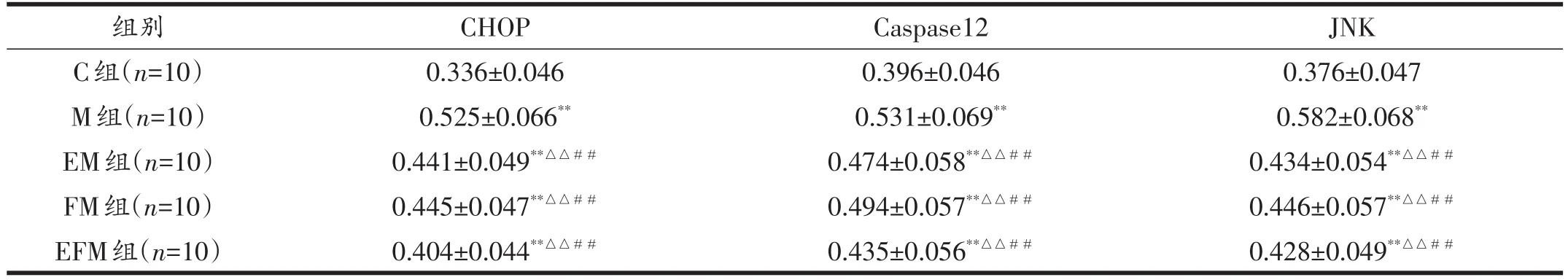
表3 各组大鼠肝脏CHOP、Caspase12和JNK平均光密度比较
3 讨论与分析
3.1 EERRSS介导细胞凋亡在NNAAFFLLDD中的作用
ERS是指机体功能紊乱时,大量错误折叠与未折叠蛋白在内质网(endoplasmic reticulum,ER)腔内聚集导致细胞平衡紊乱的状态[15]。适度的ERS可维持细胞存活,提高内质网处理未折叠蛋白和错误折叠蛋白的能力;但ERS程度过大或时间过长,ERS介导的一系列细胞信号通路将诱导细胞凋亡的发生。
ERS介导的细胞凋亡途径尚不明确。目前已知的凋亡途径有C-Jun氨基末端激酶(c-Jun N-terminal kinase,JNK)途径、C/EBP同源蛋白(CCAAT enhancerbinding protein homologous protein,CHOP)途径和半胱天冬酶12(Caspase-12)途径3种[16]。故本实验选取了CHOP、JNK和Caspase12三个反映内质网应激所介导细胞凋亡的指标。
3.1.1 CCHHOOPP与NNAAFFLLDD
CHOP属于C/EBP转录因子家族重要成员,过量表达的CHOP激活细胞凋亡途径。目前,CHOP蛋白的过表达多见于对心肌凋亡[17]和大脑海马细胞凋亡[18]的文献报道,也有少量与肝脏相关的报道。研究[19]报道,肝脏脂代谢紊乱与CHOP蛋白表达上调有关,CHOP参与脂代谢基因的转录调控。CHOP蛋白过表达在诱导肝细胞凋亡中的作用得到研究证实,有学者[20]用酒精喂养CHOP-/-大鼠和CHOP+/+野生大鼠发现,CHOP+/+野生大鼠肝细胞凋亡显著增多,而CHOP-/-大鼠未见明显肝细胞凋亡,因此,CHOP蛋白表达上调是细胞凋亡发生的显著特征。本研究中,模型组CHOP蛋白表达升高,提示ERS可能通过上调CHOP蛋白表达促进肝细胞凋亡,参与NAFLD的发展。
3.1.2 JJNNKK与NNAAFFLLDD
JNK信号转导蛋白家族在应激反应和细胞凋亡中发挥重要作用。有研究[21]报道2型糖尿病大鼠胰岛细胞凋亡增加与JNK表达升高有关,因此,我们推测JNK可能参与NAFLD的发生发展。研究证实JNK在NAFLD中发挥作用,研究[22]报道JNK1上调α-SMA表达,在CCL4诱导肝纤维化中起着重要的作用。JNK1基因敲除的肥胖大鼠在高脂喂养后,脂肪肝程度明显减轻,JNK介导了高脂喂养大鼠脂肪肝的发展[23]。本研究结果显示,模型组JNK蛋白表达增加,提示ERS可能通过上调JNK蛋白表达促进肝细胞凋亡,从而参与高脂饮食诱导NAFLD的发展,与以往研究报道一致。
3.1.3 Cassppaassee1122与NNAAFFLLDD
Caspase12在正常生理状态下以无活性的酶原Procaspase12存在,当发生ERS时,Procaspase12特异性水解,形成有活性的Caspase12,一系列Caspases酶原被激活,诱导细胞凋亡发生[24]。研究[25]报道,Caspase12仅特异性地与ERS密切相关,而与其他途径介导的细胞凋亡无关。Di Sano[26]的研究也证实,Caspase12不是线粒体介导凋亡途径所必需,它是ERS介导细胞凋亡的特异性蛋白。有学者[27]发现糖尿病大鼠肾脏Caspase12蛋白表达升高,与肾细胞凋亡增加密切相关。Caspase12在肝脏损伤中的作用,仅有少量文献报道。研究[28]报道Caspase12过表达与肝卫星细胞凋亡有关,抑制Caspase12活性可有效减少鼠肝细胞凋亡[29]。本研究结果显示,模型组肝脏Caspase12蛋白表达增加,提示ERS可能通过上调Caspase12蛋白表达促进肝细胞凋亡,从而参与高脂饮食诱导NAFLD的发展。
3.2 运动和饮食调整对非酒精性脂肪肝的干预作用
有研究[30]证实,耐力运动可较好地预防和延缓脂肪肝。本研究结果显示,与模型组比较,运动组肝脏脂滴数量明显减少,提示运动对NAFLD具有较好的干预作用。有学者[31]研究报道短期运动减少NAFLD细胞凋亡。本研究结果显示,与模型组比较,运动组内质网应激介导凋亡蛋白CHOP、JNK和Caspase-12表达均明显降低,这与研究中TUNEL法检测运动组肝细胞凋亡较模型组明显减少的结果一致,提示在NAFLD形成后,采用运动干预,运动在一定程度上可延缓高脂饮食诱导NAFLD的发展。其机制可能与其减少ERS,降低CHOP、JNK和Caspase-12蛋白表达,从而抑制细胞凋亡的发生有关。
调整饮食被认为是治疗NAFLD的基本方法,也是预防和控制NAFLD进展的重要措施之一。谭莺等[32]报道,高脂饮食喂养8周能够构建SD大鼠NAFLD模型,恢复正常饮食对高脂饮食诱导的NAFLD有一定的治疗作用。有研究[33]报道,成年肥胖人在饮食调整后,其胰岛素抵抗和心血管疾病等危险因素得到显著改善。本研究结果显示,与模型组比较,饮食调整组肝脏脂滴数量减少,ERS介导细胞凋亡蛋白CHOP、JNK、Caspase-12表达降低,这与研究中TUNEL法检测发现饮食调整组肝细胞凋亡较模型组显著减少的结果一致,提示在NAFLD形成后,采用停止高脂饮食喂养、恢复正常饮食的方法对NAFLD具有较好的治疗作用,其机制可能与饮食调整可降低CHOP、JNK、Caspase-12蛋白表达,抑制肝细胞凋亡有关。
饮食调整和有氧运动被认为是治疗NAFLD最基本而有效的方法[34]。对于运动与饮食调整对NAFLD治疗的交互作用,国内外有少量文献报道。临床随机对照实验[35]发现运动结合饮食调整对NAFLD患者肝脏病理组织学改变显著。国外学者[36]实验研究对比药物罗格列酮、二甲双胍和运动结合饮食调整对NAFLD的疗效,结果发现运动结合饮食调整在一定程度上优于药物罗格列酮、二甲双胍的疗效。本研究结果也证实,与模型组比较,运动结合饮食调整组肝细胞凋亡及CHOP、JNK、Caspase-12蛋白表达的影响具有交互效应,提示运动结合饮食调整对NAFLD具有较好的治疗作用,联合作用优于单独作用。
4 结论
内质网应激介导细胞凋亡参与NAFLD的发展,运动和饮食调整可延缓NAFLD的发展,且二者联合作用效果更佳,其机制与运动和饮食调整降低内质网应激介导细胞凋亡蛋白CHOP、JNK和Caspase12在肝细胞的表达,抑制肝细胞凋亡有关。
[1]Zezos P,Renner EL.Liver transplantation and non-alcoholic fatty liver disease[J].World J Gastroenterol,2014,20(42):15532-15538.
[2]宋光耀,任路平.非酒精性脂肪肝疾病发生机制研究新进展[J].中国老年学杂志,2012,32(3):664-666.
[3]Canbay A,Gieseler RK,Gores GJ,et al.The relationship between apoptosis and non-alcoholic fatty liver disease:an evolutionary cornerstone turned pathogenic[J].Z Gastroenterol,2005,43(2):211-217.
[4]AlkhouriN,Carter-KentC,FeldsteinAE.Apoptosisin nonalcoholic fatty liver disease:diagnostic and therapeutic implications[J].Expert Rev Gastroenterol Hepatol,2011,5(2):201-212.
[5]Ushioda R,Hoseki J,Nagata K.Glycosylation-independent ERAD pathway serves as a backup system under ER stress[J].Mol Biol Cell,2013,24(20):3155-3163.
[6]Tabas I,Ron D.Integrating the mechanisms of apoptosis induced by endoplasmic reticulum stress[J].Nat Cell Biol,2011,13(3):184-190.
[7]Ali R,Cusi K.New diagnostic and treatment approaches in non-alcoholic fatty liver disease(NAFLD)[J].Ann Med,2009,41(4):265-278.
[8]Verbeek J,Cassiman D,Lannoo M,et al.Treatment of nonalcoholicfattyliverdisease:canwealreadyfacethe epidemic?[J].Acta Gastroenterol Belg,2013,76(2):200-209.
[9]Nadeau KJ,Ehlers LB,Zeitler PS,et al.Treatment of nonalcoholicfattyliverdiseasewithmetforminversus lifestyleinterventionininsulin-resistantadolescents[J]. Pediatr Diabetes,2009,10(1):5-13.
[10]Bradford V,Dillon J,Miller M.Lifestyle interventions for the treatment of non-alcoholic fatty liver disease[J].Hepat Med,2014,6:1-10.
[11]Xiao J,Guo R,Fung ML,et al.Therapeutic approaches to non-alcoholic fatty liver disease:past achievements and future challenges[J].Hepatobiliary Pancreat Dis Int,2013,12(2):125-135.
[12]Gerber L,Otgonsuren M,Mishra A,et al.Non-alcoholic fatty liver disease(NAFLD)is associated with low level of physical activity:a population-based study[J].Aliment Pharmacol Ther,2012,36(8):772-781.
[13]常薪霞.盐酸小檗碱对高脂饮食诱导的SD大鼠非酒精性脂肪肝的疗效及机制研究[D].复旦大学,2010.
[14]唐智明,邓玉强,吴健,等.长期游泳运动对2型糖尿病大鼠Musclin分泌和脂质代谢的影响[J].中国运动医学杂志,2011,30(12):1078-1081.
[15]陆伦根,马光斌.内质网应激的细胞效应分子机制[J].生命科学,2012,24(3):287-291.
[16]Xu X,Liu T,Zhang A,et al.Reactive oxygen speciestriggered trophoblast apoptosis is initiated by endoplasmic reticulum stress via activation of caspase-12,CHOP,and the JNK pathway in Toxoplasma gondii infection in mice [J].Infect Immun,2012,80(6):2121-2132.
[17]Stirnemann JJ,Nasr B,Proulx F,et al.Evaluation of the CHOP cardiovascular score as a prognostic predictor of outcomein twin-twin transfusion syndrome after laser coagulation of placental vessels in a prospective cohort[J]. Ultrasound Obstet Gynecol,2010,36(1):52-57.
[18]Chen CM,Wu CT,Chiang CK,et al.C/EBP homologous protein(CHOP)deficiency aggravates hippocampal cell apoptosis and impairs memory performance[J].PLoS One,2012,7(7):e40801.
[19]ChikkaMR,MccabeDD,TyraHM,etal.C/EBP homologous protein(CHOP)contributes to suppression of metabolic genes during endoplasmic reticulum stress in the liver[J].J Biol Chem,2013,288(6):4405-4415.
[20]Ji C,Mehrian-Shai R,Chan C,et al.Role of CHOP in hepaticapoptosisinthemurinemodelofintragastric ethanol feeding[J].Alcohol Clin Exp Res,2005,29(8):1496-1503.
[21]MartinovicV,GrigorovI,BogojevicD,etal.Activation levelofJNKandAkt/ERKsignalingpathways determinatesextentofDNAdamageintheliverof diabetic rats[J].Cell Physiol Biochem,2012,30(3):723-734.
[22]Hong IH,Park SJ,Goo MJ,et al.JNK1 and JNK2 regulate alpha-SMAinhepaticstellatecellsduringCCl4-induced fibrosis in the rat liver[J].Pathol Int,2013,63(10):483-491.
[23]YangR,WilcoxDM,HaaschDL,etal.Liver-specific knockdownofJNK1up-regulatesproliferator-activated receptor gamma coactivator 1 beta and increases plasma triglyceride despite reduced glucose and insulin levels in diet-induced obese mice[J].J Biol Chem,2007,282(31):22765-22774.
[24]HitomiJ,KatayamaT,TaniguchiM,etal.Apoptosis inducedbyendoplasmicreticulumstressdependson activation of caspase-3 via caspase-12[J].Neurosci Lett,2004,357(2):127-130.
[25]NakagawaT,ZhuH,MorishimaN,etal.Caspase-12 mediatesendoplasmic-reticulum-specificapoptosisand cytotoxicity byamyloid-beta[J].Nature,2000,403(6765):98-103.
[26]Di Sano F,Ferraro E,Tufi R,et al.Endoplasmic reticulum stress induces apoptosis by an apoptosome-dependent but caspase 12-independent mechanism[J].J Biol Chem,2006,281(5):2693-2700.
[27]Lakshmanan AP,Thandavarayan RA,Palaniyandi SS,et al. Modulation of AT-1R/CHOP-JNK-Caspase12 pathway by olmesartan treatment attenuates ER stress-induced renal apoptosis in streptozotocin-induced diabetic mice[J].Eur J Pharm Sci,2011,44(5):627-634.
[28]HuangY,LiX,WangY,etal.Endoplasmicreticulum stress-inducedhepaticstellatecellapoptosisthrough calcium-mediated JNK/P38 MAPK and Calpain/Caspase-12 pathways[J].Mol Cell Biochem,2014,394(1-2):1-12.
[29]JiangS,XieQ,ZhouH,etal.Ribozyme-mediated inhibitionofcaspase-12activityreducesapoptosis inducedbyendoplasmicreticulumstressinprimary mouse hepatocytes[J].Int J Mol Med,2008,22(6):717-724.
[30]Ascensao A,Martins MJ,Santos-Alves E,et al.Modulation of hepatic redox status and mitochondrial metabolism by exercise:therapeuticstrategyforliverdiseases[J]. Mitochondrion,2013,13(6):862-870.
[31]Fealy CE,Haus JM,Solomon TP,et al.Short-term exercise reduces markers of hepatocyte apoptosis in nonalcoholic fatty liver disease[J].J Appl Physiol,2012,113(1):1-6.
[32]谭莺,陈金虎,张佳妮,等.饮食调整对非酒精性脂肪肝病的治疗作用及机制[J].世界华人消化杂志,2009,33:3394-3401.
[33]SundararajanK,CampbellMK,ChoiYH,etal.The relationshipbetweendietqualityandadultobesity:evidence from Canada[J].J Am Coll Nutr,2014,33(1):1-17.
[34]JinYJ,KimKM,HwangS,etal.Exerciseanddiet modificationinnon-obesenon-alcoholicfattyliver disease:analysisofbiopsiesoflivingliverdonors[J].J Gastroenterol Hepatol,2012,27(8):1341-1347.
[35]Vilar GE,Rodriguez DMA,Gra OB,et al.Clinical trial:a nutritionalsupplementViusid,incombinationwithdiet andexercise,inpatientswithnonalcoholicfattyliver disease[J].AlimentPharmacolTher,2009,30(10):999-1009.
[36]AkyuzF,DemirK,OzdilS,etal.Theeffectsof rosiglitazone,metformin,anddietwithexercisein nonalcoholic fatty liver disease[J].Dig Dis Sci,2007,52(9):2359-2367.
Exercise and Diet Modification Delays Liver Cell Apoptosis of Rats with Endoplasmic Reticulum Stress Mediated Nonalcoholic Fatty Liver Disease
Li Junhan1,2,Su Quansheng1,Sun Junzhi1,Zhang Zhongyang1
1 Chengdu Sport University,Sichuan 610041,China 2 Beijing Sport University,Beijing 100084,China Corresponding Author:Su Quansheng,Email:sqs111@163.com
ObjectiveTo explore the effect of exercise and diet modification on liver cell apoptosis of rats with endoplasmic reticulum stress mediated nonalcoholic fatty liver disease(NAFLD).Methods20 of 70 rats were randomly chosen as control group(C,fed with ordinary diet),the remaining 50 were fed with high-fat diet and finally suffered from NAFLD 8 weeks after the experiment,thereafter they were randomly regrouped into model group(M,n=10),exercise model group(EM,n=10),diet modification model group(FM,n=10)and exercise combined with diet modification model group(EFM,n=10).Rats in group C were continuously fed with ordinary diet and in groups M and EM were continuously fed with high fat diet.The rats in groups FM and EFM was shift from high fat to ordinary diet.Rats in groups EM and EFM participated in aerobic swimming for 8 weeks until the end of experiment.Liver pathological changes were observed by oil red O staining and hepatocyte apoptosis was observed by Terminal-deoxynucleoitidyl Transferase Mediated Nick End Labeling assays. The expression of CCAAT enhancer-binding homologous protein(CHOP),c-Jun n-terminal kinase(JNK)and caspase-12 gene were determined by Western blot,and the expression rate of CHOP and JNK and caspase-12 by immunohistochemical staining.Results(1)The number of lipid droplets in liver cells of group M significantly increased as compared with group C and the number of lipid droplets in liver cells of intervention groups was situated between the number of group C and M.(2)Compared to group C,the liver cell apoptosis,the protein expressions of CHOP,Caspase12 and JNK gene increased in group M.Compared to group M,the liver cell apoptosis and the protein expressions of CHOP and Caspase12 and JNK gene decreased in intervention groups.(3)There was main effect of exercise and diet on the protein expressions of CHOP and Caspase12 and JNK gene,and they were interacted each other.ConclusionsEndoplasmicreticulumstressmediatedlivercellapoptosisparticipatedinthe development of NAFLD,which could be delayed by exercise and diet modification through decreasing the protein expression of endoplasmic reticulum stress,especially the combination of exercise and diet modification.
endoplasmicreticulumstress,cellapoptosis,non-alcoholicfattyliverdisease,exercise,diet modification
2015.08.28
“十二五”国家科技支撑计划重点项目子课题(2012BAK21B01-4);四川省科技厅应用基础计划项目(2015JY0155);国家体育总局运动医学重点实验室暨运动医学四川省重点实验室资助基金(CTYY2015018)
苏全生,Email:sqs111@163.com
