人脐带间充质干细胞神经向分化与去分化基因表达谱分析
2017-03-09焦扬赵洪波刘平付旭锋陈国栋罗晓曦桑雄波郑冰蓉
焦扬赵洪波刘平付旭锋陈国栋罗晓曦桑雄波郑冰蓉
·论著·
人脐带间充质干细胞神经向分化与去分化基因表达谱分析
焦扬1,2赵洪波2刘平1付旭锋1陈国栋1罗晓曦1桑雄波1郑冰蓉1
目的 用生物信息学方法从公共基因芯片数据库(GEO)中初步筛选出与人脐带间充质干细胞(hUC-MSCs)神经向分化和去分化相关的生物学功能和对应的信号通路,分析蛋白互作关系,为进一步开展hUC-MSCs神经向分化和去分化的实验研究提供指导信息。方法 在公共基因芯片数据库GEO中搜寻hUC-MSCs神经向分化与去分化的基因芯片数据,用R和Bioconductor软件包进行统计学分析,筛选差异基因;用GeneAnalytics在线分析工具进行GO分析和通路分析;用STRING数据库进行差异表达基因对应的蛋白互作关系分析。结果 共筛选得到影响神经向分化和去分化过程的670个上调基因和1 458个下调基因;进一步对这些差异基因进行功能富集分析,发现上调过程的功能集中表现为促血管生成和细胞黏附,下调的生物学过程则主要和代谢相关;上调通路主要有与细胞增殖、分化、凋亡有关的ERK、血管生成和Akt等通路,下调通路主要有与细胞代谢和生物合成相关的萜类化合物骨架生物合成、Cholesterot Biosynthesis II和磷酸肌醇代谢等通路,其中特别的是,维持胚胎干细胞多能性的Nanog通路出现在下调通路中;蛋白互作网络分析发现,与血管生成、细胞黏附相关的蛋白VEGFA、IL-6、FGF2、MMP和IL-8有较高的degree值。结论 影响hUC-MSCs神经向分化和去分化的因素很多,其中,促进血管生成、细胞黏附及细胞繁殖相关的基因、生物反应过程、信号通路及相关蛋白起着重要作用。上述基于生物信息学的筛查分析结果为进一步开展hUC-MSCs神经向分化与去分化实验研究提供了一定的参考信息。
计算生物学; 脐带; 间质干细胞; 细胞分化; 细胞去分化; 基因表达谱
人脐带间充质干细胞(human umbilical cord mesenchymal stromal cells,hUC-MSCs)取材容易,增殖力强[1],免疫原性低[2],优于其他来源的间充质干细胞,且不涉及伦理问题,是干细胞临床治疗理想的种子细胞,特别对于神经系统疾病。在体外,hUC-MSCs已经被成功地向神经细胞诱导分化,并且发现,当hUC-MSCs向神经样细胞分化的同时,还会分泌神经营养因子[3-4]。现今,已有将hUCMSCs用于帕金森病[5-6]、缺血性脑损伤[7]、脊髓损伤[8]等神经系统疾病治疗的相关报道。但是,移植后的间充质干细胞存活率较低,限制了其在临床中的应用。
去分化指分化细胞失去特有的结构和功能,变为具有未分化细胞特性的细胞的过程。去分化的细胞具有原始干细胞特性,且再分化的速度和效率都有提高[9]。张慧等[10]在对间充质干细胞的成骨分化研究中证实,去分化的间充质干细胞具备间充质干细胞的特征,并且体外再次生骨效率明显提高。因此,如果直接用去分化的细胞做移植治疗,很可能可以提高治疗效果。
为了系统地了解hUC-MSCs向神经样细胞分化后去分化的分子机制,笔者希望从生物信息学角度,利用公共基因芯片数据库(GEO)中的芯片数据,挖掘体外培养的hUC-MSCs向神经细胞分化后去分化的基因表达数据,通过GO分析、KEGG信号通路分析和蛋白互作网络分析,获得影响hUC-MSCs神经向去分化的相关基因、生物学过程、信号通路和重要蛋白等信息,为进一步实验研究hUC-MSCs神经向去分化的机制提供前期基础和理论支持。
材料与方法
一、基因表达数据的获得
本研究选用的是GSE65631芯片数据。GSE65631是由Zhou等[11]人提交的hUC-MSCs未分化及其向神经样细胞分化、去分化和再分化的数据集。GSE65631芯片数据获得的过程如下:从重庆干细胞库购买hUC-MSCs,用DMEM/F12完全培养基+10﹪胎牛血清(FBS)培养到第5代,用1 μm/L的全反式维甲酸(ATRA)预处理24 h,然后用改良神经元诱导液(modi fi ed neuronal induction media,MNM)诱导分化成神经样细胞;将MNM换回DMEM/F12完全培养基+10﹪胎牛血清(FBS)培养24 h,使分化了的 hUC-MSCs去分化;最后,再用MNM诱导去分化的细胞再分化。抽取不同阶段(未分化、分化、去分化、再分化)hUC-MSCs的总RNA,生物素标记之后用基因芯片检测体外培养的hUC-MSCs未分化、神经向分化-去分化-再分化过程的基因表达情况。采用的分析平台是Affymetrix Human Genome U133 Plus 2.0 Array。
本研究从GEO数据库中下载GSE65631芯片数据集[11]。因本研究主要是为了解 hUC-MSCs神经向分化后细胞去分化的情况,因此仅选取了分化和去分化的数据进行分析。
二、数据预处理及差异表达基因筛选
用R软件(3.2.3)和Bioconductor(3.2)项目对数据进行处理和分析:将所得数据先用RMA(Robust Multichip Averaging)计算,进而用affy软件包背景校正、标准化、log2转化,最后用limma包筛选差异表达基因[12]。设置FDR < 0.05,|log(FC)| > 1为标准。
三、功能注释和通路分析
将得到的差异表达显著的上调和下调基因,分别提交到GeneAnalytics在线分析工具进行GO分析和通路分析[13]。
四、蛋白互作网络分析
使用STRING数据库分析差异表达基因存在的蛋白互作关系[14]。STRING数据库是一个通过收集蛋白质互作关系、基因调控关系以及文献挖掘分析和蛋白质共表达分析等计算得到物理互作和预测互作关系的数据库。且可通过计算给不同基因(蛋白质)之间的互作关系打分,并建立蛋白互作网络,再根据每个节点degree的大小选择关键蛋白。
结 果
一、差异表达基因分析
通过limma方法,将hUC-MSCs去分化和分化进行比较,筛选得到影响去分化过程的1 046个上调探针和2 385个下调探针,它们分别对应670个上调基因(P < 0.05)和1 458个下调基因(P < 0.05)。
二、生物学过程分析
用GeneAnalytics分析与hUC-MSCs神经向去分化过程相关的生物学过程。发现在上调过程中,血管生成、细胞黏附等起主要作用,下调的生物学过程主要是和代谢相关。前5个上调生物学过程和前5个下调生物学过程见表1。
三、通路分析
经GeneAnalytics分析,与hUC-MSCs神经向去分化过程相关的上调通路主要有细胞外调节蛋白激酶(extracellular regulated protein kinases,ERK)、血管生成和Akt等信号通路;下调通路主要是与细胞代谢和生物合成相关的萜类化合物骨架生物合成、Cholesterot Biosynthesis Ⅱ和磷酸肌醇代谢等通路。维持胚胎干细胞多能性的Nanog基因出现在下调通路中。排名前五的上调通路和下调通路见表2。
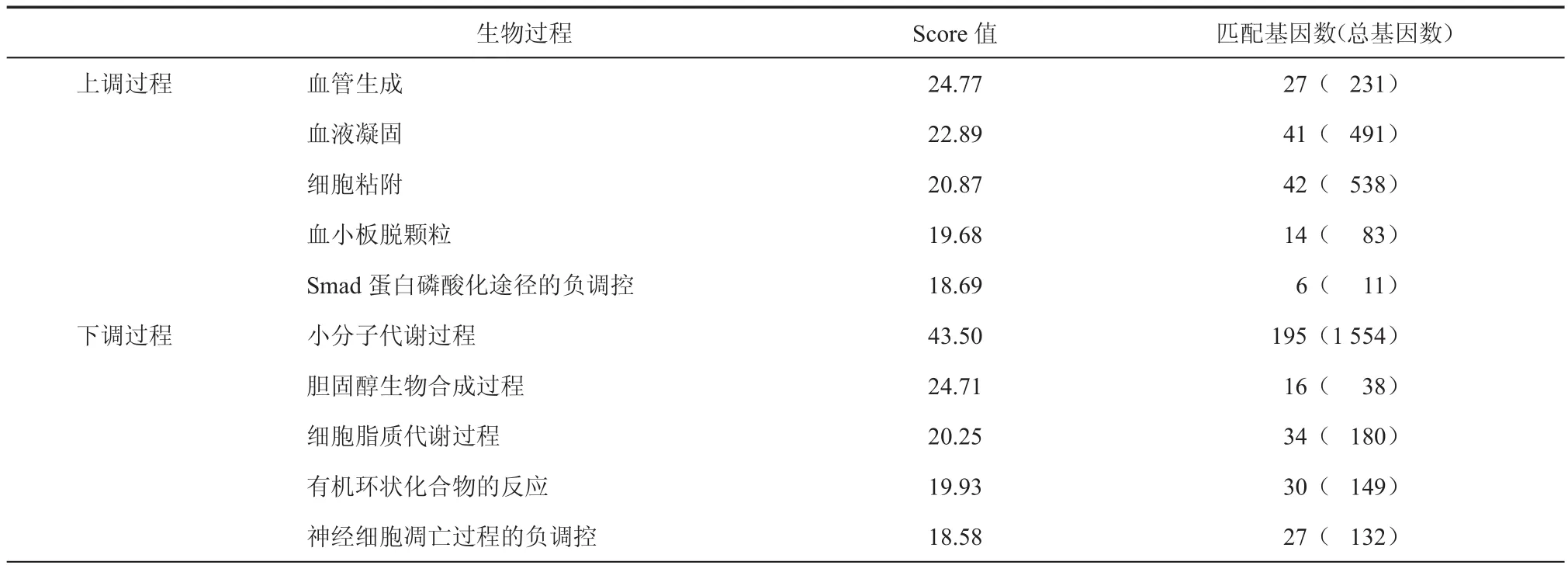
表1 与hUC-MSCs去分化密切相关的生物过程

表2 与hUC-MSCs去分化密切相关的通路
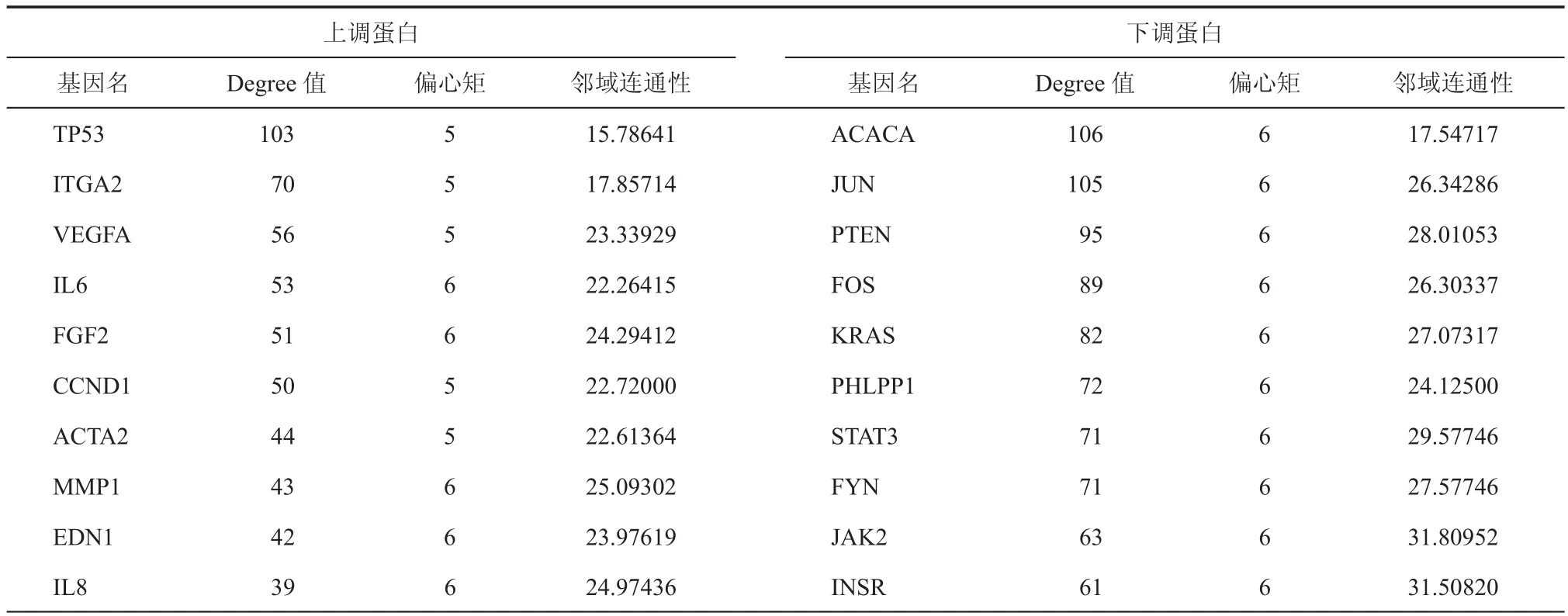
表3 排名前10的与hUC-MSCs去分化相关的上调和下调蛋白
四、蛋白互作网络分析
用STRING数据库建立蛋白互作网络图,上调基因蛋白互作网络见图1,下调基因蛋白互作网络见图2。根据degree进行排序,排名前10的蛋白见表3。其中,VEGFA,IL-6,FGF2,MMP和IL-8蛋白与血管生成和细胞黏附有关。STAT3与Nanog基因共同作用维持胚胎干细胞(embryonic stem cell,ES)的自我更新能力。

图1 上调蛋白互作网络图
讨 论
细胞去分化过程是活体生物在发生炎性反应、遭受创伤以后发生的一种自我更新、修复的过程。随着细胞生物学技术的发展及干细胞临床治疗研究的深入,人们对干细胞去分化的关注日趋增多。去分化的间充质干细胞保留了干细胞的特性,与原始干细胞相比,在体外存活时间更长,分化潜能更高[9]。hUC-MSCs由于具有取材容易、增殖力强、免疫原性低、不涉及伦理问题等特点,优于其他来源的间充质干细胞,成为临床治疗理想的种子细胞。而去分化的细胞除具有原始干细胞特性外,其再分化的速度和效率都较原始干细胞有提高。因此如果将去分化的hUC-MSCs用于临床治疗,则可望有更好的效果。但是hUC-MSCs去分化的机制目前还远不清楚。因此,尝试用生物信息学方法、从hUC-MSCs神经向去分化切入,分析hUC-MSCs神经向分化和去分化基因的表达差异及其相关的生物学功能、对应的生物信号通路及蛋白互作关系,以初步探讨hUC-MSCs神经向去分化的机制。

图2 下调蛋白互作网络图
本研究通过对用公共基因芯片数据库GEO搜寻,并用R和Bioconductor软件分析筛选出来的差异表达的上调基因P53、ITGA2、VEGFA等和下调基因ACACA、JUN和PTEN等进行功能富集分析发现:血管生成、细胞黏附在去分化过程中起重要作用。众多的研究证实:血管生成是肿瘤在生长、迁移过程中的一种基本活动,能为肿瘤提供氧气、营养物质和生长因子等,并能控制止血因子,为肿瘤细胞的散布提供适合的微环境[15]。在hUC-MSCs的去分化过程中,也伴随着与肿瘤细胞类似的细胞自我增殖能力、迁移力的恢复。因此,血管生成、细胞黏附等生物学过程也为hUC-MSCs的去分化提供了适合的促进性微环境。蛋白互作网络分析得到与血管生成、细胞黏附相关的蛋白VEGFA,IL-6,FGF2,MMP和IL-8均有较高的degree值。因此,这些蛋白可以作为研究血管生成、细胞黏附影响hUC-MSCs去分化过程的作用机制的重要蛋白。
ERK信号通路已被证实与细胞去分化密切相关。对神经细胞的相关研究发现,在Schwann细胞去分化过程中ERK信号通路起着核心调控作用[16]。本研究的基因芯片数据分析结果同样显示,在去分化的hUC-MSCs中,ERK信号通路上调,并且在所有上调通路中Score值最高,进一步证实了ERK信号通路在细胞去分化过程中的重要性。P13K/AKT信号通路与细胞增殖和存活相关。此通路的活性被类脂磷酸酶PTEN负调控[17]。并且P13K能够通过激活PAK进而激活ERK信号通路,促进细胞去分化。另外,Rac/PAK信号通路还能不依赖ERK和P13K/AKT信号通路,影响细胞黏附、细胞运动、细胞周期进程及细胞转化[18-19]。本研究的基因芯片数据分析结果与之对应良好:在去分化的hUCMSCs中,P13K/AKT和Rac/PAK信号通路均上调,而P13K/AKT信号通路的负调控蛋白PTEN表达量下调。说明P13K/AKT和Rac/PAK信号通路在hUC-MSCs去分化过程中同样起着重要作用。
TP53、ACACA、JUN蛋白在蛋白互作网络分析中有较大的degree值(均大于100),说明它们在hUC-MSCs去分化过程中的作用比较大,事实上,这些蛋白是与细胞周期、血管生成密切相关的。因此,在今后的研究工作中这些蛋白可以重点关注。
本次研究一个值得特别注意的结果是:在hUC-MSCs去分化过程中,Nanog基因下调,同时,STAT3蛋白也下调。在关于胚胎干细胞的研究中发现:Nanog与LIF/STAT3共同作用可以维持胚胎干细胞的自我更新能力[20];Nanog在具有高度增殖能力和多相分化潜能的组织和细胞中高表达[21];在Nanog缺乏的细胞团中,细胞开始分化;在已分化的胚胎干细胞中Nanog消失[21]。去分化是已分化的细胞回到具有未分化细胞状态的过程。而在hUCMSCs去分化过程中,Nanog基因的表达并未增加,STAT3蛋白量也在减少,说明去分化的过程并未使hUC-MSCs完全恢复到最初的具有干细胞完全干性的状态,而保留了一些分化过的状态。这可能是去分化细胞再分化的速度和效率都更高的原因。
通过对hUC-MSCs神经向分化和去分化差异表达基因分析,本研究得到了与hUC-MSCs神经向去分化相关的重要生物过程、信号通路和重要蛋白。其中,ERK信号通路、P13K/AKT和Rac/PAK信号通路已经证实与细胞去分化相关,血管生成、细胞黏附在细胞去分化过程中的作用研究还较少,而TP53、ACACA、JUN蛋白在细胞去分化过程中的作用尚无报道。因此,关于hUC-MSCs神经向去分化的机制还有很多未知的内容值得关注。本研究为进一步探讨hUC-MSCs去分化机制的实验研究提供了一些可供参考的线索和信息。
1 Nekanti U, Dastidar S, Venugopal P, et al. Increased proliferation and analysis of differential gene expression in human Wharton's jellyderived mesenchymal stromal cells under hypoxia[J]. Int J Biol Sci, 2010, 6(5):499-512.
2 Weiss ML, Anderson C, Medicetty S, et al. Immune properties of human umbilical cord Wharton's jelly-derived cells[J]. Stem Cells, 2008, 26(11):2865-2874.
3 Messerli M, Wagner A, Sager R, et al. Stem cells from umbilical cord Wharton's jelly from preterm birth have neuroglial differentiation potential [J]. Reprod Sci, 2013, 20(12):1455-1464.
4 李慧, 赵璨, 张华, 等. 脐带间充质干细胞源性多巴胺能神经元中脑源性神经生长因子的表达研究[J]. 实用老年医学, 2013, 27(9):734-737.
5 季兴, 李波, 李婛, 等. 脐带间充质干细胞移植治疗帕金森病效果分析[J]. 中国实用神经疾病杂志, 2014, 17(2):8-10.
6 卢爱丽. 脐带间充质干细胞治疗帕金森病的疗效[J]. 中国老年学杂志, 2013, 33(21):5245-5247.
7 Li Y, Hu G, Cheng Q. Implantation of human umbilical cord mesenchymal stem cells for ischemic stroke: perspectives and challenges[J]. Front Med, 2015, 9(1):20-29.
8 韩明远, 冯世庆, 李辉, 等. 移植人脐带间充质干细胞修复大鼠脊髓损伤[J]. 中国组织工程研究与临床康复, 2010, 14(19):3483-3489.
9 Liu Y, Jiang X, Zhang X, et al. Dedifferentiation-reprogrammed mesenchymal stem cells with improved therapeutic potential[J]. Stem Cells, 2011, 29(12):2077-2089.
10 张慧, 王贵超, 韩兴龙, 等. 去分化间充质干细胞成骨再分化潜能的实验研究[J]. 南京医科大学学报(自然科学版), 2013, 33(8):1044-1048.
11 Zhou X, Gu J, Gu Y, et al. Human umbilical Cord-Derived mesenchymal stem cells improve learning and memory function in Hypoxic-Ischemic Brain-Damaged rats via an IL-8-Mediated secretionmechanism rather than differentiation pattern induction[J]. Cell Physiol Biochem, 2015, 35(6):2383-2401.
12 Smyth GK. Linear models and empirical bayes methods for assessing differential expression in microarray experiments[J]. Stat Appl Genet Mol Biol, 2004, 3(3):1-28.
13 Ben-Ari Fuchs S, Lieder I, Stelzer G, et al. GeneAnalytics: an integrative gene set analysis tool for next generation sequencing, RNAseq and microarray data[J]. OMICS, 2016, 20(3):139-151.
14 Szklarczyk D, Franceschini A, Wyder S, et al. STRING v10: proteinprotein interaction networks, integrated over the tree of life[J]. Nucleic Acids Res, 2015, 43(Database issue):D447-D452.
15 段泽星, 谢立群. VEGF在肿瘤生长和血管生成中的作用[J]. 世界华人消化杂志, 2010, 18(27):2894-2900.
16 Napoli I, Noon LA, Ribeiro S, et al. A central role for the ERK-signaling pathway in controlling Schwann cell plasticity and peripheral nerve regeneration in vivo[J]. Neuron, 2012, 73(4):729-742.
17 许成芳,李小毛,李田,等.紫杉醇对PTEN不同状态的子宫内膜癌细胞株的作用及其机制探讨[J].中国药理学通报, 2011, 27(11):1528-1532.
18 Murali A, Rajalingam K. Small Rho GTPases in the control of cell shape and mobility[J]. Cell Mol Life Sci, 2014, 71(9):1703-1721.
19 Tabusa H, Brooks T, Massey AJ. Knockdown of PAK4 or PAK1 inhibits the proliferation of mutant KRAS colon cancer cells independently of RAF/MEK/ERK and PI3K/AKT signaling[J]. Mol Cancer Res, 2013, 11(2):109-121.
20 Chambers I, Colby D, Robertson M, et al. Functional expression cloning of Nanog, a pluripotency sustaining factor in embryonic stem cells[J]. Cell, 2003, 113(5):643-655.
21 周珍辉, 阮志刚, 韩雅婷, 等. Nanog基因的生物学功能研究进展[J].中国畜牧兽医, 2008, 35(5):60-64.
Gene expression profile analysis of neural differentiation and dedifferentiation process in human umbilical cord mesenchymal stem cells
iao Yang1,2, Zhao Hongbo2, Liu Ping1, Fu Xufeng1,Chen Guodong1, Luo Xiaoxi1, Sang Xiongbo1, Zheng Bingrong1.1the Medical School of Y unnan University, Kunming 650091,China;2Stem Cell and Regenrative Laboratory of Y unnan Province of the Kunming Medical University, Kunming 650500,China
Zheng Bingrong, Email: zhengbr@ynu.edu.cn
ObjectiveTo provide information for further experimental study, we analysed the biological function and signal pathways related to neural differentiation and dedifferentiation of human umbilical cord mesenchymal stromal cells(hUC-MSCs)and investigated the protein-protein interaction based on the chip data in public gene chip database GEO using bioinformatics methods.MethodsMicroarray data of neural differentiation and dedifferentiation in hUC-MSCs from public GEO gene chip databases were analyzed by R and Bioconductor package to screen out the differential expressed genes. Signal pathway was analyzed by online analysis tool GeneAnalytics and protein interactions of differential expressed gene were analyzed with STRING database.ResultsA total of 670 up-regulated and 1458 down-regulated genes in differentiation and dedifferentiation process were identified. Up-regulated genes are mainly involved in angiogenesis and cell adhesion, and down-regulated genes are mainly related to metabolism. Up-regulated pathways includes ERK pathway, angiogenesis pathway and Akt pathways, which are involved in cell proliferation, differentiation and apoptosis,while down-regulated pathways are related to metabolism and biosynthesis including terpenoids skeleton biosynthesis pathway, Cholesterot Biosynthesis II and Phosphoinositide metabolism pathway. It is noted that Nanog pathway which maintain the pluripotence of embryonic stem cells is also down regulated. Protein interaction network analysis found that VEGFA, IL-6, FGF2, MMP and IL-8, which are involved in angiogenesis and cell adhesion,have the higher degree value.ConclusionMany factors can influence neural differentiation and dedifferentiation in hUCMSCs, and proteins that can promote angiogenesis, cell adhesion and cell proliferation play more important role. In our future experiments, we will focus on the role of angiogenesis, cell adhesion and cell proliferation in the neural differentiation and dedifferentiation of human umbilical cord mesenchymal stromal cells.
Computational biology; Umbilical cord; Mesenchymal stem cells; Cell differentiation; Cell dedifferentiation; Gene expression profile
2016-08-02)
(本文编辑:李少婷)
10.3877/cma.j.issn.2095-1221.2017.01.006
国家自然科学基金(81560043)
650091 昆明,云南大学医学院1;650500 昆明医科大学 云南省干细胞与再生医学重点实验室2
郑冰蓉,Email:zhengbr@ynu.edu.cn
焦扬,赵洪波,刘平,等. 人脐带间充质干细胞神经向分化与去分化基因表达谱分析[J/CD].中华细胞与干细胞杂志(电子版), 2017, 7(1):29-34.
