清热解毒扶正颗粒对ETM大鼠血清IL—1β、IL—12及TNF—α含量的影响
2017-03-09万启南韦衮政李黔云
万启南+韦衮政+李黔云

摘要:目的 探讨清热解毒扶正颗粒对ETM大鼠血清IL-1β、IL-12及TNF-α含量的影响。方法 90只大鼠随机分为正常组、模型对照组、西药组以及中药低、中、高剂量组,采用腹腔注射脂多糖法(LPS)复制大鼠内毒素血症模型。正常组、模型对照组予生理盐水1ml/100g灌胃,每天1次;西药组给甲基强的松龙1.17mg/100g灌胃,每天1次;中药组给清热解毒扶正颗粒1ml/100g灌胃,每天1次;实验结束后,用ELISA法测定各组血清IL-1β、IL-12、TNF-α的水平。結果 与模型组比较,各治疗组均有效降低了血清中IL-1β浓度(P<0.05);甲强龙组、中药组高、中剂量组能有效降低血清IL-12浓度(P<0.05),低剂量组则不能有效降低血清IL-1β浓度(P>0.05);中药中、高剂量组能有效降低血清TNF-α浓度(P<0.05),低剂量组、甲强龙组不能有效降低血清TNF-α浓度(P>0.05)。结论 清热解毒扶正颗粒中、高剂量组能有效下调ETM大鼠血清中IL-1β、IL-12等炎性因子的含量,从而在某种程度上达到对内毒素血症的治疗作用。
关键词:清热解毒扶正颗粒;内毒素血症;白介素-1β;白介素-12;肿瘤坏死因子-α
中图分类号:R285.5 文献标志码:A 文章编号:1007-2349(2017)02-0087-03
现代医学认为,内毒素血症(Endotoxeamia,ETM)发生原因是在严重创伤、感染等应激状态下全身的网状内皮系统功能障碍,免疫机能下降,肠腔革兰阴性细菌内毒素从肠道移位进入血液及机体组织,诱导内毒素血症及全身免疫反应的发生,导致机体组织、细胞的损伤,造成机体死亡[1]。其诱导的大量炎性介质失控性释放所致的全身炎性反应综合征(SIRS),以及进一步恶化发展成为的多脏器功能失常综合征(MODS)是严重感染患者走向死亡的主要途径,而该恶性进展的关键启动因子为内毒素及其诱导的失控性大量炎性介质。因此,拮抗内毒素及调控其诱导的失控性大量炎性介质具有重要临床意义。本研究通过腹腔注射脂多糖(lipopo-lysaccharide,LPS)诱导大鼠内毒素血症模型,观察各处理组大鼠血清中白介素-1β(IL-1β)、白介素-12(IL-12)、肿瘤坏死因子-α(TNF-α)的浓度水平,旨在了解清热解毒扶正颗粒对大鼠ETM模型中炎性介质的影响,并探讨其部分药效。现报道如下。
1 材料
1.1 实验动物 选择Wistar大鼠(SCXK{川}2013-24,001643)90只,体重(200±20)g。
1.2 实验试剂 LPS(sigma公司,L2630),大鼠(Rat)白介素1β(IL-1β)、白介素12(IL-12)、肿瘤坏死因子α(TNF-α)ELISA检测试剂盒(Biocalvin,苏州卡尔文生物科技有限公司,20250802A)。
1.3 实验药品 ①清热解毒扶正颗粒:由翼首草,荷叶顶,鱼腥草,柴胡,葛根,太子参,麦冬,丹皮,薏苡仁等14味药组成。以上14味药由云南中医学院第一附属医院中药房鉴定为正品;薏苡仁、葛根、丹皮粉碎成细粉,其余翼首草等11味加水煎煮3次,每次1 h,合并煎液,滤过,浓缩至相应密度为1.30~1.35(500C)的浸膏1份,蔗糖3份,糊精1份,及上述细粉混匀,制成颗粒,干燥既得。1 g相当于原生药1.26 g。相当于15 g/袋含生药18.9 g,1日服生药56.7 g。低剂量组含生药为0.5 g/ml,中剂量组含生药为1 g/mL,高剂量组含生药为2 g/mL。4℃保存;②甲基强的松龙(国药集团容生制药有限公司,40 mg,国药准字H20030727)。
1.4 主要实验仪器及设备 ①酶标仪(450nm,spectraMax i3x,美国MOLECULAR DEVICES公司)。②恒温箱(3111,美国Thermo公司)。③离心机(1.0R,美国Thermo公司)。④电子天平(YP3000型,上海精科天平厂)。
2 方法
2.1. 实验动物造模 除正常组外,其余大鼠根据文献[1]采用腹腔注射脂多糖(LPS)致大鼠内毒素血症模型。具体操作方法是先每日测量大鼠体温(肛温)2次,连续2 d,取2次体温的平均值记为基础体温。单次体温超过38℃或2次体温差超过0.5℃的动物剔除。实验前6 h禁食不禁水。然后腹腔注射LPS,诱导动物发热,注射LPS后每隔30 min测一次体温,连续测8h。
2.2 实验动物分组与处理 90只大鼠进行编号,查随机数字表分为正常组、模型对照组、西药组、中药低剂量组、中药中剂量组、中药高剂量组。(1)正常组每日予生理盐水1ml /100g灌胃,每天1次;(2)其余大鼠均腹腔注射脂多糖(LPS)制成大鼠内毒素血症模型,脂多糖用生理盐水配制成10mg/ml溶液,参照文献1造模方法造模成功后分为模型对照组、西药组、中药低、中、高剂量组。①模型对照组予生理盐水1ml/100g灌胃,每天1次;②西药组给甲基强的松龙:1.17mg/100g体重灌胃,每天1次;③中药组每日灌胃1次,按照人与大鼠剂量换算标准并适当调整确定灌胃剂量:给药剂量(g/kg)=给出的人的剂量(g)×系数(0.018)/所求动物体重(kg);1ml/100g灌胃,每天1次;中药低、中、高剂量分别相当于5、10、20g/kg。分别于3d、7d和14d每组各处死大鼠1只,4周后(28天)处死所有大鼠。
2.3 观察检测指标 实验结束后,将抽取的小鼠血液放入血清分离管中,室温放置30min,以3000r·min-1离心10min分离血清,吸取血清放入1.5mL 离心管中,4℃保存,用ELISA法测定血清IL-1β、IL-12、TNF-α的水平。严格按照试剂盒说明书步骤操作。
2.4 统计学方法 结果以(x±s)表示,采用One-Way ANOVA检验并对样本进行方差齐性检验;样本方差不具有齐性时,采用Kruskal-Wallis H test进行检验,并进行组间的多重比较[2]。数据使用SPSS 19.0统计软件进行处理,以P<0.05为差异有统计学意义。
3 结果
3.1 IL-1β各组间比较 经One-Way ANOVA检验,方差不具有齐性,组间多重比较采用Kruskal-Wallis H test进行检验,结果如下:P<0.05,各组之间差异有显著统计学意义。见表1。
各组间两两比较(Kruskal-Wallis H test):各组与模型组比较,均表现出了显著差异性(P<0.05);各组与空白对照组比较,除模型对照组外(P<0.01),差异均不显著(P>0.05),提示中药组和甲强龙组均有效降低了血清中IL-1β浓度;甲强龙组和中药组比较,与中药高剂量组差异不显著(P>0.05),与中、低劑量组差异显著(P<0.05),提示甲强龙组降低血清IL-1β浓度作用优于中药中、低剂量组;中药组之间两两比较,无统计学差异(P>0.05),亦提示中药组高、中、低剂量对于均有效降低了血清中IL-1β浓度。
3.2 IL-12各组组间比较 经One-Way ANOVA检验,方差不具有齐性,组间多重比较采用Kruskal-Wallis H test进行检验,结果如下:P<0.05,各组之间差异有显著统计学意义。见表2。
各组间两两比较(Kruskal-Wallis H test):各组与模型组比较,除低剂量组外(P>0.05)均表现出了显著差异性(P<0.05),提示甲强龙组、中药组高、中剂量组能有效降低血清IL-12浓度,低剂量组则不能有效降低血清IL-12浓度。各组与空白对照组比较,高剂量组、中剂量组无统计学差异(P>0.05);甲强龙组、低剂量组均差异显著(P<0.05),表明中药组高、中剂量组调控血清IL-12浓度效果要优于甲强龙组;甲强龙组和中药组比较,与中药中、高剂量组差异不显著(P>0.05),与低剂量组差异显著(P<0.05),提示甲强龙组降低血清IL-12浓度作用优于低剂量组。中药各组两两比较,[HJ2mm]中药高、中剂量组未见明显差异(P>0.05),表明2组降低血清IL-12浓度的作用无明显差异,两组与低剂量组比较差异均显著(P<0.05),亦提示低剂量组不能有效降低血清IL-12浓度。
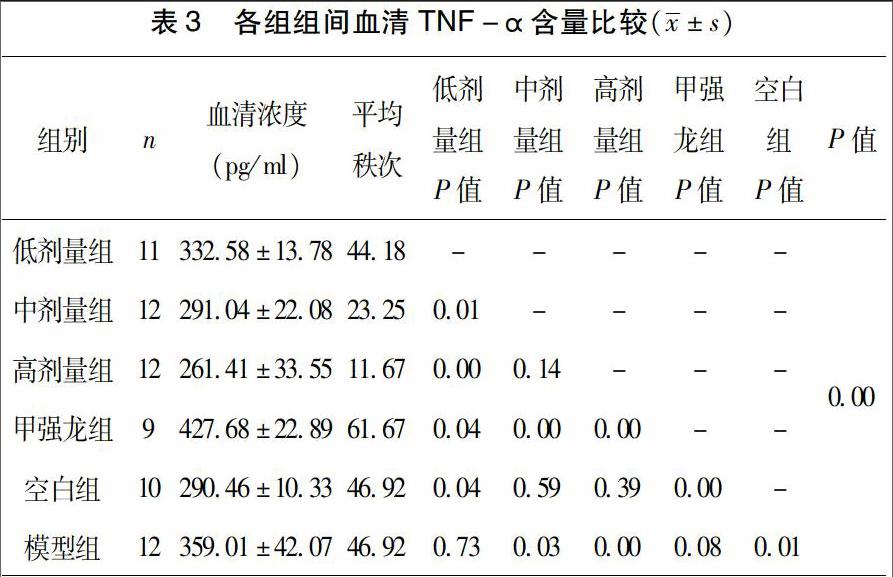
3.3 TNF-α各组组间比较 经One-Way ANOVA检验,方差不具有齐性,组间多重比较采用Kruskal-Wallis H test进行检验,结果如下:P<0.05,各组之间差异有显著统计学意义。见表3。
各组间两两比较(Kruskal-Wallis H test):各组与模型组比较,中剂量组、高剂量组表现出了显著差异性(P<0.05),低剂量组、甲强龙组差异不显著(P>0.05);各组与空白对照组比较,高剂量组、中剂量组无明显差异(P>0.05),甲强龙组、低剂量组差异显著(P<0.05),提示中药中、高剂量组能有效降低血清TNF-α浓度,中药低剂量组、甲强龙组则不能有效降低血清TNF-α浓度;中药各组与甲强龙组比较,均差异显著(P<0.05),提示中药组低剂量组降低血清TNF-α浓度亦显著优于甲强龙组;中药各组两两比较,中药高、中剂量组未见明显差异(P>0.05),表明两组降低血清TNF-α浓度的作用无明显差异,2组与低剂量组比较差异均显著(P<0.05),亦提示低剂量组不能有效降低血清TNF-α浓度。
4 讨论
内毒素血症多与中医学“温病”、“瘟疫”、“热毒”等过程的一些重症相似。其病例特点多属初时邪盛而正气抵抗力亦强,形成高热;其后热盛耗损津液,劫灼营阴,直至动血耗血,终至气阴耗竭。故内毒素血症在病机上属“正虚邪实”,对应的治疗原则应是“扶正”和“祛邪”并举。现代医学中单纯抗生素的应用只能解决“祛邪”的问题,而忽视了“扶正”的保护性治疗的重要性。所以不少医家提出热毒内盛、瘀血阻滞、气阴两虚是内毒素血症的重要病机,当治以清热解毒、活血化瘀、益气养阴[3]。
本研究在中医的整体论指导下,从整体上把握疾病“证”的变化,制定出以扶正祛邪为治疗原则,以清热解毒、凉血化瘀、益气养阴为治法的复方中药制剂——清热解毒扶正颗粒,为感染性疾病的中医药治疗提供了有效方法。本制剂由翼首草、芙蓉叶、鱼腥草、麦冬、太子参、丹参等14味中药组成,临床观察对外感高热、肺炎等具有较好的疗效[4-5]。方中君药翼首草为藏药,生长于高寒地区如西藏各地、青海、四川西部和北部、云南西北部等,具有清热解毒、祛风湿、止痛等作用,有研究表明对急性炎症的渗出和水肿有明显的抑制作用,因此具有显著的抗炎活性[6]。麦冬中的麦冬皂苷及麦冬多糖可显著增加小鼠器官胸腺、脾脏重量,并激活小鼠网状内皮系统的吞噬功能,提高血清溶血素抗体水平.增加机体的免疫力[7]。太子参多糖具有抗疲劳、抗应激和增强机体免疫功能的作用[8]。丹参有效成分丹参酮、丹酚酸类化合物有改善血液循环、抗菌和抗炎、抗氧化、抗凝血和细胞保护等作用[9]。另外鱼腥草、芙蓉叶等不仅具有抗病毒、抗菌、抗炎等功效,且均有调节免疫功能的作用。
本次研究结果表明,甲基强的松龙能有效降低血清IL-12浓度,且在降低血清IL-1β浓度方面优于中药中、低剂量组,和中药高剂量组则无统计学差异。但甲基强的松龙在本次研究中未见明显降低血清中TNF-α的水平的作用,甚至在部分ETM大鼠血清中有所升高,这可能与甲基强的松龙对ETM大鼠的免疫抑制引起的免疫调控系统紊乱有关。清热解毒扶正颗粒中、高剂量组均能有效降低血清中IL-1β、IL-12及TNF-α的浓度水平,且在调控血清IL-12水平方面优于甲基强的松龙,低剂量组能有效降低血清中IL-1β的水平,而对于IL-12及TNF-α则无明显效果,结合本药的解热、抗炎作用的前期研究[4-5],表明清热解毒扶正颗粒可以通过调节血清中IL-1β、TNF-α等炎性因子在机体的平衡达到对内毒素血症的治疗作用。关于本药治疗内毒素血症的分子机制及其作用靶点,尚有待于进一步研究探索。
参考文献:
[1]Brunn CJ,Platt JL.The etiology of sepsis tumed inside out Trends.MolMed,2006,12(1):10-16.
[2]祁海萍,申希平.Kruskal-Wallis H检验平均秩多重比较在SPSS软件中的实现[J].兰州工业学院学报,2015,02:76-78.
[3]蒲晓东.内毒素血症中医病机及治法探讨[J].中国中医急症,2005,14(12):1190-1192.
[4]万启南,陈晓华,等.清热解毒扶正颗粒治疗老年人肺炎59例疗效观察[J].光明中医,2007,22(7):59.
[5]万启南,陈晓华,叶勇,等.清热解毒扶正颗粒治疗外感高热症36例[J].中医研究,2007,20(7):20.
[6]关昕璐,阎玉凝,魏太明,等.翼首草的抗炎作用与急性毒性实验研究[J].北京中医药大学学报,2004.27(2):71-73.
[7]韩风梅,刘春霞,陈勇,等.山麦冬多糖对免疫低下小鼠的保护作用[J].中国医药学报,2004,19(6):347-348.
[8]刘训红,陈彬,王玉玺.太子参多糖抗应激和免疫增强作用的实验研究[J].江苏中医,2000,21(10):53-54.
[9]杜冠华,张均田.丹参现代研究概况与进展(续前)[J].医药导报,2004,07:435-440.
(收稿日期:2016-10-31)
