RP—HPLC法测定不同煎煮时间下藏药三果汤中槲皮素、鞣花酸、柯里拉京的含量变化
2017-03-09左晓霜陈平马定乾
左晓霜+陈平+马定乾
摘要:目的 测定并分析在不同煎煮时间条件下藏药三果汤中槲皮素、鞣花酸、柯里拉京的含量变化。方法 分别称取10 g配置好的藏药三果汤散于4个烧杯中,各加入纯净水30 mL,料液比为1:3。将烧杯置于垫有石棉网的电磁炉上,用180℃将其煮沸,待药品沸腾后,将4个烧杯转移到温度为80℃的恒温水浴锅中,进行10、20、30、40 min的煎煮。待煎煮时间均完毕后,静置冷却至室温,过滤,微孔滤膜抽滤,用反相高效液相色谱测定槲皮素、鞣花酸、柯里拉京的含量变化。结果 藏药三果汤中的槲皮素、鞣花酸、柯里拉京均在煎煮时间为40 min时含量最高。 结论 日常中药的煎煮一般均煎煮超过30 min,因此本实验以煎煮时间对藏药三果汤的某些有效成分含量的影响做出研究,为藏药三果汤的最佳煎煮时间以及某些有效成分的提取、制备及资源开发利用提供一定的参考。
关键词:三果汤;槲皮素;鞣花酸;柯里拉京
中图分类号:R284 文献标志码:A 文章编号:1007-2349(2017)02-0076-04
【Abstract】Objective: To determine and analyze the content changes of quercetin, ellagic acid and corilagin in Sanguotang of Tibetan medicine in different boiling time. Methods: 10 g of Sanguotang powder was weighed in four beakers and 30 mL of pure water was added in each beaker. The ratio of solid to liquid was 1: 3. The beakers were placed on the induction cookers matted with asbestos net to be boiled at 180℃ until the drugs were boiling. The four beakers were transferred to a temperature of 80℃ constant temperature water bath and decocted for 10 min, 20 min, 30 min and 40 min. After decocting, the drug was statically cooled down to room temperature, filtrated, and filtrated with microporous membrane, and the content of quercetin, ellagic acid and corilagine were determined by RP-HPLC. Results: The contents of quercetin, ellagic acid and corilagin were the highest at the time of 40 min. Conclusion: The decoction of traditional Chinese medicine is generally decocted for more than 30 minutes. The study provides the best decocting time and certain reference for the extraction, preparation and utilization of some effective components of Sanguotang.
【Key words】Sanguotang, quercetin, ellagic acid, corilagin
藏药三果汤又名哲布松汤,初载于我国藏药药典《四部医典》中,是由3味药材即诃子(Terminalia chebula Retz.)又名訶黎勒,毛诃子(Terminalia bellirica Roxb.),又名毗黎勒和余甘子(Phyllanthus emblica L.),又名庵摩勒组成,《四部医典》记载其:“主治瘟疫、紊乱热症、促使热症成型”[1]。后又收载于95年的藏药《部颁标准》[2]、2008年的《四川省阿坝藏族羌族自治州藏药制剂标准》[3],具有清热生津、调和气血、化解坏血的功效。现代药理学研究表明,三果汤具有抗氧化[4][5][6]、抗癌[7][8][9]、抗辐射[10]、抗炎[11]、抗菌[12]等作用。
现代研究表明三果汤的化学成分含有酚酸类、鞣质类、三萜类、黄酮类等。鞣花酸、柯里拉京属于酚酸类,槲皮素属于黄酮类。鞣花酸(Ellagic acid,EA)是广泛存 在于各种植物软果、坚果等组织[HJ2.5mm]中的一种多酚二内酯,是没食子酸的二聚衍生物。现代研究表明鞣花酸具有多种生物活性功能,如抗氧化、抗癌、抗突变等,并对人体免疫缺陷病毒也有抑制作用[13]黄酮类化合物槲皮素(quercetin,3,3,45,7-pentahydroxyflavone)是一个典型的多酚化合物,广泛存在于水果蔬菜中,具有抗炎、抗氧化、诱导凋亡活性等[14]。 柯里拉京(Corilagin)又称鞣云实素,属天然植物多酚单宁酸类化合物,常见于老鹳草中,国内外研究均表明柯里拉京具有抗肿瘤作用,能够明显抑制肺癌细胞生长[15]。见图1。
本实验根据藏药三果汤中黄酮类物质和多酚类物质的性质以及槲皮素、鞣花酸、柯里拉京的理化性质,测定在不同煎煮时间的条件下,以上物质的含量的变化。
1 材料与方法
1.1 材料与试剂 余甘子干果、诃子干果、毛诃子干果(河北省安国市旭芳中药材经营有限公司),经本校药用植物教研室李海宁教师鉴定是大戟科叶下珠属余甘子果实、使君子科植物毗黎勒的干燥成熟果实。乙腈(色谱纯),甲醇(色谱纯),甲醇(分析醇),磷酸(所有试剂均购自云南丹赤贸易有限公司),纯化水。柯里拉京标准品(成都普瑞法科技开发有限公司,批号:14021908)、槲皮素标准品(上海源叶生物科技有限公司,CAS号:117-39-5)、鞣花酸标准品(同力生物,批号:BBP03169)。
1.2 仪器 DFY-600高速万能粉碎机、Agilent1200型高效液相色谱仪(VWD检测器)、分析天平、水浴锅(HH-6)。
1.3 方法
1.3.1 三果汤散的制备 将余甘子、诃子、毛诃子三味药材干果均去核后分别经高速万能粉碎机打粉,再过5号筛,备用。按《藏药标准》称取余甘子粉末12 g,诃子粉15 g,毛诃子粉10 g各4份,分别混合均匀即得三果汤散,并置于4个烧杯中,备用。
1.3.2 三果汤供试品的制备 将4个烧杯中分别加入纯化水各约100 mL,使料液比为1:3。将烧杯均置于垫有石棉网的电磁炉上加热(温度为140℃),待药液沸腾后,取下烧杯置于温度为80℃的恒温水浴锅中,进行煎煮,并按10、20、30、40 min的时间计时,煎煮时间完毕后,置于室温冷却并过滤,将滤液用0.45的微孔滤膜过滤即得HPLC的供试品。
1.3.3 槲皮素、鞣花酸、柯里拉京的标准品溶液制备 精密称取槲皮素标准品2.2 mg,置于10 mL的容量瓶中,加60%乙醇(分析醇)定容成0.22 mg/mL的溶液,用0.45的微孔滤膜过滤即得HPLC的对照品,备用。精密称取鞣花酸标准品0.80 mg,置于10 mL的容量瓶中,加80%甲醇(分析醇)定容成0.08 mg/mL的溶液,用0.45的微孔滤膜过滤即得HPLC的对照品,备用。精密称取柯里拉京标准品0.10 mg,置于10 mL的容量瓶中,加100%的甲醇(分析醇)定容成0.01 mg/mL的溶液,用0.45的微孔滤膜过滤即得HPLC的对照品,备用。
1.3.4 槲皮素测定方法
1.3.4.1 槲皮素色谱条件 色谱柱为Agilent C18ZORBAX SB-C18柱(4.6×250 mm,5 um);流动相:甲醇-0.5%磷酸溶液(50:50),检测波长为370 nm,柱温30℃。进样量10 uL,流速为1.0 mL/min。
1.3.4.2 槲皮素线性关系考察 精密称取对照品2.2 mg,用60 %的乙醇定容至10 mL容量瓶中,摇匀作为储备液。按上述槲皮素的色谱条件分别取1、3、5、7、9、11 uL不同体积进样,以槲皮素的峰面积(Y)对标准品的质量(X)进行线性回归,可得出线性方程Y=47491X+1.301,r=0.9992。结果表明:槲皮素峰面积值与质量有良好的线性关系,线性范围为0.22-2.42μg。(HPLC色谱图见图2)
1.3.5 鞣花酸、柯里拉京含量测定方法
1.3.5.1 鞣花酸、柯里拉京色谱条件 色谱柱为Agilent C18ZORBAX SB-C18柱(4.6×250 mm,5 um);流动相:甲醇-0.1%磷酸溶液梯度洗脱:0-10 min,5:95;10-15 min,10:90;15-30 min,15:85;30-50 min,30:70;50-60 min,40:60。检测波长为259 nm;柱温:30℃;流速:1.0 mL/min;进样量为10 μL。
1.3.5.2 鞣花酸、柯里拉京线性关系考察 精密称取鞣花酸对照品0.80 mg,用80 %的甲醇定容至10 mL容量瓶中,摇匀作为储备液。精密称取柯里拉京对照品0.10 mg,用100 %的甲醇定容至10 mL容量瓶中,摇匀作为储备液,按上述鞣花酸、柯里拉京的色谱条件分别取1、3、5、7、9、11 uL不同体积进样,以鞣花酸、柯里拉京的峰面积(Y)对标准品的质量(X)进行线性回归,可得出二者的线性方程,分别为:Y=19853X-8.9757,r=0.9999。:Y=53331X+710.37,r=0.997。结果表明:鞣花酸、柯里拉京峰面积值与质量有良好的线性关系,线性范围分别为0.08-0.88μg和0.01-0.11μg。(HPLC色谱图见图3、图4)
1.4 精密度实验
1.4.1 槲皮素的精密度实验 取同一槲皮素对照品溶液按“1.3.4.1”项下的色譜条件,连续测定6针,按峰面积积分值计算,槲皮素的RSD=0.70%,表明仪器精密度良好。
1.4.2 鞣花酸的精密度实验 取同一鞣花酸对照品溶液按“1.3.5.1”项下的色谱条件,连续测定6针,按峰面积积分值计算,鞣花酸的RSD=0.47%,表明仪器精密度良好。
1.4.3 柯里拉京的精密度实验 取同一柯里拉京对照品溶液按“1.3.5.1”项下的色谱条件,连续测定6针,按峰面积积分值计算,柯里拉京的RSD=1.6%,表明仪器精密度良好。
1.5 稳定性实验
1.5.1 槲皮素稳定性实验 取备用槲皮素对照品溶液按“1.3.4.1”项下的色谱条件,在0、1、2、4、6h这些时间点上测定6针,按峰面积积分值计算,槲皮素的RSD=0.43%,表明稳定性良好。
1.5.2 鞣花酸稳定性实验 取备用鞣花酸对照品溶液按“1.3.5.1”项下的色谱条件,在0、1、2、4、6h这些时间点上测定6针,按峰面积积分值计算,鞣花酸的RSD=0.45%,表明稳定性良好。
1.5.3 柯里拉京稳定性实验 取备用柯里拉京对照品溶液按“1.3.5.1”项下的色谱条件,在0、1、2、4、6h这些时间点上测定6针,按峰面积积分值计算,柯里拉京的RSD=2.5%,表明稳定性良好。
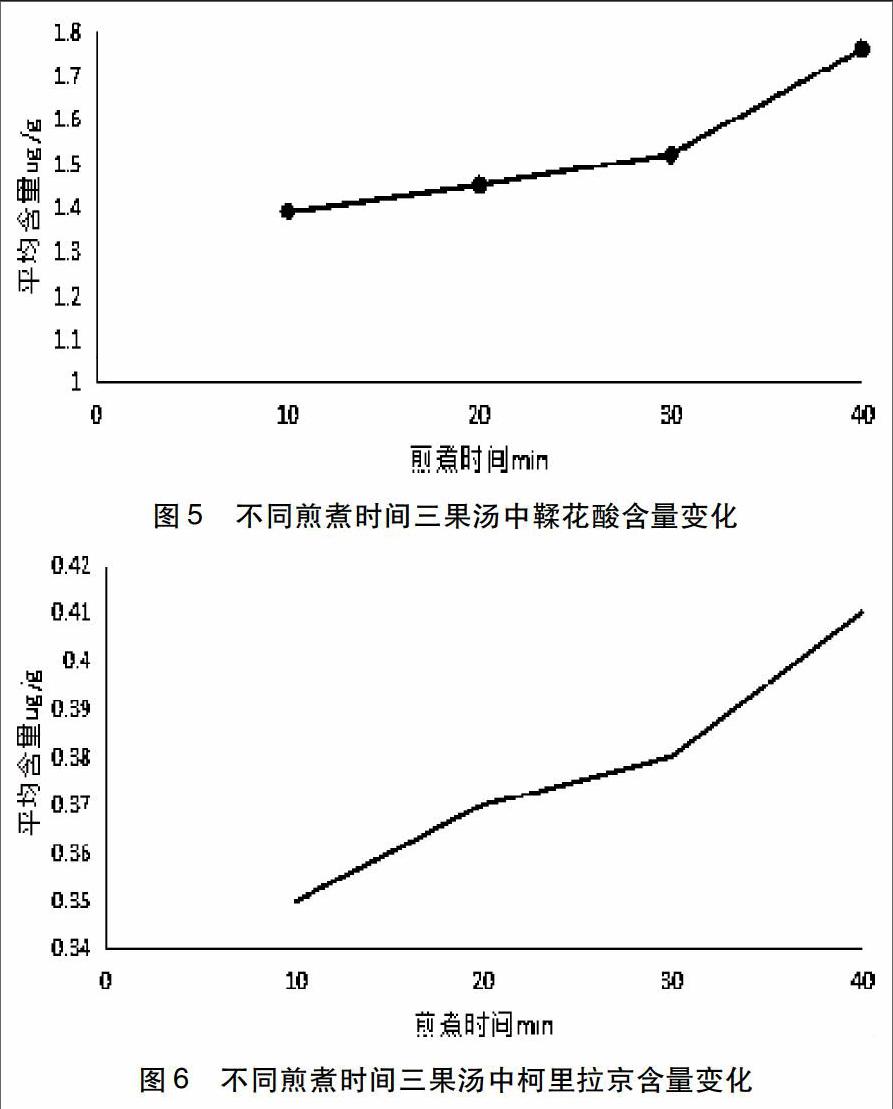
2 实验结果与分析 见表1-2。
在不同的煎煮时间下,藏药三果汤中的部分有效成分槲皮素、鞣花酸、柯里拉京的含量均随煎煮时间的延长而增加。槲皮素的含量在10-30 min内变化缓慢,而在30-40 min时含量变化显著(见图4);鞣花酸的含量在10-30 min内缓慢增加,在30-40 min时含量显著增加(见图5);柯里拉京的含量在10-20 min内增加,在20-30 min内变化较为缓慢,在30-40min内,含量明显增加(见图6)。而且槲皮素含量较少,鞣花酸含量最多,柯里拉京次之。经课题组前期预实验结果显示,这三种有效成分在煎煮时间超过60 min后,含量呈减少的趋势,且煎煮40、50、60 min的实验结果近似,因此本实验选取煎煮较短时间来测定藏药三果汤中有效成分的含量变化。
3 结论
本实验运用RP-HPLC法测得藏药三果汤在不同煎煮时间的条件下,其有效成分槲皮素、鞣花酸、柯里拉京均在煎煮40min时含量最高,得出以上结果提示因为中药材在煎煮过程中要受热充分,且有些化学成分对温度的敏感程度不同,所释出的含量不同。本实验结合前期预试验选定了煎煮藏药三果汤的最适时间为40min,不宜超过60min。为藏药三果汤的汤剂制备、质量控制及资源开发利用提供一定的参考。
参考文献:
[1]罗达尚.新修晶珠本草[M].成都:四川科学技术出版社,2004:441,470,471.
[2]中华人民共和国卫生部药典委员会中华人民共和国卫生部药品标准藏药[M],第一册1995:264.
[3]四川省阿坝食品药品监督管理局 四川省阿坝藏族宪族自治州藏药制剂标准[M],2008:290.
[4]项朋志,余洪,刘琼,等.藏药大三果抗氧化活性研究[J].化学与生物工程,2013,30(11):27-30.
[5]GunjalA H,Harimohan C,Harisha C R,etal.Pharmacognostical andPreliminaryphysicochemical evaluation of Triphaladi granules-A polyherbal Ayurvedic formulation.[J].Ayu,2013,34(3):288-293.
[6]Deepa B,Gurumurthy P,Borra S K,et al.In vitro and in vivo protective action of ethanolic extract of Triphala on LDL against glycation-oxidation[J].African Journal of Pharmacy & Pharmacology,2014.
[7]Vadde R,Radhakrishnan S,Reddivari L,et al.Triphala ExtractSuppressesProliferation and Induces Apoptosis in Human Colon Cancer Stem Cells via Suppressing c-Myc/Cyclin D1 and Elevation of Bax/Bcl-2 Ratio.[J].Biomed Research International,2015,.
[8]Russell L H,Elizabeth M,Badisa R B,etal.Differential cytotoxicity of triphala and its phenolic constituent gallic acid on human prostate cancer LNCap and normal cells.[J].Anticancer Research,2011,31(11):3739-3745.
[9]Lu K,Chakroborty D,Sarkar C,etal.Triphala and Its Active Constituent Chebulinic Acid Are Natural Inhibitors of VascularEndothelial Growth Factor-A MediatedAngiogenesis[J].Plos One,2012,7(8):906-907.
[10]Singh D P,Mani D.Protective effect of Triphala Rasayana against paracetamol-induced hepatorenal toxicity in mice[J].Journal of Ayurveda & Integrative Medicine,2014.
[11]Rayudu V,Raju A B.Effect of Triphala on dextran sulphate sodiuminduced colitis in rats[J].Ayu,2014,35(3):333-338.
[12]Mahajan D H,Bhoyar M S,Chaudhari S S.EFFICACY OF TRIPHALA KWATH YONI DHAWAN WITH TRIPHALA SIDDHA GHRITA PRATISARANIN EPISIOTOMY WOUND[J].International Journal of Research inAyurveda & Pharmacy,2013,4(2):249-252.
[13]丁運生,孙小虎,李有桂等.鞣花酸及其衍生物研究进展[J].合肥工业大学学报(自然科学版).2008,31(11):1809-1812.
[14]Kawabata K,Kawai Y,Terao J.Suppressive effect of quercetin on acute stress-induced hypothalamic-pituitary-adrenal axis response in WistarRats[J].J Nutr Biochem,2010,21(5):374.
[15]朝阳,王德昌,陈玉武等.柯里拉京抗肿瘤和致突变作用实验研究[J].肿瘤防治杂志,2003,10(5):469.
(收稿日期:2016-11-26)
