靛玉红对肿瘤血管内皮细胞增殖迁移及血管形成的影响
2017-03-09李卓虹祝朝富安佰平
李卓虹+祝朝富+安佰平

摘要:目的 探讨靛玉红(Indirubin)对肿瘤血管内皮细胞增殖、迁移、血管形成影响。方法 采用肝癌HepG2细胞上清诱导人脐静脉内皮细胞(human umbilical vein endothelial cells,HUVEC)成为肿瘤血管内皮细胞(tumor-derived endothelial cells,Td-EC),通过MTT法、细胞迁徙试验、血管形成实验检测靛玉红对HUVEC与Td-EC增殖、迁移、血管形成的影响。结果 靛玉红在体外对Td-EC有显著的生长抑制作用,并具有时间和浓度依赖性;一定浓度的靛玉红能显著降低Td-EC细胞迁徙活性和抑制血管的形成,而同样条件下,靛玉红对HUVEC的抑制作用弱于Td-EC。结论 靛玉红在体外可特异地抑制Td-EC增殖、迁移、血管形成。
关键词:靛玉红;肿瘤血管内皮细胞;增殖;迁移;血管形成
中图分类号:R285.5 文献标志码:A 文章编号:1007-2349(2017)02-0072-04
【Abstract】Objective: To investigate the effect of indirubin on the proliferation, migration and angiogenesis of vascular endothelial cells. Methods: Human umbilical vein endothelial cells (HUVEC) were induced to differentiate into tumor-derived endothelial cells (Td-EC) by HepG2 cell supernatant. MTT assay, cell migration assay and angiogenesis test were used to detect the effect of indirubin on the proliferation, migration and angiogenesis of HUVEC and Td-EC. Results: Indirubin had significant growth inhibitory effect on Td-EC in vitro and time and concentration dependence. Indirubin with certain concentration could significantly reduce the migration of Td-EC cells and inhibit the formation of blood vessels. In the similarity condition, the inhibitory effect of indirubin on HUVEC was weaker than that of Td-EC. Conclusion: Indirubin can specifically inhibit the proliferation, migration and angiogenesis of Td-EC in vitro.
【Key words】indirubin, tumor vascular endothelial cell, proliferation, migration, angiogenesis
肿瘤的生长、转移依赖于血管生成,血管生成可为肿瘤组织提供充足的营养和氧气,并带走其代谢产物,因而抗肿瘤血管生成成为目前理想的抗癌治疗策略[1]。靛玉红是从我国传统中药青黛、板蓝根、大青叶中提炼而成,已经有大量研究表明靛玉红具有抑制细胞周期[2]、杀伤肿瘤细胞以及抗炎[3]等多种功效。但对靛玉红抑制肿瘤血管内皮细胞生成的机制尚不清楚,本研究中,我们将探讨靛玉红对肿瘤血管内皮细胞增殖、迁移、血管形成影响,以期揭示其对肿瘤血管内皮细胞生长及相关功能的影响。
1 材料与方法
1.1 材料
1.1.1 主要试剂 Trizol(Ambion公司),抗体(Santa公司),胰蛋白酶(HyClone公司),胎牛血清(Invitrogen公司),Matrix基质胶(BD公司),人肝癌HepG2细胞(四川大学 生物医学工程研究室)。
1.2 方法
1.2.1 细胞培养 取健康、足月剖宫产胎儿脐带20-30 cm,以胰酶灌注法分离脐静脉血管内皮细胞,用含20%胎牛血清、10 ng/L VEGF的PRMI1640 培养传代,流式细胞术检测Ⅷ因子相关抗原以鉴定HUVEC,人肝癌HepG2细胞用含10%胎牛血清的RPMI1640 液培养至70% 汇合时,换成无血清的RPMI1640 液再培养48 h。收集培养上清液,经0.22 μm 滤膜过滤后,于-80℃保存备用。取第3代HUVEC,用含体积分数50% HepG2细胞培养上清培养,汇合至80%时收集细胞,即为肿瘤血管血管内皮细胞(Td-EC),并可培养传代。
1.2.2 RT-PCR 检测 以正常HUVEC 为对照组,提取Td-EC细胞总RNA。根据TEM1及TEM8 的cDNA 设计引物,并由成都宝信生物工程技術有限公司合成。用RT-PCR来检测TEM1及TEM8 mRNA的表达,总RNA用RevertAid First Strand cDNA试剂盒反转录合成cDNA链。TEM1、TEM8和β-actin引物为:TEM1:5-cattatcccaactgcccagc-3(R)和5-ctgatgggtgaggtctggtt5-(F);TEM8:5-gctgcaccactggaatgaaa-3(R)和5-gtctcctcctggcagaactt5-(F)β-actin:5-cctgcttgctgatccacatc-3(R)和5-cctctatgccaacacagtgc-3(F)用Deam Taq PCR Master Mix(2X)进行PCR。反应条件为:95℃,3 min的预变性;95℃,30 s;68℃,30 s;72℃,1 min;30个循环;延伸72℃,10 min。PCR产物用1.0%琼脂糖凝胶电泳后,用凝胶电泳成像系统进行观察并采集图片。
1.2.3 细胞增殖能力测定 采用MTT 法检测细胞增殖能力,取对数生长期HUVEC、Td-EC细胞,调整细胞浓度为2×104 cells/mL接种于96孔培养板,200 μL/孔。以0、5、10 μmol/L浓度靛玉红处理细胞。置37℃、5% CO2 培养箱培养,分别在24、48、72 h后,加入MTT(5 mg/mL)20 μl/孔继续培养4 h,弃原培养液,加入DMSO 150 μl/孔,室温轻度振荡10 min,酶标仪检测490 nm的OD值,实验重复3次。
1.2.4 肿瘤血管内皮细胞迁移能力测定 采用划痕法测定肿瘤血管内皮细胞迁移能力。将HUVEC及Td-EC细胞接种于6孔板,以0、5、10 μmol/L浓度靛玉红处理细胞。待细胞融合后划痕,48 h后,用导倒置显微镜观察、拍照,测量划痕距离。
1.2.5 血管形成实验 在24孔板中加入matrigel胶(按1:2比例与无血清培养基混合),置37℃凝固后,将HUVEC、Td-EC细胞以1.5×105 cells/mL接种于24孔板中,每4 h观察1次管腔形成情况,12 h终止培养。继续加入5 μmol/L靛玉红的培养基培养48 h后观察、计数。
1.2.6 体外侵袭能力实验 细胞侵袭实验采用Transwell 小室法。Transwell小室的上室膜铺ECM 凝胶。下室加10% FBS 的培养液500 μl/室,上室接种无血清培养基过夜的HUVEC、Td-EC细胞,1×105cells/孔(200 μl),每组设3个平行孔,置37℃、5% CO2培养箱培养24 h 后取出小室固定细胞,用上述方法染色计数迁移细胞数。
1.3 统计学分析 统计分析所有数据的统计分析均在SPSS21.0中进行,计量资料用(x±s)表示;各组组间比较采用t检验,以P<0.05为有显著性差异。
2 结果
2.1 HUVEC的鉴定 HUVEC具有纯度高、活性好,可在体外培养并可传代七代以上的特性。培养细胞经流式细胞仪检测细胞表面标记(CD31、CD45、CD62、vWF)和对低密度脂蛋白(LDL)的吞噬功能检测细胞纯度[4-5],用碘化丙锭(PI)检测细胞活性,细胞纯度和活性分别达到95%以上。结果见下表1、图1。
2.2 肿瘤血管内皮细胞的诱导生成及鉴定 RT-PCR 扩增产物的电泳显示:从Td-EC 中能扩增出约290 bp 及460 bp 的条带(图2),说明HUVEC 经HepG2细胞培养上清诱导后,细胞表达TEM1 和TEM8,这是肿瘤血管内皮细胞特有的表达抗原,故诱导细胞具备了肿瘤血管内皮细胞的特性(见图2)。
2.3 靛玉红对Td-EC细胞增殖的影响 靛玉红处理24 h 后,HUVEC、Td-EC細胞增殖能力均明显受到抑制,并与时间及剂量成正相关,与对照组正常HUVEC、Td-EC 细胞相比,差异有显著性,并具有时间和浓度依赖性(P<0.05);而靛玉红对HUVEC 细胞增殖能力抑制作用弱于Td-EC,对照组正常Td-EC细胞增殖能力强于HUVEC细胞(见图3)。
2.4 靛玉红对Td-EC细胞迁移能力的影响 靛玉红处理48 h 后,HUVEC、Td-EC细胞迁移能力均明显受到抑制,并与剂量成正相关,与对照组正常HUVEC、Td-EC 细胞相比,差异有显著性,并具有浓度依赖性;靛玉红对Td-EC细胞迁移能力抑制作用明显强于HUVEC细胞(见图4)。
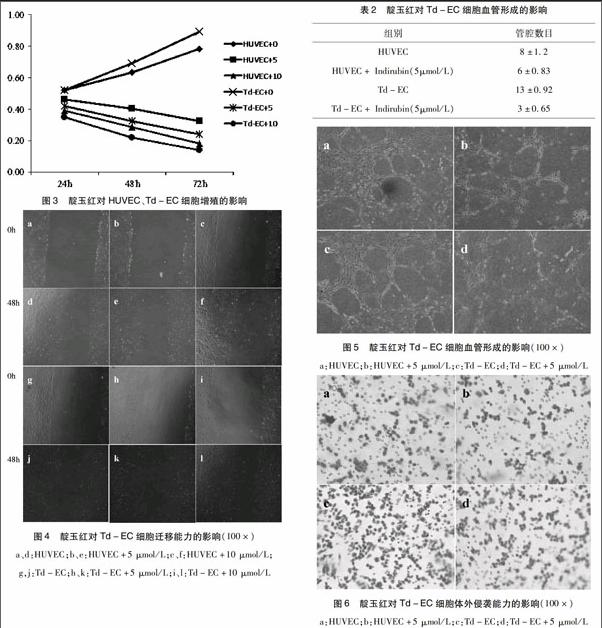
2.5 靛玉红对Td-EC细胞血管形成的影响 HUVEC是国内外建立体外血管生成模型的常用细胞,利用其在胶原组织上的爬行、融合形成小管样结构来观察研究药物对小管形成的影响是经典研究方法[6]。靛玉红处理前,Td-EC细胞管腔形成能力明显强于HUVEC(P<0.05),表明Td-EC细胞较正常HUVEC具有更强的血管形成能力。靛玉红处理后,Td-EC细胞管腔形成能力明显受到抑制(P<0.05),与HUVEC细胞相比,靛玉红对Td-EC细胞血管形成能力抑制效果更明显(P<0.05)(见图5、表2)。
2.6 靛玉红对Td-EC细胞体外侵袭能力的影响 HUVEC在靛玉红处理前后细胞迁徙数无显著性差异(P>0.05);而Td-EC细胞经靛玉红处理后其迁徙数明显减少(P<0.05);未经靛玉红处理Td-EC细胞迁徙数明显多于HUVEC细胞(P<0.05)。表明Td-EC 细胞较正常内皮细胞具有更强的迁徙能力,利于肿瘤的生长,而对正常内皮细胞的影响较小。(见图6)
3 结论
靛玉红为吲哚类化合物,存在于靛蓝、多种腹足纲软体动物、健康和患病人群的尿液,及各种野生型或重组细菌中[7],靛玉红最早被我国用于临床治疗慢性粒细胞白血病。近些年随着研究的深入,靛玉红及其衍生物不断地被发掘,在抗炎、抗肿瘤、增强免疫[3,8,9]等方面均有显著的疗效。血管内皮细胞是指衬于心、血管和淋巴管内表面的单层扁平上皮,它形成血管的内壁。血管内皮细胞具有吞噬异物、细菌、坏死和衰老组织的作用,还参与集体免疫活动。感染、炎症情况下,内皮细胞通过活化、释放细胞因子、促血小板凝集等参与病理变化,其自身还可以发生凋亡或通过增殖而自我修复。在肿瘤发生发展过程中,需伴随血管内皮细胞的异常增殖和血管新生[10]。
本研究证明靛玉红在体外对Td-EC在增殖、迁移、血管形成以及侵袭能力均具有显著的生长抑制作用,并具有时间和浓度依赖性;一定浓度的靛玉红能显著降低Td-EC细胞迁徙活性和抑制血管的形成,而同样条件下,靛玉红对HUVEC的抑制作用弱于Td-EC,说明相对正常内皮细胞靛玉红影响更加明显。由于体外肿瘤血管内皮细胞模型仍存在一定局限性,靛玉红对肿瘤内皮细胞生长抑制作用有待于动物体内实验的进一步证实,从而有利于新型抑制肿瘤血管内皮生长药物的开发。
参考文献:
[1]唐月汀,焦晓阳.血管内皮生长因子C恶性肿瘤转移中的作用与临床研究[J].汕头大学医学院学报,2015,25(3):176-178.
[2]Carassou P,Meijer L,Le Moulec S,et al.Cell cycle and molecular targets:CDK inhibition.Bull Cancer,2012,99(2):163-171.
[3]Eisenbrand G,Hippe F,Jakobs S,et al.Molecular mechanisms of indirubin and its derivatives:Novel anticancer molecules with their origin in traditional Chinese phytomedicine.J Cancer Res Clin Oncol,2004,130(11):627-635.
[4]Piebe M,Paulsen F,Jalnke T,et al.Mechanical brushcatheter abrasion method for the isclation and crlture of human conbilical veir endothelial cells.First in vitro results,2001,173(10):955-958.
[5]秦明春,王若光,秦莉花,等.人脐静脉内皮细胞的体外分离培养及鉴定[J].湖南中醫药大学学报,2007,27(4):12-15.
[6]Vailhe B,Vittet D,Feige JJ.In v itrom odels of vascu logenesis and angiogenesis.Lab Invest,2001,81(4):439 – 452.
[7]Polychronopoulos P,Magiatis P,Skaltsounis A L,et al.Structural basis for the synthesis of indirubins as potent and selective inhibitors of glycogen synthase kinase-3 and cyclin-dependent kinases[J].J Med Chem,2004,47:935-946.
[8]王通,曾耀英,肇静娴,等.靛蓝和靛玉红对小鼠T细胞活化与增殖的影响[J].中国药科大学学报,2005(5):444-447.
[9]吴琦玮,葛忠良,高月,等.靛玉红对肿瘤细胞抑制作用的研究及相关机制探讨[J].天津中医药,2008,25(1):55-56.
[10]Toya SP,Malik AB.Role of endothelial injury in disease mechanisms and contribution of progenitor cells in mediating endothelial repair[J].Immunobiology,2012,217(5):569-580.
(收稿日期:2016-10-26)
