豆腐柴愈伤组织诱导及细胞悬浮培养
2017-03-09李智超李琳玲程华程水源
李智超++李琳玲++程华++程水源


摘要:为探究适宜豆腐柴(Premna microphylla Turcz)细胞悬浮培养条件,以豆腐柴叶片为材料,进行了愈伤组织的诱导、继代培养、愈伤组织分散、悬浮培养的研究,建立了摇瓶悬浮培养体系。结果表明,豆腐柴叶片诱导得到的愈伤组织形态各异,其中诱导最适合悬浮培养的松散型胚性愈伤组织的培养基为MS+0.4 mg/L 2,4-D+0.4 mg/L NAA+3%蔗糖+0.8%琼脂。通过纤维素酶和果胶酶分散愈伤组织块可以得到较好的分散细胞系,最适合悬浮细胞生长的培养基条件为MS+0.4 mg/L 2,4-D+0.8 mg/L KT+3%蔗糖,其悬浮培养细胞鲜重增加量平均每7 d可达6.46倍,暗培养相对更适合细胞的增殖。经最佳培养条件下培养21 d的豆腐柴悬浮细胞中果胶和蛋白质平均含量达6.57%和0.12%,远低于豆腐柴天然叶片中的含量。
关键词:豆腐柴(Premna microphylla Turcz);愈伤组织;悬浮细胞
中图分类号:R282;Q813.1 文献标识码:A 文章编号:0439-8114(2017)01-0171-04
DOI:10.14088/j.cnki.issn0439-8114.2017.01.043
Embryoid Induction and Cell Suspension Culture of Premna microphylla Turca
LI Zhi-chao1,LI Lin-ling1,2,CHENG Hua1,2,CHENG Shui-yuan1,2
(1. College of Life Science, Huanggang Normal University, Huanggang 438000, Hubei,China;2.Economic Forest Germplasm Improvement and Comprehensive Utilization of Resources of Hubei Key Laboratory, Huanggang 438000, Hubei, China)
Abstract: In order to find the suspension culture conditions of Premna microphylla Turca,the leaf blades of the experimented Premna microphylla Turca,induced embryogenic callus and subculture,which established a good dispersion and a high dynamic suspension cell line. The results showed that the callus induction from leaves were different. Which induces the most suitable medium for suspension culture of loose embryogenic callus contained MS+0.4 mg/L 2,4-D+0.4 mg/L NAA+3% sucrose+0.8% agar. Cell lines can be dispersed better by cellulase and pectinase dispersed callus block. The most suitable medium for suspension cell growth contains MS+0.4 mg/L 2,4-D+0.8 mg/L KT+3% sucrose. And in this medium,the fresh weight of the suspension cultured cells could be increased by 6.46 times per 7 days. Dark culture was more suitable for cell proliferation. The average contents of pectin and protein were 6.57% and 0.12% in the suspended cells of Premna microphylla Turca,which had been cultured for 3 weeks under the optimum culture conditions.
Key words: Premna microphylla Turcz; callus; suspension culture
豆腐柴(Premna microphylla Turcz)又名臭黃荆、豆腐木、腐婢等,为马鞭草科豆腐柴属落叶直立灌木[1]。其叶片具有丰富的果胶,含量可达39.5%,酯化度73%~78%,可以作为优良的果胶提取原料[2]。此外,豆腐柴叶片中粗蛋白含量高达29.0%~34.1%,在目前已知植物中名列前茅;其根茎部含有木栓酮、木栓醇、十八碳酸、甾醇、胡萝卜甙、柚皮素、香草酸等多种药用成分[3,4],被用于中国传统中医治疗皮肤伤口、感染、疟疾、痢疾、头痛和毒蛇咬伤等[4]。
目前,豆腐柴主要通过野外采集获得,由于野生条件下豆腐柴零星散布在海拔500~1 500 m向阳山坡疏林下、林缘、沟谷边、荒山、丘陵、灌木层中[3,4],难以满足生产需要。此外,其生长缓慢,种子自然态萌发率低。因此,豆腐柴的繁殖和人工栽培尤为重要。关于这类野生药食用植物的人工繁育研究进展缓慢。房江育等[5]、李琳玲等[6]、刘世彪等[7]分别对豆腐柴扦插和水培生根进行了相关试验。程华等[8]、程水源等[9]探讨了植物生长调节剂对豆腐柴愈伤组织诱导的影响。而关于豆腐柴细胞悬浮培养体系构建的研究鲜见报道。本研究通过对豆腐柴疏松愈伤组织诱导和细胞悬浮培养进行研究,分析诱导疏松的、适合进行悬浮培养的豆腐柴愈伤组织的最适培养基及豆腐柴细胞悬浮培养的适宜条件,以期为通过细胞大规模培养生产豆腐柴果胶或次级代谢产物的研究提供参考。
1 材料与方法
1.1 材料
材料采自湖北省罗田县大别山区野生豆腐柴的新鲜植株。
1.2 方法
1.2.1 愈伤组织的诱导 从豆腐柴枝中上部剪取生长健壮、无病、虫害的嫩叶,用流水冲洗后再用去离子水浸泡冲洗干净,置于超净台上无菌风吹干,用70%乙醇消毒30 s,0.1%升汞消毒数分钟,无菌水冲洗5~6次,每次1 min,用无菌滤纸吸干材料表面水分。
将消毒处理好的叶片用解剖刀切成0.5~1.0 cm2的小叶盘,接种于MS+0.4 mg/L 2,4-D+0.8 mg/L 6-BA+3%蔗糖+0.8%琼脂。(24±2) ℃下进行14 h 2 000 lx光照+10 h黑暗培养。
1.2.2 悬浮培养分散细胞制备 分别采取机械分散法和消化分离法分散愈伤组织细胞。
机械分散法:将继代3次的愈伤组织用解剖刀切碎,再用无菌玻璃棒搅拌使其分散,经无菌80目网筛过滤后即为分散培养细胞。
消化分离法:选取生长旺盛,继代3次的愈伤组织约2.0 g,接种于细胞分散培养基MS液体培养基+0.04 mg/mL纤维素酶+0.04 mg/mL果胶酶中,24 ℃,120 r/min悬浮振荡培养2 d后,无菌80目网筛过滤即得分散培养细胞。
1.2.3 细胞悬浮体系优化设计 细胞悬浮培养采取以MS+5%蔗糖+350 mg/L水解酪蛋白为基本培养基,加上不同浓度配比的植物生长调节剂(表1)。用150 mL三角瓶悬浮培养豆腐柴愈伤组织细胞,取每瓶50 mL液体培养基进行接种。
将接种液接种于含有不同激素的MS液体培养基中(表1),置于24 ℃、24 h 2 000 lx光照或24 h黑暗条件下,120 r/min悬浮振荡培养。7 d继代1次,连续继代2~3次,将细胞悬浮培养物用80目镍网过滤,滤液分装后继续培养,作为起始悬浮培养液。每隔3 d取3瓶细胞培养液进行离心(5 000 r/min,10 min)后,于60 ℃烘干,测定细胞干重。
1.2.4 细胞形态观察 用解剖针挑取少量愈伤组织细胞于载玻片上,加一滴醋酸洋红染色液(细胞核染色用I-KI溶液),用镊子将组织捣碎,盖上盖玻片,轻压盖玻片至愈伤组织均匀分散,然后在显微镜下观察并拍照。
1.2.5 悬浮细胞果胶提取及含量测定 用孔径为100目的钢丝筛去掉细胞培养液留下悬浮细胞培养物,冷冻干燥后,用研钵粉碎,倒进50 mL烧杯中,再加入0.1 mol/L HCL 20 mL。微热搅拌30 min后,减压抽滤。滤液用2倍体积的95%乙醇沉淀,所得沉淀物呈透明、泡沫、胶状;将滤液装入分液漏斗进行分离,得到果胶后,使乙醇在空气中自然挥发,至质量恒定后,称重。
1.2.6 悬浮细胞蛋白质提取及含量测定 用孔径为100目的钢丝筛去掉细胞培养液留下悬浮细胞培养物,利用紫外吸收法测定悬浮细胞蛋白质含量。具体方法:用5 mL去离子水研磨成匀浆后,3 000 r/min离心10 min,取上清液1.0 mL于试管中。根据蛋白质浓度,用0.1 mol/mL pH 7.0磷酸缓冲液适当稀释,分别稀释成10倍、20倍和100倍3种样品,用紫外分光光度计分别在280 nm和260 nm波长下测定吸光度,以pH7.0磷酸缓冲液为空白调零。
按照以下公式计算:蛋白质浓度=1.45A280 nm-0.74A260 nm(mg/mL);蛋白質含量=(1.45A280 nm-0.74 A260 nm)n/样品重×100%,式中,A280 nm为溶液在280 nm处的吸光度;A260 nm为溶液在260 nm处的吸光度;n为稀释倍数。
2 结果与分析
2.1 植物生长调节剂对豆腐柴悬浮培养细胞生长的影响
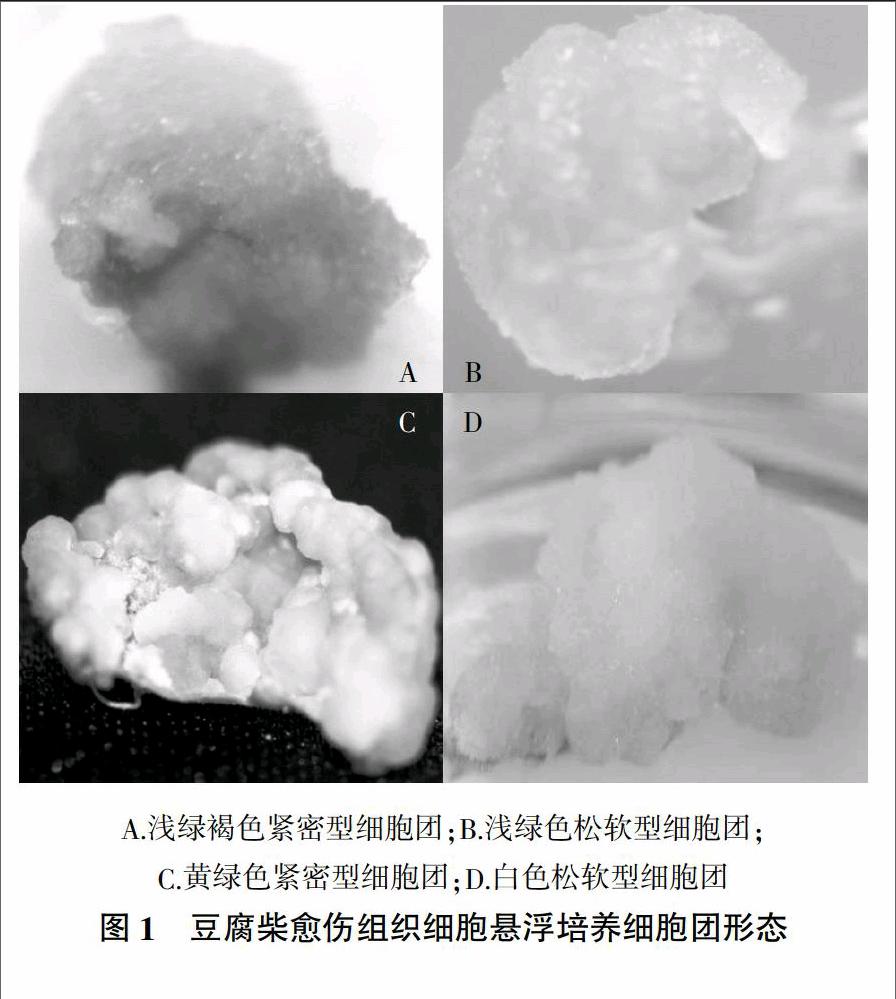
外植体经过诱导培养14 d后,在切口处形成白色或浅绿色愈伤组织。经分散后进行细胞悬浮培养,细胞均能达到较好的增殖。但组织细胞颜色和形态各有差异,主要有4种类型(图1),也有一些过渡类型。
染色后显微镜放大观测,结果(图2)表明,A类细胞多为椭圆形或接近圆形,形状规则、体积较小、细胞核较大、内含物丰富(图2A);B类细胞高度液泡化,有长条形、半月形、圆形等一些不太规则的形状。这类细胞体积大、内含物少,细胞核较小,细胞染色浅,多数不着色(图2B);C类细胞形状规则、体积较小、细胞间联系紧密,压片时不易分散(图2C);D类细胞基本为膨大变形呈长条形细胞或无细胞器的畸变细胞,形状规则的细胞几乎没有(图2D)。
以MS为基本培养基,添加不同浓度的6-BA、KT、2,4-D和NAA,培养基中植物生长调节剂配比组合、培养体系的颜色变化、镜检细胞形态变化见表2。经过比较可以看出,添加2,4-D的培养基悬浮培养得到的豆腐柴细胞内含物较多,加NAA的培养基悬浮培养得到得细胞多变形或死亡,分裂成碎片,另外,培养基中加6-BA的效果普遍要比KT好。
2.2 细胞分散程度对悬浮培养的影响
愈伤组织细胞分散方法对细胞悬浮培养体系有一定影响。图3是通过机械分散法处理愈伤组织后细胞培养产物状况,培养体系中较浑浊(图3A),细胞团大小不均一,镜检会看到溶液中有较多死细胞,但容易产生较大的细胞团,且细胞团中易分化出胚性体细胞(图3B)。利用纤维素果胶酶分散细胞后悬浮培养细胞体系,静置后培养液较清澈,细胞团大小较均一,培养后期亦会出现较大颗粒的胚性细胞。
2.3 光照条件对愈伤组织的诱导、继代培养和生长状况的影响
将豆腐柴的叶接种于相同的愈伤组织诱导培养基中,分别置于黑暗和12 h/d、2 000 lx光照条件下进行培养。结果发现,2种培养条件下的外植体产生愈伤组织的时间和诱导愈伤组织的出愈率基本相同,但愈伤组织的状态有较大差异。光培养的愈伤组织呈翠绿色、质地紧密,继代后愈伤组织生长缓慢;暗培养条件下愈伤组织呈白色,较易褐变,愈伤组织生长疏松,继代后生长较快。因此,豆腐柴愈伤组织的诱导和继代培养宜在暗培养下进行。
由于培养基中所加激素的不同,悬浮细胞培养液状态和细胞鲜重增加量也不相同(表3)。结果显示,愈伤组织分散程度越好,越有利于悬浮细胞系的建立,后期细胞增殖越明显;悬浮培养的最佳培养基是MS+0.4 mg/L 2,4-D+0.8 mg/L KT,其悬浮培养细胞鲜重增加量平均每7 d可达6.46倍。
2.4 悬浮细胞果胶和蛋白质含量
将外植体诱导培养14 d后的豆腐柴愈伤组织细胞,经纤维素酶和果胶酶处理后,置于经上述最佳悬浮培养基MS+0.4 mg/L 2,4-D+0.8 mg/L KT中,24 h黑暗条件,120 r/min悬浮振荡培养21 d后,测定细胞果胶和蛋白质含量。结果(表4)表明,培养细胞中果胶平均含量达6.57%,蛋白质达到0.12%,远比豆腐柴天然叶片中含量低。
3 小结
结果表明,豆腐柴叶片诱导的疏松型愈伤组织细胞,经过0.04 mg/mL纤维素酶+0.04 mg/mL果胶酶处理后可以得到较好的分散培养细胞,在最佳液体培养基MS+0.4 mg/L 2,4-D+0.8 mg/L KT中, 24 h黑暗条件,120 r/min悬浮振荡培养,大约7 d后即可得到较好的悬浮细胞系。虽然致密型愈伤组织块,经酶处理后也可以得到分散细胞,但由于后期培养系中细胞碎片较多,不利于悬浮细胞的增殖。初步测定比较了在最佳悬浮培养条件下,豆腐柴愈伤组织细胞和叶片中果胶和蛋白质含量差异,结果显示,豆腐柴悬浮培养的细胞中,主要的营养成分果胶和蛋白质远远低于叶片组织。后期需要对基本培养基配方、蔗糖浓度、前体物添加等因素进一步优化。
应用细胞悬浮培养技术,促成细胞增殖和细胞内营养成分的合成,进行工厂化生产,可缓解当前豆腐柴资源匮乏的困境;而且大量的研究也表明,相对于组织诱导培养,细胞悬浮培养更容易产生胚性细胞,进而促成植株再生,这也为将来克服豆腐柴自然状态下胚发育不足,种子难以繁殖等问题奠定前期基础[10,11]。虽然本研究中细胞增长量及果胶等成分均较低,但后期通过对培养技术体系进行优化,可为豆腐柴细胞工厂化扩大培养及有效成分提取提供理论依据。
参考文献:
[1] 中国科学院植物所.中国高等植物图鉴[M].北京:科学出版社,1985.
[2] 張 弛,吴永尧,彭振坤,等.豆腐柴中有效成分复合分离提取研究[J].食品科学,2005,26(8):234-241.
[3] 王 燕,许 峰,张风霞,等.豆腐柴研究进展[J].中国野生植物资源,2007,26(4):12-14.
[4] 高贵珍,曹稳根,蔡 红,等.野生豆腐柴叶营养成分分析及评价[J].植物资源与环境学报,2003,12(1):60-61.
[5] 房江育,王世强,方建新,等.冬季豆腐柴水培诱导不定根[J].中国农学通报,2008,24(11):244-246.
[6] 李琳玲,曹晓娟,程 华,等.豆腐柴枝条水培生根的研究[J].湖北农业科学,2010,49(1):123-126.
[7] 刘世彪,朱杰英,李国民,等.豆腐柴及其开发利用初步研究[J]. 中国野生植物资源,2001,20(4):11-12,34.
[8] 程 华,李琳玲,姜德志,等.植物生长调节剂对豆腐柴愈伤组织诱导的影响[J].北方园艺,2011(18):126-128.
[9] 程水源,程 华,李琳玲,等.豆腐柴的胚状体诱导分化研究[J]. 黄冈师范学院学报,2013,33(3):32-35.
[10] 戴梓茹,黎继烈.激素对植物细胞悬浮培养代谢产物的影响研究进展[J].中国生物工程杂志,2007,27(6):118-122.
[11] 边黎明,施季森.植物生物反应器细胞悬浮培养研究进展[J].南京林业大学学报(自然科学版),2004,28(4):101-104.
