鲤鱼g型溶菌酶基因的cDNA克隆及其在毕赤酵母中的表达
2017-03-08李雯,陶妍
李 雯, 陶 妍
(上海海洋大学食品学院/上海水产品加工及贮藏工程技术研究中心,上海 201306)
鲤鱼g型溶菌酶基因的cDNA克隆及其在毕赤酵母中的表达
李 雯, 陶 妍
(上海海洋大学食品学院/上海水产品加工及贮藏工程技术研究中心,上海 201306)
从鲤鱼鳃组织中分离克隆到一种新的g型溶菌酶同工型基因(CLYG).该基因的全长cDNA为558 bp,除去终止密码子,编码185个氨基酸,推断的氨基酸序列没有信号肽,含3个催化位点(谷氨酸73、脯氨酸86和天冬氨酸97),具有鱼类g型溶菌酶的基本特征.通过PCR方法在CLYG基因的5′和3′端分别引入XhoⅠ和XbaⅠ酶切位点.扩增到的目的片段与表达载体pPICZαA连接构建重组表达载体pPICZαA-CLYG后,电转至毕赤酵母X-33,筛选得到的阳性转化子在1.0%甲醇、29 ℃、pH 6.0的条件下诱导表达72 h,获得重组体CLYG.SDS-PAGE和蛋白质印迹分析显示,在毕赤酵母中成功表达了重组体CLYG.
鲤鱼; g型溶菌酶; 毕赤酵母; 重组表达
溶菌酶(EC 3.2.1.17)是一类能水解肽聚糖N-乙酰胞壁酸(NAM)与N-乙酰氨基葡萄糖(NAG)之间的β-1,4-糖苷键的酶的总称,又称为胞壁质酶,1921年,由苏格兰生物学家Fleming发现[1].溶菌酶是机体重要的先天性免疫物质,参与水解细菌的细胞壁,具有抑制外源微生物生长的作用;同时,它也是一种理想的蛋白研究模型,在蛋白质化学、酶学、结晶学、光谱学、免疫学和分子生物学等研究领域都起到重要作用[2].根据生物来源和作用机制,可以将溶菌酶分为动物源溶菌酶、植物源溶菌酶、微生物源溶菌酶和噬菌体T4溶菌酶.其中,动物源溶菌酶又可以分为c型、g型和i型.3种动物源溶菌酶在氨基酸序列、催化机制和酶的性质等方面存在很大差异,但它们具有相似的三维结构和功能.
1967年,Canfield和McMurry第一次在鹅蛋清中发现并纯化得到g型溶菌酶[3].自2001年Hikima et al[4]在牙鲆(Paralichthysolivaceus)中发现了g型溶菌酶之后,目前已在6个目12种鱼中发现g型溶菌酶[5];团头鲂(Megahbramaamblycephala)和斑点叉尾鮰(Ictaluruspunctatus)等多种鱼类的g型溶菌酶基因已被克隆[6-15].然而,迄今为止关于鱼类g型溶菌酶的重组DNA表达方面的研究报道甚少.2003年,Savan et al[16]从鲤鱼(Cyprinuscarpio)头肾中分离到一种g型溶菌酶的全长cDNA,从推断的氨基酸序列发现它与大多数鱼类及鸟类和哺乳类的g型溶菌酶在3个保守的催化残基位点(谷氨酸73、天冬氨酸86和天冬氨酸97)存在一些差异,即脯氨酸86替代了天冬氨酸86,这个关键位点的不同对g型溶菌酶的结构和功能有何影响需要在蛋白质水平上进行研究.据此,本试验参考鲤鱼g型溶菌酶(common carp g-type lysozyme, CLYG)的cDNA序列设计引物,首先通过RT-PCR从鲤鱼鳃组织中获得编码g型溶菌酶的全长cDNA,并与已知的参考序列比较,然后构建毕赤酵母(Pichiapastoris)真核重组表达系统,旨在实现CLYG的重组DNA表达,为进一步研究其结构与功能的关系提供参考.
1 材料与方法
1.1 材料
1.1.1 动物材料、菌株和质粒 鲤鱼(体重0.1 kg)来源于上海海洋大学水产与生命学院鱼类养殖实验室.毕赤酵母X-33、表达载体pPICZαA和博来霉素购自Invitrogen公司(美国).克隆质粒pMD19-T simple购自TaKaRa公司(日本).大肠杆菌(Escherichiacoli) DH5α由本实验室保存.
1.1.2 主要试剂 RNA提取试剂盒(RNAisoTMPlus)、第一链cDNA合成试剂盒(PrimeScriptTM1st Strand cDNA Synthesis Kit)和限制性内切酶XhoⅠ、XbaⅠ、SacⅠ以及T4DNA连接酶购自TaKaRa公司(日本).胰蛋白胨和酵母粉购自OXOID公司(英国).DNA割胶回收试剂盒、质粒提取试剂盒、酵母DNA提取试剂盒、DNA分子质量标准、蛋白质分子质量标准和PCR反应试剂购自天根生化科技有限公司(北京).抗His标签鼠单克隆抗体和辣根过氧化物酶标记山羊抗小鼠IgG购自北京康为世纪生物科技有限公司(北京).彩虹预染超低分子质量蛋白质标准购自中科瑞泰生物科技有限公司(北京).其他试剂均为国产分析纯试剂.
1.2 方法
1.2.1 总RNA的提取和第一链cDNA 的合成 鲜活鱼运至实验室后,立即用钝器击毙,取其鳃组织提取总RNA.采用RNAisoTMPlus试剂,按照使用说明书对鲤鱼鳃组织进行总RNA的提取.第一股cDNA的合成按照PrimeScriptTM1st Strand cDNA Synthesis Kit使用说明书进行.反应体系为:6 μL总RNA、1 μL oligo dT Primer (50 μmol·L-1)、2 μL ddH2O、1 μL dNTP mixture (10 mmol·L-1each).于65 ℃保温5 min后迅速在冰上冷却,再依次加入4 μL 5×Prime Script Buffer、0.5 μL PNase Inhibitor (40 U·μL-1)和1 μL Prime Script RTase (200 U·μL-1),缓慢混匀后,于42 ℃保温60 min,最后于95 ℃保温5 min,冰上冷却后得到第一链cDNA.
1.2.2 g型溶菌酶基因的cDNA克隆 以鲤鱼鳃组织的第一链cDNA为模板,参考CLYG基因序列(GenBank登录号:AB084624)设计引物LYG-p1和LYG-p2(表1),对编码g型溶菌酶的cDNA进行PCR扩增.PCR反应体系:LYG-p1和LYG-p2 (10 μmol·L-1) 各0.8 μL、2.0 μL 10×PCR Buffer、1.6 μL dNTPs (2.5 mmol·L-1)、0.2 μLTaqDNA聚合酶(2.5 U·μL-1)、0.2 μL第一链cDNA,用无菌水将反应液调至20 μL.PCR 反应条件:94 ℃预变性3 min、94 ℃变性40 s、54 ℃退火30 s、72 ℃延伸60 s、72 ℃终延伸5 min,保温10 min,反应进行30个循环.

表1 引物序列Table 1 Sequences of primers
采用DNA纯化试剂盒纯化上述片段;以此片段为模板,根据巢式PCR原理,使用分别添加XhoⅠ、XbaⅠ酶切位点和6×His标签的LYG-p3、LYG-p4、LYG-p5引物(表1)进行PCR扩增,除了退火温度改为58.4 ℃外,反应体系和条件基本与上述的体系和条件相同.纯化后的目的片段CLYG基因与pMD-19T simple质粒连接、转化大肠杆菌DH5α感受态细胞,于37 ℃培养过夜;经菌落PCR鉴定后,挑选阳性克隆由上海生物工程有限公司进行DNA测序.
1.2.3 序列分析及分子系统树的构建 采用SignalP 4.1在线软件 (http://www.cbs.dtu.dk/services/SignalP/)预测信号肽;采用ExPASy在线软件(http://web.expasy.org/compute_pi/)预测蛋白质分子质量和等电点;采用BioEdit version7.0.9软件进行多重序列比较;采用MEGA6临位相联法构建分子系统树.
1.2.4 重组表达载体pPICZαA-CLYG的构建及对毕赤酵母X-33的转化 用XhoⅠ和XbaⅠ对pMD-19T-CLYG进行消化,经琼脂糖凝胶电泳后,割胶回收目的片段CLYG基因,将其与用同样酶处理过的表达载体pPICZαA连接,转化至大肠杆菌DH5α感受态细胞.通过菌落PCR、双酶切和DNA测序鉴定pPICZαA-CLYG.
用SacⅠ对重组表达载体pPICZαA-CLYG进行处理后,以1∶8的体积比与毕赤酵母X-33感受态细胞混合,转入预冷的电极间距为0.2 cm的电转杯中,冰浴5 min,电击(2 kV、25 μF、200 Ω)后立即加入1 mL预冷的1 mol·L-1山梨醇,离心后菌体涂布于含100 μg·mL-1博来霉素的酵母蛋白胨葡萄糖山梨醇培养基(YPDS)平板,29 ℃下孵育至单克隆产生.挑选60个单克隆分别接种于最小甲醇培养基(MM)、最小甘油培养基(MD)、不含博来霉素的酵母蛋白胨葡萄糖培养基(YPD)和含1 000 μg·mL-1博来霉素的酵母蛋白胨葡萄糖培养基平板,筛选得到甲醇利用快速型高拷贝酵母转化子.提取转化子的基因组DNA作为模板,用pPICZαA上的通用引物5′AOX1和3′AOX1以及LYG-p3和LYG-p5引物进行PCR鉴定.
1.2.5 CLYG的诱导表达及其蛋白质印迹分析 将酵母转化子接种于25 mL缓冲复合甘油培养基(BMGY)中,于29 ℃、250 r·min-1、pH 6.0的条件下培养至D600 nm为3.0~6.0,于6 000 r·min-1离心5 min收集菌体,重悬于100 mL缓冲复合甲醇培养基(BMMY)中,调节D600 nm至1.0;于29 ℃、250 r·min-1、pH 6.0的条件下培养72 h[17].离心收集培养液上清,用于SDS-PAGE分析(分离胶浓度12%).另外,将SDS-PAGE胶上的蛋白质条带电转至硝酸纤维膜后,与封闭液反应1 h;洗去封闭液后与一抗(抗His标签鼠单克隆抗体)在室温下孵育2 h;洗去一抗后,加入二抗(辣根过氧化物酶标记山羊抗小鼠IgG)室温反应1 h;洗去二抗后用DAB显色[18].
2 结果与分析
2.1 CLYG的cDNA克隆及其与其他生物之间一级结构的比较
以鲤鱼鳃组织的第一链cDNA为模板,使用LYG-p1和LYG-p2为引物,第1次PCR扩增得到574 bp的片段(图1A);除去引物序列和终止密码子,g型溶菌酶的全长cDNA为555 bp,编码185个氨基酸残基(图2).该cDNA序列提交至GenBank,序列号为KT454836.经软件预测,g型溶菌酶的分子质量20.5 ku,等电点9.35,未检测到信号肽序列,只含一个半胱氨酸残基,包含了3个催化位点——甘氨酸73、脯氨酸86和天冬氨酸97(图2).
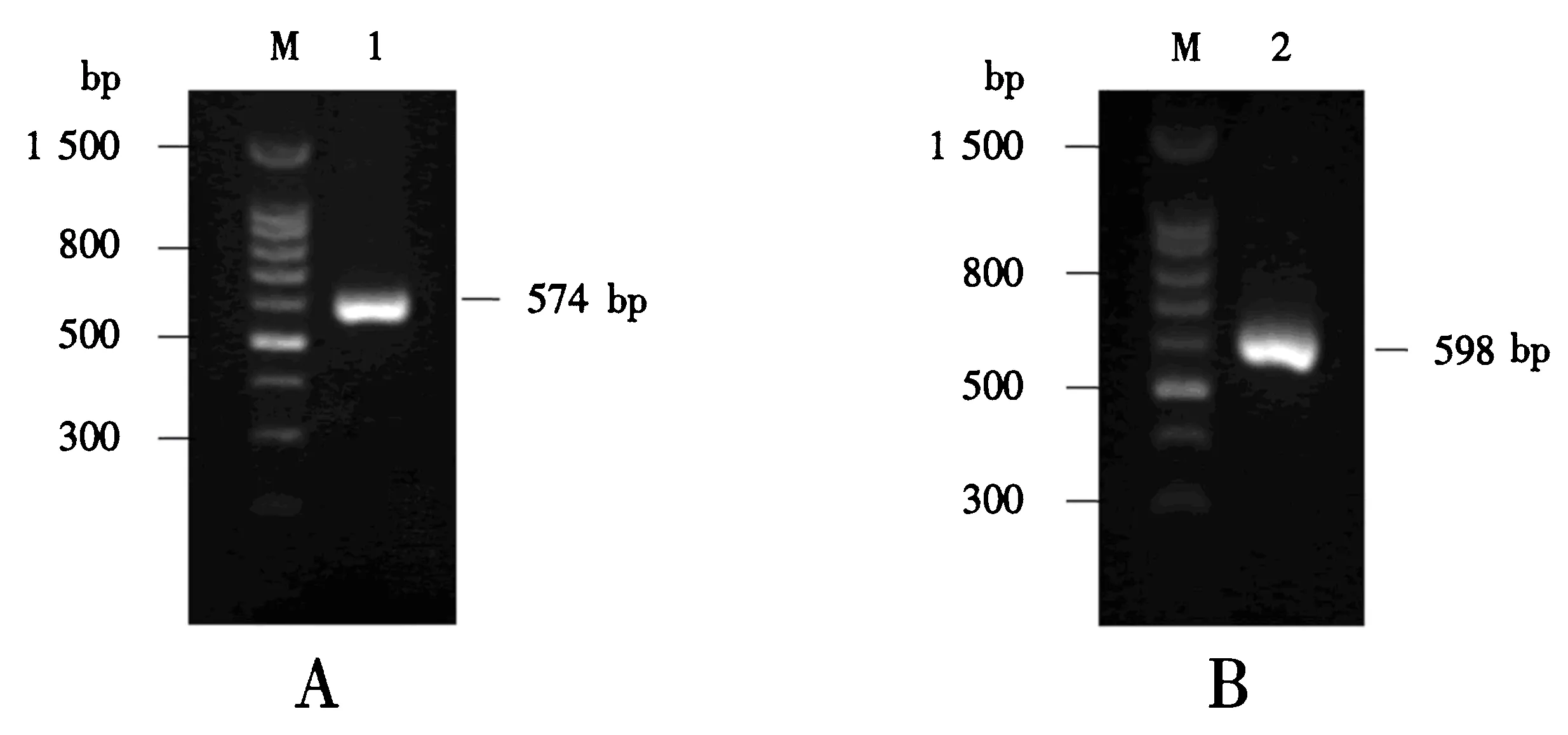
M:100 bp DNA分子质量标准;1:第1次PCR扩增产物;2:第2次PCR扩增产物.图1 CLYG基因的PCR 扩增(A)及添加酶切位点和6×His标签的PCR 扩增(B)Fig.1 PCR amplification of CLYG (A) and PCR amplification for adding restriction sites and 6×His tag (B)

斜体表示XhoⅠ和XbaⅠ酶切位点;下划线表示6×His标签;黑色方框表示Kex2识别位点;阴影表示3个催化位点;*表示终止密码子.图2 用于连接至pPICZαA的目的片段的核苷酸及推断的氨基酸序列Fig.2 Nucleotide and deduced amino acid sequences of the target fragment ligated with pPICZαA
进一步以上述片段为模板,使用LYG-p3和LYG-p4为引物,第2次PCR扩增得到5′端含XhoⅠ位点和3′端含XbaⅠ位点及6×His标签的598 bp的片段“CLYG”基因(图1B).该片段经克隆和DNA测序,证明了两个酶切位点和6×His标签被成功引入.
使用CLUSTALW程序将CLYG的氨基酸序列与其他生物进行多重比对(图3),发现鲤鱼鳃组织中的g型溶菌酶(CyprinuscarpioⅡ型)与鲤鱼头肾组织中的g型溶菌酶(CyprinuscarpioⅠ型)的同源性最高(95.7%),与其他鱼类g型溶菌酶的同源性为50.3%~75.1%,但与人类g型溶菌酶的同源性仅为41.8%.所有用作比对的氨基酸序列中均有比较保守的3个催化位点,但两种CLYG的第2个催化位点是脯氨酸而不是像大多数g型溶菌酶所显示的天冬氨酸(图3).
2.2 基于鲤鱼和其他生物g型溶菌酶氨基酸序列的分子系统树
采用临位相联法构建分子系统树,各结点的置信度由自引导值估计,重复次数1 000.由图4可见,根据不同生物的g型溶菌酶氨基酸序列构建的分子系统树可分为3大组,分别为鱼类组、鸟类组和哺乳类组.其中,鱼类组又可分为两个亚组.可以发现,同为鲤科的鲤鱼和草鱼聚在一枝,显示了更近的亲缘关系.该分子系统树的分析结果与氨基酸序列多重比对的结果是一致的.
2.3 重组表达载体pPICZαA-CLYG的构建及其鉴定
将CLYG基因与pPICZαA连接得到重组表达载体pPICZαA-CLYG(图5).以载体的通用引物5′AOX1和3′AOX1进行菌落PCR鉴定,3个泳道都在理论分子质量位置1 099 bp处有明显条带(图6A);此外,使用XhoⅠ和XbaⅠ对pPICZαA-CLYG进行双酶切,在598 bp处有明显条带,与理论分子质量相符(图6B).DNA测序结果亦证明目的片段CLYG基因已成功连接至表达载体pPICZαA中.
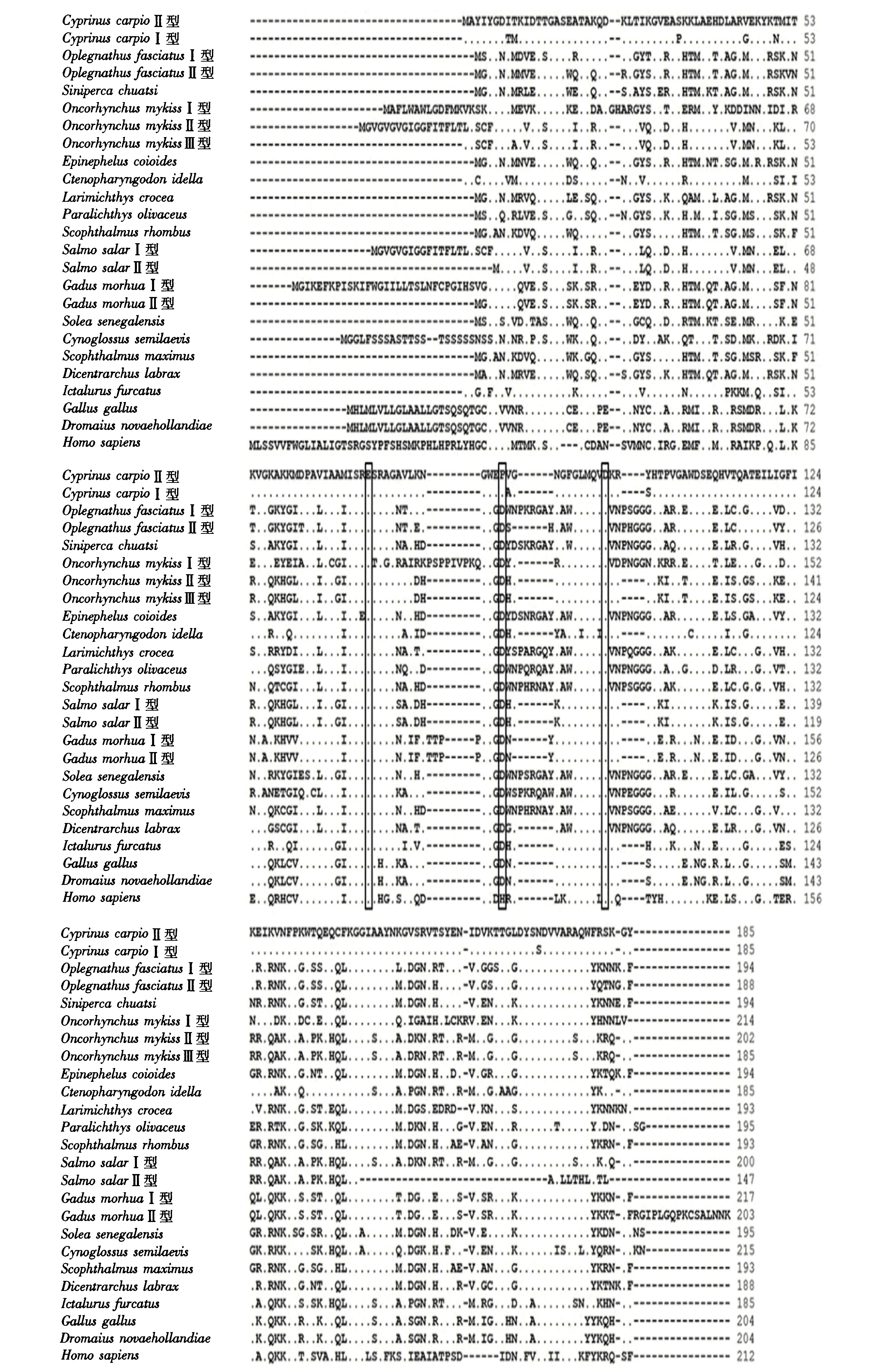
黑色方框表示3个催化位点.图3 鲤鱼与其他脊椎动物之间g型溶菌酶氨基酸序列的多重比较Fig.3 Comparison of g-type lysozyme amino acid sequences between common carp and other vertebrates
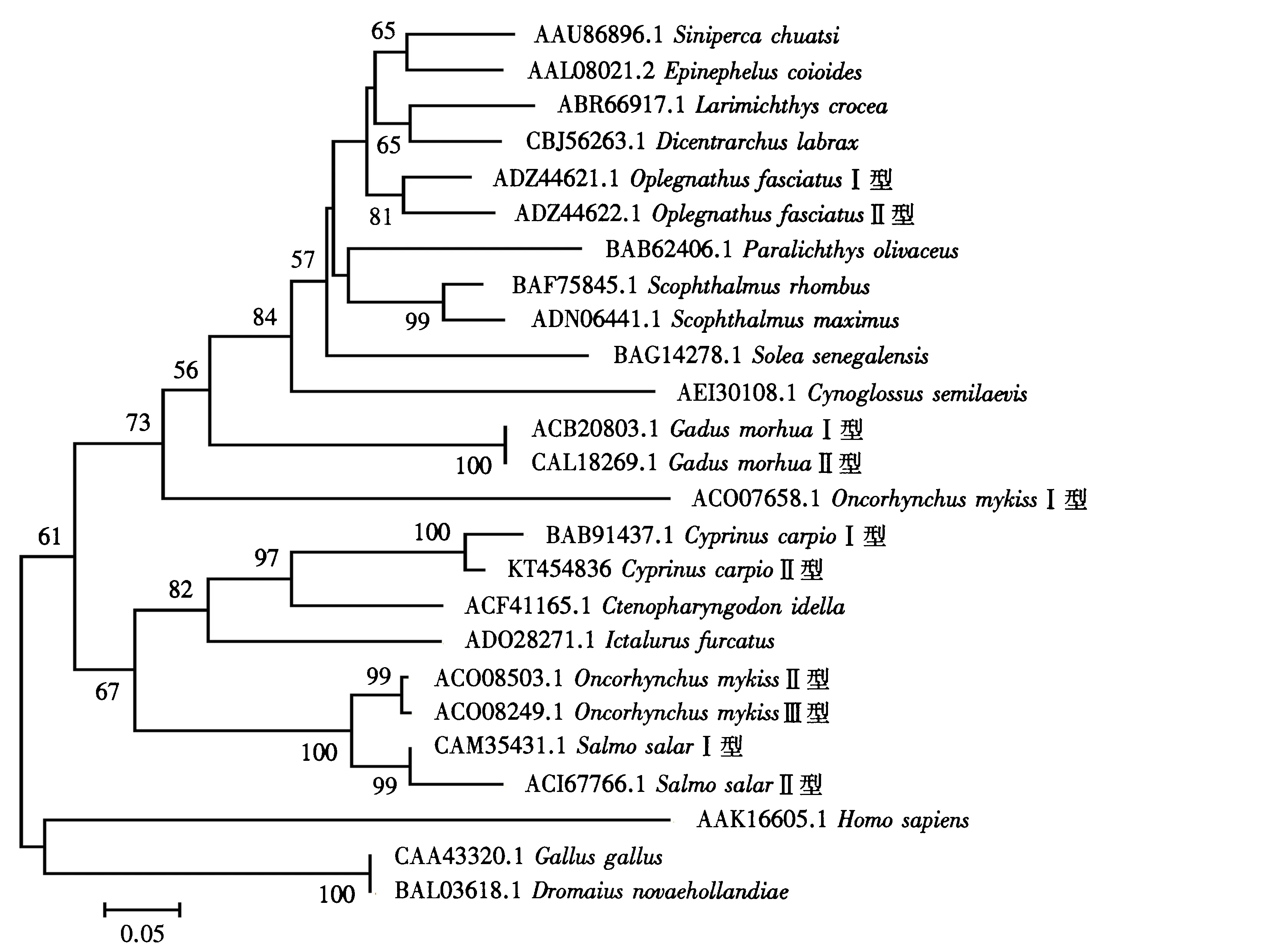
图4 基于不同动物来源的g型溶菌酶氨基酸序列构建的分子系统树Fig.4 Molecular phylogenetic tree based on amino acid sequences of g-type lysozymes from different animals
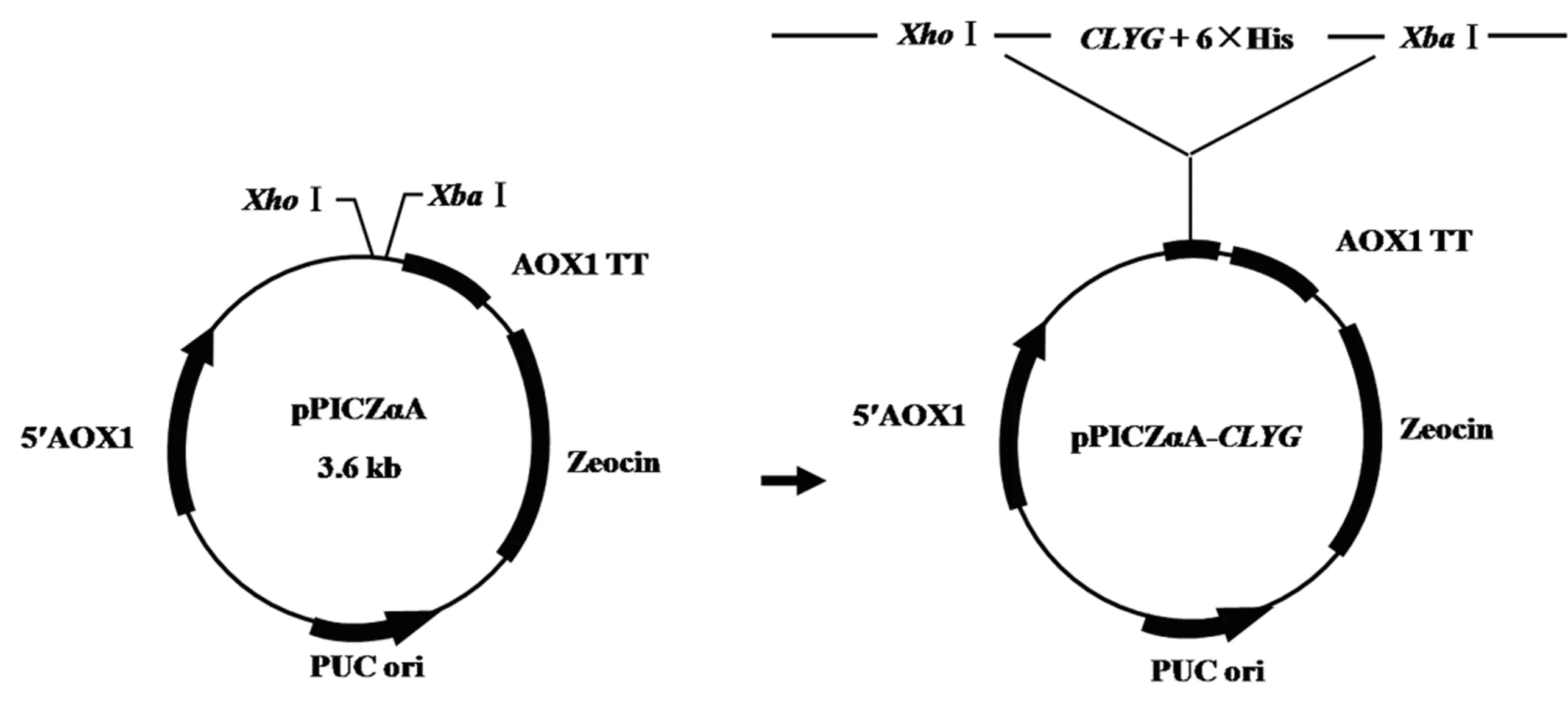
图5 重组表达载体pPICZαA-CLYG的构建Fig.5 Construction of recombinant expression vector pPICZαA-CLYG
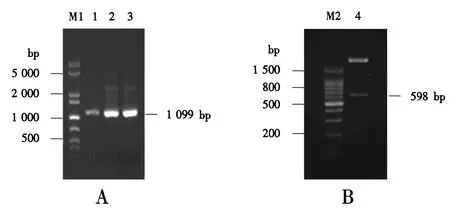
M1:1 000 bp plus DNA分子质量标准;1~3:PCR扩增产物;M2:100 bp DNA分子质量标准;4:双酶切产物.图6 重组表达载体pPICZαA-CLYG的菌落PCR(A)和双酶切鉴定(B)Fig.6 Identification of the recombinant expression vector pPICZαA-CLYG by colony PCR (A) and restriction endonuclease digestion (B)
2.4 高拷贝酵母转化子的筛选及其在毕赤酵母X-33中表达的目的蛋白
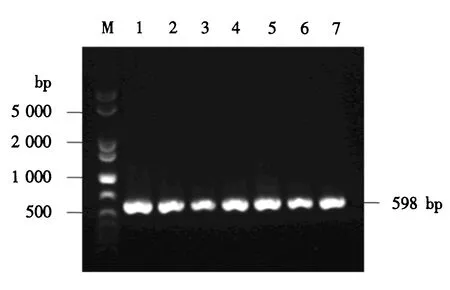
M:1 000 bp plus DNA分子质量标准;1~7:含pPICZαA-CLYG的酵母转化子.图7 酵母转化子的PCR鉴定Fig.7 PCR identification for the yeast transformants
上述重组表达载体pPICZαA-CLYG经线性化后电转至毕赤酵母X-33中,通过博来霉素筛选和甲醇利用速度筛选,获得7株长势良好的转化子.以酵母基因组DNA为模板,以载体的通用引物5′AOX1和3′AOX1进行PCR扩增,电泳结果显示在2 200和1 009 bp处有明显的条带,前者为毕赤酵母X-33中因存在醇氧化酶基因AOX1自身的引物结合位点而扩增的条带,后者为含目的基因的扩增条带(结果未显示).又以引物LYG-p3和LYG-p5进行PCR扩增,电泳结果显示了一个598 bp的明显条带,与理论值相符(图7).
选取3株经PCR鉴定的阳性酵母转化子,经1.0%甲醇诱导表达72 h,离心后的上清经透析浓缩后用于SDS-PAGE分析.结果显示,3和4号菌的培养液上清在21.3 ku处有明显的目的条带,2号菌的培养液上清显示的条带不明显;但1号菌(含pPICZαA的酵母转化子,作为阴性对照)的培养液上清并未发现相应的目的条带(图8).
2.5 重组蛋白CLYG的蛋白质印迹分析
由图9可见,1号阴性对照无条带,但3和4号泳道显示清晰的条带,与图8中的条带相对应,证明3和4号菌的上清中含有能被抗His标签的鼠单克隆抗体结合的带有6×His标签的CLYG.蛋白质印迹分析进一步证明了目的蛋白在毕赤酵母中的表达.
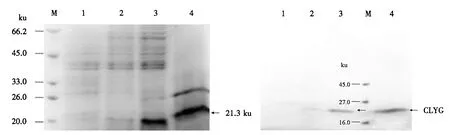
M:蛋白质分子质量标准;1:含pPICZαA的酵母转化子的培养液上清;2~4:含pPICZαA-CLYG的酵母转化子的培养液上清.图8 培养液上清的SDS-PAGE分析Fig.8 SDS-PAGE analysis for supernatants from culture solutions
3 讨论
虽然在上世纪就已经开始了对溶菌酶的研究,但关于鱼类溶菌酶的研究基本上处于起步阶段.本试验在鲤鱼的鳃组织中发现了一种新的g型溶菌酶同工型,这种在同一种鱼中存在多种g型溶菌酶同工型的现象在一些硬骨鱼类中已被报道.如在点带石斑鱼(Epinepheluscoioides)、大西洋鲑鱼(Salmosalar)和大西洋鳕鱼(Gadusmorhua)中都发现了2种g型溶菌酶同工型[8,11-12];在斑点叉尾鮰和虹鳟(Oncorhynchusmykiss)中发现有3种g型溶菌酶同工型[7].鱼体内存在多种g型溶菌酶同工型可能有助于其更好地抵御水域环境中的病原微生物侵染.相比于哺乳类和鸟类,鱼类g型溶菌酶在组织中的分布更广泛且表达量高[6-16].
本试验发现的CLYG在N端没有信号肽,含3个催化位点,只有1个半胱氨酸残基,与大多数鱼类g型溶菌酶相似,但第2个催化位点是脯氨酸86(图2),而不是大多数脊椎动物g型溶菌酶所显示的天冬氨酸86.研究表明,第1个催化位点(谷氨酸)对g型溶菌酶的催化活性和结构稳定性是必需的,而第2(天冬氨酸)和3个催化位点(天冬氨酸)也参与催化作用,但第3个更重要[19].就脯氨酸而言,它是一种亚氨基酸,可能对蛋白质的二级结构和功能产生较大的影响,这也是本试验克隆分离到这种新的CLYG基因后对其进行真核表达的原因之一.
本试验通过构建毕赤酵母表达系统,在29 ℃、pH 6.0的条件下采用1.0%甲醇诱导表达72 h,获得了重组体CLYG.进一步的研究将考虑对该g型溶菌酶CLYG进行纯化,并研究其抑菌活性和抑菌谱.
[1] CALLEWAERT L, MICHIELS C W. Lysozymes in the animal kingdom [J]. Journal of Biosciences, 2010,35(1):127-160.
[2] 张士璀,许娜.动物型溶菌酶研究新进展[J].中国海洋大学学报(自然科学版),2014,44(6):46-51.
[3] CANFIELD R E, SUSAN M. Purification and characterization of a lysozyme from goose egg white [J]. Biochemical and Biophysical Research Communications, 1967,26(1):38-42.
[4] HIKIMA J, MINAGAWA S, HIRONO I, et al. Molecular cloning, expression and evolution of the Japanese flounder goose-type lysozyme gene, and the lytic activity of its recombinant protein [J]. Biochimica Et Biophysica Acta, 2001,1 520(1):35-44.
[5] WHANGA L, LEE Y, LEE S, et al. Characterization and expression analysis of a goose-type lysozyme from the rock breamOplegnathusfasciatus, and antimicrobial activity of its recombinant protein [J]. Fish & Shellfish Immunology, 2011,30(2):532-542.
[6] 章琼,孙盛明,李冰,等.团头鲂g型溶菌酶基因全长cDNA的克隆与表达分析[J].南方水产科学,2015,11(2):41-49.
[7] WANG R, FENG J, LI C, et al. Four lysozymes (one c-type and three g-type) in catfish are drastically but differentially induced after bacterial infection [J]. Fish & Shellfish Immunology, 2013,35(1):136-145.
[8] WEI S, HUANG Y, HUANG X H, et al. Molecular cloning and characterization of a new G-type lysozyme gene (Ec-lysG) in orange-spotted grouper,Epinepheluscoioides[J]. Developmental & Comparative Immunology, 2014,46:401-412.
[9] SUN B J, WANG G L, XIE H X, et al. Gene structure of goose-type lysozyme in the mandarin fishSinipercachuatsiwith analysis on the lytic activity of its recombinant inEscherichiacoli[J]. Aquaculture, 2006,252(2-4):106-113.
[10] ZHENG W B, TIAN C, CHEN X H. Molecular characterization of goose-type lysozyme homologue of large yellow croaker and its involvement in immune response induced by trivalent bacterial vaccine as an acute-phase protein [J]. Immunology Letters, 2007,113(2):107-116.
[11] KYOMUHENDO P, MYRNES B, NILSEN I W. A cold-active salmon goose-type lysozyme with high heat tolerance [J]. Cellular & Molecular Life Sciences, 2007,64(21):2 841-2 847.
[12] LARSEN A N, SOLSTAD T, SVINENG G, et al. Molecular characterisation of a goose-type lysozyme gene in Atlantic cod (GadusmorhuaL.) [J]. Fish & Shellfish Immunology, 2009,26(1):122-132.
[13] YE X, ZHANG L, TIAN Y, et al. Identification and expression analysis of the g-type and c-type lysozymes in grass carpCtenopharyngodonidellus[J]. Developmental & Comparative Immunology, 2010,34(5):501-509.
[14] SHA Z X, WANG Q L, LIU Y, et al. Identification and expression analysis of goose-type lysozyme in half-smooth tongue sole (Cynoglossussemilaevis) [J]. Fish & Shellfish Immunology, 2012,32(5):914-921.
[15] MARIAN P, EMILIO S L, ANA G C, et al. Genomic characterization, phylogeny and gene regulation of g-type lysozyme in sole (Soleasenegalensis) [J]. Fish & Shellfish Immunology, 2011,31(6):925-937.
[16] SAVAN R, AMAN A, SAKAI M. Molecular cloning of G type lysozyme cDNA in common carp (CyprinuscarpioL.) [J]. Fish & Shellfish Immunology, 2003,15(3):263-268.
[17] 宋长丰,陶妍,赵冬梅,等.斑点叉尾鮰铁调素成熟肽在毕赤酵母中的表达及其抑菌活性[J].农业生物技术学报,2015,23(3):380-387.
[18] 文雅,陶妍.尼罗罗非鱼Hepcidin抗菌肽在大肠杆菌中的融合表达及其抗菌活性[J].上海交通大学学报(农业科学版),2012,30(4):68-75.
[19] HELLAND R, LARSEN R L, FINSTAD S, et al. Crystal structures of g-type lysozyme from Atlantic cod shed new light on substrate binding and the catalytic mechanism [J]. Cellular & Molecular Life Sciences, 2009,66(15):2 585-2 598.
(责任编辑:施晓棠)
cDNA cloning of g-type lysozyme gene from common carp and its expression inPichiapastoris
LI Wen, TAO Yan
(College of Food Science and Technology, Shanghai Ocean University/Shanghai Engineering Research Center of Aquatic-Product Processing & Preservation, Shanghai 201306, China)
G-type lysozyme plays an important role in fish′s immune response against microbial invasion. In the present study, a new g-type lysozyme isoform gene (CLYG) was separated from common carp (Cyprinuscarpio) gill. The full-length cDNA ofCLYGis 558 bp, which encodes 185 amino acid residues. The amino acid sequence deduced from the cDNA ofCLYGcontains 3 catalytic residues (Glu73, Pro86 and Asp97) without any signal peptide, which is similar to those of other teleost species. Subsequently,XhoⅠ andXbaⅠ restriction sites were added to the 5′ and 3′ ends ofCLYGgene by PCR, respectively. After that, the expected fragment was ligated with expression vector pPICZαA, and followed by being transformed into competentPichiapastorisX-33 cells. Then recombinant CLYG was induced in 1.0% methanol under pH 6.0 at 29 ℃ for 72 h. SDS-PAGE analysis and Western blot analysis demonstrated that the recombinant CLYG was successfully expressed.
common carp; g-type lysozyme;Pichiapastoris; recombinant expression
2015-12-22
2016-04-01
上海市教育委员会产学研项目(15CXY30);农业部都市农业(南方)重点实验室开放项目(UA201307);上海市交叉学科研究生拔尖创新人才培养平台项目(B5201120040);上海市2015高校内涵建设项目(A2018150009).
李雯(1992-),女,硕士研究生.研究方向:水产生物分子生物学.Email:fenzhongbahe@outlook.com.通讯作者陶妍(1961-),女,教授.研究方向:水产生物分子生物学.Email:ytao@shou.edu.cn.
Q785
A
1671-5470(2017)01-0081-08
10.13323/j.cnki.j.fafu(nat.sci.).2017.01.013
