与黄麻炭疽病抗性相关的SSR分子标记筛选及新型SNP标记开发
2017-03-07陶爱芬谢丽丽祁建民方平平林荔辉徐建堂张立武林培清
陶爱芬, 谢丽丽, 祁建民, 方平平, 林荔辉, 徐建堂, 张立武, 林培清
(福建农林大学教育部作物遗传育种与综合利用重点实验室/福建省分子设计育种实验室,福建,福州 350002)
与黄麻炭疽病抗性相关的SSR分子标记筛选及新型SNP标记开发
陶爱芬, 谢丽丽, 祁建民, 方平平, 林荔辉, 徐建堂, 张立武, 林培清
(福建农林大学教育部作物遗传育种与综合利用重点实验室/福建省分子设计育种实验室,福建,福州 350002)
为筛选出与黄麻炭疽病抗性相关的新型分子标记,本研究在前期黄麻炭疽病抗性QTL定位结果的基础上,开发出7对可能与黄麻炭疽病抗性基因连锁的新型SNP标记.同时,在前期对重组自交系群体进行田间炭疽病抗性鉴定的基础上,分别以6个抗病株系和6个感病株系的基因组DNA构建了抗池和感池.以抗、感池的DNA为模板,对36对SSR引物和7对SNP引物进行了多态性筛选,从中初步筛选出具有多态性的SSR引物15对,SNP引物2对.继而,分别以12份抗病和感病株系的基因组DNA为模板,对上述具有多态性的SSR和SNP引物进行进一步验证,最终获得1对与黄麻炭疽病抗性相关的SNP标记,其产生的多态性片段大小约为600 bp.
黄麻; 炭疽病; SSR; SNP; 抗性鉴定
黄麻(Corchorussp.)为椴树科(Tiliaceae)黄麻属(Corchorus)一年生纤维植物.黄麻有约40个种,生产上广泛栽培的主要是圆果种黄麻(CorchoruscapsularisL.)和长果种黄麻(CorchorusolitoriusL.)两个种[1-3].黄麻纤维具有吸湿性能好、散失水分快等特点,而且具有很好的消音和隔热特性,在现代服装产业、造纸业和复合材料产业等领域得到了广泛应用,其种植量和用途的广泛性仅次于棉花[4-6].
炭疽病是圆果种黄麻的主要病害,由黄麻炭疽菌(Colletotrichumcorchorum)侵染导致,从黄麻幼苗期至成株期均可发病,主要危害黄麻茎秆、叶片和果实部位,严重影响了黄麻纤维的产量和品质[7].国内外学者对黄麻炭疽菌的形态特征、生理分化、抗病性鉴定及遗传规律等进行了系统研究[8-11].关于黄麻炭疽病抗性的鉴定,以往的研究均采用传统的田间鉴定方法[12-14],田间鉴定存在所需周期较长、鉴定结果易受周围环境影响等缺点.而近年来兴起的分子标记辅助选择技术 (moleculary assisted selection, MAS),为建立快速、准确的检测植物病害的技术体系提供了依据[15].
近年来,国内外学者分别筛选出与小麦、甘蔗、豌豆等抗病性基因紧密连锁的分子标记[16-18],并获得了与黄瓜[19]、菜豆[20]、葡萄[21]、西瓜[22]等炭疽病抗性相关的SSR、AFLP等分子标记.上述研究为作物种质资源抗病性鉴定及抗病新品种的选育提供了高效、可靠、简便的新方法.研究表明,SSR分子标记技术因具有多态性高、 共显性、重复性好、数量丰富等特点,在筛选目标性状的连锁标记方面具有独特的优势[17].而SNP是指在基因组上由单个核苷酸变异所引起的DNA 序列多态性,与之前的标记相比,不仅具有多态性好、 能广泛均匀分布于全基因组的特点,而且随着高通量测序及生物信息学数据分析技术的发展,可以实现大规模自动化检测[23,24].
与其它作物相比,黄麻的分子生物学研究相对滞后.虽然国内外学者用SSR和SNP标记进行了黄麻遗传多样性分析和遗传图谱构建等研究[25,26].但目前为止,尚未见到开发及筛选与黄麻炭疽病抗性基因连锁的SSR和新型SNP等分子标记的报道.黄麻炭疽病是黄麻生产上的重要病害,对其产量和品质产生了严重影响.若能开发和筛选出与黄麻炭疽病抗性直接相关的分子标记,则在苗期即可对其进行抗性鉴定,有利于抗性种质的早期筛选和鉴定,可为黄麻炭疽病抗性鉴定提供快速有效的分子生物学方法.本研究拟开发和筛选与黄麻炭疽病抗性相关的新型分子标记,为黄麻炭疽病的早期鉴定提供简便可靠的方法,同时对黄麻抗性种质的鉴定和抗病育种亲本选配具有重要意义.
1 材料与方法
1.1 材料
1.1.1 植物材料 在对黄麻重组自交系群体142个株系进行田间炭疽病抗性鉴定的基础上,选择6份黄麻抗炭疽病株系(编号为45、76、98、101、122、123)和感炭疽病株系(编号为5、11、13、15、17、61)为材料,于2015年9月在福建农林大学田间实验室将种子播种在花盆中,放置于自然条件下生长.待植株生长至3~5片真叶时,取上部幼嫩叶片并将其混合用来提取DNA.
1.1.2 所用的SSR及SNP引物 SSR引物共36对,系由100对EST-SSR引物中初步挑选出的有多态性的引物[27](由张立武博士提供).SNP引物由厦门泰京生物技术有限公司合成.
1.1.3 试剂及仪器Taq酶为上海生工生物技术有限公司产品,dNTPs、Mix和DNA marker为北京百泰克生物技术有限公司产品,其它试剂按常规方法配制.PCR仪型号为德国Eppendorf公司的MasterCircle-gradient,电泳仪为北京六一仪器厂生产的DYY-12型电泳仪,凝胶成像分析仪为上海培清科技有限公司生产的JS-2012自动对焦型分析仪.
1.2 方法
1.2.1 黄麻基因组DNA的提取 用北京百泰克生物技术公司生产的Bioteke kit植物DNA提取试剂盒提取黄麻基因组DNA,操作过程参照说明书.用Eppendorf的核酸蛋白检测仪检测浓度情况.
1.2.2 SNP引物开发 以前期获得的22个与黄麻炭疽病抗性连锁的QTL标记序列为基础(未发表),使用primer premier 5软件进行引物设计,要求SNP位点所在的位置位于上游和下游引物之间,且序列中没有二聚体和发夹结构.
1.2.3 SSR的PCR扩增体系及程序 SSR反应体系为20 μL,其中DNA模板2 μL,上下游引物各1 μL, Mix10 μL,ddH2O 6 μL.SSR 分子标记的PCR反应程序如下:95 ℃预变性3 min;95 ℃变性30 s,56.5 ℃退火45 s,75 ℃延伸45 s,循环9次;95 ℃变性30 s,55 ℃退火45 s,72 ℃延伸45 s,循环34次;72 ℃延伸10 min.
1.2.4 SNP的PCR扩增体系及程序 SNP反应体系为20 μL,其中DNA模板3 μL,上下游引物各0.5 μL, Mix 8 μL,ddH2O 8 μL.SNP 分子标记的PCR反应程序如下:95 ℃预变性3 min;95 ℃变性15 s,55 ℃退火30 s,72 ℃延伸1.5 min,循环33次;72 ℃延伸10 min.
1.2.5 多态性引物筛选 取45、76、98、101、122、123号等6个抗炭疽病株系的DNA各10 μL混合成抗病池,同样,取6个感病株系5、11、13、15、17、61的DNA各10 μL混合成感病池.以抗病池和感病池的DNA为模板,对SSR引物和SNP引物进行初步筛选.在此基础上,分别以6份抗病株系和6份感病株系的DNA为模板,对多态性引物进行进一步验证.
1.2.6 琼脂糖电泳检测 制备浓度为1.2%的琼脂糖凝胶, 采用110 V电压和110 mA电流进行电泳,电泳时间为40 min.电泳结束后,观察电泳结果并拍照.
2 结果与分析
2.1 SNP引物开发

表1 7对SNP引物的编号、名称及序列Table 1 Codes, names and sequences of 7 pairs of SNP primers
在本实验室前期黄麻炭疽病抗性基因QTL定位研究的基础上,以与黄麻炭疽病抗性基因连锁的22个位点序列为基础,开发出7对可能与黄麻炭疽病抗性基因连锁的新型SNP标记(表1).这7对SNP引物平均长度为20 bp,其中G/C平均含量为32.5%.SNP引物位点均位于上游和下游引物之间,并且序列中没有二聚体和发夹结构,为理想的SNP标记引物,可满足后续研究的需要.
2.2 SSR多态性引物初步筛选
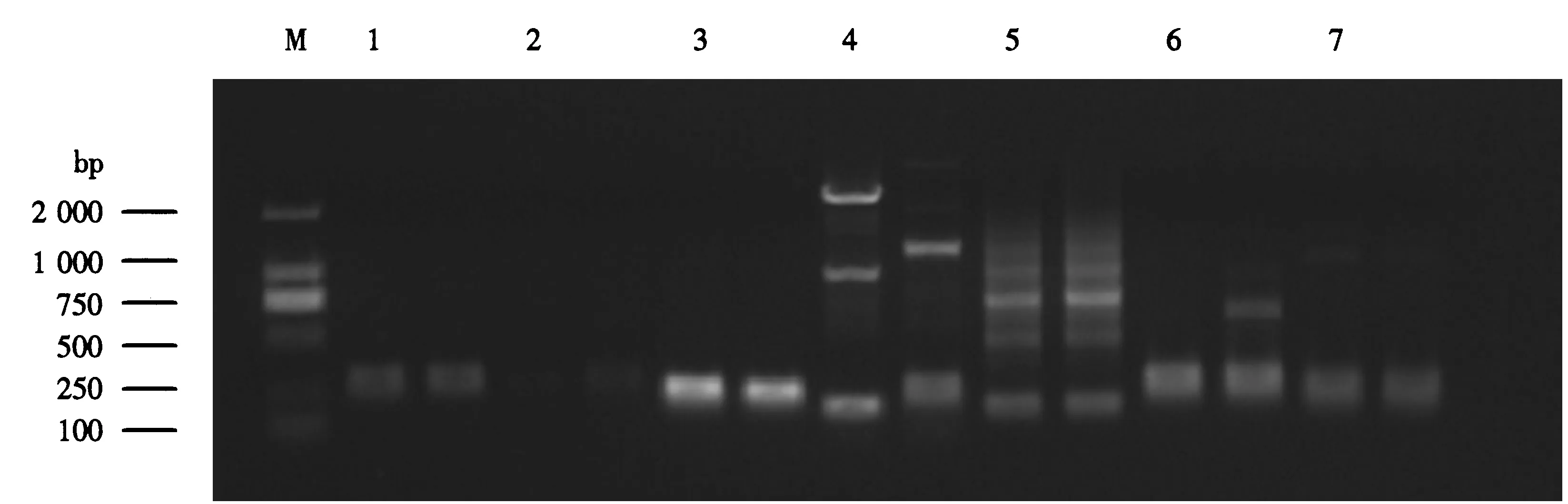
用抗病株系和感病株系构建的抗感池为模板,对由100对SSR引物中挑选出的36对引物进行PCR扩增,结果表明1号、2号和4号等15对SSR引物在抗感池之间扩增出了多态性条带(图1),各引物的多态性条带强弱和条带大小有所差异(表2).其中2、7、8、15、42和44号等6对SSR引物扩增出的条带具有清晰的特异性主带,且抗感池间条带大小有较大差异,是理想的多态性SSR引物.而另外9对SSR引物有的多态性条带为非特异带,有的抗感池间多态性条带大小差别不大,因此为多态性一般的SSR引物.

M表示marker;图上的数字为SSR引物编号;每个引物对应的左边泳道为抗病池,右边泳道为感病池.图1 部分SSR引物筛选结果电泳图Fig.1 Amplification result of some SSR primers
2.3 SSR多态性引物验证
分别以6份抗炭疽病和6份感炭疽病黄麻株系的DNA为模板,对上述15对具有多态性的SSR引物进行进一步验证.出乎意料的是,绝大多数SSR引物在抗感材料间并没有扩增出多态性条带,即没有表现出预期的多态性;仅有65号SSR引物在抗病和感病株系间扩增出多态性条带,但遗憾的是,多态性条带在抗感材料间缺乏统一性和代表性(图2),虽然3份感病株系在750 bp处扩增出一条多态性条带,但另外3份株系在此位置却没有扩增出条带,因此该SSR引物无法作为鉴定黄麻炭疽病抗性的分子标记.

表2 15对SSR引物的编号、序列及多态性情况表1)Table 2 Codes, sequences and polymorphism of 15 SSR primers
1)多态性情况中“A”表示多态性程度高,“B”表示多态性程度一般;每对引物中上行为正向引物,下行为反向引物.
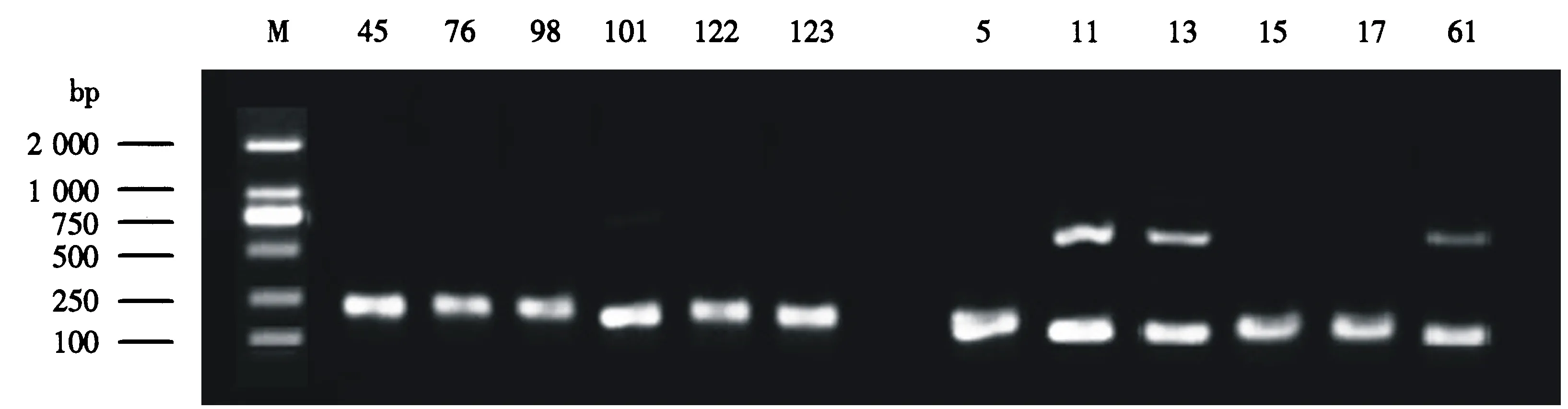
M表示Marker;前6个泳道为抗病株系,后6个泳道为感病株系;数字表示株系号码.图2 65号SSR引物进一步PCR验证的电泳结果Fig.2 Electrophoresis result of further screened No.65 SSR primer
2.4 SNP多态性引物筛选结果
分别以构建的抗病池和感病池DNA为模板,对所开发的7对SNP引物进行PCR扩增.结果表明,4号和6号SNP引物在抗病池和感病池之间具有明显的多态性(图3),可进行进一步验证,以明确其在抗病和感病株系间的多态性.
M表示marker;1-7为SNP引物序号.图3 SNP多态性引物初步筛选结果Fig.3 Electrophoresis result of screened SNP primers
2.5 多态性SNP引物进一步验证
分别以6份抗炭疽病和6份感炭疽病黄麻株系的DNA为模板,对在初步筛选中表现多态性的4号和6号SNP引物进行进一步验证.研究结果表明,6号SNP引物在所有感病株系中均扩增出约600 bp的条带,而抗病株系却无此条带(图4),说明6号SNP引物与黄麻炭疽病抗性相关,可较好地将黄麻抗炭疽病和感炭疽病株系区分开来,是黄麻炭疽病抗性鉴定的理想分子标记.

M表示marker,前6个泳道为抗病株系,后6个泳道为感病株系.图4 6号SNP引物进一步PCR验证的电泳结果Fig.4 Electrophoresis result of further screened No.6 SNP primer
3 讨论
3.1 SSR和SNP标记的PCR扩增程序
DNA模板浓度、引物浓度和退火温度均会影响PCR扩增的结果,其中退火温度和变性温度的影响较大.本实验所用的SSR引物由本实验室开发[27],所用PCR扩增程序系在先前多次相关实验的基础上形成的,因此可保证扩增结果的稳定性和可靠性.而SNP引物的退火温度参考引物设计说明书并作适当调整.同时,结合陈蓉等对穿心莲研究实验[28]和王佳媛等[29]对凹叶木兰的遗传多样性的研究中SNP引物扩增的程序,将变性温度设定为95℃,时间为15 s.研究结果表明,优化后的SNP扩增程序可扩增出清晰的条带,从而保证了试验结果的可靠性和稳定性.
3.2 SSR引物的多态性
以所构建的抗病池和感病池的DNA为模板,从36对SSR引物中初步筛选出15对多态性理想的引物,但以单个抗病和感病株系基因组DNA为模板进行进一步验证时发现,上述SSR引物在抗感材料间没有扩增出理想的多态性条带,即本研究没有获得与黄麻炭疽病抗性基因连锁的理想的SSR标记.导致这一结果的原因可能有:(1)所用的SSR引物是来源于黄麻的EST序列,EST序列是不同组织来源的cDNA序列,且来源于相对保守的转录区域[27],而这些来源于不同组织和转录区域的序列可能刚好与黄麻炭疽病抗性不相关.一般来说,由于基因组DNA包含了内含子,与外显子相比,内含子在植物进化过程中受人类驯化的选择相对较少,保留了大量的序列多态性,所以通常情况下,基因组多态性高于EST多态性[30].在后续研究中,应开发基于黄麻基因组或者转录组测序的SSR引物.(2)虽然本研究所用的36对SSR引物是从100对SSR引物中初步筛选获得,但相对来说,引物数量不够多,对黄麻基因组的覆盖面不够广泛,因此导致未筛选到与黄麻炭疽病抗性相关的多态性SSR引物.在前人的研究中,高轶静等[17]对300对SSR引物进行筛选后,获得了1对与甘蔗黑穗病抗性连锁的标记;张海英等[19]从439对SSR引物中获得2对与黄瓜白粉病抗性基因连锁的标记;王跃进等[21]在对212条引物进行筛选的基础上,获得了与葡萄炭疽病抗性相关的RAPD标记;而牛晓伟等[22]则对约4 000个AFLP引物组合进行研究后,筛选出4对与西瓜炭疽病抗性基因连锁的理想引物.由上可见,获得与作物抗病性基因连锁的分子标记的概率平均为几百分之一,有的甚至仅有千分之一.因此,今后若进行同类研究时,应加大所用SSR引物的数量,增强对黄麻基因组的覆盖程度,以获得理想的研究结果.(3)黄麻炭疽菌有胶孢炭疽菌和黑线炭疽菌两个生理小种[8],而前期研究中鉴定黄麻材料炭疽病抗性时仅对其中的黑线炭疽菌进行了接菌,而对胶孢炭疽菌未进行相关研究,因此,推测虽然所用的SSR引物与黄麻对黑线炭疽菌的抗性不相关,但有可能与黄麻对胶孢炭疽菌的抗性有关,此结论有待进一步试验验证.
3.3 SNP引物的多态性及与黄麻炭疽病抗性的相关性
以所构建的抗病池和感病池的DNA为模板,从所开发的7对SNP引物中初步筛选出2对理想的多态性引物, 进一步验证表明,1对SNP引物在抗炭疽病和感炭疽病株系之间表现出很好的多态性,即与黄麻炭疽病抗性相关,可用于黄麻种质炭疽病抗性早期鉴定等后续研究.本研究所用的SNP引物是基于黄麻炭疽病抗性QTL定位的结果开发的,其与黄麻炭疽病抗性相关,与所用的SSR相比,更具有针对性.另外,虽然这7对引物都是基于黄麻炭疽病抗性QTL定位研究的基础上开发的,但只有1对与黄麻炭疽病抗性相关,其它6对引物虽然可能与黄麻炭疽病抗性基因连锁或者相关,但连锁不紧密或相关性较弱,因此在抗感株系间未获得特异的多态性条带.
综上所述,以SNP为代表的第三代分子标记比第二代分子标记具有更多优点和更强的实用性[31].SNP所具有的优势,在某种程度上弥补了第一代和第二代分子标记与目标基因紧密连锁性差、分子标记分析自动化程度低、实验过程复杂等缺陷[32],是种质资源鉴定、遗传多样性分析和遗传连锁图谱构建等研究理想的方法.
4 小结
由于引物数量限制和引物本身特性等原因,本研究没有筛选到适合黄麻炭疽病抗性鉴定的SSR标记.然而,本研究开发了7对SNP引物,从中筛选出1对与黄麻炭疽病抗性相关的引物,可用于黄麻炭疽病抗性的早期鉴定.本研究可为黄麻种质资源炭疽病抗性鉴定提供简便有效的新型分子标记方法,同时可为黄麻抗病育种亲本选配提供理论依据,对通过分子生物学手段结合传统育种方法选育抗病性强、高产优质的黄麻新品种具有重要的理论和实践意义.
[1] 李宗道.麻类作物生产和育种概况[J].世界农业,1980(8):24-30.
[2] 卢浩然.中国农业志,农作物卷,麻类分支[M].北京:北京农业出版社,1991.
[3] 祁建民,李维明,吴为人.黄麻的起源与进化研究[J].作物学报,1997,23(6):677-682.
[4] 熊和平.麻类作物育种学[M].北京:中国农业科学技术出版社,2008.
[5] 何婉芬,朱先军,伍红,等.速生红麻纤维形态和制浆造纸性能研究[J].造纸科学与技术,2009,28(3):11-12.
[6] 王鑫鑫.黄麻纤维的复合处理及其聚丙烯基复合材料研究[D].南京:南京航空航天大学,2011.
[7] NIU X, GAO H, QI J, et al.Colletotrichumspecies associated with jute (CorchoruscapsularisL.) anthracnose in southeastern China[J/OL]. Sci Rep, 2016, doi: 10.1038/srep25179.
[8] 高红.黄麻炭疽病病原菌的分离鉴定及NBS-LRR类抗病基因的克隆[D].福州:福建农林大学,2014.
[9] 吴家琴,张继成,黎修惕.黄麻黑点炭疽病的研究.植物保护学报,1983,10(1):47-52.
[10] GHOSH, T. Anthracnose of jute[J]. Indian Phytopathol. 1957(10):63-70.
[11] 余建坤.黄麻炭疽病菌生理分化的研究[D].福州:福建农学院,1988.
[12] ISLAM N, AHMED Q A. The cause of tolerance of anthracnose (Colletotrichumcorchori) in species and varieties of jute[J]. Transactions of the British Mycological Society, 1964,47(2):227.
[13] 张继成,程新奇,肖瑞芝,等.圆果种黄麻种质资源抗炭疽病鉴定研究[J].作物品种资源,1991(4):34-35.
[14] 陈绵才,吴家琴,薛召东,等.长果种黄麻种质资源对黑点炭疽病抗性的鉴定[J].作物品种资源,1990(2):36.
[15] 翟丽艳,李娟玲,刘国民,等.与苦丁茶炭疽病抗性基因连锁的RAPD标记[J].热带生物学报,2013,4(1):25-30.
[16] 张小村,李斯深,赵新华,等.小麦纹枯病抗性的QTL分析和抗病基因的分子标记[J].植物遗传资源学报,2005,6(3):276-279.
[17] 高轶静,张荣华,张革民,等.与甘蔗抗黑穗病基因连锁的SSR标记筛选[J].热带作物学报,2013,34(11):2 222-2 226.
[18] JAVID M, ROSEWAME G M, SUDHEESH S, et al. Validation of molecular markers associated with boron tolerance, powdery mildew resistance and salinity tolerance in field peas[J]. Front Plant Sci, 2015(6):1-9.
[19] 张海英,王振国,毛爱军,等.与黄瓜白粉病抗病基因紧密连锁的SSR分子标记[J].华北农学报,2008,23(6):77-80.
[20] 古瑜,韩启厚,王武台,等.菜豆抗炭疽病基因SCAR标记在品种抗性鉴定中的应用[J].园艺学报,2011,38(5):911-920.
[21] 王跃进,徐炎,张剑侠,等.中国野生葡萄果实抗炭疽病基因的RAPD标记[J].中国农业科学,2002,35(5):536-540.
[22] 牛晓伟,,唐宁安,范 敏,等.西瓜抗炭疽病的遗传分析和抗性基因定位研究[J].核农学报,2014,28(8):1 365-1 369.
[23] 肖炳光,邱杰,曹培健,等.利用基因组简约法开发烟草SNP标记及遗传作图[J].作物学报,2014,40(3):397-404.
[24] HELYAR S J, HEMMER-HANSEN J, BEKKEVOLD D, et al. Application of SNPs for population genetics of non-model organisms: new opportunities and challenges[J]. Mol Ecol Resour, 2011,11(S1):123-136.
[25] BISWAS C, DEY P, KARMAKAR G, et al. Discovery of large-scale SNP markers and construction of linkage map in a RIL population of jute (Corchoruscapsularis)[J]. Mol Breeding, 2015,35(119):1-10.
[26] DAS M, BANERJEE S., DHARIWAL R, et al. Development of SSR markers and construction of a linkage map in jute[J]. Genet. 2012,91(1):21-31.
[27] 张立武,袁民航,何雄威,等.GenBank数据库中黄麻EST-SSR标记的开发及其通用性评价[J].作物学报,2014(7):1 213-1 219.
[28] 陈蓉,王晓云,宋毓宁,等.基于SRAP和SNP分子标记的国内穿心莲遗传多样性分析[J].中国中药杂志,2014(23):4 559-4 565.
[29] 王佳媛,吴传芳,唐亚.基于SNP分子标记的凹叶木兰遗传多样性初步研究[J].广西植物,2012(4):542-547.
[30] FERGUSON M, RABBI I, KIM D J, et al. Molecular markers and their application to cassava breeding: past, present and future[J]. Trop Plant Biol, 2012,5(1):95-109.
[31] 唐立群,肖层林,王伟平.SNP分子标记的研究及其应用进展[J].中国农学通报,2012,28(12):154-158.
[32] 孙清明,李永忠,向旭,等.利用SNP和EST-SSR分子标记鉴定荔枝新种质御金球[J].分子植物育种,2013,11(3):403-414.
(责任编辑:吴显达)
Screening of SSR markers and developing of newly SNP markers associated with anthracnose resistance inCorchoruscapsularis
TAO Aifen, XIE Lili, QI Jianmin, FANG pingping, LIN Lihui, XU Jiantang, ZHANG Liwu, LIN Peiqing
(Key Laboratory of Ministry of Education for Genetics, Breeding and Multiple Utilization of Crops/Fujian Provincial Key Laboratory of Crops by Design, Fujian Agriculture and Forestry University, Fuzhou, Fujian 350002, China)
This study aims to identify new molecular markers associated with anthracnose resistance of white jute (CorchoruscapsularisL.), as well as to provide a convenient and reliable molecular biology method for anthracnose resistance identification. Firstly, based on quantitative traits loci (QTL) identification for anthracnose resistance of white jute, 7 pairs of new single nucleotide polymorphisms (SNP) markers which might link to anthracnose resistance of jute were identified. Secondly, by examining the anthracnose resistance of the recombining inbred lines of white jute in our previous study, the resistant and susceptible pools were generated using the genomic DNA of 6 resistant and 6 susceptible lines, respectively. Thirdly, 36 pairs of simple sequence repeat (SSR) and 7 pairs of SNP primers were screened using genomic DNA from the two pools as templates, and 17 polymorphic primers including 15 pairs of SSR primers and 2 pairs of SNP primers were identified. Moreover, those polymorphic SSR and SNP primers were further verified using 12 copies of the genomic DNA of resistant and susceptible white jute lines as templates. Finally, 1 pair of SNP primer was identified with polymorphism significantly associated with anthracnose resistance of white jute, which produced a polymorphic DNA fragment with the size of around 600 bp.
jute; anthracnose; SSR; SNP; identification for resistance
2016-06-12
2016-07-28
国家自然科学基金项目(31471549); 现代农业产业技术体系建设项目(CARS-19-E06).
陶爱芬(1976-),女,副研究员.研究方向:麻类作物遗传育种学.Email:281770126@qq.com.通信作者祁建民(1948-),男,教授.研究方向:麻类作物遗传育种及分子生物学.Email:qijm863@163.com.
S563.4
A
1671-5470(2017)01-0027-07
10.13323/j.cnki.j.fafu(nat.sci.).2017.01.005
