以金纳米颗粒-二氧化钛纳米线阵列为支架的电化学免疫传感的构建及其应用
2017-03-08霍小鹤刘培培刘小强
霍小鹤,刘培培,刘小强,刘 锦
(河南大学 化学化工学院,河南 开封 475004)
以金纳米颗粒-二氧化钛纳米线阵列为支架的电化学免疫传感的构建及其应用
霍小鹤,刘培培,刘小强*,刘 锦
(河南大学 化学化工学院,河南 开封 475004)
首先以掺杂氟的二氧化锡导电玻璃为基片,采用水热法制备出二氧化钛纳米线阵列,然后使用电化学沉积法将金纳米颗粒修饰于二氧化钛纳米线阵列表面以增强其导电性和生物相容性.将纳米金-二氧化钛纳米线阵列用作电化学免疫传感器支架,利用纳米金与癌胚抗原抗体之间的静电吸附作用,将包被抗体负载于电极表面制得检测癌胚抗原的电流型免疫传感器.同样,水热法还被用于制备圆柱形二氧化钛纳米棒,以辛二酸双 (3-磺基-N-羟基琥珀酰亚胺酯) 钠盐为双氨基交联剂,将辣根过氧化物酶和信号抗体一起固定于二氧化钛纳米棒表面作为示踪标记物.扫描电子显微镜、透射电子显微镜和X射线衍射分析仪均被用于分析上述材料的结构、形貌和组成.通过夹心型免疫反应,示踪标记物上信号抗体被定量负载于免疫传感器表面.通过一个以过氧化氢为媒介体的辣根过氧化物酶催化反应,差示脉冲伏安法被用于癌胚抗原的定量测定.结果表明,该癌胚抗原免疫传感器线性范围为0.01~120 μg/L,检测限为6 ng/L.
二氧化钛纳米线阵列; 电化学沉积法; 金纳米颗粒; 夹心型免疫反应; 癌胚抗原
肿瘤标志物是一类存在于血液或组织中的生物分子,它们的含量常被作为监测正常生理过程、致病过程以及治疗效果的重要指标,也为临床癌症筛选与疾病诊断提供了重要信息[1-2].因此,准确、灵敏地检测肿瘤标志物对癌症的筛选、诊断和治疗都起着至关重要的作用.癌胚抗原是大肠癌组织产生的一种糖蛋白,是一个广谱性肿瘤标志物,它能向人们反映出多种肿瘤的存在,对大肠癌、乳腺癌和肺癌的疗效判断、病情发展监测和愈后健康评估非常重要[3-5].97%的健康成年人血清癌胚抗原浓度在2.5 μg/L以下.许多免疫分析法,包括荧光免疫分析[6]、电化学酶免疫分析[7]、化学发光免疫分析[8]、酶联免疫吸附法[9]等均被广泛用于检测肿瘤标记物.其中,电化学免疫分析法由于快速、有效和灵敏等特点得到广泛应用[10].
随着纳米材料科学的快速发展,各种各样的纳米材料被应用于免疫传感器的制备以提高其分析性能,如碳纳米材料[11]、石墨烯[12]、二氧化硅[13]、量子点[14]等.在众多纳米材料中,二氧化钛纳米材料由于其优异的生物相容性、优良的化学稳定性、大比表面积、机械性能好、合成方法简便等优点吸引了广泛的关注[15].尤其是一维二氧化钛纳米结构,如二氧化钛纳米管,被广泛用于光电化学和电化学免疫传感器的制备.例如GAO等[16]用二氧化钛纳米管阵列为传感器支架,以辣根过氧化物酶标记的信号抗体-金纳米颗粒作为信号探针来检测免疫球蛋白浓度.由于二氧化钛纳米管显著的管状特征:比表面积和内部空间大,此免疫传感器与其他普通电极相比,性能得到有效增强.其对兔免疫球蛋白的浓度线性范围为0.1~105 μg/L,检测限为0.01 μg/L.
二氧化钛纳米线阵列的光电化学性能已经有大量研究报道[17-18],但由于导电性差的缺点,限制了其在电化学传感器方面的应用.为此,将二氧化钛纳米线阵列与高导电性材料复合是一种好的方法.金纳米颗粒拥有良好的生物相容性和优异的导电性,能促进分析物与电极表面之间的电子转移[19].同时,它的大比表面积和丰富的活性位点可用来负载更多的生物分子,因此被广泛用于生物传感器的构建.
本实验采用水热法制备了整齐、致密的二氧化钛纳米线阵列,然后用电化学沉积法将金纳米颗粒修饰于二氧化钛纳米线阵列表面,并将其作为一个新型免疫传感器支架用于负载包被抗体Ab1.水热法还被用于制备圆柱形二氧化钛纳米柱,并将其与辣根过氧化物酶一起用于标记信号抗体Ab2.夹心型免疫反应后,差示脉冲伏安法被用于定量检测癌胚抗原.
1 实验部分
1.1 试剂与仪器
鼠单克隆癌胚抗原包被抗体 (Ab1) (克隆号21D6)、信号抗体 (Ab2) (克隆号24D2) 和癌胚抗原 (98%) (产品编号A0102) (成都双流正龙生化制品研究室); FTO玻璃片(厚1.1 mm,电阻10Ω / sq) (武汉晶格太阳能科技有限公司); 浓盐酸 (37%)、钛酸丁酯和四氯化钛 (天津市化学试剂有限公司); 氯仿、无水乙醇和30%过氧化氢 (国药集团化学试剂有限公司);氢醌、氨水 (28%)和壳聚糖 (北京市百灵威科技有限公司); 三水氯金酸、3-氨基丙基三乙氧基硅烷、辛二酸双 (3-磺基-N-羟基琥珀酰亚胺酯) 钠盐、辣根过氧化物酶和牛血清蛋白 (上海西格玛奥德里奇贸易有限公司); 所用超纯水均来自一个微孔水净化系统 (≥18 MΩ); 磷酸盐缓冲液(PBS) 由含0.1 mol/L氯化钾的0.05 mol/L 磷酸二氢钾与0.05 mol/L 磷酸氢二钾混合制得,并用作支持电解液; 洗涤缓冲液为含0.5 g/L Tween 20的磷酸盐缓冲液 (0.05 mol/L,pH 7.0); 封闭缓冲液为含50 g/L牛血清蛋白的磷酸盐缓冲液 (0.05 mol/L,pH 7.0).
扫描电子显微镜 (SEM,日本电子株式会社); JEM-2010型透射电子显微镜 (TEM,日本电子株式会社); Brukker D8 Advance型X射线粉末衍射仪 (XRD,德国布鲁克AXS有限公司); Zennium,IM6ex型电化学工作站 (ZAHNER,德国); CHI630D 型电化学工作站 (上海辰华仪器有限公司).
1.2 二氧化钛纳米线阵列的制备及金纳米颗粒的沉积
先将几片FTO基片相继用丙酮、乙醇和超纯水洗涤,在N2流下干燥备用.将13 mL浓盐酸 (37%) 用15 mL去离子水稀释,室温下搅拌5 min.加入300L钛酸丁酯后,继续搅拌15 min以得到澄清溶液.将所得溶液与上述洗涤干净的FTO基片一起转移至50 mL聚四氟乙烯内衬的高压反应釜内,在150 ℃下反应12 h,冷却至室温,取出FTO基片,用去离子水洗涤并在N2流下干燥.反应后,FTO基片上均匀覆盖有一层白色的二氧化钛纳米管阵列薄膜[20].
以0.1 mol/L磷酸盐缓冲液为溶剂配制1.0 mmol/L 氯金酸溶液,将所制二氧化钛纳米管阵列作为工作电极,在-1.0~1.15 V内进行循环伏安扫描以电化学沉积金.
1.3 圆柱形二氧化钛纳米棒的制备及其氨基化
将1.8 mL 四氯化钛缓慢加入到含19 mL超纯水的烧杯中 (冰水浴0~5 ℃),强力搅拌10 min获得白色悬浮液.再将1.8 mL 氯仿加入此混合液中,继续搅拌10 min,将混合液转入聚四氟乙烯内衬的高压反应釜内,160 ℃ 反应12 h.冷却至室温,离心收集白色沉淀,用去离子水和无水乙醇洗涤至pH 7.0,然后60 ℃真空干燥12 h,室温下储存备用[21].
将100 mg所得二氧化钛纳米棒置于含20 mL乙醇、1 mL氨水溶液 (28%) 和4 mL 3-氨丙基三乙氧基硅烷的混合液中,室温下搅拌过夜以防止二氧化钛纳米棒沉降.次日离心分离,弃去上清液,所得白色沉淀物洗涤、干燥后,室温下储存备用.
1.4 信号抗体示踪标记物的制备
将2 mg 辛二酸双 (3-磺基-N-羟基琥珀酰亚胺酯) 钠盐溶解在1 mL 磷酸盐缓冲液 (PBS,0.02 mol/L) 中获得溶液A,然后将3 mg 氨基化的二氧化钛纳米棒分散于溶液A中,搅拌下加入300 μL 2 g/L的辣根过氧化物酶水溶液并在室温下孵育30 min.然后加入15 μL含0.5 g/L信号抗体Ab2的磷酸缓冲液,4 ℃下搅拌8 h,离心分离,所得沉淀物用磷酸盐缓冲液洗涤并用含2%牛血清蛋白的磷酸盐缓冲液在室温下封闭30 min.最后用磷酸盐缓冲液洗涤后,分散于含0.1% 牛血清蛋白的1.0 mL 磷酸盐缓冲液中,备用.
1.5 癌胚抗原免疫传感器的组装
1.6 免疫分析过程
为进行免疫反应和电化学测试,上述制备所得的电化学免疫传感器先用20L不同浓度的癌胚抗原稀释液在室温下孵育40 min,然后分别用洗涤缓冲液和磷酸盐缓冲液洗涤1.5 min.再用20L信号抗体示踪标记物在室温下孵育40 min,并分别用洗涤缓冲液和磷酸盐缓冲液洗涤3 min.随后,将该电化学免疫传感器、参比电极、对电极置于含5 mL 磷酸盐缓冲液的电化学电池中,接着将氢醌 (最终浓度2 mmol/L) 和过氧化氢 (最终浓度1 mmol/L) 注入此电池中,在0~-0.8 V下进行差示脉冲伏安扫描,以定量测定癌胚抗原.
2 结果与讨论
2.1 二氧化钛纳米线阵列和二氧化钛纳米棒的形貌表征
SEM和TEM技术被用于表征金纳米颗粒沉积前后的二氧化钛纳米线阵列以及二氧化钛纳米棒的形貌.如图1所示,二氧化钛纳米线阵列的SEM平面图 (a) 和截面图 (b) 均表明水热反应后,FTO表面的白色薄膜为致密、垂直排列的二氧化钛纳米线阵列,它们拥有矩形横截面,其平均直径和长度分别约为150~180 nm和1.5~2 μm.电化学沉积金纳米颗粒后,如图1 (c) 所示,二氧化钛纳米线阵列上分散着直径约为30 nm小颗粒,这表明金纳米颗粒被成功沉积于二氧化钛阵列表面.TEM技术被用于表征所制备的二氧化钛纳米棒的形貌,如图 (d) 所示,所有纳米棒为圆柱形结构,其平均直径约为20 nm,平均长度约为180 nm,这有助于生物分子的负载.

图1 二氧化钛纳米线阵列的 (a) SEM平面图和(b) SEM截面图,(c) 二氧化钛纳米线阵列沉积金纳米颗粒后的SEM图,(d) 圆柱形二氧化钛纳米棒的TEM图Fig.1 (a) plane-view SEM image and (b) side-view SEM image of the TiO2 nanowire arrays,(c) SEM image of gold nanoparticle modified TiO2 nanowire arrays,(d) TEM im-age of TiO2 nanorods
2.2 材料的XRD表征
为证明金纳米颗粒的成功沉积以及二氧化钛纳米线阵列和二氧化钛纳米棒的晶型结构,图2展示了它们的XRD图谱.图2A (a)展示了FTO基片的衍射峰并用星号标记以方便比较.图2A (b)为纯二氧化钛纳米线阵列的XRD图,其中在36.1°和 62.7°处的两个特征衍射峰分别对应四方金红石型二氧化钛的 (101) 和 (002) 晶面.沉积金纳米颗粒后,如图2A (c)所示,在44.2°处出现了金纳米颗粒的特征衍射峰,它对应于金的(200)衍射晶面,说明金纳米颗粒已经被成功修饰于二氧化钛纳米线阵列表面.图2B为所制备圆柱形二氧化钛纳米棒的XRD衍射图谱,如图所示,2θ为27.55°,36.33°,39.33°,41.43°,44.24°,54.50°,56.78°,62.91°,64.23°,69.14°,70.02°处的衍射峰均为金红石型二氧化钛的特征衍射峰,它们分别归属于(110),(101),(200),(111),(210),(211),(220),(002),(310),(301),(112)特征衍射晶面,这表明纯相二氧化钛纳米材料的成功制备.
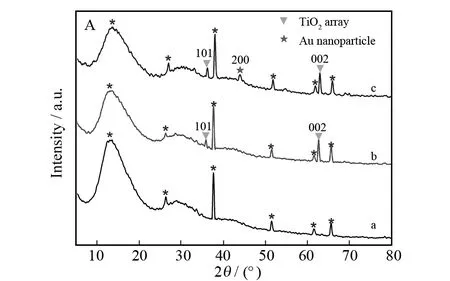
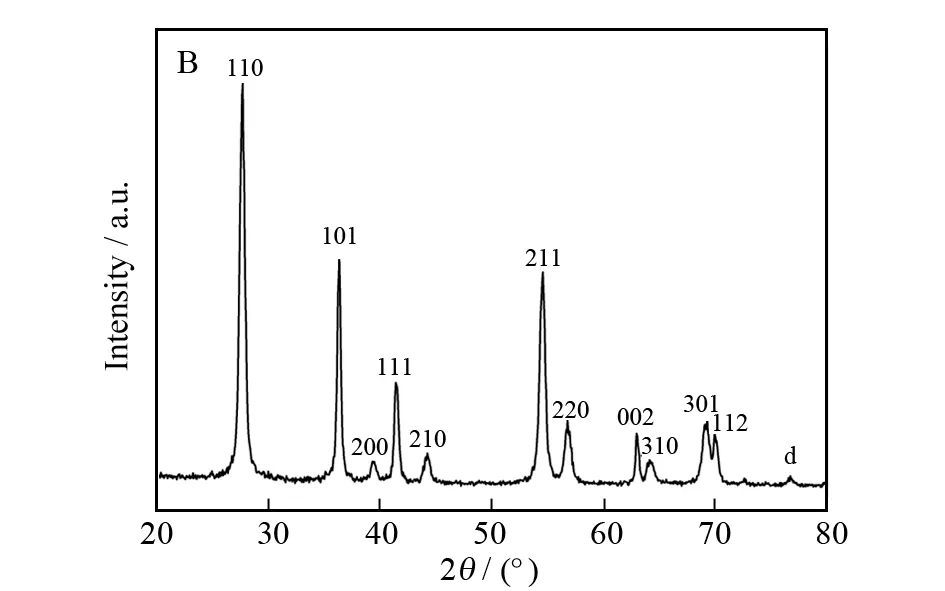
图2 (A):(a) 裸FTO基片,(b) 纯二氧化钛纳米线阵列,(c) 沉积金纳米颗粒后的二氧化钛纳米线阵列; (B):圆柱形二氧化钛纳米棒的XRD图谱Fig.2 (A):XRD pattern of (a) bare FTO substrate,(b) pristine TiO2 nanowire arrays,(c) TiO2 nanowire arrays modified with gold nanoparticles; (B):cylinder-shaped TiO2 nanorods
2.3 免疫传感器的组装过程表征
为证明该免疫传感器的成功制备,电化学阻抗和循环伏安法均被用来监测所得电化学免疫传感器的组装过程.阻抗实验是在含有0.1 mol/L KCl电解质的5 mmol/L K3[Fe(CN)6]/K4[Fe(CN)6]溶液中进行,所施加直流电压为0.230 V,上面叠加5 mV的交流电压,频率范围均为100 kHz~100 mHz.

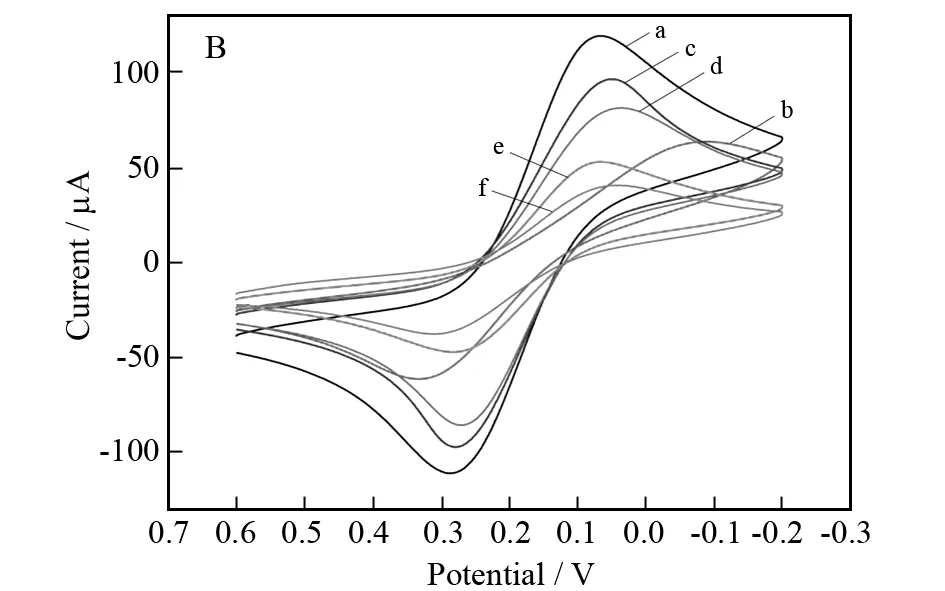
图3 (A):电化学阻抗表征该免疫传感器的组装过程; (B):循环伏安法表征该免疫传感器的组装过程Fig.3 (A):Nyquist plots of (a) bare FTO,(b) TiO2 nanowire arraysFTO,(c) AuNPs-TiO2 nanowire arrays FTO,(d) Ab1 AuNPs-TiO2 nanowire arraysFTO,(e) BSAAb1 AuNPs-TiO2 nanowire arraysFTO,and (f) Ab2 tracing labelCEABSAAb1 AuNPs-TiO2 nanowire arraysFTO; (B):Cyclic voltammetry characteriz-ation of assem-bly process of the proposed immunosensor
图3A中的所有奈奎斯特图在高频区均包含一个半圆,它对应电子转移阻力 (Ret); 在低频区呈现出一个直线部分,它对应扩散控制过程.半圆直径与修饰电极表面的铁氰化钾电子传递系数成反比,这为我们判断材料导电性提供了一个视觉判断标准[22].如图3A所示,裸FTO电极 (曲线a) 呈现出一个很小的半圆,代表表面电阻很小,属于扩散控制过程.与此相反,纯二氧化钛纳米线阵列 (曲线b) 半径较大,表明二氧化钛导电性较差.但是,电化学沉积金纳米颗粒后,阻抗半径 (曲线c) 相较于纯二氧化钛纳米线阵列 (曲线b)明显减小,表明金纳米颗粒的沉积大大增强了二氧化钛纳米线阵列的导电性.在曲线d~f中,沉积金纳米颗粒的二氧化钛纳米线阵列电极依次被修饰上Ab1、BSA和信号抗体Ab2示踪标记物.从图中可以看出,伴随着逐步修饰过程,半圆直径逐渐增加,这主要是由于蛋白质的低导电性和位阻效应,阻碍了电化学探针铁氰化钾向电极表面的电子传递,同时也表明了各种材料被成功层层组装于电极表面.
图3B为在含有0.1 mol/L KCl电解质的5 mmol/L K3[Fe(CN)6]/K4[Fe(CN)6]溶液中,使用循环伏安法表征该免疫传感器的组装过程.如图3B (a) 所示,裸FTO电极所测得氧化还原电流最大,表明导电性很好.在水热反应生成二氧化钛纳米线阵列后(曲线b),氧化还原电流明显减弱,表明二氧化钛导电性较差.电化学沉积金纳米颗粒后,如图3B (c) 所示,氧化还原电流相较于曲线b有很大增强,表明金纳米颗粒的沉积大大增强了二氧化钛纳米线阵列的导电性.随着Ab1、BSA和信号抗体Ab2标记物的一步步修饰,氧化还原电流逐渐减弱,再次表明了该免疫传感器的成功组装,这些结果与电化学阻抗所测结果高度一致.
2.4 电化学免疫传感器检测条件的优化
测试溶液的pH是影响免疫传感器性能的一个重要因素,因为强酸和强碱环境均会破坏生物分子的活性.溶液pH对免疫传感器差示脉冲伏安电流响应的影响如图4A所示,电流响应值在pH 5.0~7.0范围内随着pH的增加而快速增加,当pH超过7.0后,开始减小.因此,含0.10 mol/L KCl的0.05 mol/L PBS (pH 7.0) 缓冲液被选作检测液用于检测癌胚抗原.
癌胚抗原在免疫传感器表面的培育时间是影响免疫传感器分析性能的另一个重要因素.在室温下,癌胚抗原免疫传感器的电流响应值随癌胚抗原培育时间的增加而显著增加,超过40 min后基本达到一个恒定值 (如图4B所示),这表明癌胚抗原与电极表面的包被抗体Ab1的结合达到饱和.因此,将40 min选作此夹心型免疫传感器抗原的培育时间.
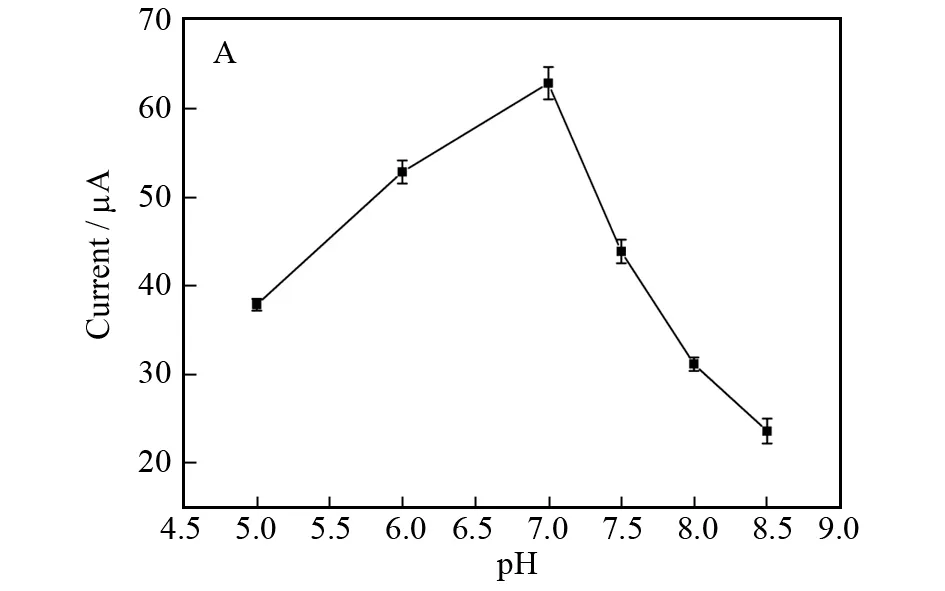
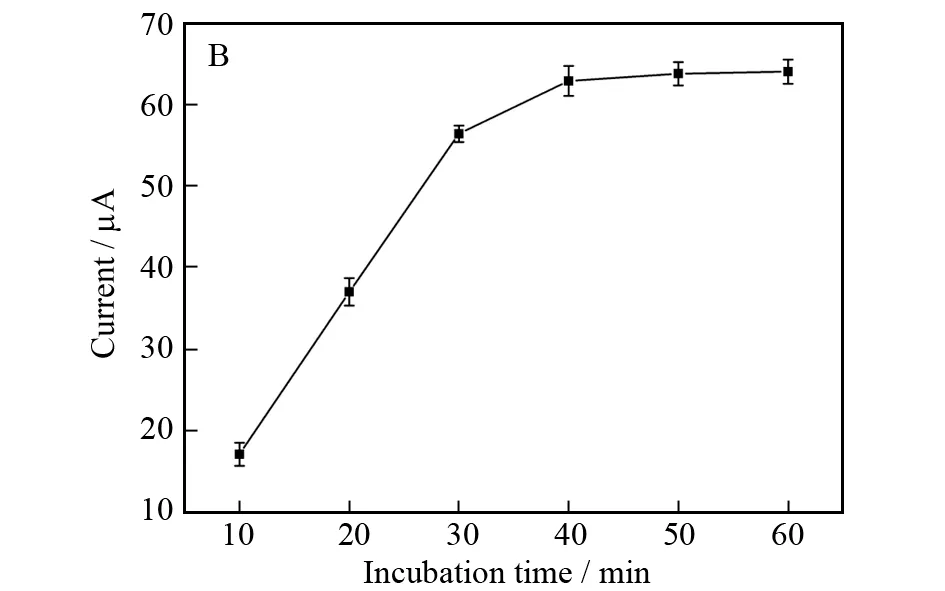
图4 (A):检测液的pH值; (B):癌胚抗原的培育时间对所制备免疫传感器差示脉冲伏安电流响应的影响Fig.4 Effects of (A) pH of detection solution and (B) incubation time of CEA on DPV response of the pro-posed im-munosensor
2.5 定量测定CEA
基于特异性夹心型免疫反应和以过氧化氢为媒介的辣根过氧化物酶催化反应,该免疫传感器被用于定量检测癌胚抗原,如图5所示,随着癌胚抗原浓度的增加,差示脉冲伏安还原峰电流逐步增加.校准曲线(图4中的插图)显示峰电流与癌胚抗原浓度的对数之间有良好的线性关系,线性范围为0.01 μg/L至120 μg/L,相关系数为0.995 (n= 6).在信噪比为3的条件下癌胚抗原的检测限低至6 ng/L,这比很多报道的免疫传感器均低.
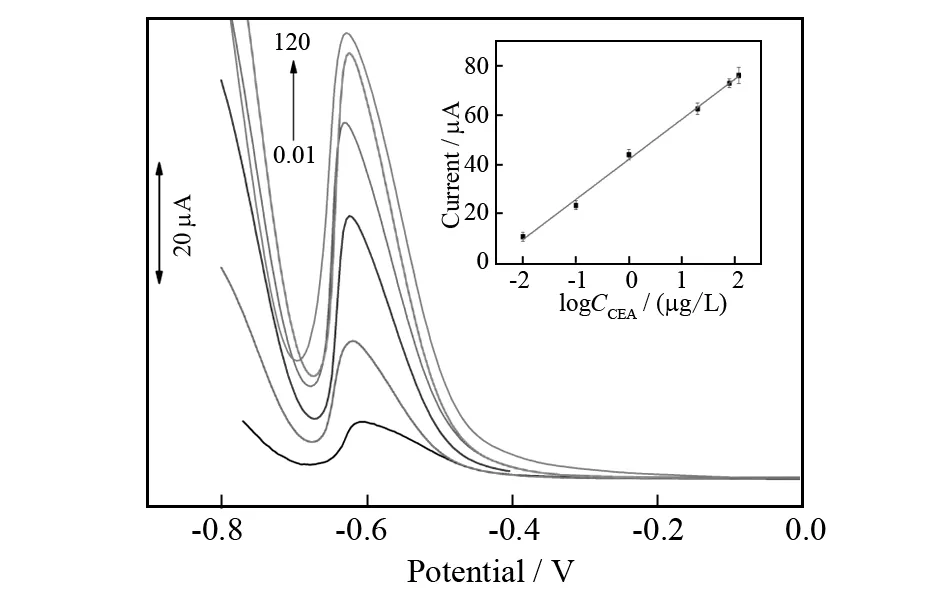
图5 免疫传感器对癌胚抗原浓度为0.01、0.1、1、20、80、120 μg/L的差示脉冲伏安响应; 插图:差示脉冲伏安响应与癌胚抗原浓度对数之间的标准曲线图Fig.5 DPV responses of the proposed immunosensor to CEA concentration of 0.01,0.1,1,20,80,and 120 μg/L; Inset:Calibration plot of DPV response versus logarithms of CEA concentration
2.6 重现性、选择性、稳定性测试
为了探究该免疫传感器的准确度和重现性,在相同条件下分别制备4根电极,在同一条件下进行分析测试,所得结果相对标准偏差 (RSD) 为 6.1%,表明此免疫传感器具有良好的准确性和重现性.
为评估该免疫传感器的特异性,引入了几种可能的干扰物,包括α-甲胎蛋白(AFP),前列腺癌蛋白抗原 (PSA),肿瘤抗原125 (CA125),免疫球蛋白G (IgG) 和牛血清蛋白(BSA).此免疫传感器分别用含有上述其中一种干扰物 (100 μg/L) 的20 μg/L CEA孵育.如图6所示,其中A为纯CEA不含干扰物,B、C、D、E、F分别为CEA与AFP,PSA,CA125,IgG,BSA的混合物.与没有干扰物相比,由干扰物引起的电流变化小于5.8%,这表明此免疫传感器具有良好的选择性.
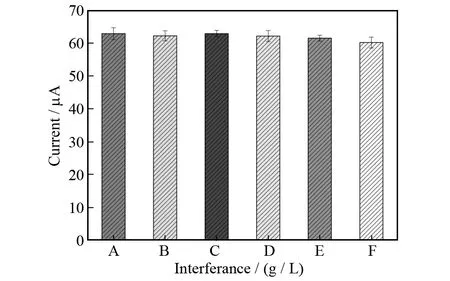
图6 免疫传感器的特异性探究Fig.6 Specificity of the proposed immunosensor
此外,此免疫传感器的稳定性也通过测量它们在4 ℃条件下储存2 w前后的电流响应进行了评估.结果表明,2 w后90.3%的电流响应得以保留,这表明此免疫传感器具有良好的稳定性.
3 结论
首先采用水热法制备了垂直、致密的二氧化钛纳米线阵列,然后将金纳米颗粒电化学沉积于纳米线阵列表面以增强其导电性,并将其用作免疫传感器支架来固定包被抗体Ab1.通过SEM、TEM和XRD对纳米材料进行形貌和组成表征,验证了复合材料的成功合成.电化学阻抗和循环伏安法均用于监测免疫传感器的组装,最终使用差示脉冲伏安法定量测定癌胚抗原浓度.结果表明,二氧化钛纳米线阵列具有高比表面积和良好生物相容性,而金纳米颗粒的沉积增强了该免疫传感器的导电性和生物相容性,极大改善了该癌胚抗原免疫传感器的性能.
[1] FERRARI M.Cancer nanotechnology:opportunities and challenges [J].Nature Reviews Cancer,2005,5(3):161-171.
[2] LIN J,WEI Z,MAO C.A label-free immunosensor based on modified mesoporous silica for simultaneous determination of tumor markers [J].Biosensors and Bioelectronics,2011,29(1):40-45.
[3] OIKAWA S,INUZUKA C,KUROKI M,et al.Cell adhesion activity of non-specific cross-reacting antigen (NCA) and carcinoembryonic antigen (CEA) expressed on CHO cell surface:homophilic and heterophilic adhesion [J].Biochemical and Biophysical Research Communications,1989,164(1):39-45.
[4] LABORIA N,FRAGOSO A,KEMMNER W,et al.Amperometric immunosensor for carcinoembryonic antigen in colon cancer samples based on monolayers of dendritic bipodal scaffolds [J].Analytical Chemistry,2010,82(5):1712-1719.
[5] SU B,TANG D,TANG J,et al.Multiarmed star-like platinum nanowires with multienzyme assembly for direct electronic determination of carcinoembryoninc antigen in serum [J].Biosensors and Bioelectronics,2011,30(1):229-234.
[6] MICHELS D A,TU A W,MCELROY W,et al.Charge heterogeneity of monoclonal antibodies by multiplexed imaged capillary isoelectric focusing immunoassay with chemiluminescence detection [J].Analytical Chemistry,2012,84(12):5380-5386.
[7] MARTINEZ N A,SCHNEIDER R J,MESSINA G A,et al.Modified paramagnetic beads in a microfluidic system for the determination of ethinylestradiol (EE2) in river water samples [J].Biosensors and Bioelectronics,2010,25(6):1376-1381.
[8] LEE J S,JOUNG H A,KIM M G,et al.Graphene-based chemiluminescence resonance energy transfer for homogeneous immunoassay [J].ACS Nano,2012,6(4):2978-2983.
[9] ZHOU G X,IRELAND J,RAYMAN P,et al.Quantification of carbonic anhydrase IX expression in serum and tissue of renal cell carcinoma patients using enzyme-linked immunosorbent assay:prognostic and diagnostic potentials [J].Urology,2010,75(2):257-261.
[10] PATEL P D.(Bio) sensors for measurement of analytes implicated in food safety:a review [J].Trac-Trends in Analytical Chemistry,2002,21(2):96-115.
[11] LIN J,WEI Z,ZHANG H,et al.Sensitive immunosensor for the label-free determination of tumor marker based on carbon nanotubes/mesoporous silica and graphene modified electrode [J].Biosensors and Bioelectronics,2013,41:342-347.
[12] LIU Y,MA H,GAO J,et al.Ultrasensitive electrochemical immunosensor for SCCA detection based on ternary Pt/PdCu nanocube anchored on three-dimensional graphene framework for signal amplification [J].Biosensors and Bioelectronics,2015,79:71-78.
[13] FANG Y S,HUANG X J,WANG L S,et al.An enhanced sensitive electrochemical immunosensor based on efficient encapsulation of enzyme in silica matrix for the detection of human immunodeficiency virus p24 [J].Biosensors and Bioelectronics,2015,64:324-332.
[14] TUTEJA S K,CHEN R,KUKKAR M,et al.A label-free electrochemical immunosensor for the detection of cardiac marker using graphene quantum dots (GQDs) [J].Biosensors and Bioelectronics,2016,86:548-556.
[15] ZHAO L,WEI Q,WU H,et al.Ionic liquid functionalized graphene based immunosensor for sensitive detection of carbohydrate antigen 15~3 integrated with Cd2+-functionalized nanoporous TiO2as labels [J].Biosensors and Bioelectronics,2014,59:75-80.
[16] GAO Z D,GUAN F F,LI C Y,et al.Signal-amplified platform for electrochemical immunosensor based on TiO2nanotube arrays using a HRP tagged antibody-Au nanoparticles as probe [J].Biosensors and Bioelectronics,2013,41:771-775.
[17] LUO J,MA L,HE T,et al.TiO2/(CdS,CdSe,CdSeS) nanorod heterostructures and photoelectrochemical properties [J].Journal of Physical and Colloid Chemistry C,2012,116(22):11956-11963.
[18] XU M,DA P,WU H,et al.Controlled Sn-doping in TiO2nanowire photoanodes with enhanced photoelectrochemical conversion [J].Nano Letters,2012,12(3):1503-1508.
[19] LIU G,ZHANG Y,GUO W.Covalent functionalization of gold nanoparticles as electronic bridges and signal amplifiers towards an electrochemical immunosensor for botulinum neurotoxin type A [J].Biosensors and Bioelectro-nics,2014,61:547-553.
[20] LIU B,AYDIL E S.Growth of oriented single-crystalline rutile TiO2nanorods on transparent conducting substrates for dye-sensitized solar cells [J].Journal of the American Chemical Society,2009,131(11):3985-3990.
[21] YANG Z,JIAN Z,CHEN X,et al.Electrochemical impedance immunosensor for sub-picogram level detection of bovine interferon gamma based on cylinder-shaped TiO2nanorods [J].Biosensors and Bioelectronics,2015,63:190-195.
[22] YU L,ZHANG Y,HU C,et al.Highly sensitive electrochemical impedance spectroscopy immunosensor for the detection of AFB 1 in olive oil [J].Food Chemistry,2015,176:22-26.
[责任编辑:刘红玲]
Construction of an electrochemical immunosensor based on Au nanoparticles-TiO2nanowire arrays and its application
HUO Xiaohe,LIU Peipei,LIU Xiaoqiang*,LIU jin
(CollegeofChemistryandChemicalEngineering,HenanUniversity,Kaifeng475004,Henan,China)
Initially,TiO2nanowire arrays (TiNW) were synthesized on a F doped SnO2(FTO) substrate through a facile hydrothermal method.With an electrochemical deposition method,gold nanoparticles (GNPs) were modified on the TiNW surface to enhance the conductivity and biocompatibility.Then,capture antibody (Ab1) was immobilized on the surface of electrode via electrostatic interaction between GNPs and Ab1.With BSA used to block possible remaining active sites against nonspecific adsorption,the amperometric immunosensor was prepared successfully.Hydrothermal method was also used to prepare cylinder-shaped TiO2nanorods,on which horseradish peroxidase (HRP) and signal antibody (Ab2) were immobilized to form the tracing labels.Bis(sulfosuccinimidyl) suberate sodium salt (BS3) was used as double amino crosslinking agent.Scanning electron microscopy (SEM),transmission electron microscope (TEM),and X-ray diffraction (XRD) were used to survey the structure,morphology and composition of the above materials.After a sandwich-type immunoreaction,the tracing labels were quantitatively captured on the immunosensor surface to generate electrochemical signals through a H2O2mediated HRP catalytic reaction.A linear range between 0.01 μg/L and 120 μg/L with a detection limit of 6 ng/L were obtained by differential pulse voltam-metry (DPV) for the quantitative determination of carcinoembryonic antigen.
TiO2nanowire arrays; electrochemical deposition method; gold nanoparticles; sandwich-type immunoreaction; carcinoembryonic antigen
2016-08-17.
国家自然科学基金(U1504215).
霍小鹤(1991-),女,硕士生,主要从事电化学生物传感器研究.*
,E-mail:13781157777@163.com.
O657.1
A
1008-1011(2017)01-0113-07
