草莓FabHLH3基因克隆表达分析与过量和干涉表达载体的构建
2017-03-06苗立祥张豫超杨肖芳蒋桂华
张 青,苗立祥,张豫超,杨肖芳,蒋桂华,*
(1.临安市农林技术推广中心,浙江 临安 311300; 2.浙江省农业科学院 园艺研究所,浙江 杭州 310021)
草莓FabHLH3基因克隆表达分析与过量和干涉表达载体的构建
张 青1,苗立祥2,张豫超2,杨肖芳2,蒋桂华2,*
(1.临安市农林技术推广中心,浙江 临安 311300; 2.浙江省农业科学院 园艺研究所,浙江 杭州 310021)
以八倍体草莓品种越心(Fragaria×ananassacv. Yuexin)为试材,利用RT-PCR技术从果实中克隆出FabHLH3基因全长编码序列,运用生物学软件对该序列进行相关生物信息学分析,同时采用实时荧光定量PCR方法对FabHLH3基因在不同组织、果实不同发育阶段及不同光质处理下的表达模式进行研究。测序和分析结果表明,FabHLH3基因的CDS全长2 094 bp,编码697个氨基酸残基,该蛋白质理论分子量约为77.43 ku、等电点(pI)为6.05;经DNAMAN分析,核苷酸序列和氨基酸序列与二倍体森林草莓(F.vesca)FvbHLH3基因的一致性分别为92.04%和90.87%。利用实时荧光定量PCR检测FabHLH3基因在叶、叶柄、花和果实中的表达情况,发现在叶中的表达量最高,随着果实发育,FabHLH3基因表达量逐渐增加,在半红期达到最高,红果期开始下降。此外,FabHLH3基因的表达还受到红光和蓝光的诱导。用无缝克隆技术构建了FabHLH3基因的过量表达载体pGreen-FabHLH3和干涉表达载体pGreen-FabHLH3i,为进一步验证FabHLH3基因的功能奠定了基础。
草莓;FabHLH3;基因克隆;表达模式;过表达和干涉表达载体
色泽是构成外观品质的重要指标,对鲜食果品及其加工具有重要的影响。色泽的形成主要由色素的种类和含量决定。植物中的色素主要有叶绿素、类胡萝卜素、花色素和甜菜素等4类。草莓是一种色、香、味倶佳的水果,在果实成熟过程中最明显的特征就是色泽的变化。已有研究表明,草莓成熟果实中最主要的色素是花青素,其中最主要成分是天竺葵素-3-O-葡萄苷[1]。
花青素是由类黄酮途径一个特异分支合成的,它的代谢可以分为上游的苯丙烷类代谢途径和下游的类黄酮代谢途径。花青素合成代谢途径各基因的表达丰度和调控机制直接影响色素的含量和组成。近年来的研究表明,转录因子在调控花青素代谢中也起着重要作用,特别是由MYB、bHLH和WD40组成的MBW三元复合体[2]。根据拟南芥MBW复合体(AtTT2、AtTT8和AtTTG1)的组成情况,Schaart等[3]利用酵母双杂交技术预测了草莓中的MBW复合体由FaMYB9/FaMYB11、FabHLH3和FaTTG1组成。
为了进一步探明FabHLH3在草莓中的表达特点,本试验以越心草莓果实cDNA为模板扩增bHLH3基因的全长,分析其在不同组织器官和果实发育期及不同光质条件下的表达特性;并将其全长CDS整合到植物表达载体上,构建出栽培草莓bHLH3基因的过量表达载体,同时选取CDS上的部分片段构建了干涉表达载体,从而为进一步验证草莓bHLH3基因的功能奠定基础。
1 材料与方法
1.1 植物材料及试剂
八倍体草莓越心植株在浙江省农业科学院海宁杨渡创新基地栽培;分别采取叶片、叶柄、花、小绿果、白果、半红果及红果,取样后立即在液氮中速冻并贮存于-70 ℃中;用红、黄、蓝、绿、白膜对草莓果实进行光质处理,在红果期进行取样。
反转录试剂盒(TransScript-Uni One-Step gDNA Removal and cDNA Synthesis SuperMix)、克隆载体(pEASY-Blunt Zero Cloning Kit)、克隆感受态细胞(Trans1-T1 Phage Resistant Chemically Competent Cell)、SYBR Green Ⅰ荧光定量试剂盒(TransStart Tip Green qPCR SuperMix)购自全式金公司;高保真DNA聚合酶(I-5TM2× High-Fidelity Master Mix)购自北京擎科新业生物技术有限公司;In-Fusion HD Cloning Plus购自宝生物工程(大连)有限公司;胶回收试剂盒(SanPrep Spin Column & Collection Tube)和荧光定量用吸头购自生工生物工程(上海)股份有限公司,其他试剂为国药药品;引物合成及克隆产物测序均委托北京擎科新业生物技术有限公司进行;荧光定量PCR板和膜购自罗氏诊断产品(上海)有限公司。
1.2 草莓总RNA的提取及总cDNA的合成
采用CTAB法从草莓各组织中提取总RNA;用反转录试剂盒(TransScript-Uni One-Step gDNA Removal and cDNA Synthesis SuperMix)进行DNA去除和cDNA合成,所得cDNA在-20 ℃保存备用。
1.3 基因全长扩增
50 μL PCR体系中,包括cDNA 1 μL,I-5TM2×High Fidelity Master Mix 25 μL,特异性上下游引物(10 μmol·L-1) Fa-b HLH3-Ford:5′- ATGGCGACACCGCCACCGAG -3′和 Fa-b-HLH3-Rev:5′- TTAAGAGTCAGACTGGGGTATGAC -3′各2 μL,用ddH2O补足至50 μL。反应程序为:98 ℃预变性2 min;98 ℃变性10 s,60 ℃退火15 s,72 ℃延伸15 s,35个循环;72 ℃终延伸 5 min,4 ℃终止反应并保存。
1.4 序列分析和结构预测
PCR产物经由1.0%琼脂糖凝胶电泳后,回收大小正确的片段,直接连接在克隆载体上,转化大肠埃希菌感受态并涂布于LB+Amp固体培养基平板上。37 ℃隔夜培养后,挑取形状规则的白斑,于LB+Amp液体培养基中培养并做菌落PCR,体系和程序同上,将扩增出大小正确条带的菌落送测。
利用NCBI Blastn/p、DNAMAN、ClustalX、MEGA5.0等生物软件进行氨基酸同源性比对,蛋白质分子量、等电点预测,以及基于氨基酸序列的系统进化树的构建。
1.5 基因表达验证
利用荧光定量PCR来检测FabHLH3基因在不同器官组织及处理中的表达水平,定量PCR仪为罗氏公司的LightCycler®96,FabHLH3基因荧光定量检测引物为FabHLH3-qFord:5′-GTAGTAGCAGACTCCGTGGTAT-3′和FabHLH3-qRev: 5′-GCACTGTCTTCCTCGTTTTGA-3′;内参基因actin的检测引物为actin-Ford: 5′-AGCGTGGTTACTCATTTAC-3′和actin-Rev: 5′-CATCAGGCAACTCATAGC-3′;试验体系包含2×transStart Tip Green qPCR SuperMix 10 μL,cDNA 0.1 μL,正反引物(10 μmol·L-1)各0.4 μL,用ddH2O补齐至20 μL;反应程序为94 ℃ 30 s;然后94 ℃ 5 s,60 ℃ 10 s,72 ℃ 30 s,45个循环;融解曲线为 95 ℃ 10 s,65 ℃ 60 s,97 ℃ 1 s;用GraphPad Prism 6进行数据处理和作图。
1.6FabHLH3基因过量表达载体和干涉载体的构建
利用NotⅠ和SpeⅠ快速内切酶酶切pGreenⅡ 62-SK质粒[4],电泳回收获得线性载体;设计包含线性载体末端重叠序列的引物(FabHLH3-35SFord: 5′-ACCGCGGTGGCGGCCGCATGGCGACACCGCCACCG-3′和FabHLH3-35Srev: 5′-CGGGGGATCCACTAGTTAAGAGTCAGACTGGGGT-3′),用高保真酶I-5TM进行扩增,电泳回收获得目的基因片段;选取FabHLH3基因CDS序列上356 bp序列构建干涉表达载体,用引物FabHLH3-RNAi-Sford(5′-ACCGCGGTGGCGGCCGCCTTTCTTCGTCGATCACCA -3′)和FabHLH3-RNAi-Srev (5′-CCTGACGACGCCTCCGGAGGCGTCGTCAGGGGA-3′)扩增干涉正向片段,用FabHLH3-RNAi-ASFord(5′-GGAGGCGTCGTCAGGGGA-3′)和FabHLH3-RNAi-ASRev(5′-CGGGGGATCCACTAGTCTTTCTTCGTCGATCACCA-3′)扩增干涉序列反向片段,电泳回收获得目的片段;利用In-Fusion HD Cloning Plus试剂盒进行无缝克隆,构建过量表达载体pGreen-FabHLH3和干涉表达载体pGreen-FabHLH3i。转化农杆菌感受态,挑选菌落,并进行菌落 PCR检测、质粒的双酶切及测序检测。
2 结果与分析
2.1FabHLH3基因克隆与序列
本研究利用CTAB法从栽培草莓品种越心半红期果实中提取出总RNA,再以总RNA为模板,利用RT-PCR技术扩增出与预期大小相符的条带。将该条带回收,连接于平端克隆载体后获得重组载体。测序结果表明,扩增片段长度为2 094 bp,编码697个氨基酸残基的假定蛋白质。该蛋白质理论分子量约为77.43 ku、等电点(pI)为6.05;与二倍体森林草莓的FvbHLH3(gene27827-v1.0-hybrid)[5]基因的核苷酸序列的一致性为92.04%,氨基酸序列的一致性为90.87%(图1、图2)。因此,扩增获得的基因为栽培草莓的bHLH3基因,我们将其命名为FabHLH3。用软件DNAStar对FabHLH3蛋白进行结构预测,其二级结构如图3所示。根据Chou-Fasman的经验参数法,FabHLH3蛋白的α-螺旋结构有25个,β-折叠结构有19个,转角结构有50个。氨基酸亲水性分析显示,FabHLH3蛋白的大多氨基酸都是亲水区域,蛋白骨架区内含有较多的柔韧区域,且分布不均匀,表明该蛋白的柔韧性较好,推测该蛋白属柔韧性较好的亲水性蛋白。
2.2 FabHLH3氨基酸序列同源性比较和系统进化
对已报道的bHLH3转录因子及文献来源的与FabHLH3功能相近的bHLH转录因子氨基酸序列,用MEGA 5.0软件构建系统进化树。图4进化树表明,草莓与蔷薇科中苹果属、梨属、李属等聚为一类,说明他们的进化关系较近,推测草莓与这些植物在进化过程中,具有某些相似的生理特征和形态特征。
2.3FabHLH3基因在不同组织中的表达

图1 FabHLH3与FvbHLH3核苷酸序列比对分析Fig.1 Alignment of FabHLH3 and FvbHLH3 using nucleotide sequence
草莓果实的发育要经历几个明显的过程,从开花坐果到绿色幼果到白果,再到开始转色的半红期,最后转红进入成熟期。利用荧光定量PCR技术研究了FabHLH3在越心草莓不同器官和果实发育期中的表达特性(图5)。结果显示,FabHLH3在草莓各器官中都有表达,其中在叶片中的表达量最高,在叶柄和花中的表达量相对较低。在果实中的表达量也显著低于叶片,随着果实逐渐成熟,FabHLH3的表达量呈先上升后下降的趋势,在果实半红期表达量达到最高,红果期开始下降。由此可见,FabHLH3与草莓果实着色存在着一定的相关性。
2.4FabHLH3基因在不同光质处理下的表达
利用红、黄、蓝、绿、黑和白膜处理草莓果实,研究了FabHLH3对不同光质的响应(图6)。结果表明,红和蓝光能够显著提高FabHLH3的表达量,其他光质与对照(白光)无显著差异。由此可见,FabHLH3能够受红光和蓝光的影响从而影响草莓果实着色进程。

图2 FabHLH3与FvbHLH3氨基酸序列比对分析Fig.2 Alignment of FabHLH3 and FvbHLH3 using amino acid sequence
图3 FabHLH3二级结构预测Fig.3 Prediction of FabHLH3 protein structure
2.5FabHLH3基因过量表达载体和干涉载体的构建
利用NotⅠ和SpeⅠ快速内切酶酶切pGreenⅡ 62-SK质粒,电泳回收获得线性载体;利用无缝克隆技术构建FabHLH3基因过量表达载体和干涉载体(图7)。转化农杆菌感受态,挑选阳性菌落,进行菌落 PCR验证,对重组质粒pGreen-FabHLH3和pGreen-FabHLH3i进行酶切验证,分别能切出2 000和700 bp左右片段,与预期大小一致(图8)。对阳性质粒送测序公司进行测序,所测出序列与预期构建序列完全一致。结果表明,过量表达载体pGreen-FabHLH3和干涉表达载体pGreen-FabHLH3i构建成功。
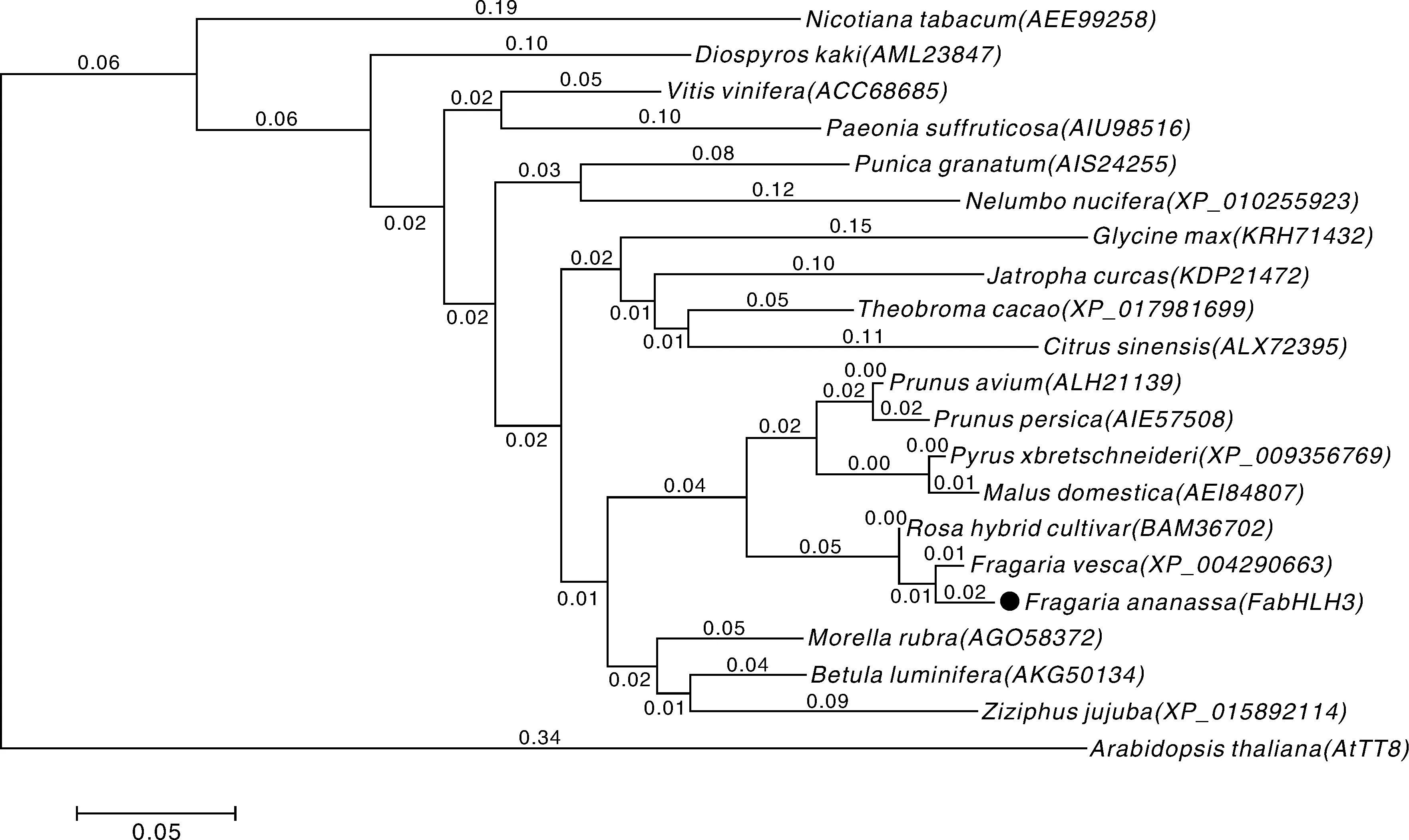
图4 FabHLH3与其他植物bHLH氨基酸推导序列系统进化树Fig.4 Phylogentic tree of bHLH deductive sequence of FabHLH3 and other plant species
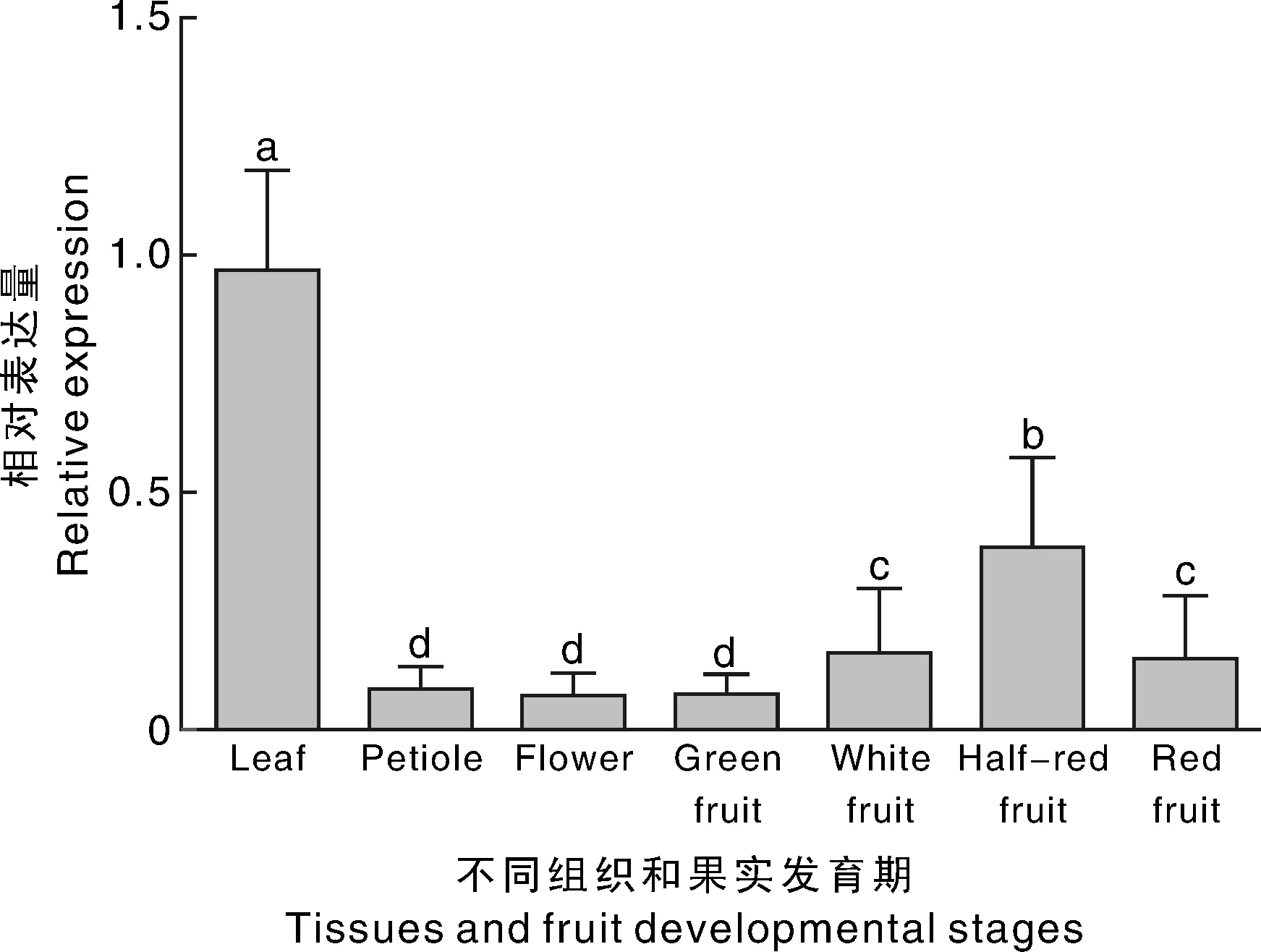
不同组织间没有相同小写字母表示差异显著(P<0.05).下同The different lowercase letters in different tissues show the significance at the level of 0.05.The same as below图5 FabHLH3在不同组织和成熟期草莓果实中的表达Fig.5 The expression of FabHLH3 in strawberry tissues and fruits at different maturity stages
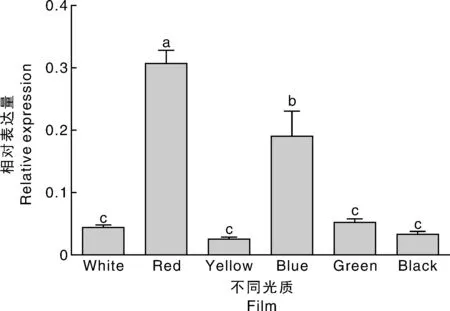
图6 不同光质条件下完全成熟果实中FabHLH3的表达Fig.6 The expression of FabHLH3 in strawberry fruits being grown under colored light-quality plastic film
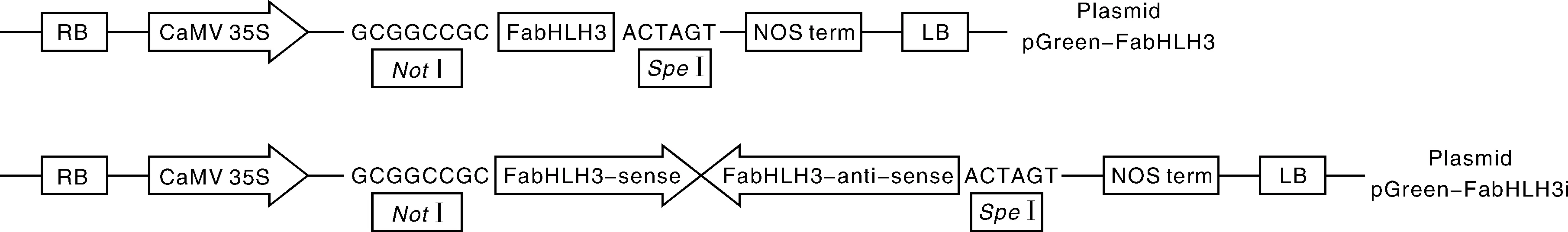
图7 无缝克隆构建FabHLH3基因过量表达载体和干涉表达载体Fig.7 Strategy for construction of overexpression and silencing vector of FabHLH3 by in-fusion
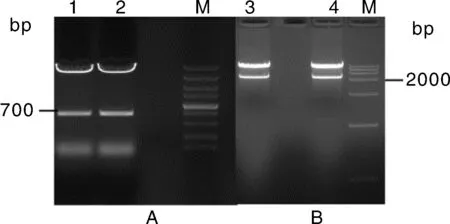
M: DNA marker;A: 酶切检测干涉表达载体pGreen-FabHLH3i的构建;1、2:挑选的2个阳性质粒酶切电泳;B:酶切检测过量表达载体pGreen-FabHLH3的构建;3、4:挑选的2个阳性质粒酶切电泳M: DNA marker; A: Analysis of pGreen-FabHLH3i vector by double digestion; 1, 2: Two products of recombinant with restriction enzyme sites; B: Analysis of pGreen-FabHLH3 vector by double digestion; 3, 4: Two products of recombinant with restriction enzyme sites图8 干涉表达载体和过量表达载体的检测Fig.8 Analysis of overexpression and silencing vector
3 讨论
成熟草莓果实中的主要花青素成分是天竺葵素,其合成除了受代谢途径的基因调控外,还受转录因子的影响。虽然草莓果实中存在着一个抑制花青素合成的转录因子MYB1[6],但最主要的是受MYB10转录因子的正向调控[7]。已有研究表明,在离体和植株上抑制果实中MYB10基因的表达都能使草莓果实不变红[8-9]。近年来越来越多的研究表明,花青素的合成是受MYB、bHLH和WD40组成的MBW三元复合体共同调控的[2,10]。拟南芥MBW复合体是AtTT2、AtTT8和AtTTG1组成的,Schaart等[3]利用酵母双杂交技术预测了栽培草莓中的MBW复合体由FaMYB9/FaMYB11,FabHLH3和FaTTG1组成的,这个MBW三元复合体既没有MYB10,也没有抑制因子MYB1,这几个基因的功能也没有明确。
bHLH转录因子广泛存在于动植物中,有着十分重要的转录调控作用。近年研究表明,bHLH家族的部分成员在植物花青素合成代谢中起着重要的调控作用[11-12]。本研究从越心草莓中分离克隆了FabHLH3基因,其核苷酸序列和氨基酸序列与野生二倍体森林草莓的FvbHLH3基因的一致性为92.04%和90.87%。在叶、叶柄、花和果实中都有表达,其中在叶中的表达量最高,随着果实发育FabHLH3基因表达量逐渐增加,在半红期达到最高,红果期略有下降。与之不同的是,有研究发现FabHLH78在果实中特异表达,且随着果实发育,表达量逐渐增加[12]。但当利用荧光定量PCR检测基因表达量时发现,FabHLH3与FabHLH78基因的表达模式类似,但其表达量是FabHLH78基因的100倍左右。
光质能够影响草莓果实中花青素的含量,也能影响产量和果实品质[13-15],其调控机理主要是通过影响合成酶活性和结构合成及转录调控因子基因的表达来实现[9,14]。本研究发现,FabHLH3基因的表达还受到不同光质的诱导,其中红光和蓝光能显著提高红果期的表达量。然而,作为MBW三元复合体中的一员,FabHLH3基因是如何调控花青素合成代谢的,还需要进一步研究。因此,我们用无缝克隆技术构建了FabHLH3基因的过量表达载体pGreen-FabHLH3和干涉表达载体pGreen-FabHLH3i,为进一步验证FabHLH3基因的功能奠定了基础。
[1] 荣宁宁, 苗立祥, 杨肖芳, 等, 反相高效液相色谱法测定草莓天竺葵素-3-O-葡萄糖苷的含量[J]. 浙江农业学报, 2014,26(3): 626-631. RONG N N, MIAO L X, YANG X F, et al. Determination of pelargonidin 3-O-glucoside in strawberry by reversed phase high performance liquid chromatography[J].ActaAgriculturaeZhejiangensis, 2014,26(3): 626-631. (in Chinese with English abstract)
[2] LI S. Transcriptional control of flavonoid biosynthesis: fine-tuning of the MYB-bHLH-WD40 (MBW) complex[J].PlantSignalingandBehavior, 2014, 9(12): e27522.
[3] SCHAART JG, DUBOIS C, ROMERO de la FUENTE, et al. Identification and characterization of MYB-bHLH-WD40 regulatory complexes controlling proanthocyanidin biosynthesis in strawberry (Fragaria×ananassa) fruits[J].NewPhytologist, 2013, 197(2): 454-467.
[4] HELLENS R P, ALLAN A C, FRIEL E N, et al. Transient expression vectors for functional genomics, quantification of promoter activity and RNA silencing in plants[J].PlantMethods, 2005, 1(1): 1-14.
[5] SHULAEV V, SARGENT D J, CROWHURST R N, et al. The genome of woodland strawberry (Fragariavesca) [J].NatureGenetics, 2011, 43(2): 109-116.
[6] AHARONI A, de VOS C, WEIN M, et al. The strawberryFaMYB1 transcription factor suppresses anthocyanin and flavonol accumulation in transgenic tobacco[J].PlantJournal, 2001, 28(3): 319-332.
[7] LIN-WANG K, BOLITHO K, GRAFTON K, et al. An R2R3 MYB transcription factor associated with regulation of the anthocyanin biosynthetic pathway inRosaceae[J].BMCPlantBiology, 2010, 10(2): 549-553.
[8] MEDINA-PUCHE L, CUMPLIDO-LASO G, AMIL-RUIZ F, et al.MYB10 plays a major role in the regulation of flavonoid/phenylpropanoid metabolism during ripening ofFragariaxananassafruits[J].JournalofExperimentalBotany, 2014, 65(2): 401-417.
[9] KADOMURA-ISHIKAWA Y, MIYAWAKI K, TAKAHASHI A, et al. Light and abscisic acid independently regulatedFaMYB10 inFragaria×ananassafruit[J].Planta, 2015, 241: 953-965.
[10] XU W, DUBOS C, and LEPINIEC L, Transcriptional control of flavonoid biosynthesis by MYB-bHLH-WDR complexes[J].TrendsinPlantScience, 2015, 20(3): 1-10.
[11] ALBERT N W, LEWIS D H, ZHANG H, et al. Members of an R2R3-MYB transcription factor family in Petunia are developmentally and environmentally regulated to control complex floral and vegetative pigmentation patterning[J].PlantJournalforCell&MolecularBiology, 2011, 65(5): 771-784.
[12] 豆玉娟, 曹飞, 马跃, 等. 栽培草莓果实中特异表达的bHLH78基因的克隆及过量表达载体构建[J]. 分子植物育种, 2014,12(3): 456-465. DOU Y J, CAO F, MA Y, et al. Cloning of bHLH78 gene expressed specifically in fruits of cultivated strawberry and construction of overexpression vector [J].MoecularPlantBreeding, 2014, 12(3):456-465. (in Chinese with English abstract)
[13] SHIUKHY S, RAEINI-SARJAZ M, CHALAVI V. Colored plastic mulch microclimates affect strawberry fruit yield and quality[J].InternationalJournalofBiometeorology, 2015, 59(8):1061-1066.
[14] MIAO L, ZHANG Y, YANG X, et al. Colored light-quality selective plastic films affect anthocyanin content, enzyme activities, and the expression of flavonoid genes in strawberry (Fragaria×ananassa) fruit[J].FoodChemistry, 2016, 207: 93-100.
[15] ZORATTI L, KARPPINEN K, LUENGO ESCOBAR A, et al. Light-controlled flavonoid biosynthesis in fruits[J].FrontiersinPlantScience, 2014, 5(5): 1-6.
(责任编辑 张 韵)
Cloning and expression analysis ofFabHLH3 gene from cultivated strawberry and construction of overexpression and silencing vector
ZHANG Qing1, MIAO Lixiang2, ZHANG Yuchao2, YANG Xiaofang2, JIANG Guihua2,*
(1.AgriculturalTechnologyExtensionCentreofLin’an,Lin’an311300,China; 2.InstituteofHorticulture,ZhejiangAcademyofAgriculturalSciences,Hangzhou310021,China)
The full-length cDNA sequence ofFabHLH3 gene was cloned from strawberry (Fragaria×ananassacv. Yuexin) through homology cloning method. Then, bioinformatics and expression pattern ofFabHLH3 gene were analyzed by some softwares and real-time fluorescent quantitative PCR technique, respectively. Sequence analysis showed that the cDNA ofFabHLH3 was 2 094 bp, encoding 697 amino acids, while the estimated molecular weight and isoelectric point of the putative protein were 77.43 ku and 6.05. After DNAMAN analysis, it shared 92.04% and 90.87% identity with the nucleotide sequence and amino acid sequence ofbHLH3 gene from woodland strawberry(F.vesca), respectively. The expression ofFabHLH3 was analyzed in leaf, petiole, flower and fruit being grown under colored light-quality plastic film. The results showed thatFabHLH3 was expressed in all the tissues and the highest level was found in leaf. The expression analysis showed that the expression level ofFabHLH3 was gradually increased during fruit development. The lowest expression was detected at small green fruit stage, and a reduced peak appeared at the full red stage. In addition, the expression ofFabHLH3 gene can be induced by red and blue light. The overexpression and silencing vectors ofFabHLH3, pGreen-FabHLH3 and pGreen-FabHLH3i, were constructed by in-fusion method with a plant expression vector pGreenII 62-SK. It would be used in functional analysis in the future research.
strawberry;FabHLH3; gene cloning; expression pattern; overexpression and silencing vector
10.3969/j.issn.1004-1524.2017.02.07
2016-10-14
国家自然科学基金(31201613);浙江省自然科学基金(LY16C150004)
张青(1962—),男,浙江临安人,高级农艺师,主要从事果树栽培技术推广。E-mail: zq373@163.com
*通信作者,蒋桂华,E-mail: jgh2004267@sina.com
S668.4
A
1004-1524(2017)02-0220-08
