标准化ADC评估宫颈癌的组织学类型及分化程度
2017-03-06强金伟田海萍王爱军
杨 蔚 强金伟 田海萍 陈 兵 王爱军
宫颈癌是妇科常见恶性肿瘤,占全世界女性肿瘤发病率的第三位、死亡率的第四位[1]。近年来,与宫颈鳞癌相比,宫颈腺癌及腺鳞癌数量有所增加。研究报告腺癌和低分化肿瘤比同分期的鳞癌和高分化的肿瘤更易复发、转移,对放疗的敏感性差,生存率明显低于鳞癌[2]。因此,早期准确地将两种病理类型进行鉴别非常重要。
常规MRI对于不同病理类型的宫颈癌表现相似。穿刺活检对于宫颈管内生型肿瘤以及分化程度高的宫颈腺癌易漏诊。扩散加权成像(diffusion-weighted imaging,DWI)为功能MR成像,通过检测活体组织水分子微观扩散运动而发现病变;其表观扩散系数(apparent diffusion coefficient,ADC)与细胞密度有很好的相关性[3-5]。但ADC值受多种因素的影响,结果并不十分可靠。有研究报道治疗前以膀胱尿液作为参照物的标准化ADC(normalized ADC,nADC)预测宫颈癌复发的诊断效能高于肿瘤ADC值,并且nADC95是宫颈癌复发的独立预后因素[6]。本研究拟选取患者膀胱尿液、臀大肌[7]的ADC值作为参照,并结合组织的细胞密度,通过标准化ADC对宫颈癌的病理学特征进行研究。
方 法
1.临床资料
收集首诊宫颈癌患者65例。其中鳞癌58例,高、中、低分化分别为12例、18例、28例;腺癌7例。患者年龄37~62岁,平均48.7岁。根据国际妇产科联盟(FIGO)分期指南,Ⅰ期14例,Ⅱ期28例,Ⅲ期18例,Ⅳ期5例。对宫颈鳞癌的病例通过病理图像分析系统自带的病理图像分析软件进行肿瘤细胞密度计数。
2.MRI检查方法
所有患者治疗前在3.0T MR系统进行常规盆腔平扫、DWI及增强扫描。横断位快速自旋回波(FSE)T1加权成像(T1WI),TR/TE 400ms/7.3ms;NEX 2;层厚/层间距8mm/1mm;FOV 380mm×380mm。横断位及矢状位脂肪抑制(FS)FSE T2加权成像(T2WI),TR/TE 4000ms/130.2ms;NEX 2;层厚/层间距:5mm/1mm;FOV 380mm×224mm。
DWI采用单次激发平面回波成像(echo planar imaging,EPI)序列行横断位扫描。扩散梯度b因子为0和1000s/mm2;TR/TE 2000ms/56.1ms;NEX 4;层厚/层间距 8mm/1mm;FOV:380mm×342mm。
增强扫描采用稳态进动快速成像序列(FSPGR)矢状位FS T1WI,TR/TE 160ms/2.1ms;NEX 2;层厚/层间距 5mm/1mm;FOV 240mm×240mm。高压注射器经肘前静脉以2ml/s的流率注射对比剂Gd-DTPA,剂量为0.2mmol/kg,然后再以同样流率注射生理盐水20ml冲管。
3.图像分析
将扫描的原始数据输入GE ADW4.4后处理工作站,使用其自带的FUNCTOOL软件进行数据处理。在DWI选择包括肿瘤实体部分的所有连续层面,沿着每个层面的肿瘤边缘手动绘制感兴趣区域(ROI),得到该层面的ADC值,将各个层面的ADC值平均作为肿瘤的ADC值。在选取ROI时,避免肿瘤囊变、坏死或出血等区域。在DWI选取膀胱充盈最饱满层面放置60~70mm2ROI,获得尿液的ADC值;在臀大肌肌腹中央放置面积约100mm2ROI,得到臀大肌的ADC值;分别计算nADC=肿瘤ADC值/参照物ADC值。
4.统计学分析
使用SPSS 17.0 软件进行统计分析。所有数值变量表示为平均值±标准差(SD)。P<0.05被认为具有统计学意义。变量组间比较采用单因素方差分析,组间两两比较采用LSD检验。对有显著性差异的变量,通过受试者工作特征(receiver operation characteristic,ROC)曲线分析,比较诊断效能。采用 Pearson 相关系数评估相关性。
结 果
宫颈鳞癌组的ADC值、nADC(尿液)、nADC(臀大肌)明显低于宫颈腺癌组,差异具有显著统计学意义(P均<0.001)。在鉴别宫颈鳞癌与腺癌时,ADC值、nADC(尿液)、nADC(臀大肌)的ROC曲线下面积(AUC)分别为0.869、0.876和0.943;nADC(臀大肌)诊断效能最高,阈值为 0.83,敏感性、特异性、PPV 和 NPV 分别为 100%、 91.4%、96.7%、100%(表1,2;图1)。
肿瘤ADC值、nADC(尿液)、nADC(臀大肌)和细胞密度在宫颈鳞癌不同分化组中有明显差异(P分别<0.001、<0.001、<0.001、0.004)。在鉴别宫颈鳞癌的分化程度时,肿瘤ADC值、nADC(尿液)、nADC(臀大肌)的AUC分别为 0.796,0.873和0.915;nADC(臀大肌)的诊断效能最高,阈值为0.73,敏感性、特异性、PPV和NPV分别为100%、78.6%、81.8%和100%(表3,4;图2,3)。
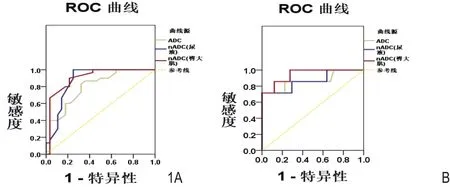
图1 A和B分别为ADC值、nADC(尿液)和 nADC(臀大肌)鉴别宫颈鳞癌与腺癌、宫颈鳞癌高-中分化与低分化的ROC曲线图。
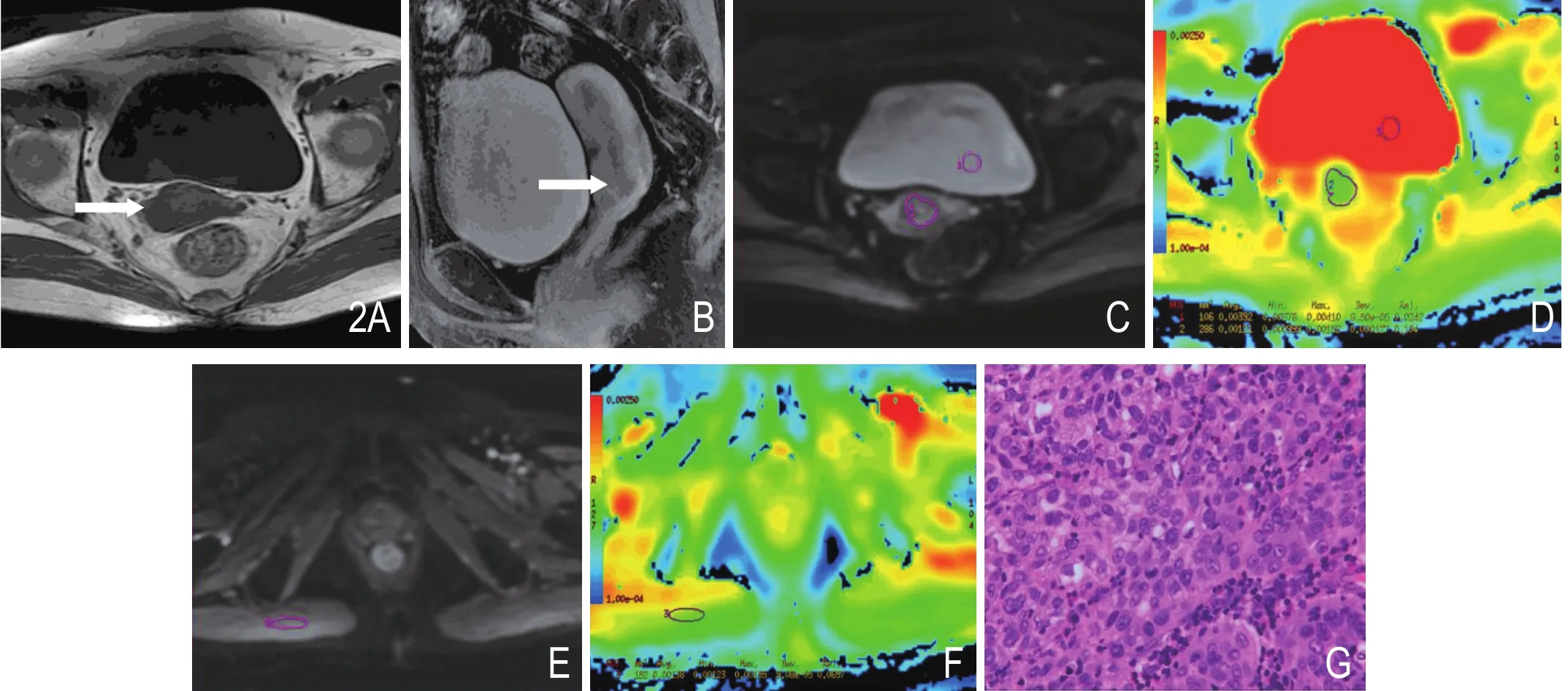
图2 52岁,宫颈低分化鳞状细胞癌。A.横断位T1WI示肿块不规则等低信号;B.矢状位增强T1WI示肿块信号混杂;C.横断位DWI示肿块明显高信号,选取肿瘤及尿液的ROI;D.对应的ADC图及肿瘤,尿液的ADC值;E.横断位DWI,选取臀大肌的ROI;F.对应的ADC图及臀大肌ADC值;G.HE染色(×200),提示宫颈低分化鳞状细胞癌,肿瘤细胞密集。

图3 45岁,宫颈腺癌。A.横断位T1WI示肿块不规则等低信号;B.矢状位增强T1WI示肿块信号混杂;C.横断位DWI示肿块明显高信号,选取肿瘤及尿液的ROI;D.对应的ADC图及肿瘤,尿液的ADC值;E.横断位DWI,选取臀大肌的ROI;F.对应的ADC图及臀大肌ADC值;G.HE染色(×200),提示宫颈中分化腺癌,肿瘤细胞中度密集。
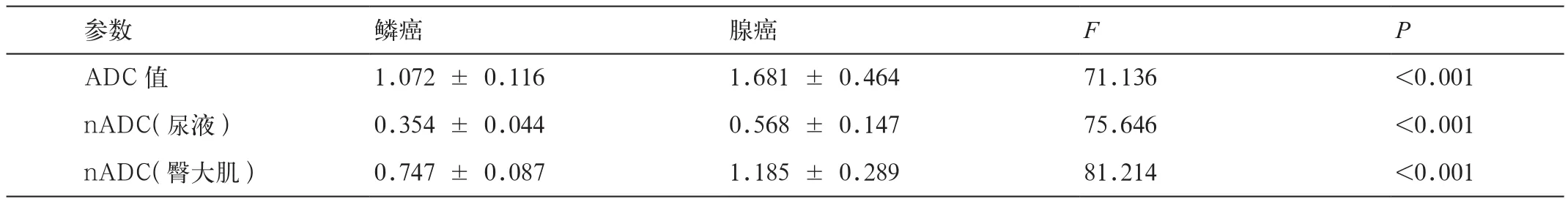
表1 不同ADC在宫颈鳞癌与腺癌间的比较

表2 不同ADC鉴别宫颈鳞癌与腺癌的诊断效能

表3 不同ADC及细胞密度在宫颈鳞癌高/中/低分化组间的比较
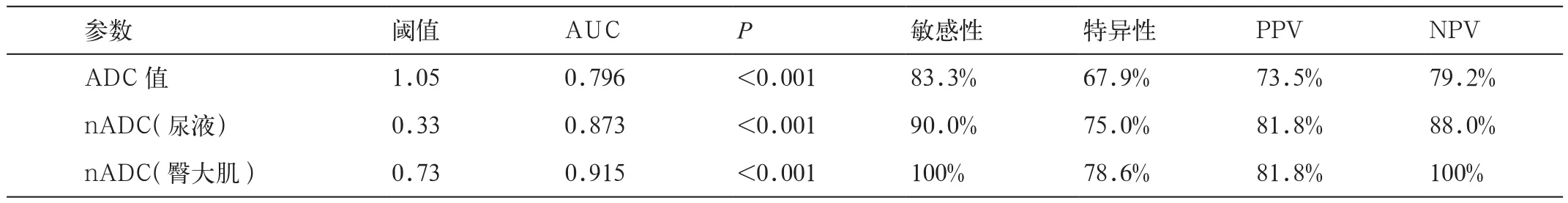
表4 不同ADC鉴别宫颈鳞癌高-中分化与低分化的诊断效能
细胞密度与宫颈鳞癌恶性程度正相关,相关系数r为0.349(P=0.007)。肿瘤ADC值、nADC(尿液)和nADC(臀大肌)与细胞密度负相关,相关系数r分别为-0.705、-0.449和-0.785(P均<0.001),其中nADC(臀大肌)与细胞密度的相关性最好。
讨 论
宫颈癌的预后不仅与肿瘤大小、分期、淋巴结转移等因素有关,还与肿瘤的组织学类型密切相关,也是选择治疗方案和决定预后的重要因素[8]。在我们的研究中,鳞癌的ADC值明显低于腺癌,差异具有统计学意义,这与大多数研究结论一致[3,9]。ADC值的差异反映出鳞癌与腺癌的组织结构不同。鳞癌结构致密,癌细胞呈巢状或片状排列,限制了水分子的扩散运动。而腺癌结构较为松散,呈腺管样排列,分泌大量黏液,水分子扩散增强。
通常DWI扫描采用双b值单指数模型,受T2穿透效应和灌注效应的影响,ADC值同时反应了水分子扩散运动和微循环灌注。一般认为b>200s/mm2,ADC值权重于组织内水分子的扩散运动;b<200s/mm2,ADC值权重于组织的血流灌注状态。在临床工作中,为了保证ADC值的准确性,多选用较高的b值。但b值升高,组织的信号强度会降低,图像信噪比下降,盆腔解剖及病灶的显示欠清晰,影响诊断。除了b值,ADC值还受很多因素的影像,包括不同的设备、扫描方案、当地气候等。这些因素可导致相同条件下ADC值5%~15%的差异[7,10]。这种较高的差异,降低了相同研究领域的可比性。为了降低ADC值的变异性,提高ADC值的准确性和可重复性,使用标准化ADC可能是必要的。在我们的研究中,对宫颈鳞癌与腺癌的鉴别,nADC(尿液)、nADC(臀大肌)的诊断效能均高于肿瘤ADC值。
细胞密度已被证明是重要的肿瘤分级指标,是在微观水平上影响肿瘤内水分子扩散的重要因素[3]。在我们的研究中,肿瘤ADC值,nADC(尿液)、nADC(臀大肌)与恶性程度、细胞密度具有相关性。并且nADC(臀大肌)在鉴别宫颈鳞癌恶性程度的诊断效能最高,以0.73作为阈值,AUC为0.915,敏感性、特异性分别为100%和78.6%。nADC(臀大肌)与细胞密度的相关性最好,能更准确地反映肿瘤的细胞密度。
在我们的研究中,选取尿液作为参照物时,患者在MRI检查前4~6小时需要排空膀胱尿液并禁食禁水,防止尿液被浓缩或稀释。测量臀大肌的ADC值时,分别测量左、右两侧臀大肌,并取其平均值。nADC(臀大肌)鉴别宫颈癌病理学特征的诊断效能高于nADC(尿液),我们考虑存在以下原因:首先,人体对水的代谢有差异,尿液的浓度不尽相同;其次,在我们的研究中,尿液的ADC值约(3.0~4.0)×10-3mm2/s,而臀大肌的ADC值约(1.3~1.5)×10-3mm2/s;标准化ADC计算公式=肿瘤ADC值/参照物ADC值,等式中分子变化不大,分母越大,比值越小,差异也就越小,显著性也会降低。
总之,标准化ADC能够有效地鉴别宫颈癌的组织学类型和分化程度,并且优于肿瘤ADC值。以臀大肌作为参照物的nADC诊断效能最高,与肿瘤细胞密度相关性最好。标准化ADC可以为宫颈癌病理学的相关研究提供一种新的方法。
[1]Siegel RL, Miller KD, Jemal A. Cancer statistics, 2015. CA Cancer J Clinic, 2015, 65: 5-29.
[2]吴海静,石 宇,张国楠. 子宫颈腺癌的临床研究进展. 中华妇产科杂志,2011,46:554-558.
[3]Liu Y, Ye Z, Sun H, et al. Clinical Application of Diffusion-Weighted Magnetic Resonance Imaging in Uterine Cervical Cancer. Int J Gynecol Cancer, 2015, 25: 1073-1078.
[4]Kuang F, Ren J, Zhong Q, et al. The value of apparent diffusion coef fi cient in the assessment of cervical cancer. Eur Radiol, 2013, 23:1050-1058.
[5]周 延,刘剑羽,刘从容,等. MR体素内不相干运动成像用于评价宫颈癌恶性程度和组织血供的价值. 中华放射学杂志,2015,49:354-359.
[6]Gladwish A, Milosevic M, Fyles A, et al. Association of apparent diffusion coef fi cient with disease recurrence in patients with locally advanced cervical cancer treated with radical chemotherapy and radiation therap. Radiology, 2016, 279: 158-166.
[7]Wang HJ, Pui MH, Guo Y, et al. Value of normalized apparent diffusion coefficient for estimating histological grade of vesical urothelial carcinoma. Clin Radiol, 2014, 69: 727-731.
[8]陆媛媛,黄群英,孙明华,等. ADC直方图区分宫颈癌常见病理类型的价值. 中国医学计算机成像杂志,2015,21:255-259.
[9]张 洁,薛华丹,张 玮,等. 多b值DWI与宫颈癌病理学特征的相关性研究. 放射学实践,2014,29:127-130.
[10]Itatani R, Namimoto T, Yoshimura A, et al. Clinical utility of the normalized apparent diffusion coef fi cient for preoperative evaluation of the aggressiveness of prostate cancer. Jpn J Radiol, 2014, 32: 685-691.
