CD34、MMP-9、VEGF、PCNA在骨巨细胞瘤中的表达及临床意义
2017-03-05彭仲华梁亮科
彭仲华,梁亮科
骨巨细胞瘤(giant cell tumor of bone,GCTB)是一类临床常见的骨肿瘤,多见于20~40岁人群,女性发病率高于男性[1]。大多数GCTB为良性肿瘤,25%~50%的患者治疗后复发,少数进展转移至肺部,一些患者复发或放疗后转为恶性[2]。近年来肿瘤病因机制的研究成果表明,肿瘤血管生成与多种肿瘤的发生、发展和预后密切相关[3-4],寻找合适的肿瘤分子标志物将有助于进一步阐明肿瘤的生物学行为。CD34是血管内皮细胞的特征性标志物,具有高再现性和稳定性;基质金属蛋白酶-9(matrix metalloproteinase,MMP-9)可间接降解胶原蛋白,标记后可用于研究内皮细胞的迁移和增殖[5-6];增殖细胞核抗原(proliferating cell nuclear antigen,PCNA)可以较好地反映细胞的增殖功能,是评价细胞增殖状态及恶性潜能的重要指标[7];而血管内皮生长因子(vascular endothelial growth factor,VEGF)可促进血管生长,与肿瘤的发生发展关系密切[8]。本文旨在观察CD34、MMP-9、VEGF、PCNA在GCTB组织中的表达水平,分析其与患者年龄、性别、肿瘤大小、Jaffe分级及预后的相关性,为GCTB的诊断与治疗提供临床依据。
1 资料与方法
1.1 一般资料
收集佛山市中医院三水医院及佛山市中医院2010年1月至2017年1月收治的80例GCTB患者的临床资料,其中男38例,女42例。平均年龄34岁(12~60岁)。肿瘤组织取材部位:脊柱7例、尺骨2例、桡骨6例、骶骨11例、股骨24例、胫骨14例、髋骨8例、指骨8例。所有肿瘤组织均经活检明确诊断为GCTB,以4%多聚甲醛固定,石蜡包埋,5 μm切片,常规苏木精-伊红染色。根据Jaffe分级[9]:Ⅰ级26例、Ⅱ级42例、Ⅲ级12例。
1.2 试验材料、仪器和试剂
免疫组化染色试剂盒;浓缩型DAB试剂盒;PBS;抗原修复液;HE染色试剂盒;CD34鼠抗人单克隆抗体、VEGF兔抗人单克隆抗体、PCNA鼠抗人多克隆抗体、MMP-9兔抗人多克隆抗体。以上试剂均由武汉谷歌生物科技有限公司提供。
1.3 检测方法
将石蜡包埋的切片脱蜡脱水,PBS洗涤3次(2 min/次),获取抗原。PBS洗涤3次(5 min/次),3%过氧化氢室温下洗涤切片15 min,去除内源性过氧化物酶活性,然后再次用PBS洗涤3次(5 min/次)。室温下将其滴入5%山羊血清封闭溶液中静止30 min,除去多余液体。加入CD34(1∶100)、MMP-9(1∶100)、VEGF(1∶100)、PCNA(1∶100)抗体,4 ℃下保存过夜,37℃下孵育1 h后PBS洗涤3次(5 min/次),滴加生物素化二抗及过氧化物酶标记的抗体。PBS洗涤切片(3次,5 min/次),DAB试剂染色并在显微镜下观察。最后洗涤5~15 min终止显色反应,苏木精-伊红染色并计数。每张切片在高倍镜下观察5个不同视野内的细胞染色情况,以胞浆或胞膜浅黄色或棕黄色为阳性细胞。
1.4 统计学方法
应用SPSS 19.0统计软件进行分析。计量资料以均数±标准差(x-±s)表示。计数资料以例表示,采用非参数秩和检验或卡方检验进行比较。CD34与MMP-9、VEGF、PCNA表达的相关性采用Spearman相关分析,P<0.05为差异有统计学意义。
2 结果
2.1 CD34、MMP-9、VEGF及PCNA在GCTB组织中的表达
2.1.1 CD34如图1所见,CD34阳性表达物(棕黄色表示阳性染色)定位于肿瘤间质小血管及微血管内皮细胞中。
2.1.2 MMP-9 MMP-9呈胞浆着色,阳性物质呈棕黄色,在GCTB中高表达,主要表达在多核巨细胞,部分单核基质细胞也有表达(图2)。
2.1.3 VEGF VEGF在GCTB中高表达,主要表达于肿瘤间质小血管及微血管内皮细胞中(图3)。
2.1.4 PCNA如图4所示,PCNA阳性表达于单核间质细胞的胞核内(棕黄色表示阳性染色)。
2.2 CD34、MMP-9、VEGF、PCNA的表达水平与GCTB临床相关参数的关系
CD34、MMP-9、VEGF、PCNA的阳性表达水
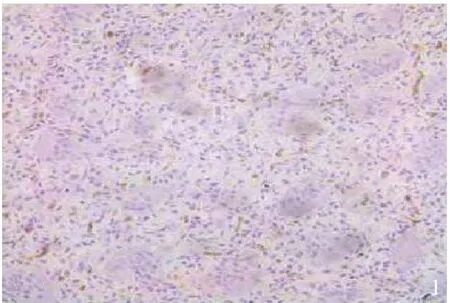
图1 CD34在骨巨细胞瘤组织中的表达(免疫组化染色×200)
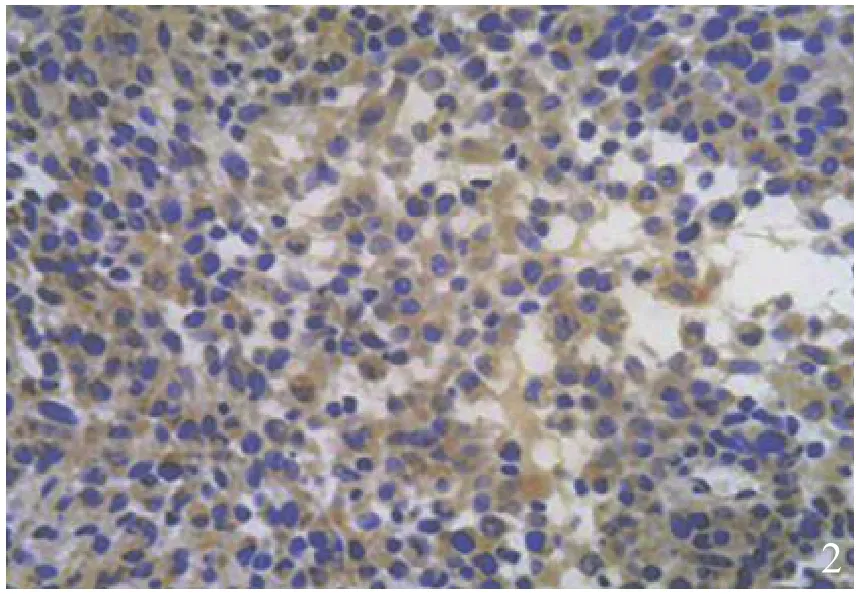
图2 基质金属蛋白酶-9在骨巨细胞瘤组织中的表达(免疫组化染色×200)
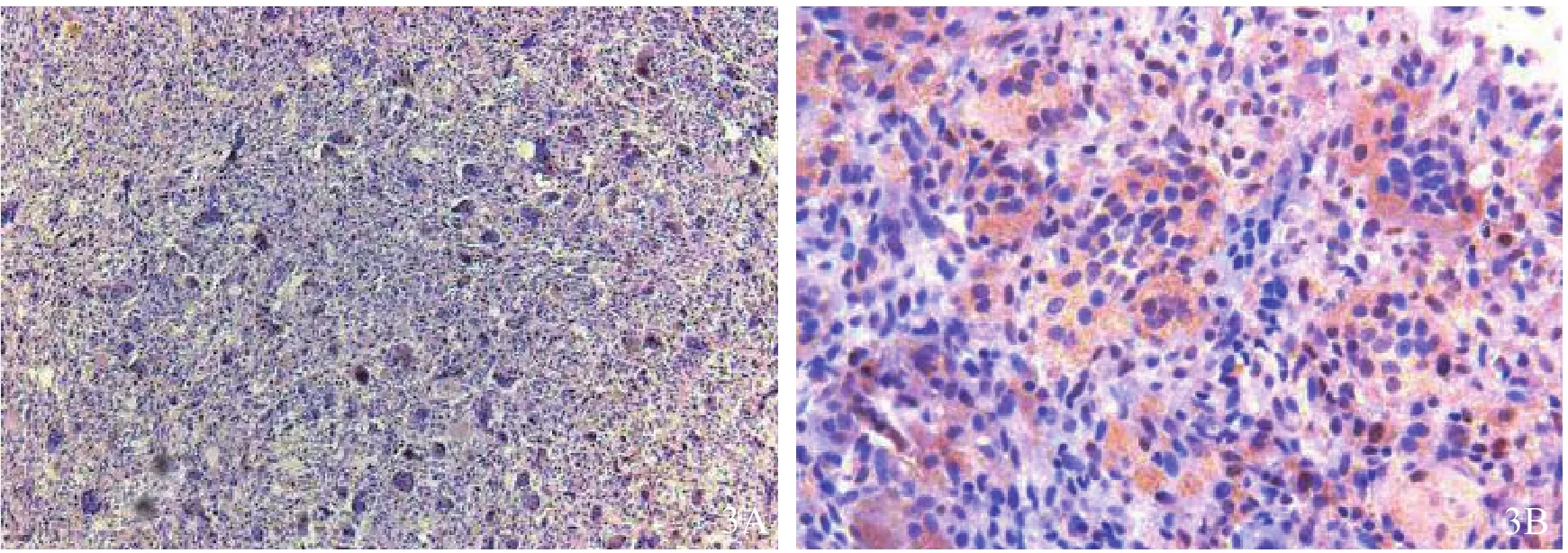
图3 血管内皮生长因子在骨巨细胞瘤组织中的表达 3A免疫组化染色×200 3B免疫组化染色×400
对于GCTB而言,病理学评分和影像学表现平与GCTB患者的年龄、性别无明显相关性(P>0.05),与肿瘤大小、Jaffe分级、预后之间存在显著相关性(P<0.05),见表1~4。
2.3 CD34与MMP-9、VEGF、PCNA表达的相关性
CD34与MMP-9、VEGF、PCNA的表达呈正相关(r=0.311,0.424,0.401;P=0.015,0.025,0.025),提示CD34可能通过某种途径调控或影响GCTB患者MMP-9、VEGF和PCNA的表达水平。
3 讨论
GCTB属于局部侵袭性肿瘤,术后复发率较高,生物学行为往往与组织学外观不一致。在对GCTB病因机制的研究中,人们发现GCTB的生长和转移与血管生成密切相关,因此,从分子水平深入探究肿瘤血管生成相关基因和蛋白产物表达水平,可为诊断和治疗GCTB提供了新思路、新策略[10-11]。
3.1 CD34、VEGF、MMP-9以及PCNA在GCTB发生发展中的作用及临床意义
并不能准确预测患者的预后,因此,研究CD34等细胞因子表达水平与GCTB临床相关参数的关系,对于指导GCTB手术方案、正确评估患者术后转归具有重要的临床意义。
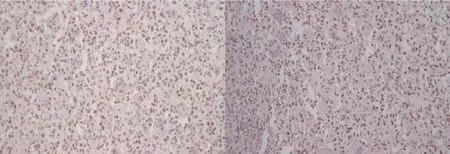
图4 增殖细胞核抗原在骨巨细胞瘤中的表达(免疫组化染色×200)

表1 CD34表达水平与GCTB临床相关参数的关系(例)
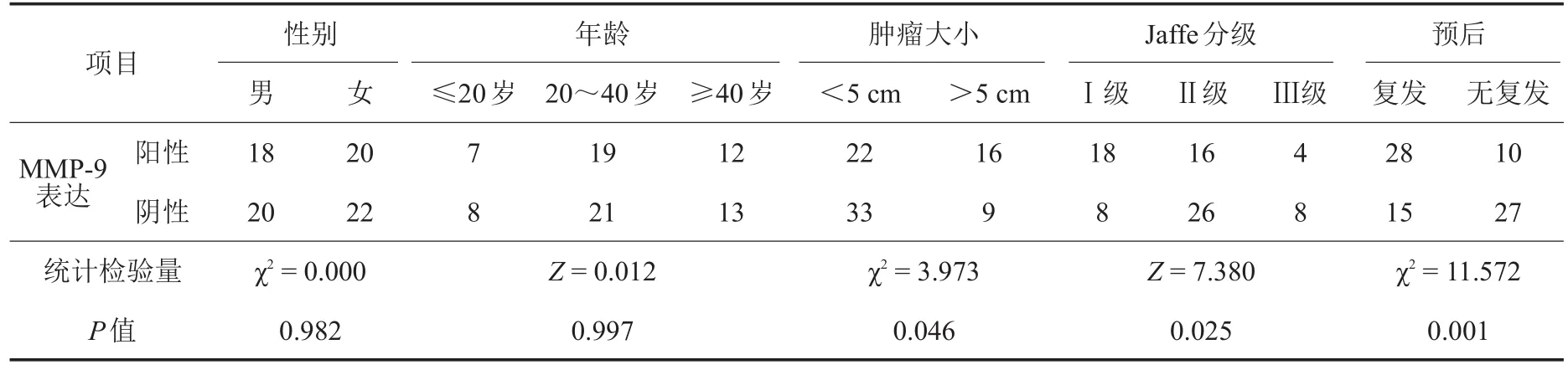
表2 MMP-9表达水平与GCTB临床相关参数的关系(例)

表3 VEGF表达水平与GCTB临床相关参数的关系(例)
3.1.1 CD34 CD34属于高度糖基化的Ⅰ型膜蛋白,在人造血干细胞和血管内皮细胞表面选择性表达[12-13],是血管内皮细胞的特异性标志物[10]。其常与VEGF一起被用于肿瘤血管的研究。
3.1.2 VEGF作为血管生成的重要激活剂,VEGF可促进新生血管的形成[14-15],从而为肿瘤的生长和转移创造有利条件。目前的研究证实,肿瘤细胞的生长、浸润和血行转移均与肿瘤新生血管的形成有关,而VEGF在血管内皮细胞的增殖、分化、迁移中起到了积极的促进作用。

表4 PCNA表达水平与GCTB临床相关参数的关系(例)
王华等[16]对69例GCTB患者进行随访研究,结果提示,CD34、VEGF与肿瘤预后密切相关;叶恒志等[17]亦指出,VEGF、MMP-9的表达与GCTB的血管生成、细胞增殖、转移及复发有关;韩跃虎等[18]也有类似发现,认为VEGF、PCNA和MMPs与GCTB肿瘤大小、Jaffe分级、预后之间均存在显著相关性。
3.1.3 MMP-9 MMP是金属蛋白酶家族中的一员,可降解细胞外基质中的各种蛋白和胶原成分,破坏正常的组织学屏障,在肿瘤浸润、侵袭和转移过程中扮演重要角色,因此与肿瘤的临床进展及预后显著相关[5]。其中MMP-9主要由巨噬细胞、中性粒细胞、肥大细胞等炎症细胞及炎症因子合成或分泌,生理状态下参与细胞外基质的代谢过程,并在骨组织改建、胚胎发育、损伤愈合及机体排异反应等生理过程中发挥作用,而其异常活化时常导致病理改变,除可降解细胞外基质,还能释放具有生物学活性的VEGF[19-20]。
Lozonschi等[21]指出MMP-9具有间接调节肿瘤血管生成的作用;Kumta等[10]则发现MMP-9在GCTB细胞中明显上调。Han等[13]的研究结果揭示GCTB患者MMPs表达水平与Jaffe分级关系密切;Zhou等[5]则发现,CD34和MMP-9与GCTB患者微血管密度(microvessel density,MVD)值呈明显正相关,且与恶性程度分级密切相关。MMP-9与GCTB局部复发的相关性目前也得到了有关研究的证实[13]。这些观点与我们的研究结果相一致,MMP-9与GCTB患者性别、年龄无关,而与肿瘤大小、Jaffe分级、预后之间存在显著相关性。
3.1.4 PCNA PCNA是一种细胞周期调节蛋白,可以反映肿瘤组织的细胞代谢水平以及肿瘤DNA、RNA的合成情况,其过度表达可提示肿瘤细胞分化、浸润、转移、复发和预后等生物学过程[13]。Saxena等[22]的研究结果提示,复发组(25例)GCTB患者较原发组PCNA增殖指数有明显增加,提示更高的细胞增殖水平与GCTB复发有关。本研究结果也证实了PCNA与GCTB肿瘤分级及预后之间存在相关性。
3.2 GCTB患者肿瘤组织CD34与VEGF、MMP-9、PCNA表达水平的相关性
我们的研究结果显示,CD34与GCTB肿瘤组织中MMP-9、VEGF、PCNA的表达水平呈正相关,而GCTB的生长和转移又与血管生成密切相关,因此推测CD34可能通过某种途径调控或影响MMP-9、VEGF、PCNA表达,最终介导骨巨细胞瘤的新生血管形成,促进内皮细胞的增殖和肿瘤边缘的进展,提示在临床上检测上述指标有助于判断肿瘤的侵袭性。
总之,CD34、MMP-9、VEGF、PCNA在GCTB的发生发展中担负着重要作用,其表达水平可作为辅助诊断、评估肿瘤恶性程度及评价预后的重要参考指标。
[1]胥少汀,葛宝丰,徐印坎.实用骨科学[M].4版.北京:人民军医出版社,2012
[2] Skubitz KM.Giant cell tumor of bone:current treatment options[J].Curr Treat Options Oncol,2014,15(3):507-518.
[3]Sobti A,Agrawal P,Agarwala S,et al.Giant cell tumor of bone:an overview[J].Arch Bone Jt Surg,2016,4(1):2-9.
[4] Li C,Zheng X,Ghert M,et al.Expressions and clinical significance of factors related to giant cell tumor of bone[J].Int J Clin Exp Med,2015,8(12):22509-22514.
[5] Zhou X,Liu XZ,Fan GT,et al.Expression of matrix metalloproteinase-9 and CD34 in giant cell tumor of bone[J].Orthop Surg,2016,8(2):220-225.
[6]Mak IW,Seidlitz EP,Cowan RW,et al.Evidence for the role of matrix metalloproteinase-13 in bone resorption by giant cell tumor of bone[J].Hum Pathol,2010,41(9):1320-1329.
[7]Byrne-Steele ML,Ng JD.Expression,purification and preliminary X-ray analysis of proliferating cell nuclear antigen from the archaeon thermococcusthioreducens[J].Acta Crystallogr Sect F Struct Biol Cryst Commun,2009,65(Pt 9):906-909.
[8]Andisheh-Tadbir A,Hamzavi M,Rezvani G,et al.Tissue expression,serum and salivary levels of vascular endothelial growth factor in patients with HNSCC [J].Braz J Otorhinolaryngol,2014,80(6):503-507.
[9]Jaffe HL,Lichtenstein L,Portis RB.Giant cell tumor of the bone:its pathological appearance,grading,supposed variant and treatment[J].Arch Pathol,1940,30:993-995.
[10]Kumta SM,Huang L,Cheng YY,et al.Expression of VEGF and MMP-9 in giant cell tumor of bone and other osteolytic lesions[J].Life Sci,2003,73(11):1427-1436.
[11]Fu S,Bai R,Zhao Z,et al.Overexpression of hypoxiainducible factor-1α and vascular endothelial growth factor in sacral giant cell tumors and the correlation with tumor microvessel density[J].Exp Ther Med,2014,8(5):1453-1458.
[12]Susarla SM,August M,Dewsnup N,et al.CD34 staining density predicts giant cell tumor clinical behavior[J].J Oral Maxillofac Surg,2009,67(5):951-956.
[13]Han YH,Gao B,Huang JH,et al.Expression of CD147,PCNA,VEGF,MMPs and their clinical significance in the giant cell tumor of bones[J].Int J Clin Exp Pathol,2015,8(7):8446-8452.
[14]Zhang J,Dong J,Yang Z,et al.Expression of ezrin,CD44,and VEGF in giant cell tumor of bone and its significance[J].World J Surg Oncol,2015,13:168.
[15]Zheng MH,Xu J,Robbins P,et al.Gene expression of vascular endothelial growth factor in giant cell tumors of bone[J].Hum Pathol,2000,31(7):804-812.
[16]王华,顾洁夫,蔡林,等.血管内皮生长因子与骨巨细胞瘤预后的关系[J].武汉大学学报(医学版),2005,26(4):517-519.
[17]叶恒志,张其亮,扬树华.骨巨细胞瘤MMP-9、血管内皮生长因子表达及其意义[J].肿瘤学杂志,2004,10(5):320-322.
[18]韩跃虎,杨柳,黄景辉,等.CD147、PCNA、VEGF和MMPs在骨巨细胞瘤中的表达及临床意义[J].中国骨与关节外科,2012,5(1):65-71.
[19]曾弘,文剑明,李海刚,等.骨巨细胞瘤中MMP-9和TIMP-3的表达及临床意义[J].中山大学学报(医学科学版),2009,30(1):74-77.
[20]李颖智,金海鸿,秦悦洋,等.VEGF、MMP-9表达水平与骨巨细胞瘤侵袭性相关性[J].中国实验诊断学,2013,17(11):1989-1991.
[21]Lozonschi L,Sunamura M,Kobari M,et al.Controlling tumor angiogenesis and metastasis of C26 murine colon adenocarcinoma by a new matrix metalloproteinase inhibitor,KB-R7785,in two tumor models[J].Cancer Res,1999,59(6):1252-1258.
[22]Saxena CC,Safaya R,Kawatra Madan N,et al.Histopathological,immunohistochemical,and image analytic parameters characterizing the stromal component in primary and recurrent giant cell tumor of bone[J].J Clin Orthop Trauma,2016,7(2):109-114.
