心梗大鼠持续和间歇运动干预的心肌血管新生相关miRNAs表征与EGFL7/miR126-PIK3R2 /SPRED1通路激活的心脏保护效应
2017-03-04宋伟田振军ShaojunDu
宋伟,田振军,Shao-jun Du
心梗大鼠持续和间歇运动干预的心肌血管新生相关miRNAs表征与EGFL7/miR126-PIK3R2 /SPRED1通路激活的心脏保护效应
宋伟1,田振军1,Shao-jun Du2
心肌梗死(Myocardial infarction,MI)导致心肌细胞缺血缺氧,发生替代性纤维化,严重损害心功能。常用的治疗手段有药物治疗、介入治疗和外科手术治疗等。但心梗患者的早期预防和治疗后的康复手段与方法筛选至关重要[10,29]。动物和人体临床研究发现,持续和间歇运动干预在心梗心脏康复中发挥积极作用[23,24,52],其机制尚未完全阐明。
Micro RNA(miRNA)是一类在进化上高度保守的单链非编码小RNA,长约18~25个核苷酸,可通过对靶mRNA的降解或抑制翻译方式负调控靶基因[32]。近年来的表观遗传学研究发现,miRNA在缺血心脏保护中发挥重要作用[39,46],目前已经证实,心梗后有数条miRNAs表达发生变化,并通过不同途径参与心梗心脏功能的调控[6,21,38]。运动可有效改变机体心肌、骨、骨骼肌和血液等多个器官和部位的miRNAs表征[5,16,35],大鼠10周游泳训练后心脏的48 条miRNA显著升高,39条miRNA显著降低[40]。耐力训练可降低心肌miR-1和miR-133a的表达,同时激活miR-208a、miR-499下游调节通路。提示,miRNA表达可能参与了心脏重塑的适应过程[4],但miRNA在运动保护心梗心脏功能的作用,缺乏文献报道。
心梗治疗与康复的关键是血运重建。研究发现,miRNA可靶向刺激血管内皮生长因子(VEGF)通路的PIK3R2/ SPRED1发挥血管新生作用[12],但在运动刺激心梗心脏血管新生中相关的miRNAs是否表达,发挥心功能保护作用,尚缺乏文献报道。本研究通过测定持续和间歇运动后心梗大鼠心肌血管新生显著相关miRNAs(包括促血管新生的miR-126、miR-130a、miR-17-5p及抗血管新生的miR-15b、miR-16、miR-221、miR-222)和miR-126宿主基因egfl7及其靶蛋白的表达,分析miRNA与血管新生在运动保护心梗心脏功能中的作用,旨在为缺血心脏运动康复机制研究与运动康复手段及方法筛选提供实验依据。
1 材料与方法
1.1 主要仪器
主要仪器:ZH-PT8通道动物跑台、BX51奥林巴斯光学显微镜、SZX16奥林巴斯体视显微镜、Powerlab/8ST生物信号采集处理系统、Thermo scientific超低温冰箱、LEICA RM2126切片机、BMII型病理组织包埋机、Bio Tek epoch超微量微孔板分光光度计、Bio Rad CFX96实时荧光定量PCR仪、DYCZ-24EN水平电泳仪和Bio MP4转膜仪、Thermo Fisher Fresco21低温高速离心机、Bio-Rad Chemidoc MP全能型凝胶成像系统。
1.2 动物分组、心梗模型制备与运动方案
雄性清洁级3月龄SD大鼠(购自西安交通大学医学院实验动物中心,动物合格号为SCXK2012-098)40只,适应性喂养1周后,随机分为假心梗组(S)、心梗组(MI)、心梗+间歇运动组(MIE)、心梗+持续运动组(MCE),每组10只。采用左冠状动脉前降支结扎法制备心肌梗死模型,假手术组仅穿线不结扎,各组大鼠分笼饲养,自由进食、饮水。
心梗大鼠模型制备:大鼠称重,腹腔麻醉(戊巴比妥钠30 mg/kg),采用人工面罩呼吸,连接呼吸机和心电图机,心电图监测采用肢体导联。开胸,暴露心脏,体视显微镜下于左心耳下缘2 mm处结扎左冠状动脉前降支,进针深度为0.3~0.5 mm。肉眼可见结扎远端心肌颜色变浅,心电图ST段弓背向上抬高为结扎成功标志。探查无出血后留管关胸并排气。
间歇运动方案:参考Kraljevic等[24]心梗4周后的8周间歇运动方案。一般心梗手术后1~4周为血管新生高峰期,故本实验选择术后1周开始跑台适应性训练(15 m/min,30 min/天×5天)。之后以25 m/min×4min(85%~90%V˙O2max)和15 m/min×3 min(50%~60%V˙O2max)依次交替进行7轮,最后以10 m/min速度运动1 min,运动总距离为1 065m,运动总时间为60 min,5天/周×8周。
持续运动方案:心梗手术1周后开始进行跑台适应性训练(15 m/min,30 min/天×5天)。正式训练以10 m/min速度(40%~50%V˙O2max)运动5 min,之后以16 m/min(50%~60%V˙O2max)速度持续运动64 min,最后以10 m/min速度运动1 min,运动总距离与间歇运动相同,总时间为75 min,5 天/周×8周。
1.3 心功能测定
训练结束后次日,腹腔麻醉,经右颈总动脉插管至左心室,以动脉血压和心室内压波形变化作为判断插管成功的标志,之后将导管连同右颈总动脉结扎固定,稳定数分钟后,采用生物信号采集系统记录左室收缩压(LVSP)、左室舒张末压(LVEDP)、左室压力最大上升和最大下降速率(±dp/dt max)等指标。
1.4 取材、样品处理与组织学实验
取材与样品处理:心功能测毕即刻迅速开胸,摘取心脏,4只速入10%中性甲醛固定,剩余6只速入液氮,24 h后移置-80℃冰箱待用。甲醛固定标本进行常规石蜡包埋,连续切片(厚度5 μm)。石蜡切片进行常规Masson染色,每张染色切片测量心肌胶原容积分数(Collagen Volume Fraction,CVF),CVF=胶原面积/心肌组织总面积×100%。
免疫组织化学实验:切片经3%H2O2灭活内源性酶,微波炉加热抗原修复。一抗为兔源单克隆抗体CD31(稀释浓度1:200,SAB)。阴性对照采用PBS替代,DAB显色,苏木素复染,常规脱水,透明,封片,显微镜观察。α-SMA阳性判定采用积分光密度法(Integrated Optical Density,IOD)。CD31阳性判定按Weidner标准进行[50],即棕黄色单个内皮细胞或者内皮细胞簇均为1个血管计数,肌层较厚及管腔大于8个红细胞直径的血管不计数。×10倍镜下观察血管高密度区,×400倍镜下计数,每个样本计数5张切片,计算微血管平均密度值(microvessel density,MVD)。
1.5 Western Blot实验
心肌组织50 mg加入预冷蛋白抽提试剂,电动匀浆机匀浆,4℃离心,12000 rpm持续15 min,取上清,BCA试剂盒蛋白定量。常规制胶、上样、电泳、转膜,3%BSA室温封闭1 h,孵育一抗PIK3R2(1:500,Signalway Antibody)、SPRED1(1:500,Merck Millipore),VEGF(1:800,SAB)4℃过夜。次日复温30 min,清一抗,孵育山羊抗兔二抗(1:10000),室温50 min,洗二抗,ECL发光,全能型凝胶成像系统成像,内部参照为GAPDH。
1.6 RT-qPCR实验
常规Trizol试剂提取MI心脏梗死边缘区心肌组织总RNA,登陆www.mirbase.org查阅相关miRNA序列,管家基因以U6作为内参,U6基因上游引物序列为5-CTCGCTTCGGCAGCACA-3。7条miRNAs引物由宝生物工程(大连)有限公司合成,其上游引物序列为:rno-miR-15b,TAGCAGCACATCATGGTTTACA;rno-miR-221,AGCTACATTGTCTGCTGGGTTTC;rno-miR-222,TCCTACATCTGGCTACTGGGT;rno-miR-16,TAGCAGCATAGAAATATTGGCG;rnomiR-17-5p,CAAAGTCCTTACAGTGCAGGTAG;rno-miR-130a,GGTCCTGAATGTTAAAAGGGCAT;rno-miR-126,GGCATTACTTTTGGTACGCGAAA。下游引物皆为TAKARA提供的通用引物,退火温度均为70℃。
pik3r2、spred1、egfl7引物由宝生物工程(大连)有限公司合成,内参基因为gapdh,序列分别为pik3r2,F:5-GGCC CTTGGATGGACCTTCT-3,R:5-GCTCAATGGCTTCTATCAGC TTCAC-3,退火温度58℃;spred1,F:5-GGAGCCTCAAGTCCCAAGCTA-3,R:5-TTTCCAC ATGTCCGGATGTC-3,退火温度55℃;egfl7,F:TGACTAGAGGCCGGACCACA,R:GCCAGTACTAG AAACCACGCTACAA,退火温度为55℃;gapdh,F:5-CAGTGCCAGCCTCGTCTCAT-3,R: 5-AGGGGCCATCCACAGTCTTC-3,退火温度55℃;分别参见QIAGEN和TAKARA公司试剂盒对miRNA和目标基因进行逆转录和实时RT-qPCR扩增反应。
1.7 图像与数据处理
免疫组化切片经光镜观察、拍照,Image Pro-plus 6.0软件进行测量分析;Real time RT-PCR数据采用2—△△Ct法计算样品miRNA相对含量;Western Blot实验结果采用Adobe Photoshop CS6和Image J软件采集处理。所有数据采用GraphPad Prism 5.0 Demo软件转换作图;数据均采用SPSS17.0进行one-way ANOVA和皮尔逊指数相关分析。所有实验结果用平均数±标准差(X±SD)表示。显著性差异选择P<0.05和P<0.01水平。
2 实验结果
2.1 心肌血管新生相关miRNAs的RT-qPCR检测结果
血管新生相关miRNAs表达的RT-qPCR结果显示,与S组比较,MI组miR-222表达显著上调(P<0.05),miR-126表达显著下调(P<0.05);与MI组比较,MIE组miR-17-5p、miR-126表达均显著上调(P<0.05,P<0.01);与MCE组比较,MIE组miR-126表达显著上调(P<0.05),其余各组miR-15b、miR-16、miR-221、miR-130a均无显著性变化(图1)。
具有显著变化的miRNAs表达平均值变化率统计显示,与S组比较,MI组miR-126表达降低38%,miR-222表达升高30%;与MI组比较,MIE组miR-126表达升高47%,miR-17-5p升高31%;与MCE组比较,MIE组miR-126平均值变化率为22%(图1)。
表明,心梗后miR-222表达显著上调,miR-126表达显著下调;心梗大鼠进行运动干预后miR-126、miR-17-5p的表达均显著上调,其中,miR-126表达变化最显著。
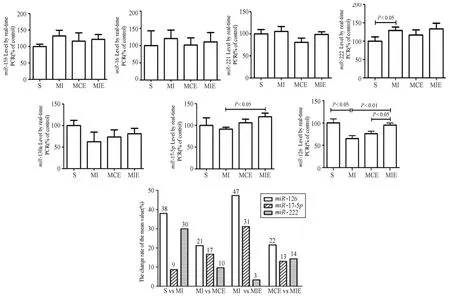
图1 心梗大鼠心肌血管新生相关miRNAs的RT-qPCR检测结果及平均值变化率Figure 1.Expression of Myocardial miRNAs Related to Angiogenesis(RT-qPCR)and the Change Rate of the Mean Value
2.2 心肌PIK3R2和SPRED1基因和蛋白表达结果
pik3r2 mRNA和spred1 mRNA表达的RT-qPCR结果显示(图2),与S组比较,MI组均显著上调(P<0.05);与MI组比较,MCE和MIE组表达均显著下调(P<0.05,P<0.01);与MCE组比较,MIE组spred1mRNA表达显著下调(P<0.05),pik3r2 mRNA表达无显著变化。
PIK3R2和SPRED1表达的Western Blot结果显示(图2),与S组比较,MI组PIK3R2表达显著上调(P<0.01),SPRED1表达无显著变化;与MI组比较,MCE和MIE组均显著下调(P<0.01,P<0.05);与MCE组比较,MIE组SPRED1表达显著下调(P<0.05)。
表明,心梗大鼠进行运动干预可抑制miR-126下游靶基因和蛋白PIK3R2/SPRED1的表达,且间歇运动的抑制效应优于持续运动。

图2 心梗大鼠心肌PIK3R2和SPRED1 mRNA和蛋白表达结果Figure 2.Gene and Protein Expression of miR-126 Targets
2.3 心肌egfl7 mRNA表达及其与miR-126表达相关性
心肌egfl7 mRNA的RT-qPCR结果显示(图3),与S组比较,MI组表达显著下调(P<0.01);与MI组比较,MIE组表达显著上调(P<0.01),MCE组表达无显著变化。egfl7 mRNA与miR-126的相关性分析结果显示(图3),两者表达呈显著正相关(R=0.65,P<0.05)。
表明,心梗大鼠进行持续和间歇运动干预可激活miR-126宿主基因egfl7的表达,且egfl7 mRNA与miR-126表达变化关系密切。
2.4 心肌血管新生、间质胶原与心功能测定结果
CD31是血管内皮细胞标记物,可反映血管新生状况。免疫组化结果显示,CD31蛋白阳性表达为棕色,主要分布于血管内皮细胞膜。与S组比较,MI组表达显著升高(P<0.05);与MI组比较,MIE组表达显著升高(P<0.05);与MCE组比较,MIE组表达显著升高(P<0.05)。心肌VEGF的Western Blot结果显示,与S组比较,MI组、MCE组和MIE组均表达显著上调(P<0.05,P<0.01);与MI组比较,MIE组表达显著上调(P<0.01,图4)。表明,心梗后梗死边缘区发生代偿性血管新生,运动干预可促进梗死边缘区的血管新生,且间歇运动更显著。
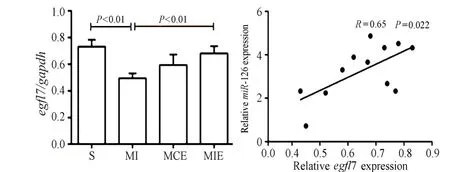
图3 心梗大鼠心肌egfl7 mRNA及其与miR-126表达的相关分析结果Figure 3.Expression of egfl7 mRNA and The Correlation Analysis between miR-126 and egfl7 mRNA
α平滑肌肌动蛋白(α-SMA)是肌动蛋白的亚型之一,特异性表达于血管平滑肌细胞(VSMC)胞浆中,是收缩型VSMC的标志蛋白。免疫组化结果显示(图5),与S组比较,MCE组表达显著升高(P<0.05);与MI组比较,MIE组表达显著升高(P<0.05)。表明,间歇运动干预可使梗死边缘区VSMC发生表型逆转,由合成型转化为收缩型。
心肌Masson染色结果显示,心肌胶原纤维呈蓝色,心肌细胞呈红色,细胞核呈蓝紫色。心肌CVF统计结果显示(图6),与S组比较,MI组显著升高(P<0.01);与MI组比较,MIE组显著降低(P<0.01),MCE组无显著性变化;与MCE组比较,MIE组显著降低(P<0.05)。表明,间歇运动干预可抑制心梗边缘区胶原纤维过度增生,且效果优于持续运动。
反映心功能的血流动力学指标显示(表1),与S组比较,MI组大鼠LVSP和±dp/dtmax均显著降低(P<0.01),LVEDP显著升高(P<0.01);与MI组比较,MIE组和MCE 组LVSP均显著升高(P<0.05),LVEDP均显著降低(P<0.05),MIE组+dp/dtmax显著升高(P<0.05);与MCE组比较,MIE组LVSP、LVEDP均显著升高(P<0.05)。表明,心梗心脏心功能受损,运动显著改善心梗心功能,且间歇运动更显著。
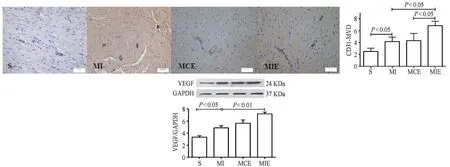
图4 心梗大鼠心肌CD31表达的免疫组化观察分析及心肌VEGF蛋白表达结果(×400)Figure 4.Expression of CD31 and VEGF Protein in Rat Hearts

图5 心梗大鼠心肌α-SMA表达的免疫组化观察分析(×200)Figure 5.Expression of α-SMA
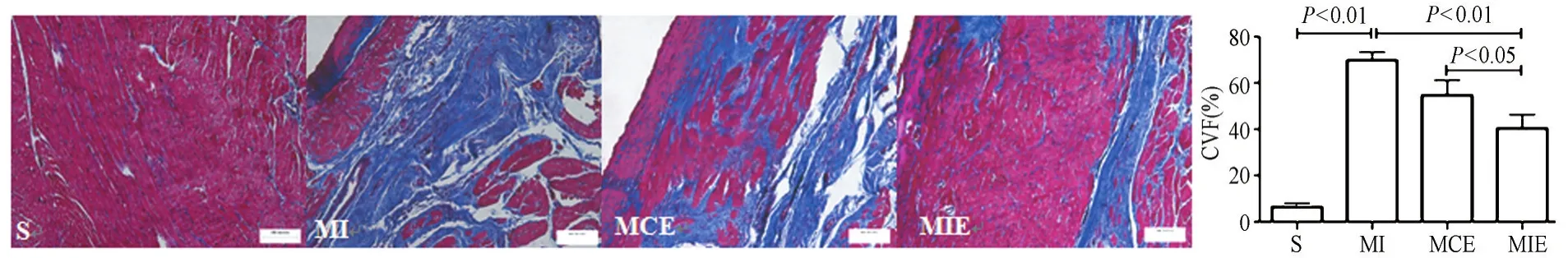
图6 心梗大鼠心肌Masson染色结果(×200)Figure 6.Masson Staining of Cardiac Muscle(×200)

表1 心梗大鼠血流动力学指标变化Table 1.The Variation of Different Hemodynamic Index in Rat Hearts
3 分析讨论
3.1 运动干预大鼠心梗心肌血管新生相关miRNAs表征分析
血管新生是在现有血管上形成新的血管并以血管内皮细胞增殖及迁移为主要表现的病理生理过程,在胚胎发育、组织再生、肿瘤生长及心梗心脏的康复过程中发挥作用。血管新生是一个受到多种信号通路和分子精确调控的复杂过程[51,53],miRNA是其中一类重要的调控因子。miRNA是一类在进化上高度保守的单链非编码小RNA,长18~25个核苷酸,它可以通过mRNA剪切和抑制蛋白质翻译的方式负调控靶基因。miRNA是血管功能的关键调控者,参与了包括细胞分化、收缩、迁移、增殖、凋亡等多个过程。已经证实有多个miRNA参与了血管新生的过程,如miR-16、miR-15b、miR-92、miR-296、miR-130a、miR-378、miR-210、miR-214、miR-221、miR-222、miR-424、miR-126和let-7 familiy等[34,42,43]。由于miRNA与血管新生之间的关系是双向的,所以有学者把内皮细胞miRNA划分为两种:miRNA靶基因参与血管新生和促血管新生(pro-angiogenic)或抗血管新生(anti-angiogenic)刺激调控的miRNA。
有学者提出,运动的适应性与基因表达相一致,而基因之间交互作用的复杂性又限制了个别基因的识别[41,45]。运动可以导致不同信号级联的激活,依次通过基因表达的变化来影响相关蛋白的合成[15,19,28,48],而这些基因表达的变化很可能是伴随着miRNA水平的变化而出现的。研究表明,运动可以导致多个细胞类型的miRNA水平出现改变[8,13]。赵永才[4]探讨了不同运动(一次性力竭、有氧耐力)对小鼠心脏miRNA的影响,结果发现,耐力训练可以降低心肌miR-1、miR-133a表达,同时提高了miR-208a及miR-499的调节通路,有利于心肌肥大的形成。贾明学等[2]对有氧运动训练前、后正常小鼠心脏中miRNA做了基因芯片扫描,结果发现,多个miRNAs在运动前后发生了显著性变化。本研究结果发现,持续和间歇运动可以不同程度改变血管新生相关的miRNAs的表达,促血管新生miRNAs增加趋势明显,抗血管新生miRNAs减少趋势明显,其中,miR-126在心梗及心梗持续和间歇运动干预后变化显著,且变化率最大。提示,持续和间歇运动很可能通过血管新生相关miRNAs来促进心梗心肌血管新生,改善微循环,进而提升心功能。
3.2持续和间歇运动激活EGFL7/miR126-PIK3R2/SPRED1通路刺激心梗心脏血管新生
本实验研究发现,心梗后心肌miR-126表达显著降低,间歇运动可显著提高miR-126的表达,且效果优于持续运动。miR-126是内皮细胞特异性miRNA,在内皮细胞中的含量非常丰富,可以促进血管新生及控制血管的完整性。EGFL7又称表皮生长因子样结构域7,是内皮细胞特异性表达因子,egfl7基因包含11个外显子和一个miR-126,在机体血管及管腔形成过程中发挥重要作用[33]。miR-126基因定位于egfl7基因第7和第8号外显子之间的内含子区[54],miR-126不是由其本身的启动子启动转录,而是作为egfl7基因转录本的一部分被转录[25],且两者之间具有相同的转录调控机制。egfl7启动子甲基化修饰可以使得miR-126的转录失活,导致表达下降甚至缺失,egfl7可通过诱导内皮细胞迁移提高miR-126的表达[37]。但是,有报道也得出相反的结论。Yang等[54]发现,在OSCC-15细胞系中过表达miR-126可以明显降低EGFL7的蛋白水平,转染miR-126的抑制剂又可以明显上调EGFL7的蛋白水平,表明在OSCC-15细胞系中miR-126与EGFL7是负相关关系。本研究RT-qPCR结果显示,egfl7 mRNA变化与miR-126趋势一致,且miR-126与egfl7 mRNA的表达高度正相关(R=0.65,P<0.05),分析原因认为,miR-126在不同的生理和病理情况下可能存在截然不同的调控机理。
通过PCR或基因芯片的方法可以对人类脐静脉内皮细胞(HUVECs)的miRNA的表达谱进行测试,结果发现高表达的miRNAs有miR-221/222、miR-2、let-7家族成员、miR-17-92簇、miR-23-24簇和miR-126,以上成员中,miR-126目前被认为是内皮细胞系和造血祖细胞中特异性表达[22];采用高通量测序方法对HUVECs在标准条件和缺氧条件下的miRNA进行了筛选后发现miR-21和miR-126占到了总量的40%[47];敲除miR-126后,导致斑马鱼血管完整性受损出血[17];敲除内皮细胞特异性miR-126后,小鼠出现肢体严重水肿、出血及血管破裂,存活的突变体小鼠视网膜血管化表现异常,提示,miR-126在血管新生中发挥重要作用[49];miR-126敲除的小鼠胚胎表现为血管新生出芽滞后,胚胎大面积出血及部分胚胎致死[49,25],出现这种现象的原因是血管新生生长因子信号降低,导致内皮细胞生长、出芽及粘附能力下降。研究发现,miR-126可以通过转录后水平抑制spred1、pik3r2、vcam1等多个靶点来发挥作用[20]。本研究通过Western Blot实验发现,心梗后伴随着心肌miR-126表达的下调,其调控靶点pik3r2(又称p85-ß)表达显著升高,运动干预后心梗心脏PIK3R2、SPRED1表达显著降低,与MCE组相比,MIE组SPRED1降低更加显著。PIK3R2是PI3K调节亚基p85之一,能够产生3-多磷酸肌醇,是PI3K/AKT信号通路的负性调控因子;Sprouty是一类广泛表达于全身组织器官的软脂酰化磷蛋白家族,对生长因子信号呈负调控[27],特别是SPRED1可作为Ras/ MAP激酶信号通路的细胞内抑制剂,抑制细胞的增殖和迁移功能。由此证实,间歇运动可能通过上调心梗心脏心肌miR-126表达,靶向pik3r2、spred1信号通路,促进心肌血管新生,进而提升了心功能。
20世纪初,心梗病人的标准治疗方案是卧床休息至少6周,指导策略是梗死组织需要充分休息,过早的工作可能会造成未愈合的左心室瘢痕破裂。后来发现,长时间卧床休息并不是治疗心脏病的最好干预方法,相反,会导致肌肉营养不良、骨质丢失、心血管功能下降等“去适应”症状[14,26,44];Morris等[31]通过研究发现,售票员患心脏疾病的危险性要比公交司机低得多(1:2.2);20世纪60年代后,大量的动物和人体实验研究已经证明,运动是心脏病人康复的最重要手段之一。但是,目前对于运动的方法和强度水平的选择仍然存在争议[11,18]。Øivind Rognmo等[36]通过对4 846个临床冠心病患者研究发现,无论是高强度还是中等强度运动对患者心血管系统所造成的风险都很低,且高强度运动可带来更显著的效益;运动量相同的情况下,4周持续和间歇运动干预后,心梗心脏心功能出现显著提高,但是,两种运动方式之间没有显著性差异[30];总运动时间相同的情况下,8周运动干预后,心梗大鼠心功能检测结果显示,间歇运动效果要优于持续运动[3]。本研究发现,心梗后心室收缩能力降低,心功能下降;总运动量相同情况下,8周持续和间歇运动都可以有效提升心梗心脏的心功能,且间歇运动效果更明显。分析可能机制:持续和间歇运动干预使存活心肌细胞发生肥大,刺激梗死部位和周边区血管增生,侧支循环增多,存活心肌血供得到改善,使缺血或供血不足的心肌细胞比例有所下降,心肌胶原纤维发生降解,抑制了心梗面积的持续扩大,刺激心肌细胞增殖[7],相对无任何干预的对照组,可有效减小心梗面积,改善心功能。间歇运动干预可使心梗心脏在短暂高强度运动后获得一定休息时间,高强度运动对机体V˙O2max的提高、心脏泵血功能的改善效果更加明显[3];间歇运动也有利于心脏低氧诱导因子1(HIF-1)的活化,HIF-1表达上调能增强心肌细胞对急性缺血性损伤的耐受,在缺血性心脏病中具有重要保护意义[1],这或许是间歇运动优于持续运动的原因。
多方面因素造成了运动维系心血管系统健康的有益效应,并延缓了心脏疾病的进展[9]。血管新生就是一个重要的原因。哺乳动物心梗后梗塞区心肌细胞由于缺血缺氧而引起坏死、凋亡,造成心肌数目减少,严重损害心功能。心梗心脏的康复过程血管新生非常关键,心梗心脏的血管新生是通过刺激心肌缺血区小血管生长,实现心肌缺血区的自我搭桥,从而建立缺血心肌的侧枝循环,改善心肌缺血区的血流状况。本研究发现,心梗运动组心肌组织中CD31蛋白阳性颗粒表达显著高于心梗组(P<0.01);间歇运动组心肌组织中CD31蛋白阳性颗粒表达显著高于持续运动组(P<0.05)。提示,间歇运动可诱导梗死边缘区心肌血管新生,改善血流状况和内皮细胞功能,且效果优于持续运动。VSMC作为一种非终末分化细胞,具有两种表型特征,收缩表型和合成表型。收缩表型VSMC细胞核较小,胞浆收缩蛋白含量丰富,收缩能力较强;合成表型VSMC细胞核体积较大,收缩能力减弱,分泌胞外基质能力显著增强。本研究发现,间歇运动干预可使心梗心脏梗死边缘区VSMC发生表型逆转,由合成型转化为收缩型。分析可能原因为,8周的间歇运动干预使新生毛细血管逐渐发育生成具有VSMC的微、小动脉,进一步提高梗死边缘区血液的输送能力,从而改善心功能。
4 结论
持续和间歇运动显著上调大鼠心梗心脏miR-126和miR-17-5p表达,且miR-126表达的变化率更大;持续和间歇运动显著激活心梗心脏EGFL7/miR126-PIK3R2/SPRED1通路,抑制其下游靶蛋白PIK3R2/SPRED1表达,促进心脏梗死边缘区血管新生,产生心脏保护效应,且间歇运动的保护效应优于持续运动。
参考文献:
[1]丁然然,哈艳平,王振良,等.低氧诱导因子-1与缺血性心肌损伤保护的研究进展[J].中国细胞生物学学报,2015,37 (10):1447-1457.
[2]贾明学,张国海,李艳,等.微小RNA30c增加有氧运动训练小鼠心室顺应性的研究[J].体育科学,2013,33(9):70-77.
[3]田振军,贺志雄,刘智炜,等.持续和间歇有氧运动对心梗大鼠Myostatin及其受体表达的影响[J].体育科学,2013,33 (11):66-74.
[4]赵永才.运动对C57BL/6小鼠心肌miRNA的影响及其在心脏肥大中的调节作用[J].体育科学,2012,32(6):62-68.
[5]BAGGISH A L,HALE A,WEINER R B,et al.Dynamic regulation of circulating microRNA during acute exhaustive exercise and sustained aerobic exercise training[J].J Physiol,2011,589:3983-3994.
[6]BOON R A,DIMMELER S.MicroRNAs in myocardial infarction[J].Nat Rev Cardiol,2015,12:135-142.
[7]CAI M X,SHI X C,CHEN T,et al.Exercise training activates neuregulin 1/ErbB signaling and promotes cardiac repair in a rat myocardial infarction model[J].Life Sci.2016,149:1-9.
[8]CHEN Y,MELTON D W,GELFOND J A,et al.MiR-351 transiently increases during muscle regeneration and promotes progenitor cell proliferation and survival upon differentiation [J].Physiol Genomics,2012,44(21):1042-1051.
[9]COATS A J.Clinical utility of exercise training in chronic systolic heart failure[J].Nat Rev Cardiol,2011,8(7):380-392.
[10]DALAL H,EVANS P H,Campbell JL.Recent developments in secondary prevention and cardiac rehabilitation after acute myocardial infarction[J].BMJ,2004,328(7441):693-697.
[11]DANGARDT F J,MCKENNA W J,LÜSCHER T F,et al.Exercise:Friend or foe[J]?Nat Rev Cardiol,2013,10(9):495-507.
[12]DA SILVA N D J R,FERNANDES T,SOCI U P,et al.Swimming training in rats increases cardiac MicroRNA-126 expression and angiogenesis[J].Med Sci Sports Exerc,2012,44(8): 1453-1462.
[13]DAVIDSEN P K,GALLAGHER I J,HARTMAN J W,et al. High responders to resistance exercise training demonstrate differential regulation of skeletal muscle microRNA expression [J].J Appl Physiol(1985).2011,110(2):309-317.
[14]DEITRICK J E,WHEDON G D,SHORR E.Effects of immobilization upon various metabolic and physiologic functions of normal men[J].Am J Med,1948,4(1):3-36.
[15]DREYER H C,FUJITA S,GLYNN E L,et al.Resistance exercise increases leg muscle protein synthesis and mTOR signalling independent of sex[J].Acta Physiol(Oxf),2010,199 (1):71-81.
[16]FERNANDES T,MAGALHAES F C,ROQUE F R,et al.Exercise training prevents the microvascular rarefaction in hyper tension balancing angiogenic and apoptotic factors:role of mi croRNAs-16,-21,and-126[J].Hypertension,2012,59(2): 513-520.
[17]FISH J E,SANTORO M M,MORTON S U,et al.MiR-126 regulates angiogenic signaling and vascular integrity[J].Dev Cell,2008,15(2):272-284.
[18]FLETCHER G F,BALADY G J,AMSTERDAM E A,et al. Exercise standards for testing and training:A statement for healthcare professionals from the American Heart Association [J].Circulation,2001,104(14):1694-1740.
[19]FRANCES M W,JENNIFER M P.Resistance exercise in cardiac rehabilitation[J].Clin Rehabil,2011,25(12):1059-1065.
[20]HARRIS T A,YAMAKUCHI M,FERLITO M,et al.MicroRNA-126 regulates endothelial expression of vascular cell adhesion molecule 1[J].PNAS,2008,105(5):1516-1521.
[21]HUANG W,TIAN S S,HANG P Z,et al.Combination of microRNA-21 and microRNA-146a attenuates cardiac dysfunction and apoptosis during acute myocardial infarction in mice[J]. Mol Ther Nucleic Acids,2016,5:296.
[22]KANE N M,THRASHER A J,ANGELINI G D,et al.Concise review:MicroRNAs as modulators of stem cells and angiogenesis[J].Stem Cells,2014,32(5):1059-1066.
[23]KEMI O J,HARAM P M,LOENNECHEN J P,et al.Moderate vs.high exercise intensity:differential effects on aerobic fitness,cardiomyocyte contractility,and endothelial function[J]. Cardiovasc Res,2005,67(1):161-172.
[24]KRALJEVIC J,MARINOVIC J,PRAVDIC D,et al.Aerobic interval training attenuates remodelling and mitochondrial dysfunction in the post-infarction failing rat heart[J].Cardiovasc Res,2013,99(1):55-64.
[25]KUHNERT F,MANCUSO M R,HAMPTON J,et al.Attribution of vascular phenotypes of the murine Egfl7 locus to the microRNA miR-126[J].Development,2008,135(24):3989-3893.
[26]LEVINE S A,LOWN B."Armchair"treatment of acute coronary thrombosis[J].J Am Med Assoc,1952,148(16):1365-1369.
[27]MASON J M,MORRISON D J,BASSON M A,et al. Sprouty proteins:multifaceted negative-feedback regulators of receptor tyrosine kinase signaling[J].Trends Cell Biol,2006,16(1):45-54.
[28]MAYHEW D L,KIM J S,CROSS J M,et al.Translational signaling responses preceding resistance training-mediated myofiber hypertrophy in young and old humans[J].J Appl Physiol,2009,107(5):1655-1662.
[29]MILLER T D,BALADY G J,FLETCHER G F.Exercise and its role in the prevention and rehabilitation of cardiovascular disease[J].Ann Behav Med,1997,19(3):220-229.
[30]MOREIRA J B,BECHARA L R,BOZI L H,et al.High-versus moderate-intensity aerobic exercise training effects on skeletal muscle of infarcted rats[J].J Appl Physiol,2013,114(8): 1029-1041.
[31]MORRIS J N,HEADY J A,RAFFLE P A,et al.Coronary heart-disease and physical activity of work[J].Lancet,1953,265(6795):1053-1057.
[32]NAZARI-JAHANTIGH M,WEI Y,SCHOBER A.The role of microRNAs in arterial remodeling[J].Thromb Haemost,2012,107(4):611-618.
[33]NICHOL D,STUHLMANN H.EGFL7:A unique angiogenic signaling factor in vascular development and disease[J]. Blood,2012,119(6):1345-1352.
[34]QIN B,CAO Y,YANG H,et al.MicroRNA-221/222 regulate ox-LDL-induced endothelial apoptosis via Ets-1/p21 inhibition [J].Mol Cell Biochem,2015,405(1-2):115-124.
[35]QI Z,LIU W,LU J.The mechanisms underlying the beneficial effects of exercise on bone remodeling:Roles of bone-derived cytokines and microRNAs[J].Prog Biophys Mol Biol,2016. [DOI 10.1016/j.pbiomolbio.2016.05.010]
[36]ROGNMO Ø,MOHOLDT T,BAKKEN H,et al.Cardiovascular risk of high-versus moderate-intensity aerobic exercise in coronary heart disease patients[J].Circulation,2012,126 (12):1436-1440.
[37]SCHMIDT M,PAES K,DE MAZIÈRE A,et al.EGFL7 regulates the collective migration of endothelial cells by restricting their spatial distribution[J].Development,2007,134(16): 2913-2923.
[38]SEEGER T,XU Q F,MUHLY-REINHOLZ M,et al.Inhibition of let-7 augments the recruitment of epicardial cells and improves cardiac function after myocardial infarction[J].J Mol Cell Cardiol,2016,94:145-152.
[39]SMALL E M,OLSON E N.Pervasive roles of microRNAs in cardiovascular biology[J].Nature,2011,469:336-342.
[40]SOCI U P,FERNANDES T,HASHIMOTO N Y,et al.MicroRNAs 29 are involved in the improvement of ventricular compliance promoted by aerobic exercise training in rats[J]. Physiol Genomics,2011,43(11):665-673.
[41]STEPTO N K,COFFEY V G,CAREY A L,et al.Global gene expression in skeletal muscle from well-trained strength and endurance athletes[J].Med Sci Sports Exerc,2009,41(3): 546-565.
[42]SUÁREZ Y,FERNÁNDEZ-HERNANDO C,YU J,et al.Dicer-dependent endothelial microRNAs are necessary for postnatal angiogenesis[J].PNAS,2008,105(37):14082-14087.
[43]SUN C Y,SHE X M,QIN Y,et al.MiR-15a and miR-16 affect the angiogenesis of multiple myeloma by targeting VEGF [J].Carcinogenesis,2013,34(2):426-435.
[44]TAYLOR H L,HENSCHEL A,B rozek J,et al.Effects of bed rest on cardiovascular function and work performance[J].J Appl Physiol,1949,2(5):223-239.
[45]TIMMONS J A,JANSSON E,FISCHER H,et al.Modulation of extracellular matrix genes reflects the magnitude of physiological adaptation to aerobic exercise training in humans[J].BMC Biol,2005,3:19.
[46]VAN ROOIJ E,OLSON E N.MicroRNA therapeutics for cardiovascular disease:opportunities and obstacles[J].Nat Rev Drug Discov,2012,11(11):860-872.
[47]VOELLENKLE C,ROOIJ J V,GUFFANTI A,et al.Deep-sequencing of endothelial cells exposed to hypoxia reveals the complexity of known and novel microRNAs[J].RNA,2012,18(3):472-484.
[48]WALKER D K,DICKINSON J M,TIMMERMAN K L,et al.Exercise,amino acids,and aging in the control of human muscle protein synthesis[J].Med Sci Sports Exerc,2011,43 (12):2249-2258.
[49]WANG S,AURORAA B,JOHNSON B A,et al.The endothelial-specific microRNA miR-126 governs vascular integrity and angiogenesis[J].Dev Cell,2008,15(2):261-271.
[50]WEIDNER N,FOLKMAN J,POZZA F,et al.Tumor angiogenesis:a new significant and independent prognostic indicator in early-stage breast carcinoma[J].J Natl Cancer Inst,1992,84(24):1875-1887.
[51]WEIS S M,CHERESH D A.Tumor angiogenesis:molecular pathways and therapeutic targets[J].Nat Med,2011,17(11): 1359-1370.
[52]WISLØFF U,STØYLEN A,LOENNECHEN J P,et al.Superior cardiovascular effect of aerobic interval training versus moderate continuous training in heart failure patients:a randomized study[J].Circulation,2007,115(24):3086-3094.
[53]YANG W J,YANG D D,NA S,et al.Dicer is required for embryonic angiogenesis during mouse development[J].J Biol Chem,2005,280(10):9330-9335.
[54]YANG X,WU H,LING T.Suppressive effect of microRNA-126 on oral squamous cell carcinoma in vitro[J].Mol Med Rep,2014,10(1):125-130.
Continuous and Interval Exercise Intervention on the Expression of Myocardial miRNAs Related to Angiogenesis and Activitation of EGFL7/miR126-PIK3R2 /SPRED1 on Protecting the Hearts of MI Rats
SONG Wei1,TIAN Zhen-jun1,Shao-jun Du2
目的:探讨持续和间歇运动对心梗大鼠心脏血管新生相关miRNAs表征及可能的效应机制。方法:3月龄雄性SD大鼠,随机分为假心梗组(S)、心梗组(MI)、心梗持续运动组(MCE)、心梗间歇运动组(MIE),每组10只。采用左脉前降支结扎制备心梗模型。MCE和MIE组术后1周进行跑台适应性训练(15 m/min,30 min/天×5天),之后MCE组以16 m/min (50%~60%V˙O2max)速度持续运动64 min/天,5天/周×8周;MIE组以25 m/min×4 min(85%~90%V˙O2max)和15 m/min×3 min(50%~60%V˙O2max)速度依次交替运动49 min/天,5天/周×8周,训练结束后次日测定心功能。Masson染色观察分析心肌胶原容积分数(CFV),免疫组化观察心肌CD31和α-SMA表达,RT-qPCR检测心肌血管新生相关miRNAs、egfl7、pik3r2和spred1表达,Western Blotting检测心肌PIK3R2、SPRED1和VEGF表达。结果:与S组比较,MI组心肌miR-222表达显著上调,miR-126表达显著下调,心肌CFV显著增加,心功能下降;与MI组比较,MIE组心肌miR-17-5p、miR-126表达均显著上调,MCE和MIE组CD31、α-SMA阳性颗粒显著增加,VEGF和egfl7 mRNA表达显著上调,且egfl7 mRNA与miR-126表达呈高度正相关,PIK3R2、SPRED1蛋白及其mRNA表达均显著下调,心功能显著提升,且间歇运动优于持续运动。结论:间歇运动可显著上调心梗心脏miR-126和miR-17-5p表达,且miR-126表达的变化率更大;持续和间歇运动显著激活心梗心脏EGFL7/miR126-PIK3R2/SPRED1通路,抑制其下游靶蛋白PIK3R2/SPRED1表达,促进心脏梗死边缘区血管新生,产生心脏保护效应,且间歇运动的保护效应优于持续运动。
心肌梗死;持续运动;间歇运动;miR-126;PIK3R2/SPRED1;心肌血管新生
Objectives:This study was carried out to investigate the continuous and interval exercise intervention on the expression of myocardial miRNAs related to angiogenesis and possible mechanism.Methods:40 three-month-old male SD rats were randomly divided into four groups: sham-operated group(S),myocardial infarction group(MI),MI with continuous exercise group (MCE)and MI with interval exercise group(MIE).MI model was induced by ligation of the left anterior descending(LAD)coronary artery.After five days'adaptive training(15m/min,30min/d× 5d),rats in MCE group performed continuous exercise for 64min/d,5d/wk×8wk at the speed of 16m/min(50%~60%V˙O2max),and MIE intervals alternated between 4min at 25m/min(85%~90%V˙O2max)and 3min at 15m/min(50%~60%V˙O2max)for 49min/d,5d/wk×8wk.Cardiac function was measured the next day after 8wk training.CFV was analyzed through Masson'trichrome staining;CD31 and α-SMA were evaluated by immunohistochemistry.The expression of miRNAs related to angiogenesis,egfl7、pik3r2,spred1 were determined by RT-qPCR,while PIK3R2,SPRED1,VEGF were measured by Western Blotting.Results:Compared with S group,cardic function in MI was impaired with miR-222’upregulation and miR-126’downregulation;Compared with MI group,levels of miR-17-5p and miR-126 increased in MIE;meanwhile,in either MIE or MCE,positive granules of CD31 and α-SMA,VEGF,egfl7 mRNA were elevated and miR-126 was found to have a highly positive correlation with egfl7 mRNA.in addition,the protein levels of PIK3R2、SPRED1 and their mRNA decreased,and rats in MIE group shows better performance than their counterparts in MCE group.Conclusions:Interval exercise training promotes an increase in the expression of miR-126 and miR-17-5p,and an even bigger change rate in miR-126.Continuous and interval exercise could suppress the protein expression of PIK3R2/SPRED1 through the activation of EGFL7/miR126-PIK3R2/SPRED1,promote angiogenesis in peri-infarct zone,all of which result in the protection of the MI hearts in the end.The protective effect of interval exercise was better than continuous exercise.
myocardial infarction;continuous exercise;interval exercise;miR-126;PIK3R2/ SPRED1;myocardial angiogenesis
G804.7
:A
1000-677X(2017)02-0057-09
10.16469/j.css.20170200
2016-08-15;
:2016-12-05
国家自然科学基金资助项目(31371199);陕西师范大学中央高校基本业务费专项资金项目(GK201504001)。
宋伟,男,讲师,在读博士研究生,主要研究方向为运动心血管生物学,E-mail:tianzhj2012@hotmail.com;田振军,男,教授,博士研究生导师,主要研究方向为运动心血管生物学,E-mail:tianzj611@hotmail.com;Shao-jun Du,男,教授,博士研究生导师,主要研究方向为骨骼肌和心肌分子遗传学。
1.陕西师范大学体育学院暨运动生物学研究所,陕西西安710119;2.马里兰大学医学院生物化学与分子生物学系,美国巴尔的摩21202。1.Institute of Sports and Exercise Biology,Shaanxi Normal University,Xi’an,Shaanxi 710119,China.2.University of Maryland,Baltimore,21202 USA.
