高产乙醇的酿酒酵母的筛选及性能检测
2017-03-03靳正忠王宁包慧芳侯敏陈福双
靳正忠,王宁,包慧芳*,侯敏,陈福双
(1.中国科学院新疆生态地理研究所,新疆 乌鲁木齐 830011;2.新疆农业科学院微生物应用研究所 新疆 乌鲁木齐 830091;3.福双果业有限责任公司,新疆 伽师 844300)
高产乙醇的酿酒酵母的筛选及性能检测
靳正忠1,王宁2,包慧芳2*,侯敏2,陈福双3
(1.中国科学院新疆生态地理研究所,新疆 乌鲁木齐 830011;2.新疆农业科学院微生物应用研究所 新疆 乌鲁木齐 830091;3.福双果业有限责任公司,新疆 伽师 844300)
目的是从新疆葡萄酒产地筛选适合当地生境的野生酵母菌种资源。采用可培养方法,分离符合条件的酵母菌株,对其生理生化、分子生物学及生长耐受性等各方面进行更细致研究。从酿酒葡萄鲜果、种植土壤及白兰地发酵基质中筛选到酵母菌36株,随后通过WL琼脂培养基初筛,获得符合产酒精特征的菌株10株。对这10株酵母菌进行生长发酵能力的复筛检测,编号为B5、B6、B9的三株菌经过48h的发酵,酒精发酵能力较好。进而结合生理生化及分子测序鉴定,分离的三株菌均属于酿酒酵母。在对供试菌株进行耐受性检测中,B5的酒精耐受性最高可达16%、B6、B9为14%;B5、B9最高可耐受2.0 mol/L KCl,B6最高可耐受2.25 mol/LKCl,同时,三株菌均能耐受50%的葡萄糖浓度,具有较广泛的酸碱适应性,热致死温度都为61℃~64℃之间,耐受10d饥饿后,仍能良好生长。获得3株有良好应用潜能的野生酿酒酵母菌株,为保护该区微生物资源及开发工业菌株具有重要意义。
酿酒酵母;乙醇;耐受性
一、引言
新疆天山北麓拥有得天独厚的酿酒葡萄种植基地,与同处北纬44°的美国加州和法国波尔多并称为“世界三大天堂级葡萄产区”,原生态、零污染的自然条件为酿酒酵母提供了优势生长环境[1]。生产实践中对酵母菌株的生理特性有一定的要求,工业发酵生产要求发酵菌株不仅要具有良好发酵性能,同时要能耐受高温、高糖、高渗透压,才能够节约冷却用水、降低能耗、缩短发酵时间,提高乙醇的生产效率和设备的利用率。选育适合新疆葡萄酒生产工艺的菌种对本地酒业的持续发展具有重要意义。人们利用纯培养的酵母菌生产葡萄酒已经有一个世纪的历史,葡萄酒生产中使用的酵母多种多样,各具特色。突变、杂交和DNA重组在酿酒酵母育种工作中也取得了广泛的应用[2,3]。现代葡萄酒的生产和消费不仅需要高效率地将葡萄汁中的糖转化为酒精,更希望得到风格各异的商品化产品。此目标的实现不仅依靠工艺的改进,具有优良特性发酵菌种的获得也是生产中极为关键的技术资源。本研究从新疆葡萄酒产地筛选适合当地生境的野生酵母,并对其生理生化、分子生物学及生产应用等各方面进行更细致全面的研究,以期获得改善本地葡萄酒酿造品质的菌种资源。
二、材料与方法
(一)材料
1.样品来源。2014年10月,从昌吉葡萄种植园采集酿酒葡萄鲜果及土壤,并从伽师县福双果业有限责任公司采集自然发酵白兰地基质用于分离酵母菌株。
2.主要试剂及来源。葡萄糖、酵母浸粉、蛋白胨、琼脂、蔗糖等均为国产分析纯试剂,引物、dNTPs、Taq酶等试剂均购自上海生工生物技术服务有限公司。
3.培养基。分离培养基:马铃薯培养基(PDA),YPD培养基[3]。
初筛培养基:WL琼脂培养基。
复筛发酵培养基:葡萄糖30%,酵母膏0.5%,蛋白胨0.5%,氯化铵0.15%,磷酸氢二钾0.15%,硫酸镁0.1%,氯化钙0.28%, 0.06MPa灭菌15 min。
(二)方法
1.产酒精酵母菌株的筛选。酵母菌的分离:将采集到的新鲜样品适当稀释后涂布于酵母菌分离培养基上,30℃培养2~3d,挑取具有典型酵母菌菌落特征的单菌落,在PDA固体平板上经划线分离纯化后镜检,初步去重复,保存备用。
产酒精酵母菌株的初筛:将分离获得的酵母菌接种于YPD液体培养基活化24 h后接种至WL琼脂培养基,30℃培养5 d后观察,筛选出菌落颜色为奶油色(浅黄色)至绿色,表面为球形突起,光滑,不透明,奶油状的菌株。
产酒精酵母菌株的复筛:将初筛获得的酵母菌按相同的接种量分别接种于发酵培养基中进行发酵试验,30℃培养,发酵结束后通过测定其总失重、酒精度和残还原糖,复筛出性状良好的酵母菌株。
酒精度的测定:取100 mL成熟发酵液到蒸馏瓶中,加入100 mL水,混匀后蒸馏,准确取馏出液100 mL,用酒精计(标温20℃)测酒精度(下缘为准),同时测定温度,然后换算成20℃时的酒精度[4]。
CO2失重量的测定:将活化后的菌液转接到100 mL发酵培养基中,30℃培养,以空白的发酵液作对照。每隔12 h称重一次,以相邻2次的质量差值作为CO2失重量。当CO2失重量小于0.1g时发酵结束。
残还原糖测定:菲林试剂直接滴定法[4]。
2.酵母菌的分类鉴定。生理生化鉴定:糖发酵、碳源同化、氮源同化试验,具体参见文献[5]。
分子生物学鉴定:挑取新鲜单菌落置于30μl 0.2%SDS中;漩涡混匀器上混匀15秒;90℃热激4min;4℃13000rpm×1min,离心,取上清液20μl至新的无菌离心管中,-20℃保藏。利用通用引物(ITS1:5’-TCCGTAGGTGAACCTGCGG -3′ITS4:5’-TCCTCCGCTTATTGATATGC-3′)进行扩增。反应体系为:10×ExTaq Buffer 5μl,dNTPs 4μl,ExTaq酶0.5μl,模板DNA1μl,引物各2μl,加超纯水至50μl。反应程序为95℃5min;94℃1min;52℃1min;72℃1min20s,循环36次;72℃延伸8min。
3.供试酵母菌耐性实验[6,7]。酒精耐受性测定:将灭菌后的YPD琼脂培养基降温至40℃左右,按10%、12%、14%、16%、18%(v/v)的浓度加入乙醇,接种新鲜单菌落在YPD固体平板进行生长实验,一周后以生长状况表征其酒精耐受性。
渗透胁迫耐受性测定:配制终浓度为1.0mol/L、1.5 mol/L、1.75 mol/L、2.0 mol/L、2.25 mol/L、2.5 mol/LKCl到YPD液体培养基中,接种新鲜单菌落培养2d,以生长状况表征其渗透胁迫耐受性。
高糖耐受性测试:在含有10%、20%、30%、40%、50%的葡萄糖的YPD斜面培养基进行生长实验,以生长状况表征其对不同浓度糖的耐受性。培养两周后观察生长差异。
热致死温度测定:将接种后的YPD液试管浸入水浴锅中,以不接种的空白试管作为对照,其中插入温度计,当空白管的温度达到40℃时,开始记录时间,并保持10 min,然后立即拿出,在冷水中冷却至室温,最后将试管置于30℃恒温培养箱中培养。同法测定45℃、50℃、55℃、60℃、65℃、70℃下的活菌数。
营养饥饿耐受性测定:将各菌株在无菌水中30℃分别静置饥饿5d、6d、7d、8d、9d、10d,在YPD液体培养基进行生长实验,培养2d后以活菌数表征其营养饥饿耐受性。
酸碱耐受性测试:配制不同pH值(1.0、2.0、3.0、4.0、5.0、6.0、7.0、8.0、9.0、10.0)的发酵培养基,接种后于30℃培养48h,测定不同pH值条件下酵母菌的OD600值及发酵力。
三、结果与分析
(一)酿酒酵母的初筛及复筛结果
利用PDA培养基对10份样品(5份鲜果、3份土壤、2份发酵基质)进行酵母菌的筛选,通过形态观察及镜检结果,初步去重,共筛选酵母菌36株,多数为多端出芽的椭球型菌株。随后将分离的所有酵母菌株经YPD固体培养基活化,24h后接种到WL琼脂培养基上,各菌株分别作三个重复,获得符合产酒精特征的菌株10株,即菌落颜色为奶油色(浅黄色)至绿色,球形突起,光滑,不透明,编号为B1-B10。对这10株酵母菌进行生长发酵能力的复筛检测,编号为B5、B6、B9的三株菌经过48h的发酵,酒精发酵能力较好,结果见表1。
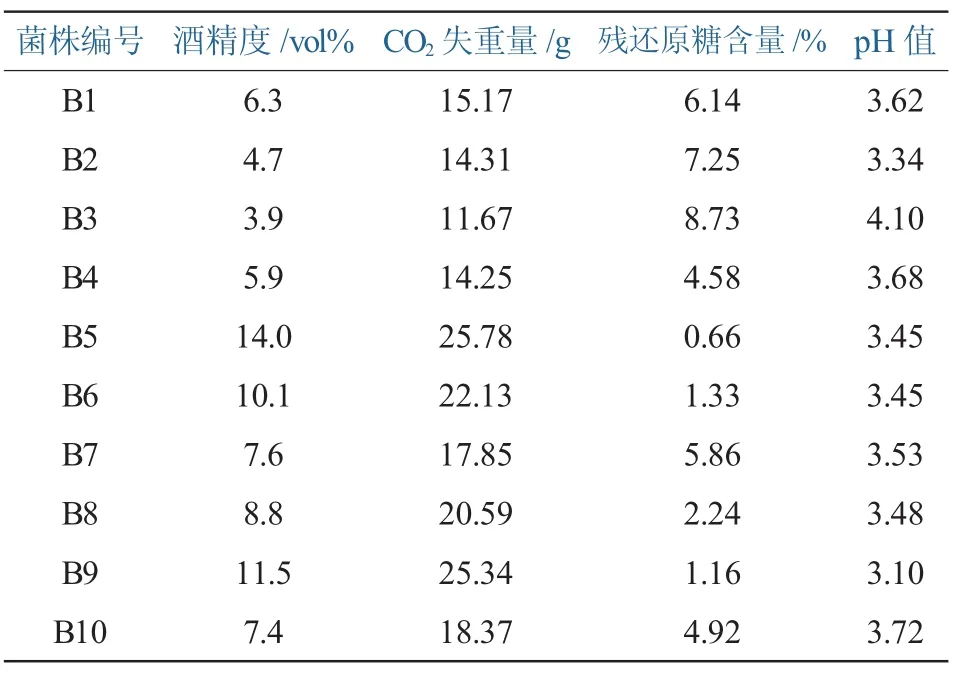
表1 复筛发酵结果比较
(二)酿酒酵母菌的分类鉴定
对复筛获得的3株酵母菌进行生理生化检测,结果见表2。在氮源基础培养基中,分别加入葡萄糖、蔗糖、麦芽糖、乳糖,检测菌株的糖发酵能力,结果显示所有菌均能发酵葡萄糖、蔗糖、麦芽糖,不能发酵乳糖;在对碳源同化的检测中,均能同化半乳糖、棉籽糖,不能同化鼠李糖、纤维二糖、菊糖、肌醇、L-阿拉伯糖、D-木糖、可溶性淀粉和山梨糖。在碳源基础培养基中,分别加入硫酸铵、天门冬素、硝酸钾和亚硝酸钠,检测三株菌的氮源同化能力,结果表明所有菌均能发酵硫酸铵、天门冬素,不能同化硝酸钾和亚硝酸钠。对糖发酵、碳源同化、氮源同化的结果与菌种鉴定手册中酿酒酵母鉴定结果一致。
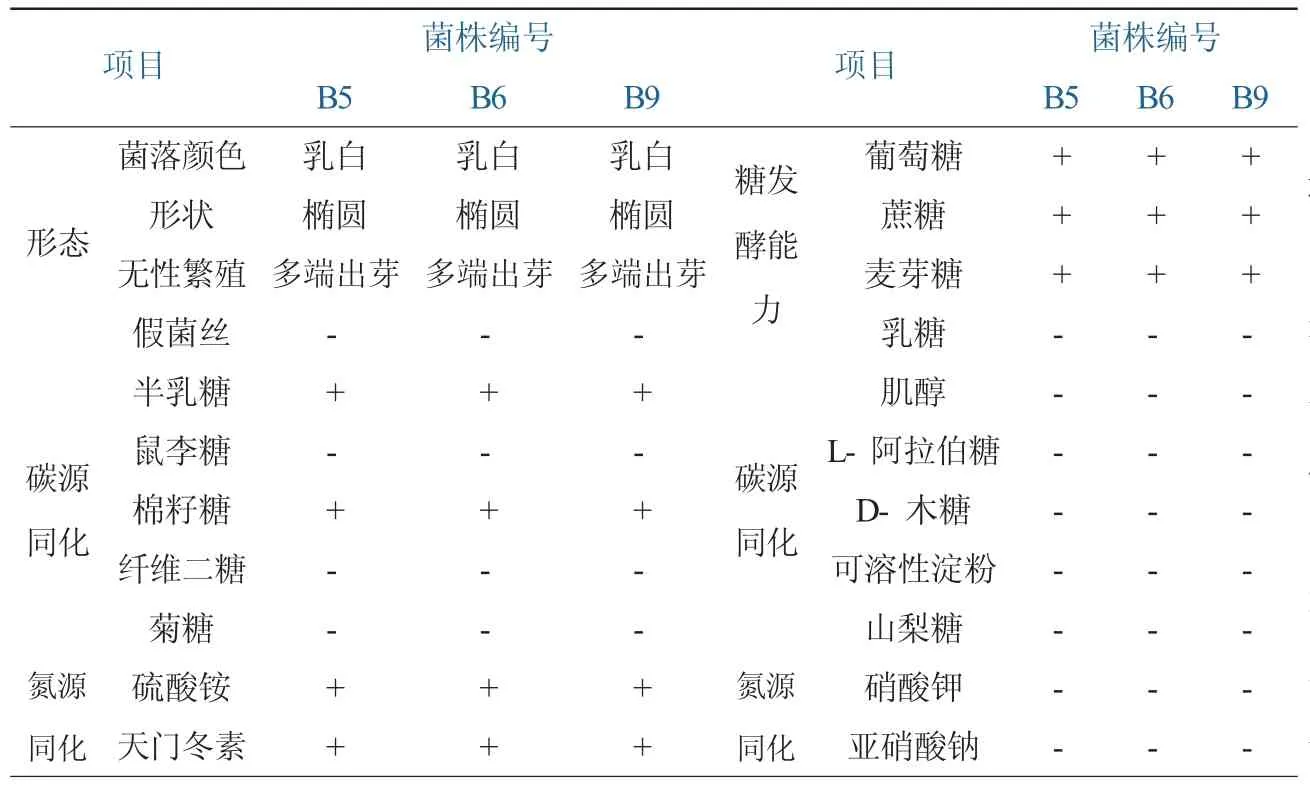
表2 三株酵母菌的生理生化特性比较
进一步对酵母菌进行ITS区分子鉴定,将所测结果提交至Genebank数据库中进行相似性比较,与这3株菌相似性最高的菌株均属于Saccharomyces cerevisiae,相似性为99%~100%,因此,将分离的菌株鉴定为Saccharomyces cerevisiae,Genebank注册号为:KR063021-KR063023。图1为与选定的同源性较高的相关菌株26Sr RNA基因序列构建的系统发育树。生理生化检测及分子鉴定结果均证明分离的菌株应属于酿酒酵母。
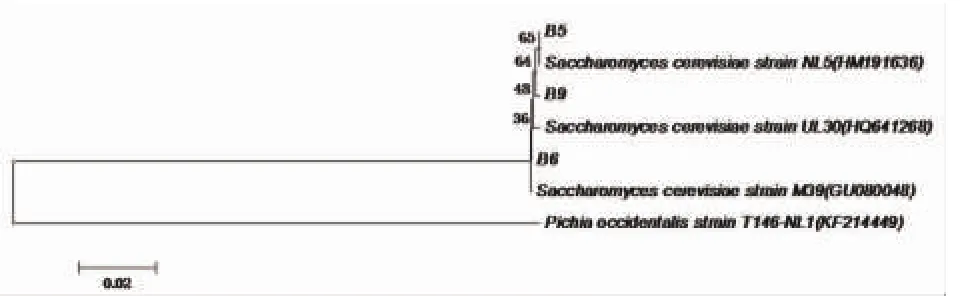
图1 各菌株系统发育树状关系
(三)酿酒酵母耐受性实验
酵母菌在发酵液中发酵,到某一时刻即停止,其最大原因是由于乙醇浓度增大所致,高乙醇浓度对酵母的生长繁殖有延滞作用,会抑制其发酵活性。因此,酵母的发酵能力在很大程度上取决于它们自身对乙醇耐受力的大小。本实验检测到B5的酒精耐受性最高可达16%、B6、B9为14%,高于此浓度均不能生长。
在自然繁殖或工业培养过程中,酵母常常会受到高盐、高糖等条件的影响,所以细胞自身的渗透调节是其非常重要的生物学反应。发酵醪的渗透压高可引起细胞内水分活度、细胞质组成发生显著变化,从而抑制酵母的生长和发酵。因此,酵母具有耐高渗和耐高糖性能就可以很好地为生产服务。经检测,B5、B9最高可耐受2.0 mol/LKCl,B6最高可耐受2.25 mol/LKCl,三株菌均能耐受50%的葡萄糖浓度。
液态培养的微生物,在某温度下10 min即被杀死,此温度称为微生物的热致死温度。通常情况下以测得的能发酵的最高温度加1~2℃为该菌的热致死温度。通过活菌计数,三株菌均能在60℃生长,不能在65℃以上的温度生长。因此,B5、B6、B9的热致死温度为61~64℃之间。
随着发酵过程的进行,营养物质的消耗会影响微生物发酵能力,酿酒酵母对营养饥饿耐受性好是发酵工艺特别是连续发酵工艺所要求的良好性质。本实验中,各菌株在25℃温箱分别静置饥饿培养10d后,均能良好生长。
酵母菌进行繁殖的适宜环境根据不同的菌株而有所区别,通过测定不同pH值条件下菌株的生物量及发酵力,以确定其耐酸碱性。结果表明,B5在pH值1.0~9.0范围内生长良好,B6的pH耐受范围为2.0~8.0,B9为2.0~9.0。相比之下,B5具有更广泛的酸碱适应性,尤其pH4.0时发酵力最强。
四、讨论
在葡萄汁和葡萄酒中存在着很多不同的酵母种类,其分类地位、形态特征和生物、化学特征各有不同,其中有的有利于葡萄酒酿造,有的则不利于葡萄酒酿造[8]。与葡萄酒酿造相关的酵母中以酵母属最为重要,通常使用该属的酵母有酿酒酵母和贝酵母等种的菌株。从自然生境中筛选对酿造有利的菌株必须先对筛选到的菌株进行分类地位的确定。传统的鉴定方法是通过形态学、生理生化性状等对酿酒酵母进行鉴定,将实验结果与标准系统进行对比得出鉴定结论,但存在繁琐耗时费力,操作不方便,因实验条件不同,重现性不好的缺陷。分子生物学方法因可快速鉴定,目前得到广泛使用,两种鉴定方法结合可使结果更加准确。
在酵母酒精发酵过程中,由于发酵作用和其他代谢活动同时存在,酵母除了将葡萄汁92%~95%的糖发酵生成酒精、CO2和热量外,还能够利用剩余的糖产生一系列的其他化合物,称为酒精发酵副产物[9]。酵母菌的代谢副产物不仅影响着葡萄酒的风味和口感,而且有些副产物如辛酸还会对酵母的生长具有抑制作用。本研究中筛选获得的菌株发酵后期均显示符合发酵成熟曲指标且有较好的生长耐受性,但是否能改善葡萄酒的特色和风味尚需进一步验证。
五、结论
从酿酒葡萄鲜果、种植土壤及白兰地发酵基质中筛选到酵母菌36株,随后通过WL琼脂培养基初筛,获得符合产酒精特征的菌株10株。对这10株酵母菌进行生长发酵能力的复筛检测,编号为B5、B6、B9的三株菌经过48h的发酵,酒精发酵能力较好。进而与菌种鉴定手册比较糖发酵、碳源同化、氮源同化试验结果,确认筛选的3株菌为酿酒酵母,通过26Sr RNA基因序列测序分析,使用Blast在线软件进行相似性分析,测序结果查询GenBank数据库,得到结果证实筛选出的酵母的确是酿酒酵母。
对筛选的3株酿酒酵母菌株进行一系列耐受性检测,结果检测到B5的酒精耐受性最高可达16%;B6、B9为14%;B5、B9最高可耐受2.0 mol/L KCl,B6最高可耐受2.25 mol/L KCl,B5在pH值1.0~9.0范围内生长良好,B6的pH耐受范围为2.0~8.0,B9为2.0~9.0。相比之下,B5具有更广泛的酸碱适应性;同时,三株菌均能耐受50%的葡萄糖浓度,热致死温度都为61~64℃之间,在25℃温箱分别静置饥饿培养10d后,均能良好生长。因此,这三株菌(尤其B5)具有良好的应用开发潜能,可进一步扩大发酵检测的规模。
[1]周婷婷,金恭玺,岳永亮,等.酿酒葡萄种质资源抗葡萄霜霉病鉴定[J].新疆农业科学,2014,(10):1845-1850.
[2]Pretorius I.S.,Curtin C.D.,&Chambers P.J.(2012).The w inemaker′s bug:From ancient w isdom to opening new vistas w ith frontier yeast science.Bioeng Bugs,(3):147-156.
[3]薛军侠.酿酒酵母的筛选鉴定及耐受性初步研究[D].杨凌:西北农林科技大学,2007.
[4]宋瑶,缪礼鸿,高素芹,等.耐高温酒精酵母菌株的筛选及发酵能力比较[J].中国酿造,2009,(5):38-42.
[5]Pinu F.R.,Edw ards P.J.,G ardner R.C.,&V illas-Boas S.G.(2014).N itrogen and carbon assimilation by Saccharomyces cerevisiae during Sauvignon blanc juice fermentation.FEM S Y east,(8):1206-1222.
[6]汤晓宏,胡文效,魏彦锋,等.葡萄酒野生酿酒酵母的筛选及其生物特性的研究[J].山东大学学报.2014,(3):12-17.
[7]宋丹,喻子牛,蔡皓.耐高温产乙醇酿酒酵母菌S-13的特性研究[J].化学与生物工程,2011,(6):63-67.
[8]de Ponzzes-G omes C.M.,de M élo D.L.,Santana C.A.,Pereira G.E.,M endon?a M.O.,G omes F.C.,O liveira E.S.,Barbosa A.M. Jr,Trindade R.C.,&Rosa C.A.(2014).Saccharomyces cerevisiae and non-Saccharomyces yeasts in grape varieties of the S?o Francisco V alley.Braz J M icrobiol,(2):411-416.
[9]Cordente A.G.,Curtin C.D.,V arela C.,&Pretorius I.S.(2012).Flavour-active w ine yeasts.A ppl M icrobiol Biotechnol,(3): 601-618.
(编辑:魏翔)
S641.2
A
1673-9019(2017)01-0034-04
2016-5-10
靳正忠(1978-),男,甘肃环县人,副研究员,主要从事微生物多样性研究;
包慧芳(1978-),女,湖南华容人,副研究员,主要从事发酵工程研究。
