盐酸克伦特罗单克隆抗体的制备和鉴定
2017-03-03,,,,,,,,,
,,,,,,,,,
(1. 山东省农业科学院畜牧兽医研究所,山东济南 250100;2. 山东省畜禽疫病防治与繁育重点实验室,山东济南 250100;3. 济南市动物卫生监督所,山东济南 250011)
盐酸克伦特罗单克隆抗体的制备和鉴定
张玲玲1,2,战 翔3,彭 喆1,2,时建立1,2,吴晓燕1,2,徐胜男1,2,郑书轩1,2,徐绍建1,2,黄保华1,2,李 俊1,2
(1. 山东省农业科学院畜牧兽医研究所,山东济南 250100;2. 山东省畜禽疫病防治与繁育重点实验室,山东济南 250100;3. 济南市动物卫生监督所,山东济南 250011)
为进一步建立克伦特罗(CL)残留检测方法,给制备CL残留检测试剂盒打下基础,进行了CL单克隆抗体(McAb)的制备研究。以重氮反应,将CL与牛血清白蛋白(BSA)、鸡卵清白蛋白(OVA)偶联,分别制备免疫原和检测原,并通过杂交瘤技术,获得了5株能稳定分泌特异结合CL小分子的单克隆抗体杂交瘤细胞株(1E9A9、2A9C1、3F2E9、6G2E9、6E10D9)。这5株细胞株经过体外传代培养和冻存复苏后均能稳定分泌抗体。用间接酶联免疫吸附试验(ELISA)测定的这5株细胞上清液抗体效价分别为1:1.28×105、1:5.12×105、1:1.28×105、1:5.12×105、1:2.56×105;选用3F2E9、6E10D9细胞株,制备CL单克隆抗体腹水并纯化,其纯化后的腹水抗体效价分别为1:1.28×105、1:2.56×105,BCA(2,2-联喹啉-4,4-二甲酸二钠)方法检测的浓度分别为1.60 mg/mL、1.54 mg/mL;最终通过斑点ELISA(Dot-ELISA)方法测定CL抗原与这2株抗体有较强的结合力。在上述方法的制备及验证下,成功获得了特异性较高的CL单克隆抗体,为进一步研制CL残留检测试剂盒奠定了基础。
盐酸克伦特罗;单克隆抗体;残留检测
盐酸克伦特罗(Clenbuterol Hydrochloride,CL)商品名称盐酸双氯醇胺、克喘素、氨哮素、氨必妥、氨双氯喘通、氨双氯醇胺,俗称“瘦肉精”,化学名称为2-[(叔丁胺基)甲基]-4-氨基-3,5-二氯苯甲醇盐酸盐[1,2],分子式为C12H18Cl2N2O· HCl。CL是一种平喘药,既不是饲料添加剂,也不是兽药,而是一种β2-肾上腺素受体激动剂,因具有营养再分配、促进蛋白质合成、增加动物酮体瘦肉率、提高饲料转化率的作用,在家畜和人体内吸收好,而且与其它β-受体激动剂相比,其生物利用度高,经常被非法用作饲料添加剂,用于畜产品的生产,以至于人类食用了含有CL的畜产品后出现严重的中毒情况,对人类健康存在非常大的潜在危害。尽管我国要求自2002年9月10日起在动物饲料和饮用水中禁止使用CL,但是近几年CL在动物饲料中的违禁添加现象依然存在,使得CL在畜禽肉制品及其尿液和毛发中的残留检测得到广泛的关注和研究。
目前可以分析瘦肉精及β2-肾上腺素受体激动剂残留的主要方法包括高效液相色谱法(HPLC)[3-4]、气相色谱-质谱联用法(GC/MS)[5-6]、液相色谱-质谱联用法(LC/MS)[7]、免疫分析法等。免疫分析法具有单次处理样本数多、易于商品化供应和检测灵敏度高的优点,目前得到广泛使用。目前市场上已有许多以免疫分析法为基础的商品化试剂盒,用于检测饲料及动物体内的CL残留,但检测用到的抗体大多数为多克隆抗体,其特异性不高。因此,研制高特异性CL单克隆抗体,并以此为基础研制快速检测试剂盒,成为当前的研究热点。
为了建立一种快速、敏感、特异的CL化学发光免疫检测方法,采用重氮反应,将CL与牛血清白蛋白(BSA)偶联,获得免疫原,用其免疫BALB/c小鼠,应用杂交瘤技术,制备高特异性单克隆抗体,为研制CL快速检测试剂盒提供特异的材料,也为试剂盒的研发打下基础。
1 材料与方法
1.1试验材料
1.1.1试验动物和细胞株。雌性BALB/c小鼠,购自上海市第一人民医院(松江)动物实验中心;小鼠Sp2/0骨髓瘤细胞,上海生工生物股份有限公司抗体部保存。
1.1.2主要试剂。RPMI-1640培养液、胎牛血清(FBS),购自GIBCO公司;盐酸克伦特罗(CL)标准品、8-氮鸟嘌呤、HT、HAT、PEG、弗氏完全佐剂、弗氏不完全佐剂,均购自Sigma公司;HRP标记的驴抗鼠IgG,购自武汉三鹰生物技术有限公司;牛血清白蛋白(Bovine serum albumin,BSA)、卵清蛋白(Ovalbumin,OVA),购自上海生工公司。其它化学试剂均为分析纯以上级别。
1.1.3主要设备。生物安全柜,购自苏净集团安泰公司;CO2细胞培养箱,购自美国Therom公司;酶标仪,购自美国 BIO-RAD伯乐公司。
1.2试验方法
1.2.1抗原制备。综合文献[8-9]方法,进行条件优化,制备抗原:称取3.295 mg 约(0.01 mmol)CL溶于400 μL 0.1 M预冷盐酸中(0.04 mmol),边震荡边向其中缓缓加入10 mg/mL 的NaNO2(约0.01 mmol),并不断用微量移液器蘸取少许,用淀粉碘化钾试纸检测,直到试纸颜色刚好变为蓝紫色时,停止加入NaNO2。继续震荡,使反应充分进行,从而使CL偶氮化,然后将偶氮化的CL 分别加入到牛血清白蛋白(BSA)和卵清蛋白(OVA)溶液中,置4 ℃冰箱过夜,第二天取出后透析。上述操作均在4 ℃避光环境中进行,透析完成后,于-20 ℃冻存备用,其中CL-BSA 作为免疫原用,CL-OVA 为ELISA 包被抗原。期间会观察到偶氮后的CL滴入到BSA和OVA时,颜色先变黄色,最后变成明亮的黄色,透析和冷冻过程中颜色均未褪去。这说明CL已结合了BSA和OVA,初步确定偶联成功,省去了SDS-聚丙烯酰胺凝胶电泳[10]和紫外扫描的鉴定步骤。
1.2.2小鼠免疫及效价测定。选用6周龄的BALB/c雌性小鼠,取偶联成功的免疫原(CLBSA),用适量PBS稀释后,与等量弗氏完全佐剂乳化(抗原乳化状态判定:取1滴混合乳化液,滴入水平面,轻轻晃动,长时间不扩散),皮下分点注射。之后以相同方式,每隔两周,以弗氏不完全佐剂乳化加强免疫,共免疫3次。在最后一次免疫7天后,尾静脉采集血液样本,分离血清,以CL-OVA包被酶标板,用间接ELISA方法检测分析血清抗体效价。选取免疫效价检测值最高的小鼠,于细胞融合前3天进行冲击免疫1次,3天后取冲击免疫过的小鼠脾脏细胞进行细胞融合。
1.2.3杂交瘤细胞株的建立
1.2.3.1骨髓瘤细胞(Sp2/0)的准备。细胞融合前两周,对Sp2/0进行复苏,并于37 ℃、5% CO2恒温培养箱中传代培养。培养过程中向培养液加入8-氮鸟嘌呤(8-Azaguanine)连续处理3次,使Sp2/0细胞对HAT培养液更加敏感。融合前一天进行传代,以便使融合当天的骨髓瘤细胞处于对数生长期。
1.2.3.2饲养细胞的准备。细胞融合前一天,取3~4周龄健康的BALB/c小鼠腹腔巨噬细胞作为饲养细胞,调整细胞浓度至(l~5)×105个/mL,之后转入96孔细胞培养板中,37 ℃、5% CO2培养箱中培养,18~24小时后观察细胞生长状态。细胞形态规则、明亮、贴壁紧密时,可供细胞融合使用。
1.2.3.3脾细胞的准备。取融合前加强免疫过的小鼠,摘除眼球,采集血液样本并分离血清作为阳性对照。采血后断颈处死小鼠,浸没于75%乙醇中2~3 min,无菌摘取脾脏,制备并收集脾细胞悬液,用台酚兰染液做活细胞计数后备用。
相互间进行数据交换时,Coreldraw可以打开版本CS5及其以下任何版本的文件,文字不会变成乱码,图层不保留,所有要素合并到一个图层内,可以另存为AI文件;Illustrator 能打开Coreldraw版本10及其以下的CDR文件,图层完全保留,但文字极易出现乱码,无法存储为CDR文件。其他项对比见表4。
1.2.3.4细胞的融合。将Sp2/0骨髓瘤细胞和免疫脾细胞按1:5的比例加入到50 mL离心管中,充分混匀制成悬液,1 000 r/min,离心7 min,尽量弃去上清,轻弹离心管,使沉淀细胞呈分散状。加入聚乙二醇(PEG)促进细胞融合,之后加入不完全培养液,使PEG稀释失去促融合作用。将终止反应后的细胞悬液离心,弃上清液并加入适量的HAT培养液,轻轻吹吸沉淀的细胞,使其混匀悬浮,然后加至铺有饲养细胞的96孔细胞培养板中,5% CO237 ℃恒温培养箱中继续培养1周,期间定期观察细胞生长情况。
1.2.3.5杂交瘤细胞的筛选及克隆化培养。融合后注意观察杂交瘤细胞的生长状况,视情况决定是否换液。一般只需更换1次液体或勿需换液。换液时,先吸去原有培养孔1/2的培养液,再加入等量新鲜培养液即可。本试验融合后1周内未换液,融合后第8天开始换HT培养液,同时进行阳性杂交瘤细胞株筛选。待细胞长到孔底的1/4~1/3时,吸出上清液100 μL进行间接ELISA抗体检测,以CL-OVA 为ELISA 包被抗原。以P/N≥2.5作为阳性判断标准,用未免疫小鼠的血清作阴性对照,用抗体稀释液做空白对照。对检测为阳性的细胞进行扩大培养,同时进行克隆化培养。
克隆化培养采用有限稀释法,待细胞长到孔底的l/4~1/3时,对细胞上清进行间接ELISA检测。选择克隆数少、OD450nm值高的阳性孔,将其再次克隆。3~4次克隆化后,当所有克隆化细胞孔阳性率检测值达100%时,确定并获得5株分泌特异性单抗的杂交瘤细胞株,及时扩大培养并冻存。
1.2.4杂交瘤细胞扩大培养及冻存。单克隆细胞株经过几次克隆后,阳性率达到100%。这时将细胞从96孔培养板转入24孔培养板中,再由24孔板转入细胞培养瓶进行扩大培养。杂交瘤细胞扩大培养后,取部分细胞按照常规方法冻存。
1.2.5单克隆抗体的鉴定
1.2.5.1单克隆细胞上清效价测定。对已经建株的杂交瘤细胞进行扩大培养,冻存保留部分细胞后,将剩余细胞培养至对数生长期,1 000 r/min,离心5 min,收集培养细胞的上清液后进行间接ELISA效价测定。将上清液进行梯度稀释,以阴性小鼠血清作为阴性对照,以融合小鼠血清作为阳性对照。
1.2.5.2单克隆抗体腹水的制备纯化及效价测定。按照文献[11]的方法,选取其中2株单克隆杂交瘤细胞(3F2E9、6E10D9),制备单克隆抗体腹水并进行纯化,对纯化的抗体用BCA测定浓度,间接ELISA测定效价。梯度稀释抗体,以阴性小鼠血清作为阴性对照,以融合小鼠血清作为阳性对照。
2 结果
2.1盐酸克伦特罗免疫抗原和检测抗原的合成
经重氮反应,分别制成了免疫原CL-BSA和检测原CL-OVA。反应过程中,偶氮后的CL滴入BSA和OVA时,颜色立即变黄色,最后变成明亮的黄色,透析和冷冻干燥过程中,均未见褪去,说明偶氮化克伦特罗与载体蛋白偶联成功。
2.2小鼠免疫
小鼠第三次免疫后1周,采尾静脉血,用间接ELISA方法检测抗体效价。结果显示1#、2#、3#小鼠的血清抗体效价较高,其中1#小鼠血清效价最高,大约为1:6.4×104(表1),满足细胞融合的要求。因此细胞融合前,对1#小鼠进行冲击免疫,并于3天后取其脾细胞,与对数生长期的Sp2/0细胞融合。
2.3单克隆细胞株的筛选及杂交瘤细胞株的建立
将免疫的BALB/c小鼠脾细胞和Sp2/0小鼠骨髓瘤细胞经PEG方法融合,1周后可见孔内呈葡萄串状分布的小型克隆集落生长,细胞浑圆透亮。采用间接ELISA方法,以未免疫的BALB/c小鼠血清作阴性对照,适当倍数稀释的小鼠血清为阳性对照测定OD450nm值,选择其中阳性值最高的杂交瘤细胞株,经亚克隆筛选,最终获得5株能稳定分泌单克隆抗体的杂交瘤细胞株,分别命名为1E2A9、2A9C1、3F2E9、6G2E9和6E10D9。
2.4单克隆杂交瘤细胞上清效价检测
系列倍比稀释杂交瘤细胞培养上清,用间接ELISA法测定OD450nm值,同时设立阳性、阴性血清对照。以P/N比值≥2.5时单克隆抗体的最大稀释度(即其抗体效价),测定5株阳性杂交瘤细胞上清效价(表2)。
2.5单克隆抗体腹水效价检测和斑点免疫法(Dot-ELISA)检测结果
利用间接ELISA法和BCA法,对纯化后的抗体效价和浓度进行检测,结果见表3、表4。 斑点免疫法(Dot-ELISA)检测结果见图1。

表1 用于细胞融合的免疫BALB/c小鼠血清效价(OD450nm)
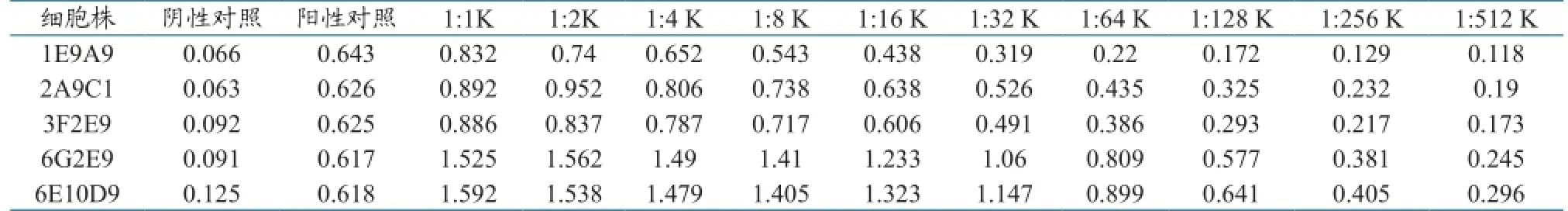
表2 单克隆杂交瘤细胞上清效价(OD450nm)

表3 单克隆抗体腹水效价(OD450nm)
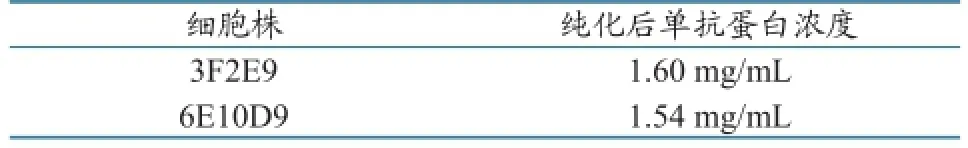
表4 单克隆抗体腹水纯化后的蛋白质浓度
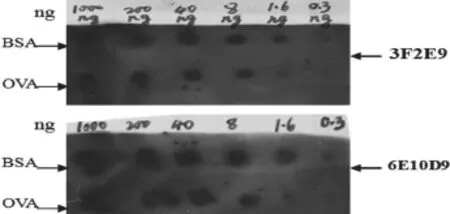
图1 斑点免疫法(Dot-ELISA)检测结果
3 结论
1997—2005年,我国相继发布《关于严禁非法使用兽药的通知》《关于查处非法生产、销售和使用盐酸克伦特罗等药品的紧急通知》《饲料及畜产品中瘦肉精等违禁药品专项整治计划》《关于加强盐酸克伦特罗管理的通知》等,农业部、卫生部、国家药监局等部门多次单独或共同发布公告,明确规定不允许在饲料和动物饮用水中添加包括CL(Clenbuterol Hydrochloride,盐酸克伦特罗)、RAC(Ractopamine,莱克多巴胺)、SAL(Salbutamol,沙丁胺醇)在内的7种药物。目前 CL 引起的中毒事件仍有发生[12],相关部门对此也广泛关注,从而出现了大量的关于抗盐酸克伦特罗单抗或多抗制备的报道。国内研究者陈继明[13]、胥传来[14]等建立了一种用兔多克隆抗体来检测CL的方法,但相比单克隆抗体,多克隆抗体特异性及稳定性效果明显不如单克隆抗体,因此在CL抗体的制备上大多还是倾向于单克隆抗体。目前国内市场上有很多种检测CL的酶免疫试剂盒,其主要为进口产品,检测成本高,费用昂贵。因此,特异性高、稳定性好的抗盐酸克伦特罗单克隆抗体的研制和发展显得有尤为重要。
众所周知,作为完全抗原,其结构必须同时具备T 细胞和B 细胞表位。小分子物质,如小肽、抗生素、激素等,其结构简单,不具备免疫原性,必须将其连接到一些大分子蛋白质载体上,借助载体蛋白的T细胞表位,间接诱导B细胞激活,使其分化增殖,从而产生针对半抗原小分子的特异性抗体[15]。目前建立半抗原免疫检测方法的主要局限性是能否获得可靠的、特异性强的抗体。本试验利用重氮反应将CL分子与载体蛋白BSA和OVA偶联,成功制备了单克隆抗体的免疫原和检测原,通过对后期细胞株的鉴定和筛选,最终获得了5株与CL有特异性反应的杂交瘤细胞株。选3F2E9、6E10D9株细胞进行抗体腹水制备和纯化,并分别通过间接ELISA和BCA方法测定效价及蛋白浓度,最终通过Dot-ELISA方法确定了抗原与筛选出的单克隆抗体的结合能力。在使用ELISA检测效价时,因为ELISA 法的重复性不好,所以摸索适宜的反应条件非常重要,还需考虑样品中基质对反应的影响,因此本试验方法在实际应用中还有待进一步优化。在以上所有的前期构建及后期鉴定后,本试验成功研制出5株单克隆抗体(1E9A9、2A9C1、3F2E9、6G2E9、6E10D9),并选取了其中2株(3F2E9、6E10D9)投入使用,为建立CL残留现场快速检测试剂盒打下了基础。
[1]韩森,马国霞,李卫芬. 盐酸克伦特罗检测技术的研究进展[J]. 畜牧与饲料科学,2006(2):33-35.
[2]贺铁明,青传来,王武康.盐酸克伦特罗免疫原的合成与鉴定[J]. 中国粮油学报,2004,19(2):85-88.
[3]林奕芝,刘奋,戴京晶,等. 高效液相色谱法测定肉与肉制品中盐酸克伦特罗残留量[J]. 中国卫生检验杂志,2002,12(2):180-181.
[4]BAZYLAK G,NAGELS L J. Simultaneous high-throughput determination of clenbuterol,ambroxol and bromhexine in pharmaceutical formulations by HPLC with potentiometric detection[J]. J Pharm Biomed Anal,2003,32(4/5):887-903.
[5]HARKINS J D,WOODS W E,LEHNER A F,et al. Clenbuterol in the horse:urinary concentrations determined by ELISA and GC/MS after clinical doses[J]. J Vet Pharmacol Ther,2001,24(1):7-14.
[6]DAMASCENO L,VENTURA R,ORTURA R,et al. Derivatization procedures for the detection of β2-agonists by gas chromatographic/mass spectrometric analysis[J]. J Mass Spectrom,2000,35(11):1285-1294.
[7]MUCKERHEIDE A,DOMEN P L,MICHAEL J G.
Cationization of protein antigens,II. Alteration of regulatory properties [J]. J Immunol,1987,138(9),2800-2804.
[8]FESSER A C,DICKSON LC,MACNEIL J D,et al. Determination of beta-agonists in liver and retina by liquid chromatography-tandem mass spectrometry[J]. J AOAC Int,2005,88(1):61-69.
[9]ITARU Y,KOHJI I. Enzyme immunoassay for clenbuterol,an β2-adrnergicstimulant[J]. Journal of immunoassay,1982,3(2):155-171.
[10]杨利国. 酶免疫测定技术[M].南京:南京大学出版社,2001,31(6):238.
[11]APPLE J,DOMEN L,MUEKERHEIDE A,et al. Cationization of protein antigens. IV. Increased antigen uptake by antigen-presenting cells[J]. Journal of Immunology,1988,140(10):3290-3295.
[12]马静. 盐酸克伦特罗胶体金免疫层析试纸条制备与应用[D]. 福建:集美大学,2015.
[13]陈继明,黄士新,周光宏,等. 酶联免疫吸附测定法检测克伦特罗[J]. 中国兽药杂志,1999,33(2):19-22.
[14]胥传来,贺铁明,王武康,等. 动物源食品中残留克伦特罗检测抗体的制备与应用[J].中国兽医科技,2004,34(12):50-54.
[15]邵炜慧,贾红,刘文博,等. 盐酸克伦特罗单克隆抗体的制备及检测方法的初步建立[J].中国预防兽医学报,2006,28(4):450-453.
(责任编辑:朱迪国)
Preparation and Identi fi cation of Monoclonal Antibodies against Clenbuterol
Zhang Lingling1,2,Zhan Xiang3,Peng Zhe1,2,Shi Jianli1,2,Wu Xiaoyan1,2,Xu Shengnan1,2,Zheng Shuxuan1,2,Xu Shaojian1,2,Huang Baohua1,2,Li Jun1,2
(1. Animal Husbandry and Veterinary Research Institute,Shandong Academy of Agricultural Sciences,Jinan,Shandong 250100;2. Shandong Key Laboratory of Animal Disease Control and Breeding,Jinan,Shandong 250100;3. Jinan Animal Health Supervision Institution,Jinan, Shandong 250011)
In order to further develop the method for detecting residual Clenbuterol(CL),so as to lay foundation for research and development of the detection kits,monoclonal antibodies(mAbs)against CL were prepared. Through diazo reaction,CL was coupled with Bovine serum albumin(BSA)and Ovalbumin(OVA),the coupling products were used as immunogen and detection antigen,respectively. Using hybridoma technique,5 monoclonal hybridoma cell strains(1E9A9、2A9C1、3F2E9、6G2E9、6E10D9)which could secret antibodies against small CL molecules were obtained. During serial subcultivation in vitro and cryopreservation and resuscitation,the antibodies could be secreted stably. ELISA detection showed the antibody titers of supernatant of the 5 strains were 1:128 000,1:512 000,1:128 000,1:512 000 and 1:256 000,respectively. Ascites containing mAbs were induced by hybridoma cell strain 3F2E9 and 6E10D9 and the antibody titers in puri fi ed ascites were 1:128 000 and 1:256 000. Measurement by BCA protein determination method showed their concentrations were 1.60 mg/mL and 1.54 mg/mL repectively. Through Dot-ELISA,good reactivity between the two mAbs and CL was veri fi ed. As a conclusion,speci fi c mAbs against CL were prepared successfully,which would lay foundation for further research of the kits for CL residue detection.
Clenbuterol;monoclonal antibody;residue detection
S851.34
:A
:1005-944X(2017)02-0091-06
10.3969/j.issn.1005-944X.2017.02.027
“十三五”国家重点研发计划(2016YFD0500708);山东省现代农业产业技术体系疫病控制岗位(SDAIT-08-07);山东省农业重大应用技术创新课题;山东省科技发展计划(2014GNC111011);山东省农业科学院青年英才培养工程;山东省农业科学院青年科研基金项目(2016YQN53)
李 俊
