维生素D受体在体外培养SD大鼠脂肪细胞中的表达
2017-03-02杨祎琦庞田田
程 佳,杨祎琦,庞田田
(陕西理工大学维生素D生理与应用研究所,陕西汉中 723000)
维生素D受体在体外培养SD大鼠脂肪细胞中的表达
程 佳,杨祎琦,庞田田
(陕西理工大学维生素D生理与应用研究所,陕西汉中 723000)
为了探索维生素D受体(VDR)在SD大鼠脂肪细胞分化过程中的表达规律,采用Ⅱ型胶原酶消化法进行SD大鼠脂肪细胞的分离培养,并将其诱导分化为成熟的脂肪细胞,分别在细胞生长至单层汇合后的第0、4、8、12、16天收集细胞样品。对VDR和脂滴进行荧光染色,同时采用Western blot对脂肪细胞分化过程中的VDR蛋白表达量进行分析,采用real-time PCR定量分析脂肪细胞分化过程中的VDR表达量。结果显示,随SD大鼠脂肪细胞的分化,细胞中脂滴逐渐增加,VDR mRNA和蛋白的表达量与脂质积累过程呈负相关性,表明VDR的表达在脂肪细胞分化过程中有一定的变化规律,其可能以负反馈的调节机制参与了脂肪细胞的分化过程。
维生素D受体;脂肪细胞;脂滴;SD大鼠
维生素D受体(vitamin D receptor,VDR)属于核受体(类固醇激素/甲状腺激素受体)超家族成员,在体内主要介导维生素D的细胞生物学作用[1]。当VDR与其活性配体1,25(OH)2D3结合后,在细胞核内与视黄酸X受体(retinoid X receptor,RXR)形成异二聚体[2],并结合于靶基因启动子区的维生素D反应元件(vitamin D response elements,VDREs)上,以直接或间接的作用方式激活下游靶基因的表达,从而介导细胞增殖、分化和凋亡,调节机体免疫和血管生成等各种生物学过程[3-7]。越来越多的研究证明,VDR及其配体1,25(OH)2D3不仅参与钙磷代谢的经典调节过程,还参与了由肥胖引起的代谢相关综合征等疾病的发生[8-10]。临床研究显示,在肥胖患者体内,25(OH)D水平较正常个体低,而当肥胖患者补充维生素D药物增加血清25(OH)D水平后,能有效减少内脏脂肪的沉积[11]。此外,体内1,25(OH)2D3水平与肥胖患者的BMI和体脂量呈负相关[12]。诸多研究表明,VDR及其配体1,25(OH)2D3与脂肪组织功能之间存在一定的相关性[13],但维生素D系统对脂肪细胞的影响尚有争论,有待进一步验证。我们的前期研究检测了VDR在大鼠不同脂肪组织中的表达,结果证实VDR在脂肪组织中的表达不受性别和部位的影响,并主要存在于脂肪细胞核中[14]。
为了进一步探明VDR在脂肪细胞分化过程中的作用,以VDR在SD大鼠脂肪细胞分化过程中的表达规律为研究内容,采用细胞生物学和生物化学等方法对VDR的表达进行分析,以期为VDR及其配体1,25(OH)2D3预防和治疗肥胖提供理论依据。
1 材料与方法
1.1 材料
SD大鼠的乳鼠10只(西安交通大学实验动物中心);200目细胞筛网(浙江);Ⅱ型胶原酶(Sigma),F12培养基(武汉),胎牛血清FBS(Gibco),青霉素、链霉素(Hyclone),SDS-PAGE凝胶试剂盒(碧云天),PVDF膜、脱脂奶粉(北京鼎国),胰岛素(Geneviwe),Master mix(ABI),Bodipy(Sigma),VDR D-6 mouse monoclone antibody(Santa Cruz),Alex flour 488 conjugate Goat anti-mouse IgG(H+L)(Invitrogen);其他未标明试剂均为分析纯。
1.2 方法
1.2.1 SD大鼠脂肪细胞分离与培养 根据已建立的方法[15],断颈处死SD大鼠,于750 mL/L乙醇中浸泡15 min,取腹股沟脂肪组织,在PBS中漂洗数次,剪碎至1 mm3大小,置于15 mL离心管中,加入5倍脂肪组织体积的2 g/LⅡ型胶原酶,置于37℃恒温摇床中60 r/min消化1.5 h;加入等体积含200 mL/L FBS F12完全培养基终止消化,200目不锈钢网筛过滤,滤液经1 200 r/min离心15 min,弃上清后,用PBS重悬细胞沉淀,1 200 r/min离心5 min;重复2次。将细胞沉淀重悬于F12完全培养基中,接种到培养皿,于37℃、体积分数为5% CO2培养箱中静置培养,48 h后更换培养液,以后2 d换液1次。倒置显微镜下观察细胞生长情况,当细胞密度达到95%左右,加入2.5 g/L胰蛋白酶进行消化传代培养。为促进脂肪细胞分化,用含有10 μg/mL胰岛素完全培养基进行诱导培养。
1.2.2 脂滴bodipy染色 将细胞用10 mL/L多聚甲醛于冰上固定30 min,PBS洗涤细胞2次~3次,加bodipy工作液避光浸染,室温染色30 min,PBST清洗细胞2次~3次[16]。倒置荧光显微镜观察结果。
1.2.3 VDR免疫荧光染色 将细胞用10 mL/L多聚甲醛于冰上固定30 min,PBS洗涤细胞2次~3次,用10 g/L Triton X-100 浸洗15 min;PBST溶液洗涤2次;30 g/L BSA+100 mL/L山羊血清溶液室温封闭20 min。VDR抗体D-6(1∶250稀释)溶液,37℃孵育2 h。PBST洗4次~5次后,加二抗孵育(1∶500稀释)溶液,37℃温育1 h。PBST洗4次~5次;倒置荧光显微镜观察结果。
1.2.4 VDR的实时荧光定量PCR(real-time PCR)检测 Trizol法提取各个分化阶段的脂肪细胞总RNA,反转后用于qPCR分析。各基因引物序列如表1所示。按照Thermo Scientific RevertAid First Strand cDNA Synthesis Kit说明书,将RNA反转录为cDNA。qPCR反应体系为20 μL:Master mix 10 μL(ABI),上下游引物各0.5 μL,cDNA模板1 μL,灭菌ddH2O 8 μL。反应程序为:95℃ 30 s;60℃ 30 s,72℃ 2 min,共40个循环。各基因均以相同的条件进行qPCR,重复3次,以β-actin为内参基因,根据各样品的Ct值计算基因表达量并分析结果。
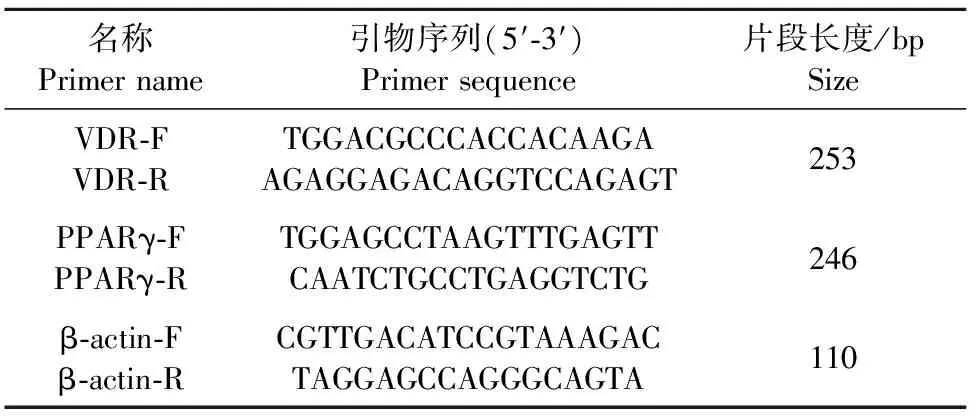
表1 各基因real-time PCR引物信息
1.2.5 VDR的Western blot(WB)检测 蛋白裂解液提取各个分化阶段的脂肪细胞总蛋白,采用WB技术分析各分化阶段VDR的蛋白表达情况。SDS-PAGE凝胶电泳用120 g/L分离胶和60 g/L浓缩胶,每孔点样20 μL,浓缩胶电压为100 V,分离胶电压为120 V。转PVDF膜,电流200 mA,冰浴2 h。50 g/L脱脂奶粉室温封闭2 h,TBST清洗。一抗1∶1 000稀释,室温孵育2 h,TBST清洗,二抗1∶2 000稀释,室温孵育2 h,TBST清洗。显色液曝光,记录结果并进行灰度分析。
1.2.6 统计分析 利用SPSS 13.0统计软件对数据进行单因素方差分析(One-way ANOVA)和t检验进行显著性检验。
2 结果
2.1 SD大鼠脂肪细胞的分离培养
经试验发现,P0代脂肪细胞在接种24 h贴壁,35 h达到对数生长期,细胞快速增殖;P1代细胞在传代24 h后仍保持旺盛的增殖能力,72 h单层汇合,细胞呈现多边形,细胞核位于细胞中心(图1)。说明以Ⅱ型胶原酶消化法得到的大鼠脂肪细胞,经过1次传代之后的状态良好,为了进一步检测细胞的成脂分化能力,对其进行了诱导分化。
2.2 SD大鼠脂肪细胞分化各阶段的荧光染色
经过诱导处理后,对各个分化时期的脂肪细胞进行了荧光染色。其中bodipy的染色结果显示(图2),在SD大鼠脂肪细胞分化的0~12 d,脂滴逐渐增加。随着脂质的在细胞中的积累,bodipy染色也逐渐增加,在12 d达到峰值。但对比12 d和16 d的染色结果发现,16 d的脂滴少于12 d,说明SD大鼠脂肪细胞在12 d~16 d的分化后期,脂质的分解过程增强,脂滴沉积下降,表现为脂滴减少。
同时,为了分析VDR在脂肪细胞分化过程中的亚细胞定位,对经过分化处理的各个时期的脂肪细胞进行了VDR的免疫荧光染色。结果显示(图3),VDR主要分布在体外培养的SD大鼠脂肪细胞的细胞核内,在细胞质中有少量表达。此外,在SD大鼠脂肪细胞分化的不同阶段,VDR的表达有一定的变化。0~4 d的VDR表达变化不明显,但相比第4天的VDR表达,在细胞分化的8 d VDR表达明显降低,而在8 d~16 d VDR的表达又有所增加。
2.3 VDR在SD大鼠脂肪细胞分化各阶段的蛋白表达
由于免疫荧光的染色只能定性说明VDR的分布与表达。因此,为了在蛋白水平分析VDR的表达规律,对VDR在脂肪细胞分化阶段的表达量进行定量分析,将细胞样品进行WB检测。由图4可知,内参β-actin在大鼠脂肪细胞分化各阶段的表达水平基本一致,而VDR的表达水平表现出与免疫荧光染色相似的规律性。VDR在0 d和4 d表达量变化不明显,而在分化8 d,VDR蛋白表达量显著下降(P<0.01),在12 d和16 d又明显增高,但16 d与12 d相比没有显著差异。

图1 体外培养SD大鼠脂肪细胞的生长情况(100×)
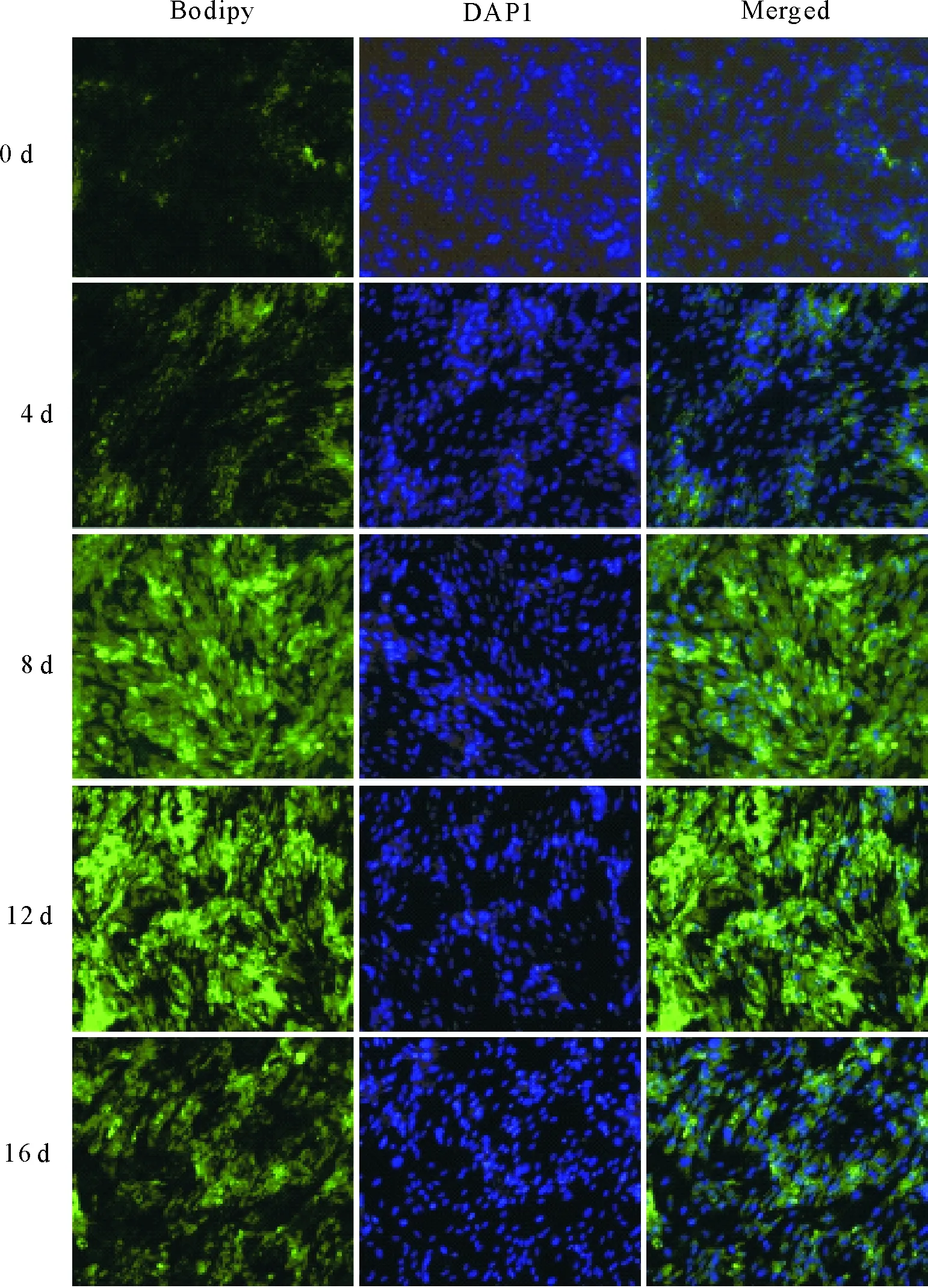
绿色荧光为bodipy染料(左),蓝色荧光为DAPI核染(中),两者叠加(右)
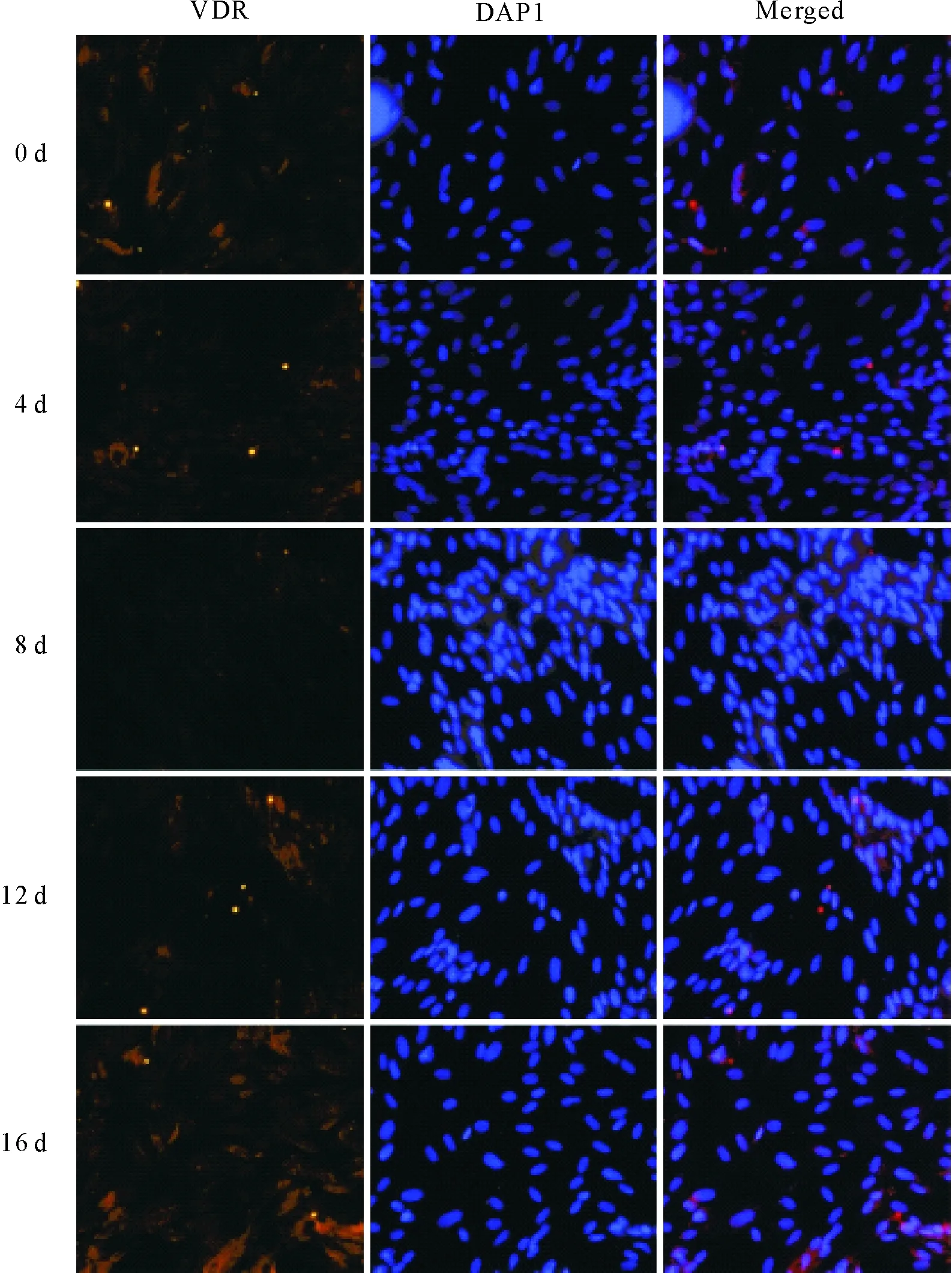
红色荧光为VDR(左),蓝色荧光为DAPI核染(中),两者叠加(右)
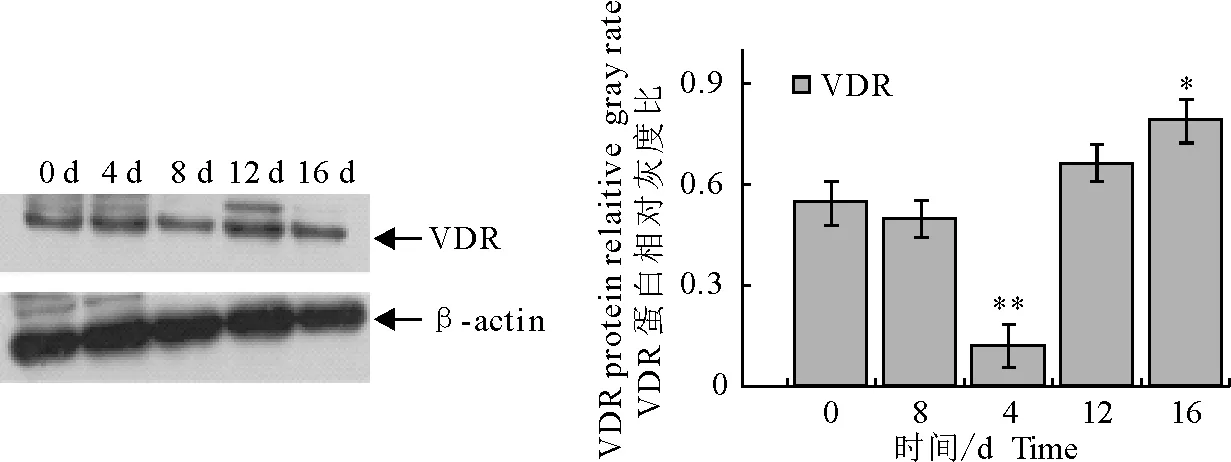
β-actin为内参,WB检测VDR表达(左),灰度分析(右),*P< 0.05,**P< 0.01
2.4 VDR在SD大鼠脂肪细胞分化各阶段基因表达分析
对结果分析发现,PPAR γ基因表达量在大鼠脂肪细胞分化过程中是逐步增加的,只在16 d有所降低。而VDR表达量在脂肪细胞分化前期(0~8 d)基本稳定,从分化8 d开始至16 d过程中VDR逐渐增加,并在16 d达到峰值(P<0.01)(图5)。qPCR的分析结果说明了两个问题,一方面从PPAR γ的表达趋势可以说明该细胞培养和诱导分化的方法是有效的,可以获得分化明显的脂肪细胞。另一方面,结合免疫荧光染色和WB检测的结果可知,在大鼠脂肪细胞分化过程中,脂滴在分化8 d开始增加,而VDR的mRNA和蛋白表达在分化8 d最少,而当脂滴在分化16 d开始减少时,VDR的mRNA和蛋白表达却最多。由此说明,随SD大鼠脂肪细胞中脂滴的增加,VDR mRNA和蛋白的表达量与脂质积累过程呈负相关性。
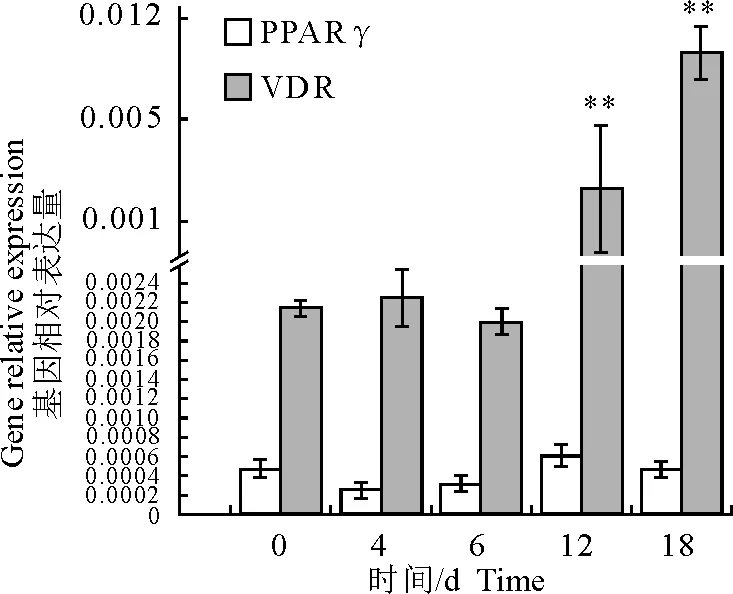
β-actin为内参,n=3,** P< 0.01
3 讨论
早期研究表明,VDR敲除小鼠表现出能量消耗增强,同时减少高脂饮食引起的肥胖症[17]。另有研究进行了基因组分析和人原代脂肪间充质干细胞的分化检测,明确了VDR及其配体1,25(OH)2D3在脂肪细胞分化中的作用——在诱导成脂的过程中,1,25(OH)2D3可促进脂质积累,并增强PPARγ的表达[18]。在VDR敲除小鼠间充质细胞中,表现出脂肪组织受损,但在小鼠中脂肪细胞中特异性表达人VDR能增强脂滴的积累,表明VDR能激活体内脂肪细胞脂质存储[19]。同时,维生素D代谢也能影响脂肪组织中脂肪因子的生产和炎症反应[20]。然而,体内的研究结果易受到脂肪组织分泌因子的影响,探索VDR及其配体1,25(OH)2D3对体外培养脂肪细胞分化的作用相对可靠。
在细胞水平上,脂肪形成可分为2个阶段,即决定性分化和终端分化。由于大多数已经被用来研究脂肪形成的细胞模型主要为脂肪细胞系(如3T3-L1和3T3-F442A)。因此,对于脂肪细胞的决定性分化过程了解较全面,但对于脂肪细胞终端分化的研究较少[10]。
本研究主要采用Ⅱ型胶原酶消化法对SD大鼠的脂肪细胞进行体外培养。结果显示,通过该方法得到的P1代脂肪细胞呈现出多边形,细胞核位于细胞中心。该方法与Ⅰ型胶原酶消化法相比,能够获得更多的脂肪细胞(结果未显示)。经诱导处理后,脂肪细胞在分化后期可见大小不同的脂滴分布于细胞内部。Bodipy作为一种荧光染料能特异性的与细胞中的脂质结合并发绿色荧光,以此定位细胞中的脂滴,并能与油红O染色结果相互验证[15]。但由于油红O染色效果不理想,只展示了bodipy的染色结果。此外,在大鼠脂肪细胞诱导分化过程中,脂肪细胞形态变化与其他文献表述略有差异[21],其原因主要是由于诱导液成分不同引起的。然而,大鼠脂肪细胞的分化能力要明显强于小鼠等其他动物的脂肪细胞。用胰岛素单独诱导的方法也尚未影响到后续脂滴的形成和相关基因的表达,是可行的。
VDR及其配体1,25(OH)2D3作用机制对代谢健康的维持有着重要的作用,本文着重研究VDR潜在影响脂肪细胞的分化作用。结果显示,VDR的表达在SD大鼠脂肪细胞分化过程中呈现一定的规律性,并与脂质沉积过程有负相关性,表明VDR可能通过负反馈调节的方式参与脂肪细胞分化,且与1,25(OH)2D3在临床试验中的结果相互印证,为VDR及其配体1,25(OH)2D3预防和治疗肥胖症提供了相关证据和理论基础。
[1] Mutt S J,Hyppönen E,Saarnio J,et al.Vitamin D and adipose tissue-more than storage[J].Front Physiol,2014,24:5:228. doi: 10.3389/fphys.2014.00228.
[2] Syal K,Srinivasan A,Banerjee D.VDR,RXR,coronin-1 and interferon gamma levels in PBMCs of type-2 diabetes patients:molecular link between diabetes and tuberculosis[J].Indian J Clin Biochem,2015,30(3):323-328.
[3] Ding C,Gao D,Wilding J,et al.Vitamin D signalling in adipose tissue[J].Br J Nutr,2012,108(11):1915-1923.
[4] Johnson A L,Zinser G M,Waltz S E.Loss of vitamin D receptor signaling from the mammary epithelium or adipose tissue alters pubertal glandular development[J].Am J Physiol Endocrinol Metab,2014,307(8):E674-E685.
[5] Ochs-Balcom H M,Chennamaneni R,Millen A E,et al.Vitamin D receptor gene polymorphisms are associated with adiposity phenotypes[J].Am J Clin Nutr,2011,93(1):5-10.
[6] Narvaez C J,Simmons K M,Brunton J,et al.Induction of STEAP4 correlates with 1,25-dihydroxyvitamin D3 stimulation of adipogenesis in mesenchymal progenitor cells derived from human adipose tissue[J].J Cell Physiol,2013,228(10):2024-2036.
[7] Tsai C W,Liu K L,Lin Y R,et al.The mechanisms of carnosic acid attenuates tumor necrosis factor-alpha-mediated inflammation and insulin resistance in 3T3-L1 adipocytes[J].Mol Nutr Food Res,2014,58(4):654-664.
[8] Ricciardi C J,Bae J,Esposito D,et al.1,25-Dihydroxyvitamin D3/vitamin D receptor suppresses brown adipocyte differentiation and mitochondrial respiration[J].Eur J Nutr,2015,54(6):1001-1012.
[9] Bouillon R,Carmeliet G,Lieben L,et al.Vitamin D and energy homeostasis:of mice and men[J].Nat Rev Endocrinol,2014,10(2):79-87.
[10] Ji S,Doumit M E,Hill R A.Regulation of adipogenesis and key adipogenic gene expression by 1,25-dihydroxyvitamin D in 3T3-L1 cells[J].PLoS One,2015,10(6):e0126142.
[11] Barchetta I,Angelico F,Del Ben M,et al.Strong association between non alcoholic fatty liver disease (NAFLD) and low 25(OH) vitamin D levels in an adult population with normal serum liver enzymes[J].BMC Med,2011,9:85-91.
[12] Landrier J F,Karkeni E,Marcotorchino J,et al.Vitamin D modulates adipose tissue biology:possible consequences for obesity?[J].Proc Nutr Soc,2016,75(1):38-46.
[13] Osei K.25-OH vitamin D:is it the universal panacea for metabolic syndrome and type 2 diabetes?[J].J Clin Endocrinol Metab,2010,95(9):4220-4222.
[14] 程 佳,杨祎琦,祁珊珊,等.维生素D受体在大鼠脂肪组织中的表达定位[J].生物技术,2014(6):31-34.
[15] 程 佳,蒲 蕾,杨 浩,等.慢病毒介导shRNA干扰RBP4促进猪前体脂肪细胞成脂分化[J].畜牧兽医学报,2013,44(6):937-943.
[16] 王 平,熊 燕,杨公社,等.慢病毒载体介导的RNA干扰Akt2表达抑制猪前体脂肪细胞分化[J].中国生物化学与分子生物学报,2012(1):53-60.
[17] Guzey M,Jukic D,Arlotti J,et al.Increased apoptosis of periprostatic adipose tissue in VDR null mice[J].J Cell Biochem,2004,93(1):133-141.
[18] Sadie-Van Gijsen H,Crowther N J,Hough F S,et al.The interrelationship between bone and fat:from cellular see-saw to endocrine reciprocity[J].Cell Mol Life Sci,2013,70(13):2331-2349.
[19] Keith M E,LaPorta E,Welsh J.Stable expression of human VDR in murine VDR-null cells recapitulates vitamin D mediated anti-cancer signaling[J].Mol Carcinog,2014,53(4):286-299.
[20] Sun J.VDR/vitamin D receptor regulates autophagic activity through ATG16L1[J].Autophagy,2016,12(6):1057-1058.
[21] 蒲 蕾,程 佳,吴国芳,等.干扰视黄醇结合蛋白4对猪脂肪细胞PI3K/Akt信号通路的影响[J].生物工程学报,2013,29(4):447-457.
Expression of Vitamin D Receptor in SD Rat AdipocyteinVitro
CHENG Jia,YANG Yi-qi,PANG Tian-tian
(VitaminDResearchInstitute,ShaanxiSci-TechUniversity,Hanzhong,Shaanxi,723000,China)
To explore the vitamin D receptor (VDR) expression in SD rat adipocyte differentiation process,Type Ⅱ collagenase digestion method was used to separate the SD rat adipocyte,and the insulin was used as an inductive agent to induce the preadipocyte into adipocyte.Collection of samples in the periods of cell growth in 0 day,4 day,8 day,12 day,16 day respectively.Fluorescent staining was used to analyze VDR and lipid droplets.Western blot was used to detect VDR protein expression,qPCR was used to detect VDR gene expression quantity in the process of adipocyte differentiation.The results showed that lipid drops increased gradually,the expression of VDR mRNA and protein was negative with lipid accumulation in the process of SD rat adipocyte differentiation.The results indicated that the exprssion of VDR is regular in adipocyte differentiation,and VDR could regulate lipid homeostasis in the way of negative feedback mechanism.
vitamin D receptor; adipocyte; lipid droplet; SD rat
2016-07-14
陕西省科技厅项目(2014JQ3109);汉中市科技局项目(2014ZKC47-07);陕西理工学院博士启动项目(SLGQD13(2)-22)
程 佳(1983-),女,内蒙古呼和浩特人,讲师,博士,主要从事维生素D的细胞生物学作用的研究。*通讯作者
S852.163
A
1007-5038(2017)02-0040-06
