曙红-蛋白质体系吸收光谱的应用
2017-03-02张彦青
张 彦 青
曙红-蛋白质体系吸收光谱的应用
张 彦 青
(衡水学院 化工学院,河北 衡水 053000)
采用分光光度法,以曙红染料为显色剂,研究了在酸性介质中曙红与牛血清蛋白作用的吸收光谱并用于测定样品中蛋白质的含量.曙红与蛋白质作用构成了曙红-蛋白复合物,研究了影响该复合物稳定和灵敏度的因素,确定了该实验的最佳条件.实验表明,曙红-蛋白质复合物最大吸收波长从515 nm红移到531 nm.在最佳条件下,线性范围为0.4×10-5~ 1.6×10-5mol/L,检出限为0.09×10-5mol/L.
曙红;牛血清蛋白;吸收光谱;分光光度法
蛋白质是生命的物质基础之一,在生物化学和其他生物学科、食品检验、临床检验、疾病诊断、生物药物分离提纯和质量检验中蛋白质的分离与定性、定量分析是最重要的工作[1].蛋白质也是生命科学中很重要的研究对象,化学家及生物学家对蛋白质的分析研究极为关注.目前,蛋白质测定方法有分光光度法、凯氏定氮法、荧光法、质谱法等方法.其中分光光度法因操作简便、快速、可测范围广、仪器价廉而得到广泛的应用,由此建立曙红-蛋白质体系吸收光谱的应用分析.
1 实验部分
1.1 仪器与试剂
PH-3C型精密酸度计(上海精密科学仪器有限公司);TU-1901双光束紫外可见分光光度计(北京普析通用仪器有限责任公司);FA2204B电子天平(上海精密科学仪器有限公司).牛血清蛋白(卫生部上海生物制品研究所)标准溶液1.0 × 10-4mol/L,曙红储备液浓度1.0 × 10-4mol/L;磷酸氢二钠-柠檬酸缓冲溶液:0.2 mol/L磷酸氢二钠溶液与0.1 mol/L柠檬酸溶液按一定比例混合,配成不同pH的缓冲溶液,并用酸度计校正pH值.其余试剂均为分析纯,实验用水为二次蒸馏水.
1.2 实验方法
于10 mL比色管中,加入一定量的1.0 × 10-4mol/L牛血清蛋白标准溶液,1.2 mL 1.0 × 10-4mol/L曙红溶液,1.2 mL pH 2.50的磷酸氢二钠-柠檬酸缓冲溶液,用水稀释至刻度,摇匀,静置10 min后,以试剂的空白作参比,在531 nm处测定溶液的吸光度.
2 结果与讨论
2.1 吸收光谱
按实验方法配制溶液后,对曙红与蛋白反应体系进行扫描,如图1所示.由图1可知:曙红在紫外可见光区产生强烈吸收,最大吸收波长为515 nm,当曙红与蛋白反应后生成复合物,最大吸收波长从原来的515 nm红移到531 nm确定测定蛋白质的最大吸收波长为531 nm.因此本实验选用波长为535 nm作为测定波长.
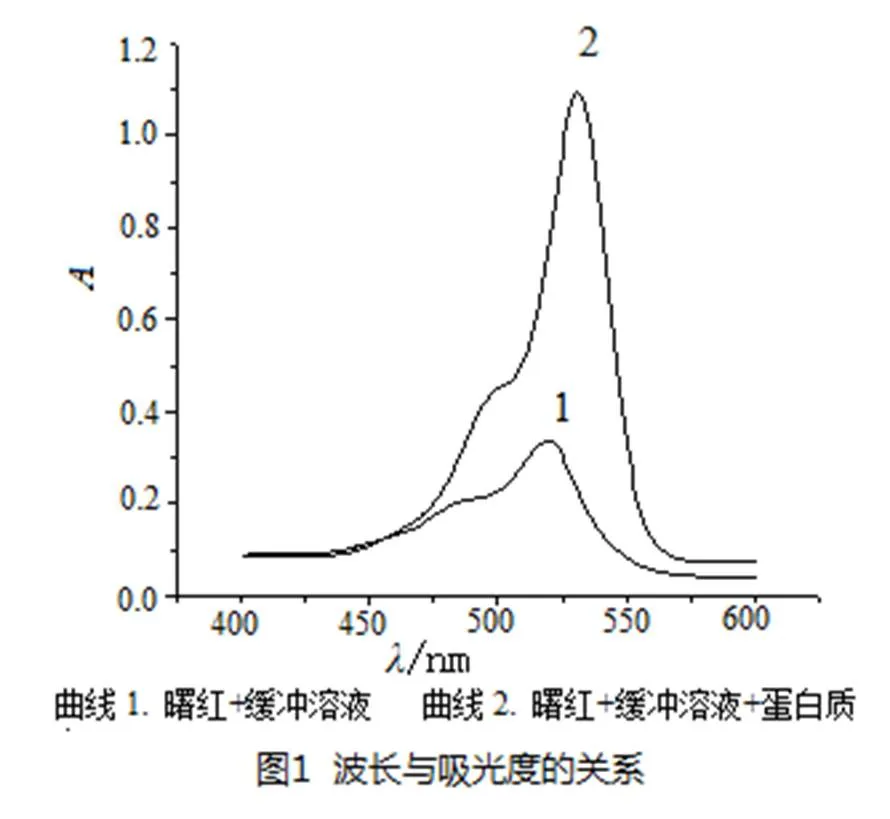
2.2 溶液酸度的影响
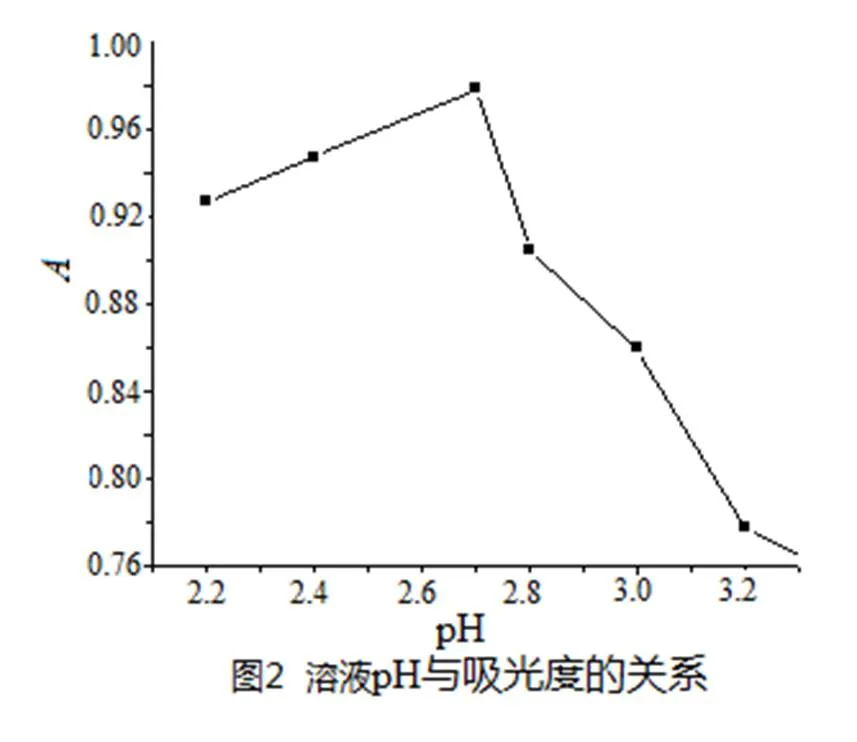
试验了混合酸-氢氧化钠、盐酸-乙酸钠、磷酸氢二钠-柠檬酸缓冲溶液等多种缓冲溶液对实验的影响,结果表明,加入磷酸氢二钠-柠檬酸后体系的灵敏度最高,故选用磷酸氢二钠-柠檬酸作为缓冲溶液,试验结果见图2表明:反应体系在pH为2.5时,复合物的吸光度为最佳,反应的灵敏度也较高.本试验选择pH为2.5的磷酸氢二钠-柠檬酸缓冲溶液控制体系酸度,缓冲溶液的用量以1.2 mL为宜.
2.3 曙红溶液用量的影响
按实验方法操作表明只改变曙红溶液的用量,且随着曙红浓度的增加,曙红分子和蛋白分子之间结合程度不断增大,复合物吸光度不断增加.从现象上看,反应体系颜色桃红色逐渐加深.当曙红用量为1.0 × 10-5~2.0 × 10-5mol/L时,体系荧光强度增加最大.故实验选1.0 × 10-4mol/L曙红溶液最佳用量为1.2 mL.
2.4 复合物的稳定性
试验结果表明,曙红-蛋白质复合物在室温下,5 min后显色较稳定,稳定时间至少在3h以上.实验选在10 min后进行.
2.5 标准曲线
按实验方法操作,改变牛血清白蛋白用量,以牛血清白蛋白的浓度为横坐标,以吸光度为纵坐标绘制出标准曲线,如图3所示.线性回归方程为:= 0.977 32 + 0.1481 6,r = 0.998 2,线性范围为0.4 × 10-5~ 1.6 × 10-5mol/L.利用3σ/K法11次平行测定得该方法的检出限为0.9 × 10-6mol/L.
3 分析应用
准确移取4.5 mL市售牛奶于100 mL的容量瓶中,蒸馏水定容,混合均匀.取3.00 mL分析,对不同厂家牛奶中蛋白含量按实验方法进行操作并进行了加标回收率实验测定,结果如表1所示.由此看出,该方法准确、可靠,适用于市售牛奶中蛋白质含量的快速分析.

表1 牛奶中蛋白含量的测定(n = 6)
[1] CAO W G, JIAO Q C. Mechanism of the Interaction Between Coomassie Brilliant Blue and Bovine Serum Albumin[J]. Acta Laser Biology Sinica, 2008,17(1):32-37.
[2] 曹红翠.紫外分光光度法测定蛋白质的含量[J].广东化工,2007,34(8):93-94.
[3] 詹国庆,罗登柏,蓝金贵,等.刚果红分光光度法测定血清蛋白质[J].分析化学,2002,30(11):1399.
[4] 张国芝.凯氏(Kjeldahl)定氮法之实验总结[J].山东化工,2011,40(1):57-59.
[5] 陈鸿琪,夏闽.荧光染料吖啶红测定蛋白质的生物探针[J].理化检验-化学分册,2001,37(2):53-55.
[6] 陈小萍,郑玉聪,金玉玲.荧光分光光度法测定保健品中的微量蛋白[J].卫生研究,2001,25(l):62-63.
[7] 黄珍玉,于雁灵,方彩云,等.质谱鉴定磷酸化蛋白研究进展[J].质谱学报,2003,24(4):494-500.
Application of Absorption Spectrum of Eosine and Bovine Serum Albumin System
ZHANG Yanqing
(College of Chemistry, Hengshui University, Hengshui, Hebei 053000, China)
With spectrophotometry, under the acidic condition and with eosin dye as chromogenic agent, the absorption spectrum of interaction between eosine Y (EOSY) and bovine serum albumin (BSA) is studied. The total proteins in serum samples have been determined with the proposed method. Eosin interacts with bovine serum albumin (BSA) and forms a complex of EOSY-BSA and the factors influencing the complex’s stability and sensitivity has been studied. The best conditions of the experiment are determined. Experiments show that the maximum absorption wavelength of EOSY-BSA bathochromic-shifts from original 515 nm to 531 nm. Under the best condition, the linear range is 0.4×10-5~ 1.6×10-5mol/L and the detection limit is 0.09×10-5mol/L.
eosin; bovine serum albumin; absorption spectrum; spectrophotometry
10.3969/j.issn.1673-2065.2017.01.004
O657.32
A
1673-2065(2017)01-0013-03
2016-05-20
河北省高等学校科学技术研究项目(zc2016087)
张彦青(1982-),女,河北衡水人,衡水学院化工学院讲师.
(责任编校:李建明 英文校对:李玉玲)
