煤粉再燃CH基团均相还原NO的量子化学研究
2017-03-02崔晓丽温正城胡金旭王关晴徐江荣
崔晓丽,温正城,胡金旭,王关晴,徐江荣
(杭州电子科技大学能源研究所,浙江 杭州 310018)
煤粉再燃CH基团均相还原NO的量子化学研究
崔晓丽,温正城,胡金旭,王关晴,徐江荣
(杭州电子科技大学能源研究所,浙江 杭州 310018)
采用量子化学方法从理论上研究了以CH基团为代表的挥发份均相还原NO的反应过程,运用ub3lyp方法计算各反应通道上所有驻点的结构参数、虚频振动和相对能量,获得了反应路径,揭示了挥发份均相还原NO的反应机理,得到的反应活化能约为150 kJ/mol.实验表明,焦炭异相还原NO的活化能为260~300 kJ/mol.通过比较可知,相比煤焦异相还原NO,挥发份均相还原NO具有更高的还原效率,是煤粉再燃中更为重要的脱硝还原剂.
煤粉再燃;量子化学;挥发份;CH基团;活化能
0 引 言
NOx是目前常见的大气污染物,也是危害极大的一类污染物.煤粉再燃技术是目前常用的燃烧过程中脱硝的方法,是降低NOx排放的诸多炉内方法中最有效的措施之一[1].实验研究表明,煤粉再燃过程中热解出的挥发份和煤焦固体颗粒都对NOx具有显著的还原作用,可将NO还原为N2[2-4].文献[5]发现再燃燃料使用挥发份含量较高的褐煤时,NOx脱除率较高,效果比使用天然气时好.由于煤热解出的挥发份对NOx的还原起重要的作用,而煤粉炉中生成的氮氧化物90%以上为NO[6],因此对挥发份还原NO的微观机理进行详细研究具有一定的现实意义和学术价值.
近年来关于煤焦和挥发份还原NO反应,许多研究者已经展开了广泛的研究,主要是研究了温度、比表面积、孔隙结构和碳的活性位及催化剂等对焦炭异相还原NO的反应的影响[7-9],但对于挥发份还原NO反应研究较少,具体反应路径尚不明确,本文以CH基团作为典型的挥发份,采用量子化学方法计算并获得了挥发份均相还原NO的反应途径,计算得到反应的活化能,揭示反应机理,分析并比较了挥发份均相还原NO和焦炭异相还原NO的反应性能.
1 研究方法
本文采用量子化学UB3LYP和QCISD(T)方法,综合考虑计算时间和计算精度,选择在6-31G(d)基组水平上,对CH基团均相还原NO的相关基元反应进行详细的研究.利用UB3LYP/6-31G(d)计算方法得到反应物、过渡态、中间体及产物的几何参数,通过振动分析和IRC分析获得反应路径,并在QCISD(T)/6-31G(d,p)水平上计算驻点能量,同时进行零点能较正,得到了反应活化能[10-11].最后,对挥发份和煤焦还原NO反应的活化能进行比较,讨论分析以CH为代表的挥发份还原NO的反应机理.
B3LYP是从头计算中的一种较为常用的密度泛函方法,UB3LYP是指开壳层的B3LYP计算.密度泛函方法(Density Function Theory, DFT)是目前常用的一种从头计算方法,密度泛函理论不再以轨道波函数为基而是以密度函数为基.DFT方法是在Hartree-Fock(HF)方法的基础上通过泛函计算发展得到的,而QCISD(T)则是一种高精度的能量计算方法.本文所有计算均采用Gaussian09程序包计算[12].
2 机理研究与结果分析
采用UB3LYP方法,在6-31G(d)基组水平上进行计算,获得反应通道上所有驻点的结构参数,得到挥发份CH基团均相还原NO的反应路径.通过计算得到该还原反应可能的基元反应为:

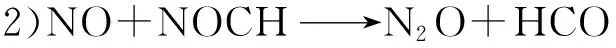

反应1是CH基团与NO结合生成中间体NOCH的反应.反应2是NO与上一步反应生成的中间体反应生成中间产物基团HCO与N2O.反应3是生成的N2O被CH还原,生成N2与基团HCO.
2.1 中间体NOCH的生成
CH基团与NO活性较强并能够结合生成中间体NOCH,查东等[13]通过理论分析和同素异构等方式找到了9种中间体.本文重点研究CH基团与NO经过多次反应后生成N2的反应,因此重点关注N原子在两端的以下2种中间体,如图1所示,图中标注了各个原子之间的键长、键角以及平面角的大小.
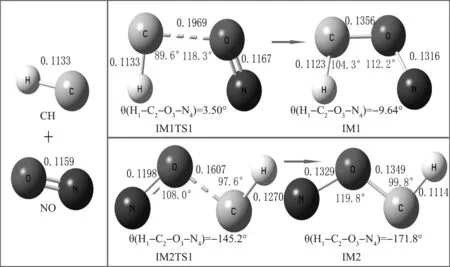
图1 CH与NO反应的产物
如上图1所示,CH与NO反应经过过渡态IM1TS1,IM2TS1生成中间体IM1,IM2.IM1TS1中在C与O之间有一个-277.42 cm-1虚频,使得C与O逐渐靠近成键.从上图中可以看到IM1路径中C与O之间的键长从0.196 9 nm缩短到0.135 6 nm生成中间体IM1.同理,IM2路径中的C与O之间的键长从0.160 7 nm缩短到0.134 9 nm生成中间体IM2.通过QCISD(T)方法计算得到以上两种中间体IM1和IM2的相对能量分别为-89.572 kJ/mol和-107.624 kJ/mol,生成IM1所需要的活化能较小,所以IM1更容易生成.
2.2 中间体与NO反应生成中间产物
反应2是中间体IM1与IM2分别与NO反应生成中间产物HCO与N2O,反应过程如图2和图3所示.经过计算发现每个反应都有3条不同的路径.该反应的生成的N2O是CH基团均相还原NO过程中的重要的中间产物,马利锦[14]在研究煤粉热解过程中发现了N2O,说明该条反应路径可能是CH基团均相还原NO的真实反应路径.
2.2.1 IM1与NO反应生成中间产物
IM1与NO反应有3条不同的路径分别为IM1L1,IM1L2,IM1L3,反应过程如图2所示,图2中标明了反应物、生成物以及中间体过渡态的键长、键角和平面角的大小.图2中的3条路径可以分别描述为:
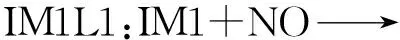

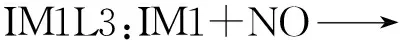

图2 IM1与NO的反应过程
从图2中可以看到,反应过程中IM1端点处的N原子与NO中的N原子逐渐靠近成键,而IM1中的N原子与O原子逐渐远离,最后NO键断开生成HCO与N2O.
图4(a)分别为IM1与NO反应路径IM1L1,IM1L2,IM1L3的相对能量变化,IM1与NO结合后分别形成过渡态IM1L1TS1,IM1L2TS1和IM1L3TS1,这3个过程都是吸收能量的,所需能量分别为167.587 kJ/mol,159.496 kJ/mol和160.200 kJ/mol,然后这3个不稳定的中间体释放能量生成了稳定的IM1L1A1,IM1L2A1和IM1L3A1.之后,这3个中间体分别从外界吸收5.860 kJ/mol,15.110 kJ/mol和-10.200 kJ/mol的能量,从而形成不稳定的过渡态IM1L1TS2,IM1L2TS2和IM1L3TS2,最后NO键断裂形成稳定的产物HCO和N2O.该步反应的活化能分别为167.587 kJ/mol、159.496 kJ/mol和160.200 kJ/mol.
2.2.2 IM2与NO反应生成中间产物以及产物
IM2与NO反应有3条不同的路径分别为IM2L1,IM2L2,IM2L3,反应过程如图3所示,图中标明了反应物、生成物以及中间体过渡态的键长、键角和平面角的大小.图中的3条路径可以分别描述为:


在IM2L1,IM2L2两条路径反应过程中,IM2端点处的N原子与NO中的N原子逐渐靠近成键,而IM2中的N原子与O原子逐渐远离,最后NO键断开生成HCO与N2O.由于IM2L3路径空间结构上的特殊性,在IM2端点处的N原子与NO中的N原子逐渐靠近成键的同时,IM2中的C原子与NO中的O原子也逐渐靠近成键,形成IM2L3A1所示的五边形结构,然后2个NO键逐渐断裂生成HCOO和N2.

图3 IM2与NO的反应过程
图4(b)分别为IM2与NO反应路径IM2L1,IM2L2,IM2L3的相对能量变化,IM2与NO结合后分别形成过渡态IM2L1TS1,IM2L2TS1和IM2L3TS1,这3个过程都是吸收能量的,所吸收的能量分别为175.598 kJ/mol,161.940 kJ/mol和155.920 kJ/mol,然后这三个不稳定的中间体释放能量生成了稳定的IM2L1A1,IM2L2A1和IM2L3A1.之后,这3个中间体从外界吸收一定的能量形成不稳定的过渡态IM2L1TS2,IM2L2TS2和IM2L3TS2,所吸收的能量分别为20.210 kJ/mol,22.910 kJ/mol和23.940 kJ/mol.前两条路径为NO键断裂形成稳定的产物HCO和N2O,最后一条路径为2个NO键断裂生成HCOO和N2.该步反应的活化能分别为175.598 kJ/mol,161.940 kJ/mol和155.920 kJ/mol.
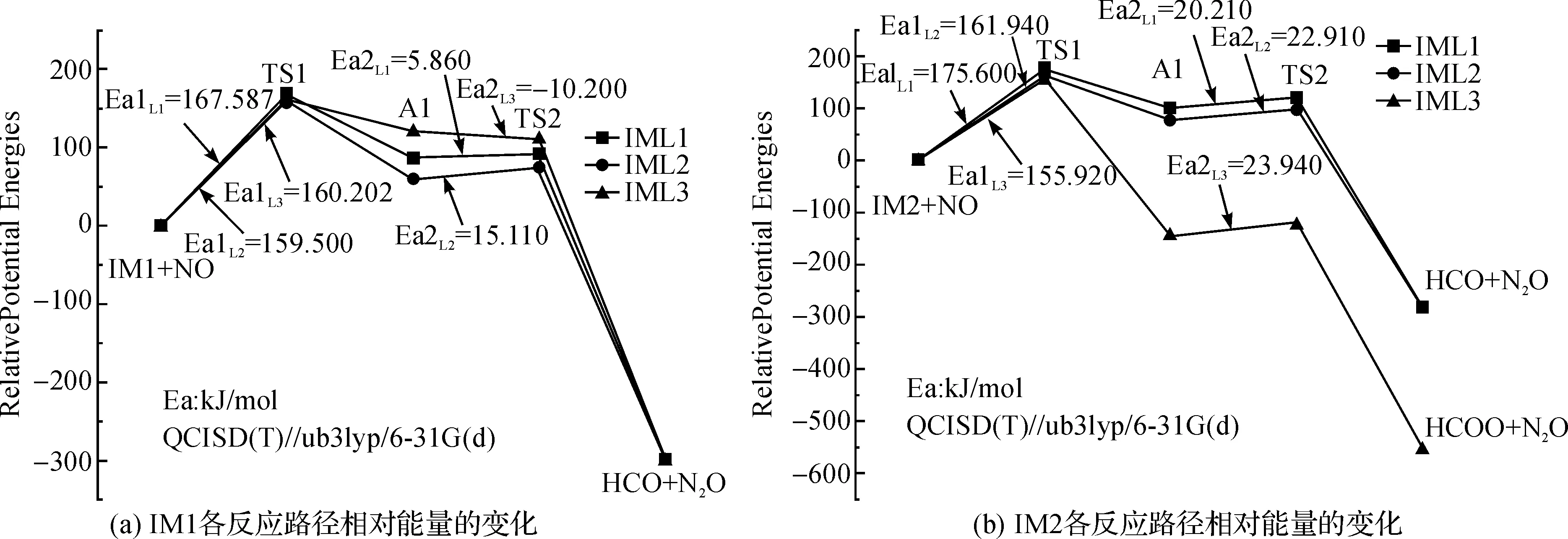
图4 各反应路径相对能量的变化
2.3 CH还原中间产物N2O
反应3是反应2中生成的N2O与CH反应生成HCO和N2,反应过程如图5所示,图5中标明了反应物、生成物以及中间体过渡态的键长、键角和平面角的大小.反应开始时CH靠近N2O中的O原子和N原子并逐渐成键,形成CON三边形结构,然后NO键断裂,CN键断裂,生成HCO与N2.反应路径简要描述如下:
能量变化如下:CH+N2O吸收103.440 kJ/mol的能量后形成不稳定的过渡态R2TS3,然后释放能量生成中间体R2IM2,中间体吸收18.480 kJ/mol的能量形成过渡态R2TS4,最后生成HCO和N2.反应3的反应活化能为103.440 kJ/mol.

图5 CH还原中间产物N2O的反应过程
2.4 挥发份均相还原NO与焦炭异相还原NO的比较
综合上文所述,CH基团均相还原NO的反应的6条路径的反应活化能分别为167.587 kJ/mol,159.496 kJ/mol,160.200 kJ/mol,175.598 kJ/mol,161.940 kJ/mol和155.920 kJ/mol.其中路径IM2L3的反应活化能最小,为155.920 kJ/mol.该路径经过2步反应将NO还原为N2,其他路径则需要3步反应.
煤粉再燃过程中,焦炭一般以固相形式存在,CH自由基和NO为气相,因此焦炭异相还原NO,而CH均相还原NO.实验文献表明[15-16],焦碳异相还原NO的活化能一般为260~300 kJ/mol,最低为258.50 kJ/mol,而挥发份CH基团均相还原NO反应的活化能为155.920 kJ/mol,明显低于焦炭异相还原NO反应的活化能,说明在煤粉再燃过程中,挥发份均相还原NO比煤焦异相还原NO具有更高的反应活性.
3 实验结论
1)针对CH均相还原NO反应,计算得到路径IM1L1,IM1L2,IM1L3,IM2L1,IM2L2和IM2L3的反应活化能分别为167.587 kJ/mol,159.496 kJ/mol,160.200 kJ/mol,175.598 kJ/mol,161.940 kJ/mol和155.920 kJ/mol.
2)分析比较各反应路径,得到活化能最低的路径为IM2L3反应的产物为HCOO和N2,IM1L3反应路径的能量也较低,为155.920 kJ/mol.反应较难沿着路径IM2L1进行,该条路径的反应活化能较高为175.598 kJ/mol.
3)查阅文献[15-16]得到:焦碳异相还原NO的活化能一般为260~300 kJ/mol,最低为258.500 kJ/mol,而挥发份均相还原NO反应的活化能为155.920 kJ/mol,明显低于焦炭异相还原NO反应的活化能,说明挥发份均相还原NO比煤焦异相还原NO具有更高的反应活性.
4 结束语
本文通过计算获得挥发份均相还原NO的反应途径,揭示了反应机理,通过比较发现,挥发份均相还原NO比煤焦异相还原NO具有更高的反应活性,今后将进一步研究如何提高该类反应的效率以降低煤粉再燃过程中NOx的含量,从而使挥发份均相还原NOx的优势得到充分的发挥.
[1]凌荣华,文军,齐春松.燃料分级燃烧技术的研究现况和应用前景[J].热力发电,2003,32(8):6-8.
[2]杨建成.高挥发份煤分级燃烧NOx减排实验及应用研究[D].哈尔滨:哈尔滨工业大学,2015.
[3]DRUMMOND L J.Shock Induced Reactions of Methane with Nitrous and Nitric Oxides[J].Bulletin of the Chemical Society of Japan,1969,42 (2):285-289.
[4]刘茂省.煤粉空气分级和再燃技术机理、应用和模型研究[D].杭州:浙江大学,2009.
[5]CHEN S L,MCCARTHY J M,CLARK W D,et al. Bench and pilot scale process evaluation of reburning for in-furnace nox reduction[J].Journal of Engineering for Gas Turbines & Power,1986,108:3(3):450-454.
[6]张聚伟.高温条件下NO-焦炭反应动力学的研究[D].哈尔滨:哈尔滨工业大学,2009.
[7]LI Y H,RADOVIC R,LU G Q,et al.A New Kinetic Model for the NO-carbon Reaction [J].Chemical Engineering Science,1999,54(19):4125-4136.
[8]AARNA I,SUUBERG E M.A Review ofthe Kinetics of the Nitric Oxide-carbon Reaction [J].Fuel,1997,76(6):475-491.
[9]LOPEZ D,CALO J.The NO-carbon Reaction: the Influence of Potassium and CO on Reactivity and Population of Oxygen Surface Complexes[J].Energy & Fuels,2007,21(4):1872-1878.
[10]LEE C,YANG W R,PARR R G,et al.Development of the Colle-Salvetti correlation-energy formula into a functional of the electron density [J]. Physical Review B Condensed Matter,1988,37(2):785-792.
[11]温正城,周俊虎,王智化,等.碱金属对煤焦异相还原NO的催化机理的量子化学研究[J].浙江大学学报(工学版),2008,42(8):1452-1457.
[12]GAUSS J,CREMER D.Analytical evaluation of energy gradients in quadratic configuration interaction theory[J].Chemical Physics Letters,1988,150(3/4):280-286.
[13]查东,郑妍,尚静,等.CH基团与NO反应机理的量子化学研究[J].四川师范大学学报(自然科学版),2006,29(1):101-105.
[14]马利锦.煤焦燃烧过程中燃料氮转化规律研究[D].哈尔滨:哈尔滨工业大学,2013.
[15]张秀霞,周志军,周俊虎,等.含氮焦炭异相还原NO反应机理的密度泛函理论研究[J].化工学报,2011,62(4):1048-1054.
[16]张秀霞.焦炭燃烧过程中氮转化机理与低NOx燃烧技术的开发[D].杭州:浙江大学,2012.
Quantum Chemistry Study on the Homogeneous Reaction of CH and NO in the Progress of Pulverized Coal Reburning
CUI Xiaoli, WEN Zhengcheng, HU Jinxu, WANG Guanqing, XU Jiangrong
(InstitutionofEnergy,HangzhouDianziUniversity,HangzhouZhejiang310018,China)
There is a detailed study on homogeneous reduction reaction of the volatile represented by the CH group and NO in this paper, and the reaction is investigated by employing quantum chemical calculations in theory. The calculation method of ub3lyp is used to calculate the structural parameters, vibration frequency and energy of stagnation in all reaction, at the same time, it can reveal the mechanism of homogeneous reduction reaction between NO and the volatile, which is as same as a reaction path. Finally, it can obtain the activation energy about 150 kJ/mol by calculating. Experimental data in the literature show that the activation energy is about 260-300 kJ/mol. The homogeneous reduction reaction of NO and volatile has higher reduction efficiency comparing to reduction of NO with char. It is an important denitration reducing agent in pulverized coal reburning.
pulverized coal reburning; quantum chemistry; volatile; CH group; activation energy
10.13954/j.cnki.hdu.2017.01.018
2016-03-14
崔晓丽(1991-),女,河南周口人,硕士研究生,能源装备洁净化技术.通信作者:温正城副教授,E-mail:wenzc@hdu.edu.cn.
X511
A
1001-9146(2017)01-0081-06
