响应曲面法分析低盐条件下温度与pH对斜带石斑鱼幼鱼能量代谢的联合效应
2017-03-02黄建盛张健东汤保贵王忠良
黄建盛,陈 刚,张健东,汤保贵,王忠良,周 晖
(广东海洋大学水产学院,湛江 524088)
响应曲面法分析低盐条件下温度与pH对斜带石斑鱼幼鱼能量代谢的联合效应
黄建盛,陈 刚,张健东,汤保贵,王忠良,周 晖
(广东海洋大学水产学院,湛江 524088)
采用二因素五水平的中心复合设计和响应曲面分析方法,以温度(21~33℃)和pH(6.5~8.5)为因子,以耗氧率和排氨率为响应指标,探讨了在低盐条件下温度和pH对斜带石斑鱼(Epinephelus coioides)幼鱼能量代谢的联合影响。结果表明,本实验条件下,随着温度的上升,耗氧率(MO2)和排氨率(MTAN)呈上升的变化;随着pH的上升,MO2和MTAN呈先上升后下降的变化。温度一次效应对幼鱼的MO2影响极显著(P<0.01),二次效应对幼鱼的MO2影响显著(P<0.05);pH一次效应对幼鱼MO2影响显著(P<0.05),二次效应影响极显著(P<0.01);温度与pH互作效应对MO2影响显著(P<0.05)。温度一次效应对幼鱼的MTAN影响极显著(P<0.01),二次效应对幼鱼的MTAN无显著影响(P>0.05);pH一次效应和二次效应对幼鱼MTAN影响显著(P<0.05);温度与pH互作效应对MTAN无显著影响(P>0.05)。所考察因子与幼鱼MO2、MTAN间二次多项回归过程的决定系数分别为0.981 1、0.954 6(P<0.01),可用于分析与预测。通过对所建立的回归方程同时优化,得到温度与pH的最佳组合为:温度31.2℃和pH 7.6。在此组合条件下,幼鱼MO2、MTAN最大值分别为188.44 mgO2·(kg·hr)-1;7.01 mgTAN·(kg·hr)-1,可靠度为0.902。实验结果提示,低盐条件下斜带石斑鱼养殖可在本实验中得到的最优因子组合下进行,以提高生产效益。
斜带石斑鱼;耗氧率;排氨率;低盐水体;响应面法
鱼类摄取食物后,营养物质经过一系列复杂的化学反应为机体提供能量,这一过程受到内在因素和外在因素的共同影响。水温和水体pH是鱼类生物能量学的重要影响因子,水温主要通过改变鱼体体温,从而对鱼体组织细胞内的各种酶活力产生影响,进一步影响鱼体新陈代谢的水平;水体pH也是主要通过改变代谢酶活力而影响能量代谢[1]。关于温度、pH对鱼类能量代谢的研究已有一些报道,如,鮸(Miichthys miiuy)幼鱼的耗氧率随温度升高而增大并呈指数相关,pH对鮸幼鱼耗氧率无显著影响[2];条石鲷(Oplegnathus fasciatus)幼鱼耗氧率、排氨率随温度的升高而增大[3]。卵形鲳鲹(Trachinotus ovatus)幼鱼随着温度的升高,耗氧率和排氨率均是先增大后减少;随着pH的升高,耗氧率无显著性变化,排氨率呈先增大后减少的趋势[4]。上述这些研究结果揭示了温度和pH对鱼类能量代谢的变化规律。然而,上述的研究主要集中在单因素的温度和pH几个孤立的水平上对能量代谢的影响,没有涉及环境因子之间的互作效应,同时,上述这些研究只分析了温度或pH对能量代谢的一次效应,并未建立模型和考察温度或水体pH的二次效应,使得研究结果缺乏可靠的预测性。
目前,斜带石斑鱼(Epinephelus coioides)作为广东、海南、福建等地区的海水网箱养殖的主要品种之一正在蓬勃发展着,并成为沿海部分地区水产养殖经济增长的支柱产业之一。然而,近年来为了避免沿海地区的恶劣环境因素对其生长造成的风险,逐渐发展池塘低盐度养殖并取得成功。目前,关于水温和水体pH对低盐条件下斜带石斑鱼幼鱼能量代谢的联合效应尚未见有报道。本文在已有研究基础上,应用中心复合试验设计(central composite design,CCD)分析方法考察温度与水体pH对斜带石斑鱼幼鱼在低盐环境下耗氧率和排氨率的联合影响,并对各因子的二次效应及其交互作用进行分析。并结合响应曲面法(response surface methodology,RSM)分析耗氧率、排氨率随温度和pH的变化规律,建立相应模型,旨在为斜带石斑鱼低盐养殖生理生态及养殖过程中水质管理提供一定的参考。
1 材料与方法
1.1 实验鱼和低盐适应
实验于2013年6月10日~8月10日于广东海洋大学鱼类实验室进行,共60 d。实验鱼为广东海洋大学鱼类实验室在广东省湛江市东海岛生物研究基地繁育的幼鱼,选取健康、活力好的幼鱼600 ind充氧运回实验室,幼鱼平均体质量23.67 g,平均体长10.3 cm。在实验室水槽中暂养,水槽共40个,规格为70 cm×50 cm×60 cm,每个水槽15 ind鱼,暂养期间,持续充气,自然光照,每天8∶00时和16∶00时各饱食投喂1次,溶解氧保持在6 mg·L-1以上,水温为(27.5 ±0.3)℃,pH 7.8,氨氮<0.01 mg·L-1,自然海水的盐度为28~31,每天换水1次。暂养2周后,待幼鱼摄食正常后每个水槽中开始加入经曝气后的自来水,以每天2~4个盐度单位逐渐降低水体盐度至12左右,并保持在此盐度下稳定适应1周。盐度测定使用手持式盐度计(HSS-100,上海精密仪器仪表有限公司)进行测定。每天换水一次,并尽量保持水体环境因子一致,换水量根据水质情况而定。
实验所用的饲料为东丸石斑鱼专用C6配合饲料(广东越群海洋生物研究开发有限公司),近似营养成分:水分9.01%,粗蛋白52.94%,粗脂肪12.21%,粗灰分14.51%,粗纤维3.0%以下,钙2.0%以下,磷1.8%以下。
1.2 实验方法
1.2.1 实验鱼驯化
实验鱼经过低盐适应后,先开始温度驯化,采用渐变方式进行,每天温度升降控制在2℃范围之内,用电子恒温棒和冰袋控温,驯化至相应温度后开始进行相应的pH驯化。水体pH也采用渐变方式调节,用盐酸(0.2 mol·L-1)和氢氧化钠(0.2 mol·L-1)调节,每天变幅不超过0.5,pH测定采用pH计(PHS-3C,上海精密仪器仪表有限公司)进行测定。驯化至相应pH后,稳定适应1周后开始实验。
1.2.2 实验设计
正式实验前先进行预实验,通过单因子实验确定低盐条件下斜带石斑鱼可以正常摄食和生长的水体温度和pH范围。实验采用中心复合实验设计,因子为温度(21~33℃)和pH(6.5~8.5)。该实验设计因子点数4,轴点数4,中心点数5,星号臂α=1.41,共计13次实验组合,每个实验组合重复3次。能量代谢为耗氧率及排氨率为响应指标,具体的温度和pH组合见表1。
1.2.3 响应指标测定
耗氧率测定所用测定装置是间歇性流水式呼吸仪(AQUARE SP,Qubit Systems Inc.,Canada,下文简称呼吸仪)(图1)。此套系统测定过程包括测定、水体交换及等待3个阶段,在测定阶段,呼吸室完全封闭,测定时间可根据时间需要调节,通常最长以水中溶氧量下降不大于呼吸前溶氧的10%为基础。测定阶段结束后是水体交换阶段启动,以更新呼吸室内的水保持溶解氧饱和度,接着是短暂的滞后等待阶段。如此往复,实现长时间实时测定。溶解氧探头(OxyGuard Probes,德国)安装在呼吸室里面,通过数据采集器连接到计算机,在计算机软件(RESP-EDU)中可直接读出耗氧率的数据。
将驯化至实验设置的温度-pH组合条件后,暂养的实验鱼禁食3 d(以确保胃排空)。禁食后随机取实验鱼称量湿重后,轻轻地转入相应条件呼吸室内,待鱼稳定适应后进行呼吸测定和水样采集(用于测定氨氮)。从取鱼称重到转入呼吸室过程时间在5 min内,而且尽量避免实验鱼反应过激。每个实验组合梯度测定6 ind鱼,有4套呼吸装置,其中3套呼吸装置放置1 ind鱼,剩下的1套呼吸装置不放置鱼,留作空白对照组。耗氧率数据直接由呼吸仪在线测定读取,至少读取5个数据取平均值作为该尾鱼耗氧率。呼吸仪持续测定每尾鱼耗氧率,每次需要时间13~19 min,包括水体交换时间6~9 min,测定时间6~9 min,等待时间1 min。

图1 间歇性流水呼吸系统原理结构图Fig.1 Map of intermittent flow respirometry
排氨率测定用于测定排氨率的水样采集时间与耗氧率测定时间相对应。在呼吸室进水时间点(测起始氨氮含量)和出水时间点(测终末氨氮含量)迅速取10 mL的水样用于氨氮测定。氨氮测定用Test Kits氨氮测试盒(默克公司,原理:水杨酸分光光度法)采用分光光度计(6600,UVVIS,德国)在340 nm光波下测定。一般而言,氨态氮是氮排泄的主要物质,故不考虑其它形式的氮化合物。排氨率的计算公式如下:
式中,V是呼吸室的有效体积(L);△ATAN是在测定期间氨氮质量浓度的变化量(mg·L-1);△T是测定时间(h);W是幼鱼湿重(kg)。
氧氮比计算根据测定的耗氧率、排氨率的数据计算氧氮比。计算公式如下:
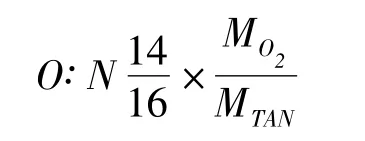
1.2.4 数据处理
数据测定结果用平均值±标准差(Mean± SD)表示,通过最小二乘法拟合因子与响应值之间的二次多项回归方程为:
Y=b0+b1T+b2pH+b3T×pH+b4T2+b5pH2式中,Y是响应变量(在此响应为耗氧率或排氨率);b0为回归常数;b1为温度的一次效应;b2为pH的一次效应;b3为温度与pH间的互作效应;b4为温度的二次效应;b5为pH的二次效应。
采用Design-Expert(v8.0)软件进行实验设计与统计分析,对温度、pH与响应值进行二次多项回归拟合并绘制响应曲面图和等高线图。并对回归模型方差分析和系数进行显著性检验,当P<0.05时认为差异显著,P<0.01时认为差异极显著。
2 结果与分析
2.1 耗氧率
温度与pH不同组合对低盐水体下斜带石斑鱼幼鱼耗氧率的测定结果见表1,并对所测定的结果采用最小二乘法进行回归拟合,得到幼鱼耗氧率与温度、pH之间实际的二次多项回归模型为:
MO2=-1 644.19+31.31T+341.46pH-1.84T×pH-0.20T2-19.15pH2
式中,R2=0.981 1,校正系数R2=0.967 6,说明回归模型能解释98.11%响应值的变化,仅有总变异的1.89%不能用此模型解释,精密度(adeq precisior)是指有效信号与噪声的比值,大于4.0视为合理,耗氧率模型精密度达到27.284,因此说明回归模型拟合程度良好。
对幼鱼耗氧率回归模型方差分析进行显著性检验,结果见表2。表2中的数据显示,回归模型F=72.77,P=0.000 1<0.01,表明回归模型极显著;失拟项F=0.36,P=0.784 2>0.05,说明所建立的模型有效。因此,可以用上述回归模型来分析和预测温度和pH对幼鱼的耗氧率的结果。
幼鱼耗氧率回归模型系数显著性检验结果见表3。表3中数据显示,温度一次效应对幼鱼的耗氧率有极显著影响(P<0.01),二次效应对幼鱼的耗氧率有显著影响(P<0.05);pH一次效应对幼鱼耗氧率有显著影响(P<0.05),二次效应有极显著影响(P<0.01);温度与pH互作效应对耗氧率有显著影响(P<0.05)。
温度与pH和幼鱼的耗氧率之间的响应曲面及其等高线图见图2所示。通过图2能直观地评价温度与pH对幼鱼耗氧率的相互作用,等高线的性状可反映出两因子交互效应的强弱,椭圆形表示两因子交互效应显著,而圆形则表示两因子交互效应不显著。在本实验条件下,幼鱼耗氧率在温度为21~33℃范围内随着温度的上升而上升;在pH为6.5~7.5范围内随着pH的上升而上升,pH高于7.5则开始下降;图2-A中等高线为椭圆形反映温度与pH对幼鱼的耗氧率有显著的互作效应(P<0.05)。

表1 温度与pH的实验设计组合及结果Tab.1 Experimental design of temperature(T)and pH and results

表2 温度与pH对斜带石斑鱼幼鱼耗氧率的回归模型方差分析Tab.2 Variance analysis for the effects of temperature(T)and pH on oxygen consumption rate of juvenile E.coioides under low-salinity culture

表3 温度与pH对斜带石斑鱼幼鱼耗氧率的模型回归方程系数显著性检验Tab.3 Test of significance for regression coefficient of temperature(T)and pH on oxygen consumption rate of juvenile E.coioides under low-salinity culture
2.2 排氨率
温度与pH不同组合对低盐环境下斜带石斑鱼幼鱼排氨率的测定结果见表1,并对所测定的结果采用最小二乘法进行回归拟合,得到幼鱼排氨率与温度、pH之间实际的二次多项回归模型为:
MTAN=-89.46+1.70T+17.39pH-0.08T ×pH-0.01T2-0.97pH2
式中,R2=0.954 6,校正系数R2=0.905 6,说明回归模型能解释95.46%响应值的变化,仅有总变异的4.54%不能用此模型解释,精密度(adeq precisior)是指有效信号与噪声的比值,大于4.0视为合理,排氨率模型精密度达到15.852,因此说明排氨率回归模型拟合程度良好。
对幼鱼排氨率回归模型方差分析进行显著性检验,结果见表4。表4中的数据显示,回归模型F=24.33,P=0.000 3<0.01,表明回归模型极显著;失拟项F=1.41,P=0.363 6>0.05,说明所建立的模型有效。因此,可以用上述回归模型来分析和预测温度和pH对幼鱼的排氨率的结果。
幼鱼排氨率回归模型系数显著性检验结果见表5。表5中数据显示,温度一次效应对幼鱼的排氨率有极显著影响(P<0.01),二次效应对幼鱼的排氨率无显著影响(P>0.05);pH一次效应和二次效应对幼鱼排氨率有显著影响(P<0.05);温度与pH互作效应对排氨率无显著影响(P>0.05)。
温度与pH和幼鱼的排氨率之间的响应曲面及其等高线见图3所示。通过图3能直观地评价温度与pH对幼鱼排氨率的相互作用。在本实验条件下,幼鱼排氨率在温度为21~33℃范围内随着温度的上升而上升;在pH为6.5~7.5范围内随着pH的上升而上升,pH高于7.5则开始下降;图3-A中等高线为椭圆形反映温度与pH对幼鱼的排氨率无显著的互作效应(P>0.05)。

图2 温度与pH及其交互作用对低盐条件下斜带石斑鱼幼鱼耗氧率影响的等高线(A)和响应面(B)Fig.2 Response of contour plot(A)and its surface plot(B)of the effects of temperature(T)and pH and their mutual interactions on oxygen consumption rate of juvenile E.coioides under low-salinity culture

表4 温度与pH对斜带石斑鱼幼鱼排氨率的回归模型方差分析Tab.4 Variance analysis for the effect of temperature(T)and pH on ammonia excretion rate of juvenile E.coioides under low-salinity culture

表5 温度与pH对斜带石斑鱼幼鱼排氨率的模型回归方程系数显著性检验Tab.5 Test of significance for regression coefficient of temperature(T)and pH on ammonia excretion rate of juvenile E.coioides under low-salinity culture

图3 温度与pH及其交互作用对低盐条件下斜带石斑鱼幼鱼排氨率影响的等高线(A)和响应面(B)Fig.3 Response of contour p lot(A)and its surface p lot(B)of the effects of temperature(T)and pH and their mutual interactions on ammonia excretion rate of juvenile E.coioides under low-salinity culture

表6 温度与pH对低盐条件下斜带石斑鱼幼鱼耗氧率和排氨率影响的优化置信区间Tab.6 Optimization of confidence interval of the effects of temperature and pH on ammonia excretion rate of juvenile E.coioides under low-salinity culture
2.3 氧氮比
斜带石斑鱼幼鱼氧氮比的计算结果见表1。幼鱼在温度21~33℃范围和pH 6.5~8.5范围,不同组合条件下其氧氮比值范围为22.93~40.22。
2.4 响应值优化
参考MONTGOMERY的方法[5],对幼鱼的耗氧率、排氨率的最适温度和pH进行同时优化(表6),结果显示,温度和pH的最优组合为31.2℃和7.6,此时幼鱼耗氧率、排氨率最大值为188.44 mgO2·(kg·hr)-1、7.01 mgTAN·(kg·hr)-1,可靠度为0.902。
3 讨论
温度与pH作为鱼类生长发育的重要环境因子,直接影响鱼类能量代谢[2-4,6-11]。研究认为,温度和pH主要通过影响鱼体组织细胞内代谢酶活力而影响能量代谢[3]。本实验结果表明,采用中心复合设计是一种有效的实验设计与统计分析的技术,所得的回归方程精度高,具有可预测性。在本实验条件下,温度与pH对低盐环境下的斜带石斑鱼幼鱼的耗氧率、排氨率均有显著的影响,二次回归模型决定系数分别为0.981 1、0.945 6和0.988 0,方程拟合较好,可以进行分析与预测。
温度对鱼类代谢酶活性起控制作用[12]。本实验中,pH为6.5~8.5范围,温度为21~33℃范围,幼鱼的耗氧率、排氨率均随着温度的上升而上升。这说明在该温度范围,随着温度的上升,斜带石斑鱼幼鱼维持生命代谢的各种组织器官活性增强,代谢酶活性增大,因此表现为耗氧率升高、产生的代谢产物氨氮增多的现象。这也符合鱼类能量代谢随温度变化的一般规律。与鮸[2]、条石鲷[3]、黄鲈(Percaf luviatilis)[6]、大口黑鲈(Micropterus salmoides)[13]等研究结果相类似。
水体pH对鱼类的耗氧率的影响,目前存在两种不同观点。第一种观点认为,耗氧率随水体pH升高而升高,当pH超过适宜范围,耗氧率则随之下降。在红鲍(Haliotis rubra)[14]、杂交鲟(Huso huso♀×Acipenser baerii♂)[15]、胖头鱥(Pimephales promelas)[16]的研究结果支持第一种观点。第二种观点认为,水体pH在一定范围内变化,对耗氧率无显著性影响。如,对日本黄姑鱼(Nibea japonica)[8]、鮸[2]的研究结果支持第二种观点。这反映了鱼类随着生活环境、生态习性及发育阶段不同对pH的调节能力存在着差异。本实验发现,pH对低盐环境下的斜带石斑鱼幼鱼的耗氧率有显著影响,随pH的升高而上升,pH超过7.5则开始下降,说明适宜pH范围内,维持生命代谢的组织器官的代谢酶活性增强,基础代谢旺盛,表现为耗氧率的升高,而pH超过7.5可能会引起水中一些化学物质含量的变化,阻碍鱼类的呼吸,表现为耗氧率下降,但下降的幅度较小,是否会引起代谢紊乱还有待进一步研究证实。虽然鱼类具备一定的酸碱平衡调节能力,但是从能量利用的角度来看,对于鱼类长期处于酸碱平衡的调节耗能状态,势必导致其它生理功能的降低。上述研究结果及本实验结果都是利用盐酸驱动的水体酸化进行的,这与CO2驱动的海水酸化的结果会存在差异,这是因为CO2驱动的海水酸化不仅增加氢离子的含量,而且增加了碳酸氢根离子的浓度,降低了碳酸根离子的浓度,改变了海水的化学性质[17]。另有研究将真鲷(Pagrus major)的受精卵及仔鱼分别在由盐酸和CO2驱动相同pH值的海水中进行实验,结果发现与盐酸组死亡率为1%~4%,而CO2组表现为更高的死亡率,为60%~100%,说明不是海水pH值降低而是CO2产生了碳效应导致了真鲷仔鱼的大量死亡[18]。关于CO2驱动和盐度驱动的水体pH下降对斜带石斑鱼幼鱼能量代谢的影响差异,需进一步探究。
以往的研究表明,环境因子对鱼类的生长发育有重要的影响。但环境因子之间的互作效应更应受到关注。在因子互作效应存在的情况下,往往比因子主效应更重要[5]。在尼罗罗非鱼(Oreochromis niloticus)[10]、大菱鲆(Scophthalmus maximus)[19]、犬齿牙鲆(Paralichthys dentatus)[20]、花狼鱼(Anarhichas minor)[21]等研究中证实环境因子对鱼类生长有明显的互作效应。本实验中,斜带石斑鱼幼鱼耗氧率、排氨率回归模型系数显著性检验结果显示(表3、表5),温度和pH的互作效应对幼鱼耗氧率显著影响(P<0.05),这说明温度与水体pH对幼鱼的耗氧率是紧密关联的。可能原因是温度与水体pH对酶活力的影响存在关联。pH影响酶活力主要有两个途径,一是改变酶的构象;二是改变酶与底物的结合,而温度影响酶活力主要是通过改变酶与底物的结合,温度与pH以相同的途径影响酶活力。另外,温度会改变水中的二氧化碳含量,从而影响水体的pH,因此温度与pH存在着明显的互作效应。而温度和pH的互作效应对幼鱼排氨率却无显著影响(P>0.05),可以推测温度和pH对氨氮排泄的影响是独立进行的,其确切的机理还待深入研究。
响应曲面法最大的优点在于把因素和实验结果的关系函数化,可以研究因子与响应值之间、因子与因子之间的相互关系,并进行优化,找到最佳因子组合[22]。然而,国内外学者关于环境因子对鱼类能量代谢影响的研究,大部分只针对某个环境因子的几个孤立水平点进行分析,具有很大局限性。而传统正交试验方法虽能寻找最佳因子水平组合,但不能建立因子与响应值间明确的函数关系,从而无法找到因子最佳组合和最优响应值。本实验中,采用响应曲面法建立可靠的回归模型,可对响应进行连续的预测。方差分析结果(表2、表4)显示,回归模型均极显著(P<0.01),回归方程决定系数高,模型失拟项检验结果不显著(P>0.05),说明建立的模型有意义,可用于分析与预测。并获得模型优化后得出最优的因子组合为温度31.2℃、pH 7.6,在此组合下,幼鱼耗氧率、排氨率的最大值为188.44 mgO2·(kg·hr)-1、7.01 mgTAN·(kg·hr)-1。一般而言,鱼类耗氧率、排氨率表现较高的现象,反映了鱼类的新陈代谢旺盛,生存环境适宜,有利于鱼类生长。说明低盐条件下的斜带石斑鱼幼鱼在温度31.2℃、pH 7.6左右时,生长性能较好。
应用响应面法分析水生动物能量代谢的联合效应,该方法具有实验次数少、灵活、方便、全面考察各因素及因素间的交互作用等优点,在实际应用中大大节约了实验时间及费用,可提前达到预期的实验目的,为我们提供了一种新的数学分析方法。在斜带石斑鱼低盐养殖生理生态及养殖的水质管理过程中,还涉及其它因子的影响,如氨氮、亚硝酸盐、养殖密度、光照强度等。因此,还有待进一步深入研究这些因子的影响及因子间是否存在互作效应,以便更好地指导生产实践。
[1] 强 俊,王 辉,李瑞伟,等.酸碱胁迫对不同体质量尼罗罗非鱼幼鱼能量代谢的影响[J].应用生态学报,2011,22(9):2438-2446.QIANG J,WANG H,LI R W,et al.Effects of acid and alkaline stress on energy metabolism of Oreochromis niloticus juveniles with different body mass[J].Chinese Journal of Applied Ecology,2011,22(9):2438-2446.
[2] 闫茂仓,单乐州,邵鑫斌,等.温度及体重对鮸鱼幼鱼耗氧率和排氨率的影响[J].热带海洋学报,2007,26(1):44-49.YAN M C,SHAN L Z,SHAO X B,et al.Influences of temperature and weight on respiration and excretion of Miichthymiiuy juvenile[J].Journal of Tropical Ocean Nography,2007,26(1):44-49.
[3] 闫茂仓,单乐州,谢起浪,等.温度,盐度及体重对条石鲷幼鱼耗氧率和排氨率的影响[J].海洋科学进展,2009,26(4):486-496.YAN M C,SHAN L Z,XIE Q L,et al.Influence of temperature,salinity and body weight on oxygen consumption and ammonia excretion of Oplegnathus fasciatus juvenile[J].Advances in Marine Science,2009,26(4):486-496.
[4] 王 刚,李加儿,区又君,等.环境因子对卵形鲳鲹幼鱼耗氧率和排氨率的影响[J].动物学杂志,2012,46(6):80-87. WANG G,LI J E,OU Y J,et al.Influence of environmental factors on oxygen consumption and ammonia excretion of juvenile Trachinotus ovatus[J].Chinese Journal of Zoology,2012,46(6):80-87.
[5] MONTGOMERY D C.Design and analysis of experiments[M].New York:John Wiley and Sons,2008.
[6] ZAKE S′Z,DEMSKA-ZAKE S′K,KATA K.Rates of oxygen consumption and ammonia excretion of juvenile Eurasian perch Perca fluviatilis L.[J].Aquaculture International,2003,11(3):277-288.
[7] 曾令清,张耀光,付世健,等.双向急性变温对南方鲇幼鱼静止耗氧率和临界游泳速度的影响[J].水生生物学报,2011,35(2):276-282.ZENG LQ,ZHANG Y G,FU S J,et al.Effects of acute temperature change on resting oxygen consumption rate and critical swimming speed in juvenile southern catfish(Silurus meridionalis CHEN)[J].Acta Hydrobiologica Sinica,2011,35(2):276-282.
[8] 柴学军,胡则辉,徐君卓,等.盐度和pH对日本黄姑鱼幼鱼耗氧率和排氨率的影响[J].浙江海洋学院学报(自然科学版),2009,28(2):146-150.CHAIX J,HU Z H,XU J Z,et al.Effect of salinity and pH on oxygen consumption rate and ammonia excretion rate in juvenile Nibea japonica[J].Journal of Zhejiang Ocean University(Natural Science),2009,28(2):146-150.
[9] 唐道军,徐善良,马 斌.温度对黑鱾幼鱼耗氧率和排氨率的影响[J].动物学杂志,2013,48(2):256-260.TANG D J,XU S L,MA B.Influence of temperature on oxygen consumption and ammonia excretion of juvenile Girella melanichthys[J].Chinese Journal of Zoology,2013,48(2):256-260.
[10] 王 辉,强 俊,王海贞,等.温度与盐度对吉富品系尼罗罗非鱼幼鱼能量代谢的联合效应[J].中国水产科学,2012,19(1):51-61.WANG H,QIANG J,WANG,H Z,et al.Combined effect of temperature and salinity on energy metabolismof GIFT Nile tilapia(Oreochromis niloticus)juveniles[J].Journal of Fishery Sciences of China,2012,19(1):51-61.
[11] 闫茂仓,单乐州,邵鑫斌,等.盐度和pH值对鮸鱼幼鱼耗氧率和氨氮排泄率的影响[J].台湾海峡,2007,26(1):85-91.YAN M C,SHAN L Z,SHAO X B,et al.Influence of salinity and pH on the rates of oxygen consumption and ammonia excretion of juvenile Miichthy mijuy[J].Journal of Oceanography in Taiwan Strait,2007,26(1):85-91.
[12] LIKONGWE JS,STECKO T D,STAUFFER JR,et al.Combined effects of water temperature and salinity on growth and feed utilization of juvenile Nile tilapia Oreochromis niloticus(Linneaus)[J].Aquaculture,1996,146(1):37-46.
[13] 徐如卫,江锦坡,肖建忠.大口黑鲈仔、稚鱼窒息点与耗氧率的初步测定[J].浙江水产学院学报,1994,13(2):110-115.XU R W,JIANG J B,XIAO J Z.A preliminary measurement on suffocation point and oxygen consumption rate of Micropterus salmoides[J].Journal of Zhejiang College of Fisheries,1994,13(2):110-115.
[14] HARRIS JO,MAGUIRE G B,EDWARDSS J,et al.Effect of pH on growth rate,oxygen consumption rate,and histopathology of gill and kidney tissue for juvenile greenlip abalone,Haliotis laevigata donovan and blacklip abalone,Haliotis rubra leach[J].Journal of Shellfish Research,1999,18(2):611-619.
[15] 吴常文,朱爱意,赵向炯.海水养殖杂交鲟耗氧量、耗氧率和窒息点的研究[J].浙江海洋学院学报(自然科学版),2005,24(2):100-104.WU CW,ZHU A Y,ZHAO X J.Study on oxygen uptake,oxygen uptake rate and asphyxiation point of mari-culture hybrid sturgeon[J].Journal of Zhejiang Ocean University(Natural Science),2005,24(2):100-104.
[16] IGRAM R,WARESII W D.Oxygen consumption in the fathead minnow(Pimephales promelas rafinesque)—II effects of pH,osmotic pressure,and light level[J].Comparative Biochemistry and Physiology Part A:Physiology,1979,62(4):895-897.
[17] 刘洪军,张振东,官曙光,等.海洋酸化效应对海水鱼类的综合影响评述[J].生态学报,2012,32(10):3233-3239.LIU H J,ZHANG ZD,GUAN SG,et al.A review of comprehensive effect of ocean acidification on marine fishes[J].Acta Ecologica Sinica,2012,32(10):3233-3239.
[18] KIKKAWA T,KITA J,ISHIMATSU A.Comparison of the lethal effect of CO2and acidification on red sea bream(Pagrus major)during the early developmental stages[J].Marine Pollution Bulletin,2004,48(1):108-110.
[19] IMSLAND A K,FOSS A,GUNNARSSON S,et al.The interaction of temperature and salinity on growth and food conversion in juvenile turbot(Scophthalmus maximus)[J].Aquaculture,2001,198(3):353-367.
[20] MALLOY K D,TARGETT T E.Feeding,growth and survival of juvenile summer flounder Paralichthys dentatus:Experimental analysis of the effects of temperature and salinity[J].Marine Ecology Progress Series,1991,72(3):213-223.
[21] MAGNUSSEN A B,IMSLAND A K,FOSS A.Interactive effects of different temperatures and salinities on growth,feed conversion efficiency,and blood physiology in juvenile spotted wolffish,Anarhichas minor Olafsen[J].Journal of World Aquacult Society,2008,39(6):804-811.
[22] 国 蓉,李剑君,国 亮,等.采用响应曲面法优化甘草饮片中甘草酸的超声提取工艺[J].西北农林科技大学学报(自然科学版),2006,34(9):187-192.GUO R,LI J J,GUO L,et al.Optimization of the ultrasonic extraction technique of glycyrrhizic acid by using response surface methodology[J].Joural of Northwest Sci-ech University of Agriculture and Forestry(Natural Science),2006,34(9):187-192.
Combined effects of temperature and pH on energy metabolism of Epinephelus coioides juveniles cultured in low salinity using response surface methodology
HUANG Jian-sheng,CHEN Gang,ZHANG Jian-dong,TANG Bao-gui,WANG Zhong-liang,ZHOU Hui
(Fisheries College,Guangdong Ocean University,Zhanjiang 524088,China)
Orange-spotted grouper,which inhabit subtropical and tropical areas,have become a very popular cultured species of marine teleost currently in China.Metabolic rate is the most fundamental biological rate as it represents the rate of energy uptake,transformation and allocation.Oxygen consumption is a widely studied indicator of metabolic rate,and measurements of oxygen consumption rate are often used to examine energy utilization and stress in aquatic animals.We evaluated the combined effects of temperature and pH on the energy metabolism of Epinephelus coioides juveniles cultured in low salinity.Two-factor central composite experimental design and response surface methodology were used to test the effects of temperature(21-33℃)and pH(6.5-8.5)on the oxygen consumption rate(MO2)and ammonia excretion rate(MTAN)under laboratory conditions.Results showed that MO2and MTANincreased with the increasing temperature,and increased at the beginning then decreased with the increasing pH.The linear effects of temperature on MO2were highly statistically significant(P<0.01),the quadratic effects of temperature were significant(P<0.05);the linear effects of pH on MO2were significant(P<0.05),the quadratic effects of pH were highly statistically significant(P<0.01).Interaction effects of temperature and pH on MO2were significant(P<0.05).The linear effects of temperature on MTANwere highly statistically significant(P<0.01),but the quadratic effects of temperature were not significant(P>0.05);the linear and quadratic effects of pH on MTANwere significant(P<0.05);interaction effects of temperature and pH on MTANwere significant(P<0.05).The optimal temperature-pH combination was obtained through statistical optimization approach,and it was 31.2℃/7.6,at which the maximal MO2,MTANreached 188.44 mgO2·(kg·hr)-1,7.01 mgTAN·(kg·hr)-1respectively,with the desirability of 0.902.The data obtained suggested that producing profit can be improved by rearing at an optimal combination of temperature and pH of juvenile E.coioides under low-salinity culture.
Epinephelus coioides;oxygen consumption rate;ammonia excretion rate;low salinity water;response surface methodology
S 917
:A
1004-2490(2017)01-0041-10
2016-02-01
广东省教育厅育苗工程(自然科学)项目(No.2013LYM-0038);广东省海洋渔业科技推广专项项目[No.A2010-08D04,A2010004-016(c)];广东省海洋经济创新发展区域示范专项“石斑鱼等名贵海水鱼工厂化循环水高效养殖产业化”(No.GD2012-A02-003)
黄建盛(1981-),男,广东湛江人,汉族,博士,研究方向:水产经济动物养殖生理生态学。E-mail:fishaqu@126.com
陈 刚,教授。Tel:0759-2382462,E-mail:cheng@gdou.edu.cn
