氯化钙种球浸泡和叶面喷施提高香水百合花期和品质的研究
2017-03-02潘远智杨亚男文亚迪姜贝贝刘光立刘庆林
孙 位,潘远智,2*,杨亚男,文亚迪,姜贝贝,刘光立,刘庆林
(1 四川农业大学风景园林学院,四川成都 611130;2 四川农业大学园林研究所,四川成都 611130)
氯化钙种球浸泡和叶面喷施提高香水百合花期和品质的研究
孙 位1,潘远智1,2*,杨亚男1,文亚迪1,姜贝贝1,刘光立1,刘庆林1
(1 四川农业大学风景园林学院,四川成都 611130;2 四川农业大学园林研究所,四川成都 611130)
【目的】研究钙肥施用方式和浓度对香水百合生长初期和开花期内源激素和碳氮营养的动态变化,以期探讨钙对香水百合开花花期和开花品质的影响。【方法】以香水百合 (Lilium casa blanca) 为材料,采用盆栽试验,配置 0%、0.4%、0.8%、1.2%、1.6% 5 个浓度的 CaCl2溶液,采用种球浸泡 (在定植前,连续浸泡 10 h) 和叶面喷施 (在生长初期,每隔 3 d 喷施一次,连续喷施 3 次) 两种方式处理。生长初期、现蕾期、初花期、盛花期和末花期分别取样,测定香水百合在开花进程中钙含量以及碳氮营养和内源激素的的动态变化。开花期测定香水百合开花形态指标 (株高、茎粗、蕾长、花径、开花率和开花整齐度) 和花期调控指标 (开花持续天数、到花日数)。【结果】1) 在处理浓度范围内,CaCl2溶液浸泡处理水平与株高、蕾长、花径呈显著正相关,与茎粗呈极显著负相关,而叶面喷施处理的钙水平与株高、茎粗、蕾长和花径均呈极显著正相关。浸泡浓度在 1.2%和喷施浓度在 1.6% 时,开花率较高,而浸泡浓度为 0.8% 和喷施浓度为 1.6% 时,开花整齐度高。浸泡与喷施处理浓度均与到花日数和现蕾天数呈极显著负相关,与末花天数和开花持续天数呈极显著正相关。2) 在开花时期,低浓度种球浸泡间 (0.4% 与 0.8% 处理) 百合叶片的钙含量差异不显著,而高浓度种球浸泡 (1.6%) 和高浓度叶面喷施 (1.6%) 钙含量开始下降。3) 两种处理方式下,CaCl2溶液处理浓度与开花期吲哚乙酸 (IAA)、赤霉素(GA3)、玉米素 (ZR)、玉米素/脱落酸 (ZR/ABA) 和 (吲哚乙酸+赤霉素) /脱落酸 ( (IAA+GA3) /ABA) 呈显著正相关,与 ABA、IAA/GA3和 IAA/ZR 呈显著负相关,采用叶面喷施效果更是达到极显著水平。施钙提高了开花前期百合叶片 IAA 含量 (15.77%~42.93%)、GA3含量 (35.57%~65.67%),降低了 ABA 含量 (66.14%~26.27%),使花期提前。施钙处理提高了开花后期 ZR 含量 (46.66%~60.42%),香水百合开花持续天数延长了 3~11 d。4) CaCl2浸泡处理的钙水平与百合叶片中可溶性糖呈显著正相关,与可溶性蛋白和总糖/全氮比值相关不显著。CaCl2喷施处理的钙水平与可溶性糖、可溶性蛋白质和总糖/全氮比均呈极显著正相关。种球浸泡和叶面喷湿均可促进开花前中期可溶性糖和淀粉含量的积累,叶面喷施百合盛花期叶片中可溶性蛋白质含量较浸泡处理平均高 22.5%,百合花衰老推迟 3~5 d。【结论】种球浸泡和叶面喷施 CaCl2溶液均可提高香水百合开花品质,提前开花期,延长开花持续天数。种球浸泡处理对促进香水百合开花和提高开花品质的效果较好,高浓度种球浸泡 (1.6%) 可显著提高香水百合的株高、蕾长和花径,低浓度种球浸泡 (0.4%) 可促使百合开花期提前。叶面喷施CaCl2溶液在提高香水百合开花率,延长开花持续天数上效果明显,中浓度种球浸泡 (1.2%) 和高浓度叶面喷施(1.6%) 更适宜对香水百合开花和花期调节。
钙;香水百合;花期;开花品质;内源激素;碳氮营养
钙营养对植物开花有重要作用,香水百合(Lilium casa blanca) 开花期是钙的需求高峰期[1]。唐宽强等[2]研究发现,喷钙可以提前番茄幼苗开花,Rudd 等[3]发现施用钙能缩短花芽开放时间,提早开花。张圣旺等[4]研究发现,适量施钙可以延长牡丹花期,过量则会延迟个体开花,降低开花率。内源激素的平衡和营养物质含量变化与开花密切相关。植物开花受内源激素之间的平衡影响,而这种平衡的变化控制着营养物质代谢,促使与成花有关的营养物质向生殖器官传递进而完成花器官的建造[5]。钙对植物开花调节的机理之一是通过多种激素的平衡和营养代谢的相互作用来实现的。Evensen 等[6]研究认为,Ca2+可以影响植物内源激素的运输,进而改变植物内源激素的含量,调节植物的生长开花过程。张少帅等[7]认为,钙处理可提高开花期叶片中可溶性糖和可溶性蛋白质含量,影响菊花开花品质,同时,单花寿命随处理浓度的增加而延长,提高了菊花的株高和开花整齐度。
由于钙吸收和转运的特殊性,土壤中的钙很难被植株利用,从而使植株容易出现缺钙现象,这在苹果、梨和桃等果树上都有发生[8–9]。植物根、茎和叶对钙的吸收速率和运输方式不同[10],吸收与蒸腾作用密切相关[11],因此,不同的施钙方式对香水百合开花的影响有一定差异。本试验采用种球浸泡和叶片喷洒两种方式对香水百合施钙,研究了钙对香水百合开花期内源激素和碳氮代谢的调节作用以及施钙对花期和开花品质的影响,以期为钙营养对香水百合开花的调节提供理论依据。
1 材料与方法
1.1 试验材料
本试验于 2014 年 3 月至 8 月在四川农业大学农场 4 号试验基地进行。供试栽培基质由腐叶土、园土、细沙按照 3∶1∶1 的比例配成,其中园土的有机质含量为 121.5 g/kg,EC 为 2.82 mS/cm,pH 为 7.15,速效磷、钾含量为 132.6、459.8 mg/kg,有效钙和镁含量为 403.2 和 197.3 mg/kg。将园土碾碎、自然风干、剔除杂物,再与腐叶土按比例混匀后过 5 mm 钢筛。供试香水百合 (Lilium casa blanca) 选择荷兰进口品种‘木门’,周径为 14~16 cm。并采用口径 35 cm、高 20 cm 的塑料盆为栽培容器,每盆填供试土壤 10 kg,每盆 3 个种球。
1.2 试验设计
试验配置 5 个水平浓度的 CaCl2溶液:0%、0.4%、0.8%、1.2%、1.6%。采用两种处理方式,一是将种球CaCl2,融液中浸泡 10 h,晾干后定植于塑料盆中 (处理标记为 S0、S0.4、S0.8、S1.2、S1.6);另一方式是叶面喷施,在生长初期 (30~35 d)每隔 3 d 喷施一次,连续喷施 3 次 (处理标记为 F0、F0.4、F0.8、F1.2、F1.6)。每个处理重复 15 次,随机排列。
1.3 测定指标与方法
1.3.1 开花指标 参考彭桂群等[12]、赵家昱等[13]对花期的划分:80% 植株现蕾为现蕾期;5% 的花蕾已经形成完整的花,80% 的花蕾已经露瓣的时期为初花期;80% 的花蕾已经形成完整花的时期为盛花期;80% 的花已经开始凋谢、枯萎的时期为末花期。
开花持续天数[12]:从初花期开始到衰败期开始的开花总天数。
到花日数[13]:从种植到有 30%植株开花的天数。开花率[14]:开花植株数占出苗植株总数的百分比。开花整齐度[15]:从第一株开花至最后一株开花日期的累计值/实际开花数 (以第一株开花日期为 1,余下以此类推,例如第一天开花 3 株,即 1 × 3;第二天开花 5 株,即 2 × 5。累计值越低,则反映开花时间越集中)。
开花形态指标:蕾长指花蕾与花梗连接处与花蕾顶点之间的距离;花径指花朵开放第一天花的直径;茎粗指茎干基部的直径 (用游标卡尺测量)。株高指地表至花梗基部垂直于地面的植株长度 (用卷尺测量)。
1.3.2 碳氮营养物质指标 于生长初期、现蕾期、初花期、盛花期和末花期分别取样,从上往下数取供试植株第 7~8 片叶,去中脉剪碎后进行充分混合、称量,测定碳、氮营养物质指标,每次测定重复 3 次。
采用蒽酮比色法[16]测定叶片可溶性糖和淀粉含量;用 Bradford 的考马斯亮兰 G-250 染色法[16]测定叶片可溶性蛋白质含量;采用凯氏定氮法测定全氮[17]。1.3.3 内源激素指标 取各时期供试植株从上往下第7~8 片叶用于测定生长素 (IAA)、赤霉素 (GA3)、脱落酸 (ABA)、细胞分裂素 (ZR),及时进行液氮处理,置于–70℃ 冷温冰箱待用。采用高效液相色谱法测定,Agilent 1100 高效液相色谱仪;色谱柱为 C18柱 (250 mm × 4.6 mm,5 μm);检测波长为 254 nm;流动相为 50 mL 甲醇 + 50 mL 水 + 0.6 mL 冰乙酸;流量为 1 mL/min;柱温为 30℃。
内源激素的提取纯化[18]:准确称取叶片 2.0 g,放到预冷的研钵中,加入 4℃ 预冷的 80% 甲醇 15 mL,冰浴研磨成浆,4℃ 下浸提 12 h,于 4℃ 5000 r/min离心 15 min,取上清夜保存于 4℃ 冰箱中,残渣分 3次,间隔 12 h,每次加入 80% 甲醇浸提液 10 mL 左右浸提后同上离心,收集合并全部浸提液;将提取液倒入 10 cm 培养皿中,放到 4℃ 培养箱内自然吹干。过小 C18柱,甲醇定容至 10 mL,作为供试液。整个过程都在弱光下完成。
1.4 数据处理
数据采用 SPSS 22.0 软件对不同水平处理进行单因素方差分析 (One-way ANOVA),并用最小显著差异法 (LSD) 检验数据差异性 (α = 0.05),Duncan’s 进行多重比较和相关性分析。
2 结果与分析
2.1 CaCl2溶液施用方式与浓度对香水百合开花品质和花期的影响
由表 1 可知,两种施用方式香水百合株高、蕾长和花径均高于对照。种球浸泡以 S1.2处理最高,叶面喷施以 F1.6处理最高,分别比对照增长了 22.83%、23.19% 和 32.22%,21.17%、19.59% 和 33.17%,差异达到显著水平 (P < 0.05)。高浓度种球浸泡 (S1.2、S1.6) 显著抑制茎粗增加。高浓度 F1.6处理较对照茎粗增加了 18.27%,而中低浓度叶面喷施 (F0.4、F0.8、F1.2)与对照相比,茎粗变化不显著。中浓度喷施处理(S0.4、S1.2) 和高浓度叶面喷施 (F1.2、F1.6) 开花率较高,有利于开花。而低浓度种球浸泡 (S0.4、S0.8) 和高浓度叶面喷施 (F1.2、F1.6) 开花整齐度较好。由表 2 可知,施钙对香水百合花期有显著影响。S0.8和 F1.2处理的到花日数最短,开花持续天数最长,分别为 73 d 和21 d,73 d 和 19 d,与对照 CK 相比,差异均达到显著水平 (P < 0.05)。高浓度种球浸泡 (S1.2) 进入现蕾期和初花期较中低浓度种球浸泡延迟,但比对照提前 3 d 和 6 d。而喷施处理随着处理浓度的增加,现蕾期和初花期均出现逐渐提前的趋势。同时,高浓度种球浸泡 (S1.6) 和高浓度叶片喷施 (F1.6) 提前进入末花期,分别比对照提前 2 d 和 1 d。
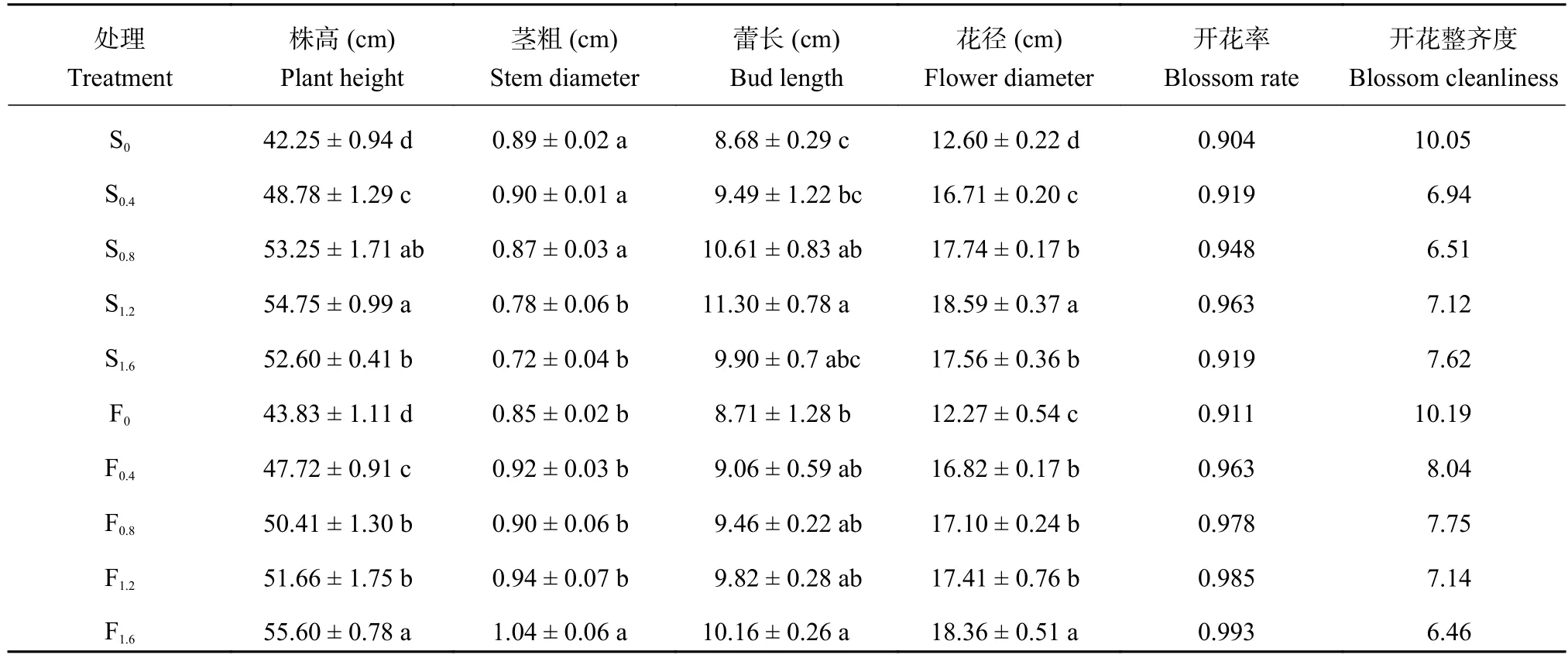
表1 不同施钙处理对香水百合开花品质的影响Table 1 Flowering quality of Lilium casa blanca under the different Ca treatments
2.2 施钙方式与水平对香水百合钙含量的影响
由表 3 可知,Ca 含量变化在香水百合开花期呈逐渐上升趋势,末花期达到最大值。施钙提高了开花各时期叶片中钙的含量,其中,S0.8和 F0.8处理最高,分别比对照提高了 40.48% 和 63.41%、53.09%和 63.29%、35.45% 和 34.26%、26.67% 和 74.81%、45.03% 和 67.38%,差异均达到显著水平 (P <0.05)。低浓度种球浸泡间 (S0.4、S0.8) 钙含量在生长初期和现蕾期差异不显著 (P > 0.05),而在初花期以后差异显著。开花各时期喷施处理间差异均达显著水平。高浓度种球浸泡 (S1.6) 和高浓度叶面喷施 (F1.6) 在开花各时期叶片中的钙含量开始下降。
2.3 施钙方式与水平对香水百合内源激素的影响
2.3.1 对香水百合叶片内源激素含量的影响 由图 1可知,IAA 和 GA3含量变化在香水百合开花期呈先下降后升高的趋势,在生长初期最高,末花期时有所回升。IAA 含量在盛花期达到最低,GA3含量在初花期达到最低。施钙处理显著提高了开花各时期IAA 和 GA3含量,其中,S1.2和 F1.6处理在开花各时期的含量最高,IAA 含量分别比对照高 16.81%、19.64%、29.10%、14.78%、42.93% 和 15.77%、26.06%、32.38%、22.81%、33.97%。GA3含量分别比对照高 35.57%、43.19%、57.86%、62.57%、65.67% 和 22.44%、33.58%、48.04%、61.16%、63.05%,差异均达到显著水平 (P < 0.05)。低浓度种球浸泡 (S0.4、S0.8) 间开花各时期 IAA 含量没有显著差异 (P > 0.05),而 GA3含量逐渐升高,差异显著。高浓度种球浸泡 (S1.6) 的开花各时期 IAA 和 GA3含量开始下降。而喷施处理随着浓度的增加 IAA 和 GA3含量呈逐渐上升趋势。
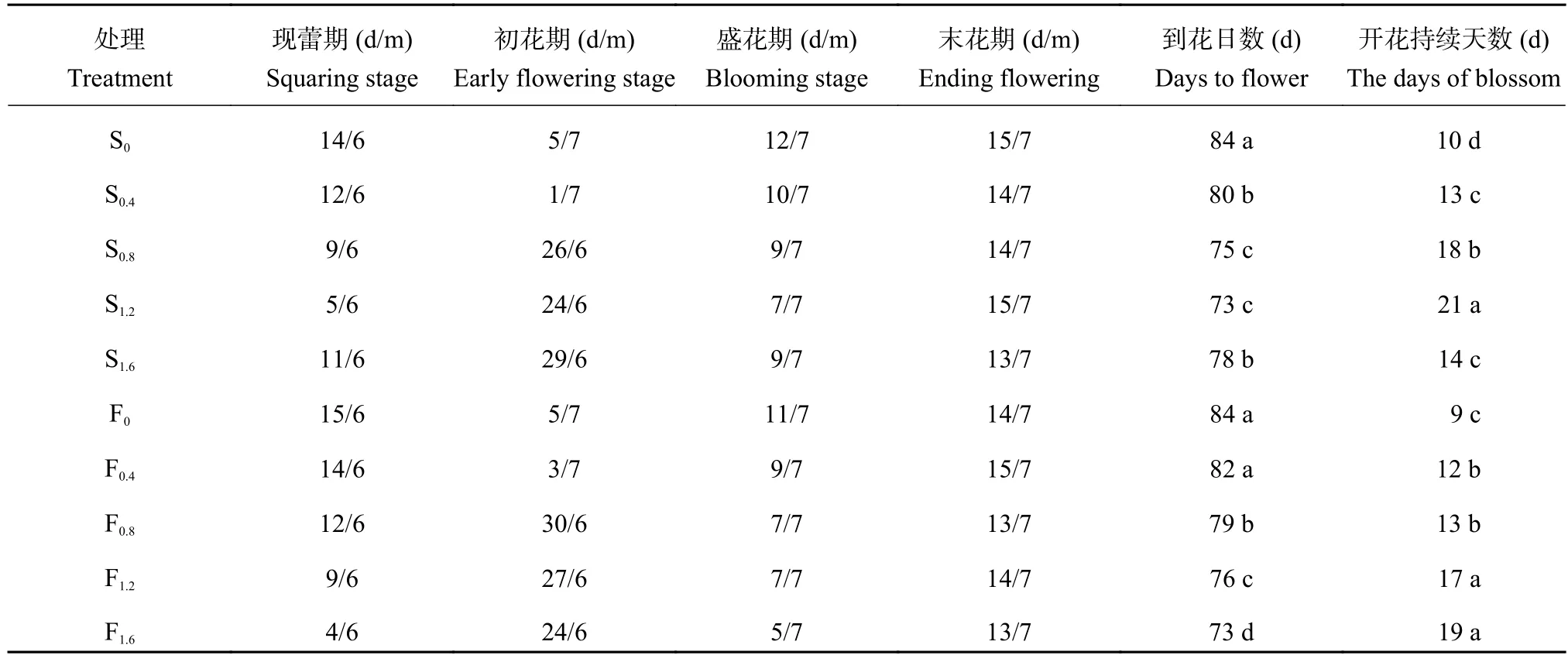
表2 不同施钙处理对香水百合花期的影响Table 2 Effects of flowering regulation of Lilium casa blanca under the different Ca treatments
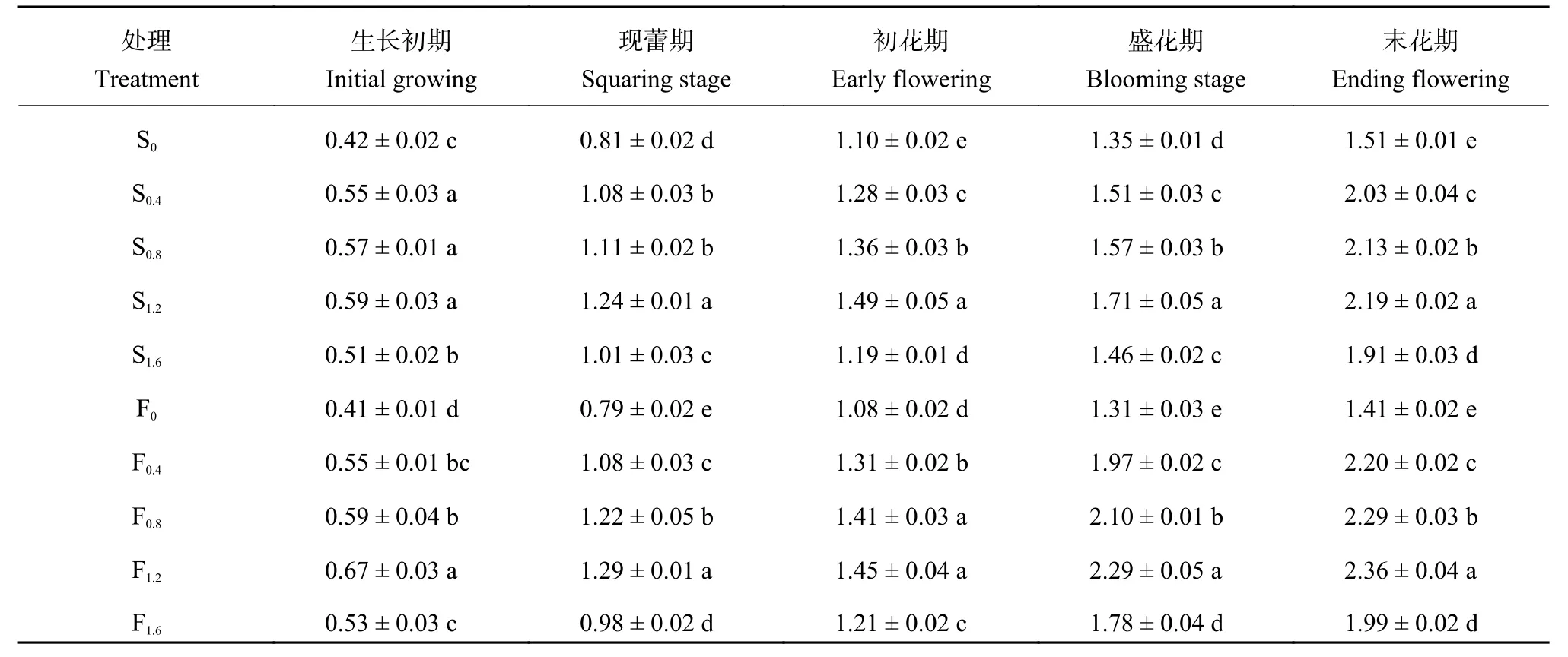
表3 不同生育期百合第 7~8 片叶内 Ca 含量的变化 (mg/g, FW)Table 3 Variation of Ca content in the 7th and 8th leaves of Lilium casa blanca
图 1 还显示,ABA 和 ZR 含量随着开花进程呈逐渐上升趋势,末花期达到最大。施钙降低了开花各时期 ABA 含量,提高了 ZR 含量。其中,S1.2和F1.6变化最大,与对照 CK 相比,ABA 含量在开花各时期分别下降了 66.14%、63.90%、44.49%、47.00%、 26.27% 和 53.83%、58.51%、50.23%、47.93%、41.91%,ZR 含量分别上升了 46.66%、46.69%、60.42%、60.42%、57.92% 和 50.76%、47.36%、56.76%、59.13%、57.36%,差异显著 (P < 0.05)。中低浓度种球浸泡(S0.4、S0.8、S1.2) 随着处理浓度的提高,ABA 含量逐渐下降,而 ZR 含量逐渐上升,ABA 含量在开花各时期处理间差异达显著水平。低浓度种球浸泡 (S0.4、S0.8)间,ZR 含量在开花前中期 (生长初期和现蕾期),差异不显著 (P > 0.05),但进入开花中后期 (初花期、盛花期和末花期) 处理间差异显著。高浓度种球浸泡(S4) ABA 含量开始上升,而 ZR 含量下降,除生长初期,其他各时期与 S3 处理有显著差异。喷施处理随处理浓度的升高,开花各时期 ABA 含量逐渐下降,而 ZR 含量逐渐上升。在生长初期,中低浓度处理 (F0.4、F0.8和 F1.2) 间 ABA 含量差异不显著,而开花中后期差异达显著水平,而 ZR 含量分别在低浓度 (F0.4、F0.8) 间和高浓度 (F1.2、F1.6) 间在生长初期,无显著差异,而开花其他时期各处理差异均达到显著水平。
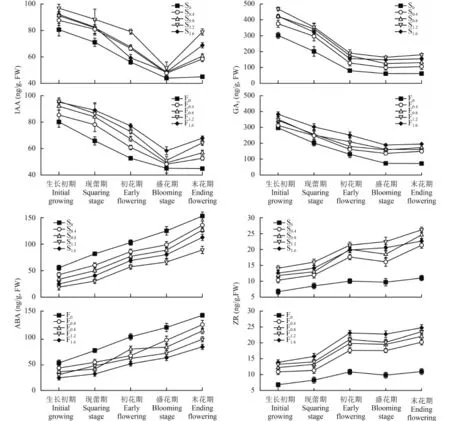
图1 百合第 7 和第 8 片叶内源激素含量随生育期的变化Fig.1 Variation of growth regulator contents in the 7th and 8th leaves of Lilium casa blanca with growing stages
2.3.2 对香水百合叶片内源激素比值的影响 由图 2可知,IAA/GA3在香水百合开花前期 (生长初期、现蕾期) 维持在较低水平,初花期迅速增加,盛花期略有下降,进入末花期开始回升。开花进程中,整体呈上升趋势。施钙降低了开花各时期 IAA/GA3比值。其中,浸泡处理中,S1.2比值最低,与对照相比,各时期分别下降了 22.47%、27.76%、45.70%、54.33% 和 38.84%。在生长初期,低浓度种球浸泡(S0.4、S0.8) 与对照差异不显著 (P > 0.05),而开花其他时期,处理间有显著差异 (P < 0.05)。而高浓度种球浸泡 (S1.2、S1.6) 在开花各时期下降较大,与对照差异显著,但处理间无显著差异。喷施处理随着处理浓度的增加,比值逐渐下降。在生长初期,各处理与对照差异不显著。初花期开始,高浓度叶面喷施(F1.2、F1.6) 与中低浓度叶面喷施 (F0.4、F0.8) 间有显著差异,也与对照差异显著,而中低浓度叶面喷施 (F0.4、F0.8) 间,没有显著差异。
IAA/ZR、ZR/ABA 在香水百合开花期呈下降趋势,施钙降低了 IAA/ZR 比值,而升高了 ZR/ABA比值 (图 2)。各处理与对照在开花各时期差异显著,其中,S1.2和 F1.6处理变化最大。在开花前期,IAA/ZR比值在低浓度种球浸泡处理间 (S0.4、S0.8) 差异不显著,高浓度间 (S1.2、S1.6) 也不显著 (P > 0.05),叶面喷施各处理差异也不显著。在开花期内,种球浸泡处理间和叶面喷施处理间差异均达到显著水平。
由图 2 可知, (IAA+GA3) /ABA 在开花前期较高,随着开花进程,逐渐降低,开花中后期 (盛花期和末花期) 维持在较低水平。施钙不同程度地升高了各时期 (IAA+GA3) /ABA 比值,以 S1.2和 F1.6处理变化最大,分别与 S0 和 F0 差异达显著水平 (P <0.05)。低浓度种球浸泡 (S0.4、S0.8) 在开花前,处理间差异显著,而在开花后 (初花期、盛花期和末花期)没有明显差异。高浓度种球浸泡 (S1.2、S1.6) 在开花后期 (盛花期、末花期) 差异不显著。叶面喷施处理中,该比值随着处理浓度的提高而逐渐上升,除末花期外,处理间在其他开花时期达到显著水平,也分别与对照差异显著。
2.4 施钙方式与水平对香水百合碳氮营养的影响
2.4.1 可溶性糖和淀粉含量 由图 3 可知,可溶性糖和淀粉含量在开花各时期呈现先上升后下降的趋势,在初花期达到最大值。施钙处理显著提高了开花各时期可溶性糖和淀粉含量,其中,S1.2和 F1.6处理含量增加最大,与各自对照有显著差异 (P <0.05)。叶面喷施随处理浓度的增加可溶性糖和淀粉含量逐渐增加,各处理间在开花各时期差异显著。
2.4.2 可溶性蛋白质和全氮含量 由图 4 可知,可溶性蛋白质和全氮含量在香水百合开花期呈现先升高后下降的趋势,其中,可溶性蛋白质对照处理在初花期达到最大值,施钙处理,最大值推迟到盛花期,而全氮含量最大值均出现在盛花期。施钙处理提高了各时期可溶性蛋白质和全氮含量,以 S1.2和F1.6处理最高,与对照差异显著 (P < 0.05)。在生长初期,种球浸泡低浓度处理间 (S0.4、S0.8) 可溶性蛋白质含量差异不显著 (P > 0.05),S0.4与 S0差异不显著,其他处理在开花各时期与对照均达到显著水平。低浓度喷施处理 (F0.4),可溶性蛋白质含量在开花前期(生长初期、现蕾期) 与对照没有显著差异,但开花中后期,差异达显著水平。其他浓度处理间在开花各时期均有显著差异;但高浓度 (F1.2、F1.6) 处理间的全氮含量在开花中后期 (盛花期和末花期) 差异不显著,其他各时期均有显著差异。
2.4.3 碳氮比 由图 5 可知,可溶性糖/可溶性蛋白质比值随香水百合开花进程呈先升高后降低,再升高的趋势,在生长初期比值较低,现蕾期升高,初花期和盛花期开始下降,在末花期有所回升。而总糖/全氮比值在生长初期最高,以后逐渐降低。施钙升高了开花各时期可溶性糖/可溶性蛋白质和总糖/全氮比值,其中,可溶性糖/可溶性蛋白质比值中低浓度种球浸泡 (S0.4、S0.8) 在开花前中期 (生长初期、现蕾期、初花期和盛花期) 与对照差异不显著 (P >0.05),处理间也没有显著差异。在现蕾期,各处理与对照均没有显著差异,进入初花期后,高浓度种球浸泡 (S1.2、S1.6) 与对照相比,差异显著 (P < 0.05)。而喷施处理,在开花各时期均与对照差异显著,但中高浓度叶面喷施 (F0.8、F1.2) 处理间没有显著差异。总糖/全氮比值中,在开花各时期,处理组与对照差异性均达显著水平。
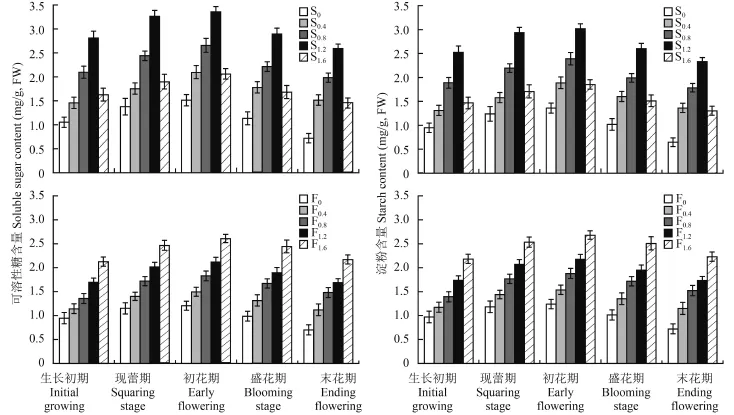
图3 不同生育期百合第 7 第 8 片叶可溶性糖含量和淀粉含量Fig.3 Soluble sugar and starch content in the 7th and 8th leaves of Lilium casa blanca in different growing stage
3 讨论
3.1 施钙方式与水平对香水百合开花品质和花期的影响
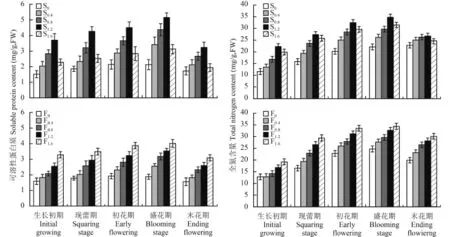
图4 不同生育期百合第 7 第 8 片叶可溶性蛋白质和全氮含量Fig.4 Soluble protein and total nitrogen content in the 7th and 8th leaves of Lilium casa blanca in different growing stage
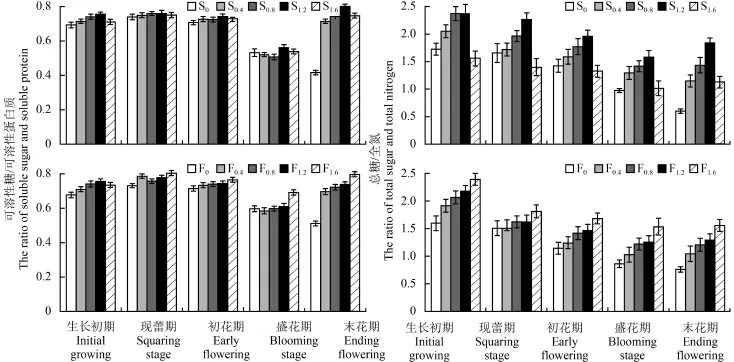
图5 不同生育期百合第 7 和第 8 片叶可溶性糖/可溶性蛋白质以及总糖/全氮比Fig.5 Ratio of soluble sugar and soluble protein,total sugar and total nitrogen in the 7th and 8th leaves of Lilium casa blanca in different growing stages
钙是植物开花构成的重要营养,适当浓度的外源 Ca2+能够提高开花品质,延缓植物开花衰老[10]。但过高浓度钙会导致植株生长缓慢,降低开花品质和开花率,这可能与过高的 Ca2+浓度抑制了植物对其他营养元素的吸收有关[19–20]。本研究显示,中浓度种球浸泡 (1.2%) 和高浓度叶面喷施 (1.6%) 处理有较高开花率,低浓度种球浸泡 (0.8%) 和高浓度叶面喷施 (1.6%) 开花整齐度较好。种球浸泡处理与茎粗呈显著负相关,高浓度种球浸泡香水百合开花品质开始下降。种球浸泡处理和叶面喷施处理均不同程度地提高了香水百合开花品质 (表 3),这和 Marschner等[21]研究结果相似。钙参与植物开花和衰老控制[3],施钙处理与到花日数呈极显著负相关 (浸泡处理 r =–0.666**;喷施处理 r = –0.954**),与现蕾天数呈显著负相关 (浸泡处理 r = –0.601*;喷施处理 r =–0.962**),表明两种施钙处理均利于香水百合提前开花。两种施钙处理浓度与开花持续天数呈显著正相关 (浸泡处理 r = 0.558*;喷施处理 r = 0.949**),浸泡处理与末花天数呈正相关 (r = 0.493),喷施处理达到显著水平 (r = 0.930**),因此,施钙延长了香水百合开花持续天数,叶面喷施在延长末花天数和开花持续天数,提前到花日数等作用效果上好于种球浸泡处理,叶面喷施处理在提高蕾长、花径和株高等开花品质上效果明显,不仅与不同施钙措施引起的钙在植物体内运输、积累和吸收存在差异有关[10],也与钙供给时期不同有很大关系。浸泡处理受到高浓度的影响作用较大,这和 Murillo-Amador等[22]、张圣旺[4]研究结果相同。这可能是由于喷施叶片的钙(喷施处理) 通过韧皮部运输到植株生长器官,而韧皮部的运输明显慢于种球根系 (浸泡处理) 运输,这就导致高浓度种球浸泡受到的拮抗作用明显,而喷施处理缓慢,同时,不同处理方式与不同的钙的吸收方式也是其原因之一。因此,中低浓度种球浸泡促进前期的营养生长,而喷施处理对后期生殖生长的促进效果更好。
3.2 施钙方式与水平对香水百合钙含量的影响
香水百合对钙的吸收主要通过球根和叶两种途径,一方面种球吸收的钙主要通过木质部向上运输到达叶片和花器官,其吸收很大程度上受到蒸腾强度的影响;另一方面,叶片吸收的钙需要经过韧皮部转运到花器官,而通过韧皮部进行运输的速度较慢[20]。本试验研究发现,在香水百合开花各时期,浸泡处理中叶片的钙含量低于喷施处理 (表 5),说明种球浸泡钙的利用效率更高。同时,施钙的浓度与叶片钙含量呈正相关,这与张天志等[23]、董彩霞等[10]的研究结果一致。但高浓度施钙处理,叶片中钙的含量开始降低。相关研究表明,种球浸泡施钙是通过增加外界离子供应强度而提高了植株整体对钙的吸收,由此引起的离子间的拮抗作用也相对明显,而叶片喷施则能通过改变钙的转运途经调节植株的钙含量,能显著降低由于钙含量的增加导致的对其他元素的拮抗作用。这也解释了试验中低浓度种球浸泡显著提高百合的开花品质,而喷施处理在延缓香水百合开花,延长开花持续天数的效果更好有一定相关性。
3.3 钙处理条件下内源激素对香水百合开花的调节
香水百合开花与内源激素变化密切相关,激素间的平衡状态对百合开花有重要影响作用[24–25,31]。IAA、GA3和 ZR 能促进植物细胞分裂,影响植物营养器官及生殖器官的成熟及衰老[26–28],而 ABA 是植株体内重要的生长抑制剂,能促进花和叶片衰老、脱落。本试验中,IAA、GA3、(IAA+GA3)/ABA 均与到花日数呈极显著负相关 (浸泡处理 r = –0.657**、–0.88** 和 –0.816**;喷施处理 r = –0.828**、–0.891** 和 –0.911**),而 ABA 与到花日数呈极显著正相关 (浸泡处理 r = 0.891**;喷施处理 r = 0.928**),这和王磊等[29]、覃喜军等[30]的研究结果相似。种球浸泡和叶面喷施钙的浓度均与百合叶片中IAA、GA3和 ZR 含量呈显著正相关,与 ABA 呈显著负相关,与 IAA/GA3和 IAA/ZR 呈显著负相关,与 ZR/ABA 和 (IAA + GA3) /ABA 呈显著正相关,喷施处理效果更是达到极显著水平。表明两种施钙方式均提高了开花前期 IAA、GA3和 ZR 含量,降低了ABA 含量,相对高含量的 IAA、GA3和低含量的ABA 有效缩短了香水百合到花日数,促进了香水百合开花。
在浸泡处理中,IAA 和 GA3均与香水百合的株高、蕾长和花径呈显著正相关 (株高 r = 0.777** 和0.946**;蕾长 r = 0.918** 和 0.791**;花径 r = 0.731** 和 0.911**),与茎粗呈负相关 (r = –0.106 和–0.68**)。在喷施处理中,与香水百合的株高、茎粗、蕾长和花径均成显著正相关 (株高 r = 0.922** 和0.965**;茎粗 r = 0.955** 和 0.79**;蕾长 r = 0.86**和 0.744**;花径 r = 0.755** 和 0.974**),因为在开花前期,较高含量的 IAA 和 GA3促进香水百合的营养生长,进而影响花芽的孕育。ABA 与开花率和开花持续天数呈极显著负相关 (浸泡处理 r = –0.775**和 –0.837**;喷施处理r=–0.935** 和 –0.931**),ZR、ZR/ABA、(IAA + GA3) /ABA 与开花持续天数呈极显著正相关 (浸泡处理 r = 0.893**;喷施处理 r = 0.940**),说明开花前期低含量 ABA 和高含量的ZR、IAA 有利于百合开花率,开花后期高浓度 ABA加速百合衰老。两种施钙方式均降低了开花后期ABA 含量,显著提高了 ZR 和 IAA 含量,有效延长了开花持续天数,缓解了香水百合的衰老进程,这和施钙与开花持续天数呈显著正相关的结果相吻合(浸泡处理 r = 0.585*;喷施处理 r = 0.988**)。在维持香水百合开花,延长开花持续天数上,喷施处理的效果要优于浸泡处理。
3.4 钙处理条件下碳氮营养对香水百合开花的调节
碳氮代谢是植物体最基本的代谢过程,其在开花期的动态变化直接影响着光合产物的形成、转化和矿质营养的吸收、蛋白质的合成,二者的平衡决定着植物体营养生长和生殖生长的关系[32]。可溶性糖是植物体内重要的有机物质,与植物体内有机物质转化有密切关系,是植物碳代谢的重要“源”和“库”;而可溶性蛋白质作为一种结构物质,是花器官形态建成的重要物质基础[33–34]。可溶性糖/可溶性蛋白质反映了植物碳氮代谢活动的基本状态,而总糖/全氮代表植物碳氮“库”的大小,是植物前期代谢积累的结果。本试验研究表明,在香水百合开花进程中,可溶性糖和淀粉均呈现先增加后降低的趋势,在初花期达到最大值,可溶性蛋白质也呈现先升高后降低的趋势,在初花期含量较低,在盛花期达到最大值,这与前人在梨、草莓和烟草上的研究结果相似[9,18]。其中,浸泡处理促进可溶性糖含量的增加,呈显著正相关,但与可溶性蛋白和总糖/全氮比值没有显著相关性。而 F 处理与可溶性糖、可溶性蛋白质和总糖/全氮比均呈极显著正相关。同时,可溶性糖和总糖/全氮均与到花日数呈极显著负相关 (浸泡处理 r = –0.937** 和 –0.782**;喷施处理r = –0.976** 和 –0.898**),而可溶性蛋白质与开花持续天数呈极显著正相关 (浸泡处理 r = 0.945**;喷施处理 r = 0.951**),这可能是因为,在开花初期,高水平的总糖导致其细胞液浓度高,大量的淀粉水解产物供给植株作为结构物质,参与花的形态结构建成,有利于开花。而在盛花期,高含量的氮为百合花器官提供同化物和能量,延长开花持续天数。因此,香水百合在开花诱导阶段需要维持较高含量的可溶性糖和淀粉,较低水平的可溶性蛋白质,即高水平的碳氮比有利于成花[11,35];但进入盛花期,需要较高水平的蛋白质含量[34],有利于缓解香水百合花衰老。
4 结论
施钙方式与施用水平对香水百合开花期内源激素和碳氮营养变化有显著影响,可不同程度地提高香水百合开花品质,调节花期。在香水百合现蕾期和初花期,IAA 和 GA3的迅速下降和低含量 ABA 会协同植物体内碳水化合物的积累和 C/N 率的提高,为成花提供物质条件,促进香水百合开花。在盛花期和末花期,ZR 含量的升高以及 IAA 和 GA3的回升协同可溶性糖、可溶性蛋白质的增加能够显著延长香水百合开花持续天数,延缓香水百合花衰老。
种球在种植前于氯化钙中浸泡 10 h,可有效促进香水百合开花和提高开花品质,氯化钙浓度为0.8%~1.2% 时可显著提高香水百合株高、蕾长和花径,浓度为 0.8%~1.2% 时百合开花期可提前 5~9 d。
在百合生育早期叶面喷施氯化钙可有效提高香水百合开花率,延长开花持续天数。叶面喷施中低浓度氯化钙 (0.4%~1.2%) 显著提高了香水百合开花中后期营养物质含量。
[1]王书丽, 马文奇. 钙对东方百合生长和开花的影响[J]. 河北农业大学学报, 2006, 29(3): 17–21. Wang S L, Ma W Q. Effects of calcium on the growth and quality of oriental lily[J]. Journal of Agricultural University of Hebei, 2006, 29(3): 17–21.
[2]唐宽强, 刘守伟, 吴凤芝, 等. 外源喷施CaCl2对低温逆境下番茄抗冷性及开花结果的影响[J]. 北方园艺, 2013, (11): 10–14. Tang K Q, Liu S W, Wu F Z, et al. Effects of exogenous CaCl2on the cold resistance and blossom and yield of tomato under cold stress[J]. Northern Horticulture, 2013, (11): 10–14.
[3]Rudd J J, Franklin-Tong V E. Calcium signaling in plants[J]. Cellular and Molecular Life Sciences, 1999, 55: 214–232.
[4]张圣旺. 钙素对牡丹花衰老调控效应的研究[D]. 泰安: 山东农业大学硕士学位论文, 2002. Zhang S W. Effects of calcium on senescence in petals of tree peony[D]. Tai’an: MS Thesis of Shandong Agricultural University, 2002.
[5]傅永福, 孟繁静. 植物的成花生理信号[J]. 中国农业大学学报, 1998, 3(3): 1–11. Fu Y F, Meng F J. Flowering physiological signals in plant[J]. Journal of China Agricultural University, 1998, 3(3): 1–11.
[6]Evensen K B. Effects of calcium on ethylene and ethane production and 1-aminocyclopropane-1-carboxylic acid content in potato discs[J]. Physiologia Plantarum, 1984, 60: 128–132.
[7]张少帅. 外源甜菜碱和钙离子对菊花生理和形态的影响[D]. 新乡:河南师范大学硕士学位论文, 2012. Zhang S S. Exogenous betaine and calcium on the physiological and morphological characteristics of the chrysanthemum[D]. Xinxiang: MS Thesis of Henan Normal University, 2012.
[8]陈丽璇, 陈丽虹, 庄荣福, 等. 田间喷钙对草莓果实和叶片营养元素含量的影响[J]. 园艺学报, 2003, 30(4): 449–451. Chen L X, Chen L H, Zhuang R F. Effects of calcium spray on nutrient element contents in fruit and leaf of strawberry[J]. Acta Horticulturae Sinica, 2003, 30(4): 449–451.
[9]孔海燕, 贾桂霞, 温跃戈. 钙在植物花发育过程中的作用[J]. 植物学通报, 2003, 20(2): 168–177. Kong H Y, Jia G X, Wen Y G. The role of calcium in flower development[J]. Chinese Bulletin of Botany, 2003, 20(2): 168–177.
[10]董彩霞, 周健民, 范晓辉, 等. 不同施钙措施对番茄果实钙含量和钙形态的影响[J]. 植物营养与肥料学报, 2004, 10(1): 91–95. Dong C X, Zhou J M, Fan X H, et al. Effects of different ways of Ca supplements on the Ca content and forms in mature fruits of tomato[J]. Plant Nutrition and Fertilizer Science, 2004, 10(1): 91–95.
[11]李美宁, 危常州, 朱齐超, 等. 不同施钙措施对加工番茄脐腐病发生率及产量品质的影响[J]. 石河子大学学报(自然科学版), 2013, 31(2): 133–136. Li M N, Wei C Z, Zhu Q C, et al. Effects of different Ca sources on blossom-end rot incidence, yield and quality of processing tomato[J]. Journal of Shihezi University (Natural Science), 2013, 31(2): 133–136.
[12]彭桂群, 王力华. 平阴玫瑰花芽分化期叶片内源激素的变化[J]. 植物研究, 2006, 26(2): 206–210. Peng G Q, Wang L H. Quantitative variation of endogenoushormones in Rosa rugosa leaf during flower bud differentiation[J]. Bulletin of Botanical Research, 2006, 26(2): 206–210.
[13]赵家昱, 潘远智, 李永红. 外源ABA对叶子花开花及内源ABA合成关键酶的影响[J]. 园艺学报, 2014, 41(10): 2085–2093. Zhao J Y, Pan Y Z, Li Y H. Effects of abscisic acid on flowering and some key enzymes of bougainvillea glabra[J]. Acta Horticulturae Sinica, 2014, 41(10): 2085–2093.
[14]袁媛. 栽植期与遮荫对野生大百合成花过程生理变化及开花期性状的影响[D]. 成都: 四川农业大学硕士学位论文, 2007. Yuan Y. Effects of different planting date and shading on the physiological change in flower formation and characteristics in florescence of Cardiocrinum Giganteum[D]. Chengdu: MS Thesis of Sichuan Agricultural University, 2007.
[15]沈革志, 杨红娟, 张永春. 百合不同品种的花芽分化观察及切花评价[J]. 上海农业学报, 1999, 15(2): 65–69. Shen G Z, Yang H J, Zhang Y C, et al. Observation of flower bud differentiation and evaluation of cut flowers of different lily(Lilium) cultivars[J] Acta Agriculturae Shanghai, 1999, 15(2): 65–69.
[16]熊庆娥. 植物生理学实验教程[M]. 成都: 四川科学技术出版社, 2003. Xiong Q E. Plant physiology[M]. Chengdu: Sichuan Science and Technology Press, 2003.
[17]鲍士旦. 土壤农化分析[M]. 北京: 中国农业出版社, 2000. Bao S D. Soil agro-chemistrical analysis[M]. Beijing: China Agriculture Press, 2000.
[18]曾庆钱, 陈厚彬, 鲁才浩, 等. HPLC测定荔枝不同器官中内源激素流程的优化[J]. 果树学报, 2006, 23(1): 145–148. Zheng Q Q, Chen H B, Lu C H, et al. An optimized HPLC procedure for analyzing endogenous hormones in different organs of litchi[J]. Journal of Fruit Science, 2006, 23(1): 145–148.
[19]介晓磊, 刘世亮, 李有田, 等. 不同浓度钙营养液对烟草矿质营养吸收与积累的影响[J]. 土壤通报, 2005, 36(4): 560–563. Jie X L, Liu S L, Li Y T, et al. Effect of Ca2+concentrations on absorption and accumulation of mineral nutrients in tobacco[J]. Chinese Journal of Soil Science, 2005, 36(4): 560–563.
[20]范双喜, 伊东正. 钙素对叶用莴苣营养吸收和生长发育的影响[J].园艺学报, 2002, 29(2): 149–152. Fan S X, Ito Tadashi. Effects of calcium on nutrient absorption and growth and development of Lactuca sativa var. longifolia Lam. in nutrient film technique culture[J]. Acta Horticulturae Sinica, 2002, 29(2): 149–152.
[21]Marschner H. Mineral nutrition of higher plants[M]. London: Academic Press, 1995: 285–299.
[22]Murillo-Amador B, Jones H G, Kaya C. Effects of foliar application of calcium nitrate on growth and physiological attributes of cowpea (Vigna unguiculata L. Walp. ) grown under salt stress[J]. Environmental and Experimental Botany, 2006, 58: 188–196.
[23]张天志, 郑伟尉, 邵晓岚等. 采前钙处理对猕猴桃果实和叶片营养元素含量的影响[J]. 浙江农业学报, 2014, 26(4): 966–970. Zhang T Z, Zheng W W, Shao X L, et al. Effects of preharvest calcium treatments on nutrients contents in fruits and leaves of kiwifruit[J]. Acata Agriculturae Zhejiangensis, 2014, 26(4): 966–970.
[24]赵莉, 潘远智, 朱峤. GA3、IBA和6-BA对香水百合开花特性及内源激素的影响[J]. 湖北农业科学, 2012, 51(7): 1385–1389. Zhao L, Pan Y Z, Zhu Q.Effects of 6-BA, GA3and IBA on flowering and endogenous horomone content of Lilium casa blanca[J]. Hubei Agricultural sciences. 2012. 51(7):1385-1389.
[25]李宁毅, 于洋, 付印东, 等. S3307浸球对盆栽百合生长和内源激素含量的影响[J]. 植物生理学通讯, 2007, 43(1): 104–106. Li N Y, Yu Y, Fu Y D, et al. Effects of bulb soaking with S3307 on growth and endogenous hormone contents of potting lily (Lilium brownii F. E. Brown Asiatic hybrids)[J]. Plant Physiology Communications, 2007, 43(1): 104–106.
[26]Guinn G, Brumett D L. Fruiting of cotton IV. Nitrogen, abscisic acid, indole-3-acetic acid[J]. Field Crops Research, 1989, 22(4): 257–266.
[27]李秉真, 孙庆林, 张建华, 等. 苹果梨花芽分化期内源激素含量的变化[J]. 植物生理学通讯, 2000, 36(1): 27–29. Li B Z, Sun Q L, Zhang J H, et al. The changes of endogenous hormones in apple-pear during flower bud formation[J]. Plant Physiology Communications, 2000, 36(1): 27–29.
[28]谢丽娟, 孙敏, 赵梁军, 等. 毛棉杜鹃芽形态分化期间封顶叶内源激素含量变化的研究[J]. 中国农业大学学报, 2010, 15(4): 33–38. Xie L J, Sun M, Zhao L J, et al. Quantitative variation of endogenous hormones in leaf under buds of Rhododendron moulmainense Hook f. during buds morphological differentiation[J]. Journal of China Agricultural University, 2010, 15(4): 33–38.
[29]王磊, 汤庚国, 刘彤. 石蒜花芽分化期内源激素和核酸含量的变化[J]. 南京林业大学学报(自然科学版), 2008, 32(4): 67–70. Wang L, Tang G G, Liu T. Variation of endogenous hormone and nucleic acid content during flower bud differentiation in Lycoris radiate[J]. Journal of Nanjing Forestry University (Natural Sciences Edition), 2008, 32(4): 67–70.
[30]覃喜军, 黄夕洋, 蒋水元, 等. 罗汉果花芽分化过程中内源激素的变化[J]. 植物生理学通讯, 2010, 46(9): 939–942. Qin X J, Huang X Y, Jiang S Y, et al. Changes in endogenous hormones during floral bud differentiation of Siraitia grosvenorii(Swingle)C. Jeffrey[J]. Plant Physiology Communications, 2010, 46(9): 939–942.
[31]吴月燕, 李波, 朱平, 等. 植物生长调节剂对西洋杜鹃花期及内源激素的影响[J]. 园艺学报, 2011, 38(8): 1565–1571. Wu Y Y, Li B, Zhu P, et al. Effects of plant growth regulator on flowering and endogenous hormones of Rhododendron hybridum[J]. Acta Horticulturae Sinica, 2011, 38(8): 1565–1571.
[32]张万萍, 史继孔. 银杏雄花芽分化期间内源激素、碳水化合物和矿质营养含量的变化[J]. 林业科学, 2004, 40(2): 51–54. Zhang W P, Shi J K. Changes of endogenous hormones, carbohydrate and mineral nutrition during the differentiation of male flower buds in ginkgo biloba[J]. Scientia Silvae Sinicae, 2004, 40(2): 51–54.
[33]梁芳, 郑成淑, 张翠华, 孙庆春. 菊花花芽分化过程中芽和叶片碳水化合物含量的变化[J]. 山东农业科学, 2008, (1): 40–42. Liang F, Zheng C S, Zhang C H, Sun Q C. Change of carbohydrate content in buds and leaves of chrysanthemum during floral differentiation[J]. Shandong Agricultural Sciences, 2008, (1): 40–42.
[34]常钟阳, 张金政, 孙国峰等. 德国鸢尾‘常春黄’花芽分化的形态观察及两种代谢产物的动态变化[J]. 植物研究, 2008, 28(6): 741–745. Chang Z Y, Zhang J Z, Sun G F, et al. Morphological studies and changes of two metabolites content during floral bud differentiation period in Iris germanica cv. Lovely Again[J]. Bulletin of Botanical Research, 2008, 28(6): 741–745.
[35]王小红, 周祖基. 水竹开花期间碳氮代谢特性[J]. 林业科学, 2008, 44(4): 35–40. Wang X H, Zhou Z J. Characteristics of carbon and nitrogen metabolism of Phyllostachys heteroclada at flowering stage[J]. Scientia Silvae Sinicae, 2008, 44(4): 35–40.
Study on the improvement of bulb soaking and foliar spraying of CaCl2on the flowering period and quality of Lilium casa blanca
SUN Wei1, PAN Yuan-zhi1,2*, YANG Ya-lan1, WEN Ya-di1, JIANG Bei-bei1, LIU Guang-li1, LIU Qing-lin1
( 1 College of Landscape Architechture, Sichuan Agricultural University, Chengdu 611130, China; 2 Institute of Landscape Architecture of Sichuan Agricultural University, Chengdu 611130, China )
calcium; Lilium casa blanca; flowering phase; the blossom quality; endogenous hormones; carbon and nitrogen nutrients
2016–08–31接受日期:2016–09–10
四川农业大学学科建设双支计划项目资助。
孙位(1989—),男,四川成都人,硕士,主要从事园林植物培育研究。E-mail:1003102365@qq.com
* 通信作者 E-mail:scpyzls@163.com
Abstract: 【Objectives】The experiment was to study the effects of calcium supplemental levels and methods on the dynamics of endogenous hormones and nutrition during the flowering period of Lilium casa blanca, to provide a cost effective way for high quality of blossom production.【Methods】Pot experiments were conducted using Lilium casa blanca as materials. The CaCl2was supplied by soaking bulbs for 10 h before planting and foliar spraying 3 times in interval of 3 days during the initial growing stage. The tested CaCl2levels included 0,0.4%,0.8%,1.2%,1.6% for both the supplying ways. The growth and flower shape indicators (plant height, stem diameter, bud length, flower diameter, blossom rate, blossom cleanliness) and the flowering period indicators (days to blossom, flower lasing days) were investigated. The endogenous hormones and carbon and nitrogen nutrient contents during whole flowering phase were analyzed.【Results】1) In bulb soaking treatment, the Ca levels were significantly and positively correlated with the plant height, bud length and flower diameter, but extremely significant and negatively correlated with the stem diameter. In spraying foliar treatment, the Ca levels were highly significant and positively correlated with plant height, stem diameter, bud length and flower diameter. Bulb soaking with 1.2% and foliar spraying with 1.6% of CaCl2had the highest blossom rate, and bulb soaking with 0.8% and foliar spraying with 1.6% of CaCl2had the highest blossom cleanliness. The CaCl2levels in both bulk soaking and foliar spraying treatments were extremely significantly negative correlated with the days to flower, days of squaring, and extremely significantly positive correlated with the days to end flowering and the days of blossom. 2) During flowering, the differences in leaf Ca content were significant between Ca level of 0.4% and 0.8% in bulb soaking treatment, and the leaf Ca content declined when the bulbs were soaked in 1.6% or foliar sprayed with 1.6% of CaCl2. 3) In both the bulb soaking and foliar spraying treatments, the contents of IAA, GA3, ZR, ZR/ABA, (IAA + GA3)/ABA were significantly and positively correlated with the CaCl2levels, and those of ABA, IAA/GA3, IAA/ZR were significantly and negatively correlated with CaCl2levels. Calcium supplements improved the contents of IAA (15.77%–42.93%), GA3(35.57%–65.67%) in the early stage of the bloom, and decreased those of ABA (66.14%–26.27%). As a result, the days to flower were earlier. Calcium supplements increased the contents of ZR (46.66%–60.42%) in the end stage of the bloom, and as a result, the days of blossom were prolonged from 3 to 11 days. 4) In bulb soaking treatment, the soluble sugar contents were significantly and positively correlated with CaCl2levels, but the contents of protein, the ratio of total sugar and total N were not significantly correlated. While for foliar spraying treatments, the correlations were all significant and positive. Both bulb soaking and foliar spraying of calcium increased the soluble sugar and starch contents in the early stage of bloom. During full blossom stage, the soluble protein content treated with foliar spraying was 22.5% higher than that treated with bulb soaking, and the flower of Lilium casa blanca lasted 3–5 days more.【Conclusions】Bulk soaking with CaCl2solution has positive effect in increasing the blossom quality of Lilium casa blanca, advancing the days to blossom, and delaying the aging of Lilium casa blanca. Bulb soaking with 1.6% CaCl2solution will increase plant height, bud length and flower diameter, with the 0.4% CaCl2solution will lead to earlier blossom stage. Foliar spraying of CaCl2solution performs better in increasing the blossom rate and prolonging the blossom days. Generally, bulb soaking with 1.2% and foliar spraying with 1.6% CaCl2solution are recommended for satisfactory flowering of Lilium casa blanca.
