心脏淋巴管新生及其与心血管疾病预后的关系
2017-03-01张海锋谭玉珍综述王海杰审校
张海锋 谭玉珍(综述) 王海杰(审校)
(复旦大学上海医学院人体解剖与组织胚胎学系 上海 200032)
心脏淋巴管新生及其与心血管疾病预后的关系
张海锋 谭玉珍(综述) 王海杰△(审校)
(复旦大学上海医学院人体解剖与组织胚胎学系 上海 200032)
心脏淋巴管的生理病理作用一直未引起人们的重视。但近年来,随着血管内皮生长因子受体-3(vascular endothelial growth factor receptor 3,VEGFR-3)、淋巴管内皮细胞透明质酸受体(lymphatic vessel endothelial hyaluronan receptor 1,LYVE-1)、果蝇同源基因转录因子(prospero homeobox protein 1,Prox-1)、肾小球足细胞膜黏蛋白(podoplanin)等淋巴管内皮细胞标志物的发现,心脏淋巴管的研究迅速发展。心脏淋巴管引流淋巴液,其功能异常可引起心肌水肿、动脉硬化、心律失常、间质纤维化等。深入认识心脏淋巴管的生理病理作用,对于治疗心肌梗死、改善心血管功能、预防心脏手术后并发症等有着重要意义。本文综述了心脏淋巴管的发生、分布以及与心血管疾病预后的关系。
淋巴管; 心脏; 淋巴管新生; 心肌梗死
Rudbeck等最早在研究犬心时发现心外膜下存在淋巴管。此后,有学者采用染料注射、过氧化氢注入等方法证实心内膜下和心肌间存在淋巴管[1]。Miller于1982年详细描述了人心脏淋巴引流入局部淋巴结的途径[2]。由于研究方法和技术的限制,对于心脏淋巴管功能的研究远远落后于心脏血管的研究,而且在心脏疾病研究中淋巴管的重要性也受到了忽视[3]。直到近几年,随着血管内皮生长因子受体-3(vascular endothelial growth factor receptor 3,VEGFR-3)[4]、淋巴管内皮细胞透明质酸受体(lymphatic vessel endothelial hyaluronan receptor 1, LYVE-1)[5]、果蝇同源基因转录因子(prospero homeobox protein 1,Prox-1)[6]、肾小球足细胞膜黏蛋白(podoplanin)[7]等淋巴管内皮细胞特异性标志物的发现,淋巴管的研究得到迅速发展。研究发现心脏淋巴管的主要功能是引流淋巴液,其异常时与心肌水肿、动脉硬化、心律失常、间质纤维化等发生密切相关[8]。因此,研究心脏淋巴管的结构、功能和新生等,对于减轻心肌梗死的病理变化、深入认识动脉硬化的发生发展、预防心脏手术后并发症发生等有着重要意义。然而,关于心脏淋巴管与心血管疾病之间关系的研究刚刚起步。为此,本文综合近年来心脏淋巴管相关的研究,对其发生、分布以及与疾病的关系等作一概述。
心脏淋巴管的发生 关于淋巴管的起源一直存在争议[9-13]。1902年,Sabin等通过猪胚实验提出淋巴管以出芽的方式起源于静脉,称为“离心模式”。1910年,Huntingdon等通过对猫胚切片的研究,提出淋巴管并非起自于静脉,而是来源于间质内的不同细胞,称为“向心模式”[8]。
采用墨汁注射并利用特异性标记Prox-1、LYVE-1或VEGFR-3免疫染色等显示淋巴管的技术方法,在研究大鼠[14]、小鼠[15-18]、鸟类[16,19]心脏淋巴管发育时,发现淋巴管最初出现于心脏膈面的冠状沟附近,然后沿血管从心底向心尖长出。然而,对于心脏发生过程中淋巴管内皮细胞的来源也一直没有定论。2014年,Ratajska等[14]用免疫染色方法标记小鼠胚胎心脏,发现LYVE-1+细胞和管状结构首先发生于冠状沟背侧,随后构成这些结构的内皮细胞表达Prox-1。在小鼠胚胎发育晚期,这些管状结构呈CD31+和LYVE-1+,这表明心脏淋巴管内皮细胞可能来源于早期的心脏静脉。然而,尚未有确切证据表明所有的心脏淋巴管内皮细胞均以出芽方式来自于静脉。2015年,Klotz等[20]用Whole-mount法检测小鼠胚胎心脏的VEGFR-3、LYVE-1、Prox-1、podoplanin等标记物,发现在心脏淋巴管发育过程中新生的淋巴管内皮细胞至少部分来自于内皮祖细胞。Dashkevich等[21]将晚期心力衰竭心脏与正常心脏比较,提出心力衰竭后淋巴管的新生是在已有淋巴管基础上由Prox-1+内皮细胞增殖形成,而并非由多分化潜能的干细胞分化而来或者由静脉以出芽方式形成。然而,对于这些增殖的Prox-1+细胞是否来源于内皮祖细胞,目前尚不清楚。上述实验结果表明,心脏淋巴管的新生可能有不同的细胞来源。关于心血管疾病时淋巴管内皮细胞的来源,还有待于进一步研究。
心脏淋巴管的分布和淋巴引流方向 心脏淋巴管的分布见图1A。按分布位置心脏的淋巴管可分为心内膜下淋巴管、心肌层淋巴管和心外膜下淋巴管等[1]。毛细淋巴管汇合为淋巴管,后者再汇合成为左、右心淋巴干[14,22]。心脏内的淋巴引流途径见图1B。
心脏的毛细淋巴管 1924年,Aagaard等通过将染料注入活体犬的心肌,观察到心内膜下、心肌层和心外膜下均有毛细淋巴管,三处之间形成连续性的毛细淋巴管网。1939年,Patek等采用印度墨水注射法证实了此发现,并提出心脏的淋巴引流起自心内膜下区,继而穿过心肌层,汇入心外膜下淋巴管,再经心淋巴干注入淋巴结。此后,有学者采用注射过氧化氢,可使心外膜下淋巴管扩张,以更容易与心外膜组织相区分,从而研究了人、猪、犬等不同物种的心脏,进一步证实了这些发现[1,14]。
心内膜下的毛细淋巴管位于内皮下层的结缔组织内,常有多个膨大,彼此交织形成网状。心内膜下的毛细淋巴管穿入心肌层,与心肌层淋巴管汇合[23]。心肌层毛细淋巴管位于心肌纤维间的结缔组织内,数目较少,缺乏连续性的基膜,内皮细胞连接的方式多样,以适应不同的功能需要。间质内的淋巴管与毛细血管周围的基膜紧密相连,形成“篮网状”,沿微血管注入心外膜下淋巴管[1,23]。心外膜下的毛细淋巴管位于心外膜深面的结缔组织内,形成疏松网状,分为浅、深两层,深层的毛细淋巴管比浅层的毛细淋巴管粗大,最后汇合成淋巴管[1]。
心脏的淋巴管 心脏的淋巴管形态多样,由毛细淋巴管直接汇集成的淋巴管管壁较薄,内皮周围有不规则和不连续的平滑肌层。沿着冠状血管分支走行的淋巴管有较完整的平滑肌层,并有弹性纤维将其连于邻近的结缔组织。这些淋巴管在冠状沟附近汇合成左、右心淋巴干[14,22]。与前室间支、左缘支和后室间支等伴行的淋巴管汇聚成左心淋巴干,在左心耳后方上行,经肺动脉干后面注入平主动脉弓高度的气管前淋巴结。由该淋巴结发出的输出淋巴管向上至主动脉的右后方,注入上腔静脉和头臂干之间的心淋巴结。在注入心淋巴结前,该输出淋巴管通常分为两个或多个分支,其中一支在变异时可向上经右淋巴导管注入右静脉角。右心淋巴干引流右半心的淋巴,沿主动脉前面上行,注入左侧气管旁淋巴结,最后经胸导管注入左静脉角[14,22,24]。

图1 心脏淋巴管的分布(A)和淋巴引流方向(B)示意图
Cui等[25]认为心脏淋巴的引流是由心肌舒缩等引起的被动性泵吸效应。当心肌舒张时,心室内血压驱使淋巴从心内膜下进入心肌层。当心肌收缩时,心肌收缩的挤压力又驱使淋巴从心肌层进入心外膜下淋巴管,随后通过心淋巴干注入局部淋巴结。但目前尚无确切的实验来证明这一观点。
心脏淋巴管损伤对心血管疾病的影响 正常情况下,水和电解质等经毛细血管滤入心肌间隙,形成组织液,组织液中的水、脂肪和蛋白质等物质经心脏淋巴管收集,再引流入血管,以保持组织液代谢的动态平衡[2,26]。肿瘤、炎症、外伤和缺血性心脏病等均可引起淋巴管闭塞[1],淋巴回流受阻,心肌间隙内组织液积聚,从而导致心肌水肿、心包积液等[27],心肌水肿压迫心的传导系可诱发心律失常[23],导致心脏功能障碍,而心肌收缩能力的下降又会加重心肌水肿[1]。近年来研究发现心脏淋巴管除了可以维持心肌间压力和防止组织水肿以外,也与动脉硬化、间质纤维化等多种心血管疾病的病理变化及发展有关[2]。心脏淋巴管损伤,代谢产物堆积,易于引起成纤维细胞增殖,导致心肌梗死后纤维化的发生[14];冠状血管内膜代谢物积聚引起动脉硬化[2],粥样斑块的脱落导致心肌缺血,进一步形成心肌梗死和纤维化,从而影响心脏功能(图2)。
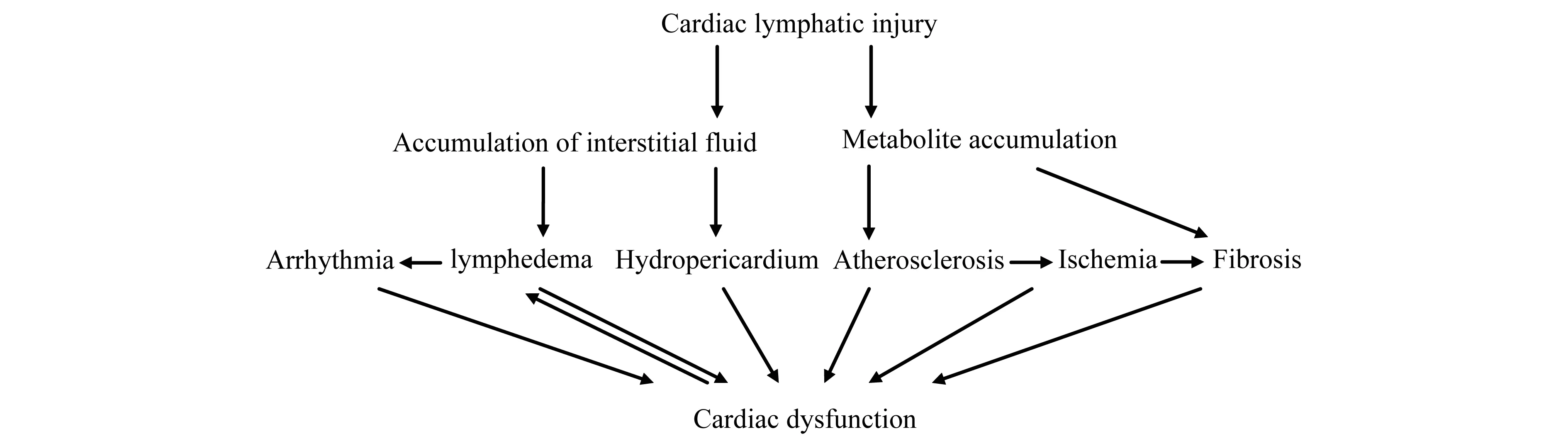
图2 心脏淋巴管损伤对心血管疾病的影响
心脏淋巴管新生与心血管疾病的预后
心脏淋巴管与心肌梗死 心肌梗死后的心肌重建过程依次经过心肌坏死、肉芽形成和纤维化等阶段。2007年,Ishikawa等[28]报道在心肌梗死后早期未发现淋巴管新生,其新生时间晚于血管新生。在肉芽形成早期,淋巴管在梗死边缘从已存在的淋巴管以出芽方式开始新生,但对于这些新生淋巴管的内皮细胞来源尚不清楚。在纤维化和疤痕形成期,由于血管减少,主要依赖新生的淋巴管引流组织液和蛋白质。冠状血管阻塞引起心肌梗死后,淋巴回流受阻,可加重心肌组织损伤。由于透明质酸和硫酸软骨素等黏性物质的积聚,易于引起成纤维细胞增殖,导致心肌梗死后纤维化的发生[14]。2010年,Cui等[25]提出心肌梗死后淋巴回流得到改善可减轻间质水肿,有效排出缺氧后的组织代谢产物,从而改善心脏功能。促进淋巴管新生可能成为治疗心肌梗死的一项理想措施[29]。
2011年,Park等[30]在急性心肌梗死后移植骨髓源性内皮祖细胞,并未发现这些细胞参与梗死边缘区淋巴管的新生,但水肿减轻,纤维化减弱,心肌收缩功能得到改善。令人感兴趣的研究发现,内皮祖细胞能够分化为淋巴管内皮细胞[12-13,31]。Park等[30]未发现内皮祖细胞参与淋巴管新生,可能是因为心肌层淋巴管数目过少,而移植的细胞数目也较少所造成的。2015年,Klotz等[20]提出小鼠心肌梗死后给予血管内皮生长因子-C(vascular endothelial growth factor C,VEGF-C)可显著地增强淋巴管新生,心脏功能得到明显改善。2016年,Henri等[32]观察到在大鼠心肌梗死后心肌注射纳米材料结合的VEGF-C可以显著地促进淋巴管新生,减轻心肌水肿,缓解炎症和纤维化程度,改善心脏功能。这些研究证明淋巴管新生有利于心肌梗死后心脏功能的恢复。然而,细胞移植是否参与淋巴管新生,以及采用何种方式能更有效地促进心脏淋巴管新生有待进一步研究。
心脏淋巴管与动脉硬化 心脏淋巴管可能与冠状动脉粥样硬化的预后有关,但其作用机制尚不明确。Nakano等[33]报道冠状动脉粥样硬化时淋巴管新生较少,血管壁内组织液积聚,影响氧气供应和微循环,可能导致粥样斑块的破裂和脱落。促进淋巴管新生是否可以延缓动脉硬化发展,目前尚不清楚。Xu等[34]认为动脉硬化引起血管损伤时,释放多种因子促进血管新生和淋巴管新生。新生的淋巴管输送炎性细胞和细胞因子至淋巴结,炎性细胞在淋巴结内因致敏而被激活,随后经淋巴管回流至血液循环。这些被激活的炎性细胞又可通过血液循环被再输送至损伤部位。这样,血管和淋巴管因炎症而组成了一个免疫应答环路。炎性细胞和细胞因子的功能被逐渐放大,导致粥样硬化、持续性内膜增生和血管重构等。这些研究表明淋巴管新生参与了动脉硬化的病理发展过程,然而关于心脏淋巴管在动脉硬化发生发展过程中的具体作用机制,目前尚未见有确切的实验依据证实。
心脏淋巴管与心脏手术后并发症 心脏手术后淋巴管损伤所引起的心律失常很少引起人们的注意。Lupinski等[23]发现淋巴管损伤后心脏淋巴淤滞,组织水肿,间质压力升高。心电图出现类似心肌缺血样的Q波、ST段改变和T波异常,进而发生心律失常。这些改变可能与淋巴水肿引起的缺血有关。由于主动脉根部脂肪垫内有引流窦房结附近淋巴的右心淋巴干通过,该淋巴干损伤可引起心房颤动和心脏功能障碍等并发症[35]。因此,心脏手术时应注意保护好主动脉根部脂肪垫内的淋巴管,以减少术后心律失常等并发症的发生[23]。心肌收缩是心肌层淋巴回流的决定因素[25],对心脏淋巴管的新生也有影响[36],淋巴管受损后引起心肌收缩能力的降低,从而加重了心脏手术后心肌水肿,可进一步导致心室功能障碍[1]。心外膜淋巴液的渗出可能产生心包腔积液[2]。心脏移植手术后,淋巴管受损引起心肌损伤和冠状血管病变,是导致心脏移植手术失败的重要原因之一[37]。然而,淋巴管过度新生可引起心脏移植后的免疫排斥反应[38]。因此,心脏手术时淋巴管的损伤对于手术预后产生影响。关于淋巴管新生对于不同并发症的作用及其机制有待于进一步研究。
以上研究表明,心脏淋巴回流受阻是引起组织水肿、炎症发生、纤维化、心律失常等病理变化的重要因素。心脏淋巴管新生和功能恢复可促进心血管功能的改善,有利于心脏疾病的转归。然而,有关心脏淋巴管新生的细胞分子生物学机制,譬如淋巴管新生时的细胞来源、淋巴管新生对动脉硬化和心脏移植的影响、细胞移植是否参与心肌梗死后的淋巴管新生等,目前尚未明确。至今为止,对心脏淋巴管新生的认识仍然有限,有待于深入研究。
[1] LOUKAS M,ABEL N,TUBBS RS,etal.The cardiac lymphatic system[J].ClinAnat,2011,24(6):684-691.
[2] MILLER AJ.The grossly invisible and generally ignored lymphatics of the mammalian heart[J].MedHypotheses,2011,76(4):604-606.
[3] CHOI I,LEE S,HONG YK.The new era of the lymphatic system:no longer secondary to the blood vascular system[J].ColdSpringHarbPerspectMed,2012,2(4):a006445.
[4] JOUKOV V,PAJUSOLA K,KAIPAINEN A,etal.A novel vascular endothelial growth factor,VEGF-C,is a ligand for the Flt4 (VEGFR-3) and KDR (VEGFR-2) receptor tyrosine kinases[J].EMBOJ,1996,15(7):1751.
[5] BANERJI S,NI J,WANG SX,etal.LYVE-1,a new homologue of the CD44 glycoprotein,is a lymph-specific receptor for hyaluronan[J].JCellBiol,1999,144(4):789-801.
[6] WIGLE JT,OLIVER G.Prox1 function is required for the development of the murine lymphatic system[J].Cell,1999,98(6):769-778.
[7] BREITENEDER-GELEFF S,SOLEIMAN A,KOWALSKI H,etal.Angiosarcomas express mixed endothelial phenotypes of blood and lymphatic capillaries:podoplanin as a specific marker for lymphatic endothelium[J].AmJPathol,1999,154(2):385-394.
[8] NORMAN S,RILEY P.Anatomy and development of the cardiac lymphatic vasculature:its role in injury and disease[J].ClinAnat,2016,29(3):305-315.
[9] BAUTCH VL,CARON KM.Blood and lymphatic vessel formation[J].ColdSpringHarbPerspectBiol,2015,7(3):a008268.
[10] NICENBOIM J,MALKINSON G,LUPO T,etal.Lymphatic vessels arise from specialized angioblasts within a venous niche[J].Nature,2015,522(7554):56-61.
[11] HOGAN BM,BLACK BL.Developmental biology:diversity in the lymphatic vasculature[J].Nature,2015,522(7554):37-38.
[12] STANCZUK L,MARTINEZ-CORRAL I,ULVMAR MH,etal.cKit lineage hemogenic endothelium-derived cells contribute to mesenteric lymphatic vessels[J].CellRep,2015,10(10):1708-1721.
[13] MARTINEZ-CORRAL I,ULVMAR MH,STANCZUK L,etal.Nonvenous origin of dermal lymphatic vasculature[J].CircRes,2015,116(10):1649-1654.
[14] RATAJSKA A,GULA G,FLAHT-ZABOST A,etal.Comparative and developmental anatomy of cardiac lymphatics[J].SciWorldJ,2014,2014:183170.
[15] JUSZYNSKI M,CISZEK B,STACHURSKA E,etal. Development of lymphatic vessels in mouse embryonic and early postnatal hearts[J].DevDyn,2008,237(10):2973-2986.
[16] KARUNAMUNI G,YANG K,DOUGHMAN YQ,etal. Expression of lymphatic markers during avian and mouse cardiogenesis[J].AnatRec(Hoboken), 2010,293(2):259-270.
[17] FLAHT A,JANKOWSKA-STEIFER E,RADOMSKA DM,etal.Cellular phenotypes and spatio-temporal patterns of lymphatic vessel development in embryonic mouse hearts[J].DevDyn,2012,241(9):1473-1486.
[18] YANG Y,GARCIA-VERDUGO JM,SORIANO-NAVARRO M,etal.Lymphatic endothelial progenitors bud from the cardinal vein and intersomitic vessels in mammalian embryos[J].Blood,2012,120(11):2340-2348.
[19] WILTING J,BUTTLER K,SCHULTE I,etal. The proepicardium delivers hemangioblasts but not lymphangioblasts to the developing heart[J].DevBiol,2007,305(2):451-459.
[20] KLOTZ L,NORMAN S,VIEIRA JM,etal.Cardiac lymphatics are heterogeneous in origin and respond to injury[J].Nature,2015,522(7554):62-67.
[21] DASHKEVICH A,BLOCH W,ANTONYAN A,etal. Morphological and quantitative changes of the initial myocardial lymphatics in terminal heart failure[J].LymphatResBiol,2009,7(1):21-27.
[22] 王海杰,谭玉珍.实用心脏解剖学[M].上海:复旦大学出版社,2007:134-136.
[23] LUPINSKI RW.Aortic fat pad and atrial fibrillation:cardiac lymphatics revisited[J].ANZJSurg,2009,79(1-2):70-74.
[24] FLAHT-ZABOST A,GULA G,CISZEK B,etal.Cardiac mouse lymphatics:developmental and anatomical update[J].AnatRec(Hoboken),2014,297(6):1115-1130.
[25] CUI Y.The role of lymphatic vessels in the heart[J].Pathophysiology,2010,17(4):307-314.
[26] ASPELUND A,ROBCIUC MR,KARAMAN S,etal.Lymphatic system in cardiovascular medicine[J].CircRes,2016,118(3):515-530.
[27] DAVIS KL,LAINE GA,GEISSLER HJ,etal.Effects of myocardial edema on the development of myocardial interstitial fibrosis[J].Microcirculation,2000,7(4):269-280.
[28] ISHIKAWA Y,AKISHIMA-FUKASAWA Y,ITO K,etal.Lymphangiogenesis in myocardial remodelling after infarction[J].Histopathology, 2007,51(3):345-353.
[29] ANGELI V,HARVEY N.Lymphatic vessels at the heart of the matter[J].CellMetab,2015,22(1):56-58.
[30] PARK JH,YOON JY,KO SM,etal.Endothelial progenitor cell transplantation decreases lymphangiogenesis and adverse myocardial remodeling in a mouse model of acute myocardial infarction[J].ExpMolMed,2011,43(8):479-485.
[31] TAN Y,WANG H,ZHANG M,etal.CD34+VEGFR-3+progenitor cells have a potential to differentiate towards lymphatic endothelial cells[J].JCellMolMed,2014,18(3):422-433.
[32] HENRI O,POUEHE C,HOUSSARI M,etal.Selective stimulation of cardiac lymphangiogenesis reduces myocardial edema and fibrosis leading to improved cardiac function following myocardial infarction[J].Circulation,2016,133(15):1484-1497.
[33] NAKANO T,NAKASHIMA Y,YONEMITSU Y,etal.Angiogenesis and lymphangiogenesis and expression of lymphangiogenic factors in the atherosclerotic intima of human coronary arteries[J].HumPathol,2005,36(4):330-340.
[34] XU X,LIN H,LV H,etal.Adventitial lymphatic vessels-an important role in atherosclerosis[J].MedHypotheses, 2007,69(6):1238-1241.
[35] DAVIS Z,JACOBS HK,BONILLA J,etal.Retaining the aortic fat pad during cardiac surgery decreases postoperative atrial fibrillation[J].HeartSurgForum,2000,3(2):108-112.
[36] GREIWE L,VINCK M,SUHR F.The muscle contraction mode determines lymphangiogenesis differentially in rat skeletal and cardiac muscles by modifying local lymphatic extracellular matrix microenvironments[J].ActaPhysiol,2016,217(1):61-79.
[37] KONG X,WANG L,KONG D.Cardiac lymphatic interruption is a major cause for allograft failure after cardiac transplantation[J].LymphatResBiol,2007,5(1):45-47.
[38] DASHKEVICH A,RAISSADATI A,SYRJALA S,etal.Ischemia-reperfusion injury enhances lymphatic endothelial VEGFR3 and rejection in cardiac allografts[J].AmJTransplant,2016,16(4):1160-1172.
Cardiac lymphangiogenesis and its relation to prognosis of cardiovascular diseases
ZHANG Hai-feng, TAN Yu-zhen, WANG Hai-jie△
(DepartmentofHumanAnatomyandHistoembryology,ShanghaiMedicalCollege,FudanUniversity,Shanghai200032,China)
Physiopathological effects of cardiac lymphatics have been neglected for many years.Recently research on cardiac lymphatics increases greatly following discovering of specific markers of lymphatic endothelial cells such as vascular endothelial growth factor receptor 3 (VEGFR-3),lymphatic vessel endothelial hyaluronan recepotor 1 (LYVE-1),prospero homeobox protein 1 (Prox-1) and podoplanin.Cardiac lymphatics drain lymph and balance the fluid metabolism.Dysfunction of the lymphatic vessels contributes to lymphedema,atherosclerosis,arrhythmia and fibrosis.It is significant to explore physiopathological effects of cardiac lymphatics for treatment of myocardial infarction,improvement of cardiovascular functions and prevention of complication after heart surgery.This review summarizes development and distribution of cardiac lymphatics and their relation to prognosis of cardiovascular diseases.
lymphatic vessels; heart; lymphangiogenesis; myocardial infarction
国家自然科学基金(81270200,81470385);高等学校博士学科点专项科研基金(20130071110080)
R322.2+6
B
10.3969/j.issn.1672-8467.2017.01.018
2016-05-06;编辑:王蔚)
△Corresponding author E-mail:hjwang@shmu.edu.cn
*This work was supported by the National Natural Science Foundation of China (81270200,81470385) and the Scientific Research Foundation of State Education Commission (20130071110080).
